boiling points or wtv
1/10
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
11 Terms
تعتمد درجات الغليان على
نواع الروابط التي يكونها الجزئ مع نفسه
عدد ذرات الكربون
حجم الذرات أو المركب
العلاقة بين درجة الغليان والكثافة واللزوجة
علاقة طردية
الالكانات والالكينات والالكاينات
الالكانات : درجات غليان منخفضة لأن القوى التي تربطها قوى تشتت لندن ضعيفة
تزداد درجة الغليان هذه بزيادة الكتلة وقلة التفرعات
الالكينات : درجات غليان وانصهار مختلفة ولكن اعلى من الالكانات
الالكاينات : درجات غليان وانصهار اعلى من الالكانات والالكينات
كلما زادت الكتلة الجزيئية
زادت درجة الغليان
مثال : الهكسان درجة غليانه اعلى من البيوتان
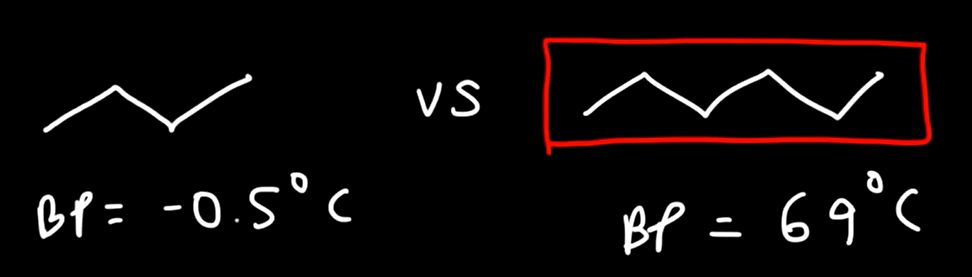
كلما زادت التفرعات
قلت درجة الغليان
مثال النيو بنتان (تفرعاته كثيرة) درجة غليانه أقل من البنتان ( تفرعاته أقل)

الهالوكربونات
درجات غليان أعلى من الألكانات والالكينات والالكاينات
لها كتلة جزيئة أكبر وبالتالي درجة غليان اكبر وبالتالي قوى تشتت اكبر
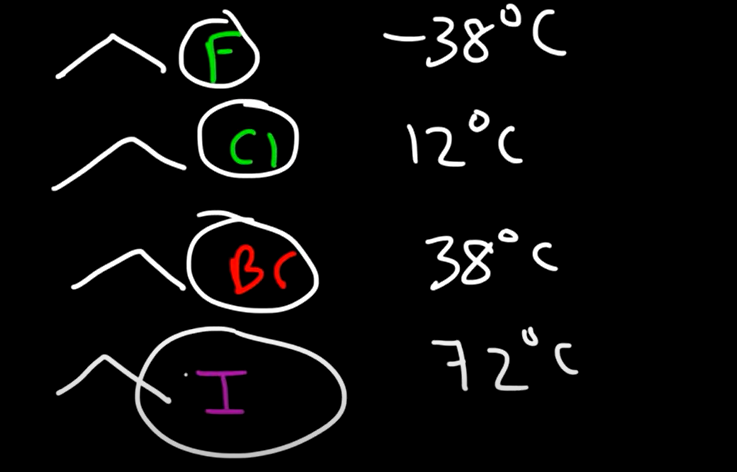
بين الهالوكربونات
تزداد درجة الغليان بالانتقال الى
اسفل من الفلور ( اقل درجة غليان ) الى البروم ( اعلى درجة غليان )
مثال : البرومو ايثان درجة غليانه اكبر من الكلورايثان
السبب : تزداد الكتلة الجزيئية وتزداد قوى تشتت لندن ويكون اقطاب مؤقتة
المركبات القطبية لها
درجة غليان أعلى
مثال الايثانول (كحول) درجة غليانه أعلى من الايثان ( الكان)
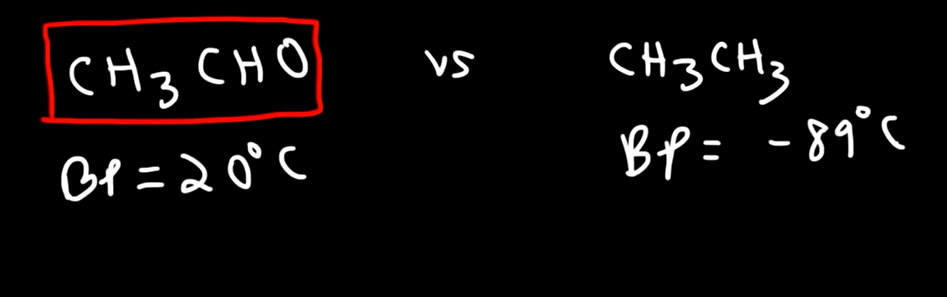
بين المركبات القطبية
المركبات الي تحتوي على روابط هيدروجينة لها
درجة غليان أعلى
مثال : الايثانول ( كحول) له درجة غليان اعلى من الايثانال ( الدهيد)
ملاحظة : الروابط الهيدروجينية تكون بين الهيدروجين و ( F,O,N)
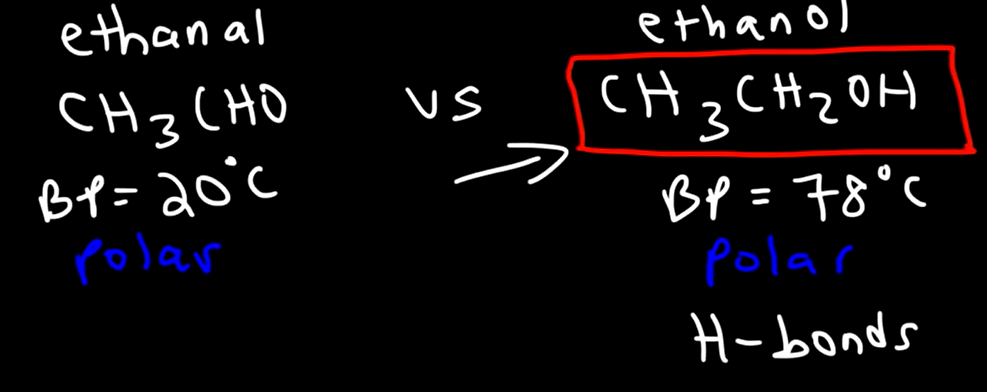
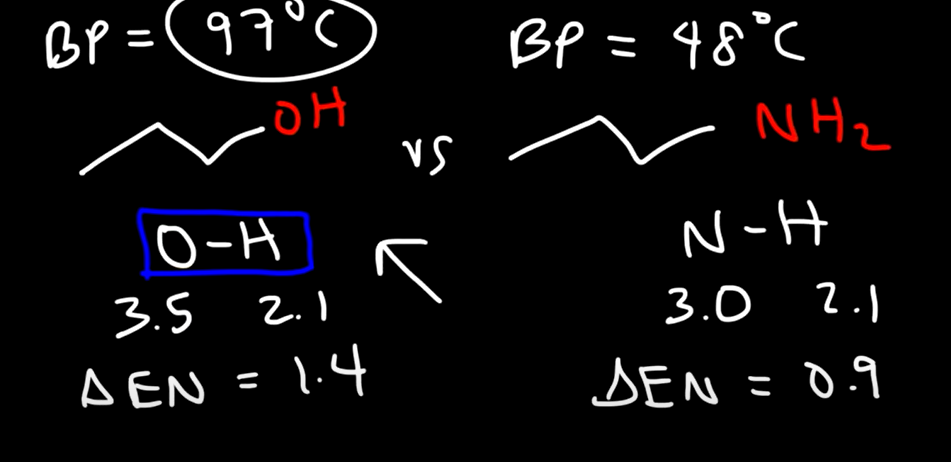
مقارنة الكحول بالأمينات
الكحولات لها درجة غليان أكبر
السبب: الرابطة الهيدروجينية في الكحولات تكون بين ( الاكسجين والهيدروجين ) وهي اقوى من رابطة الامينات التي تكون بين ( النيتروجين والهيدروجين )
فرق السالبية في رابطة الاكسجين والهيدروجين اكبر
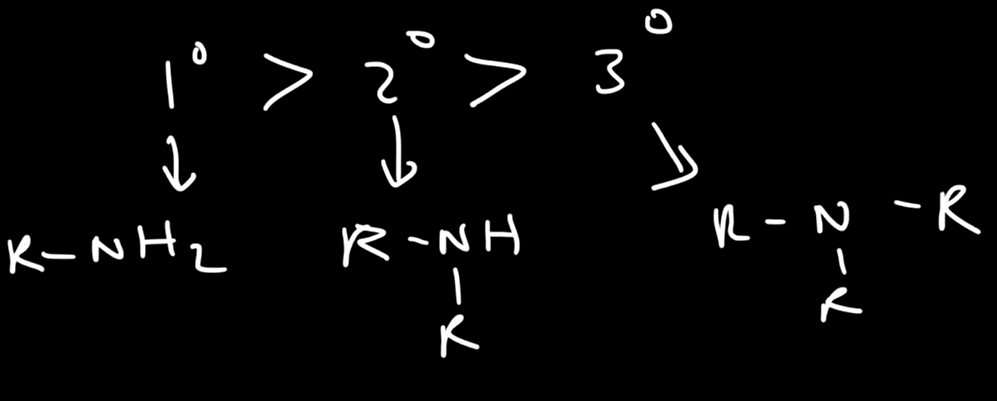
درجات غليان انواع الامينات الثلاث
بالترتيب من الأعلى الى الاقل
الأولي ثم الثاني ثم الثالثي
السبب: في الثالثي لا يوجد روابط هيدروجينة
في الثاني تكون هناك هيدروجينة واحدة مرتبطة بالنيتروجين
في الأولي تكون هناك هيدروجنتين مرتبطات بالنيتروجين