Enlace covalente
0.0(0)
0.0(0)
Card Sorting
1/10
Earn XP
Description and Tags
Study Analytics
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
11 Terms
1
New cards
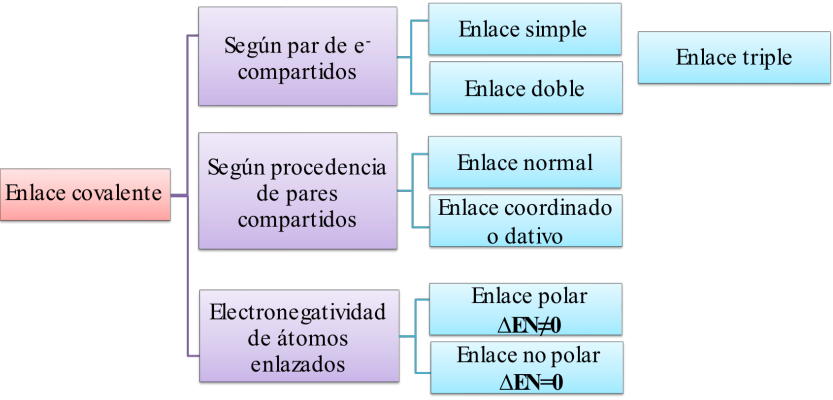
Clasificación del enlace covalente
2
New cards
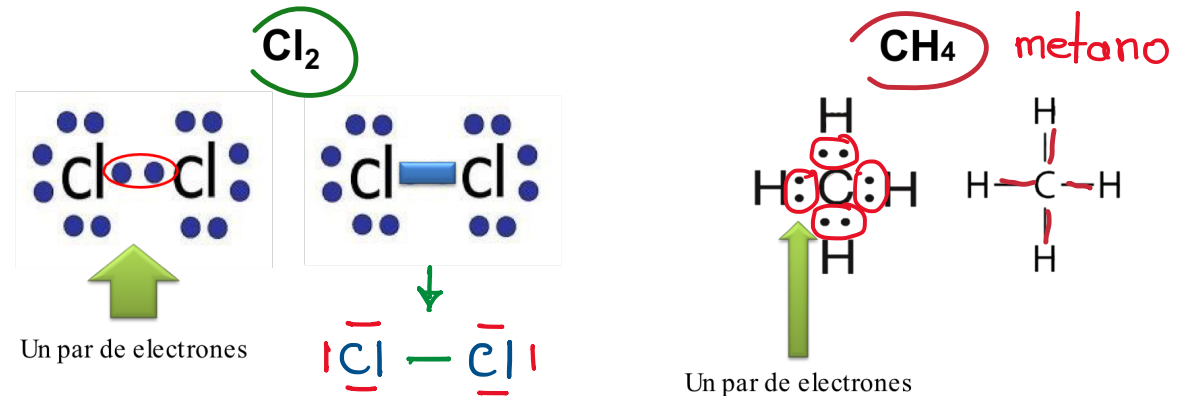
Según el par de e- compartidos: Enlace simple
Compartición de un único par de e- entre 2 átomos enlazados.
3
New cards
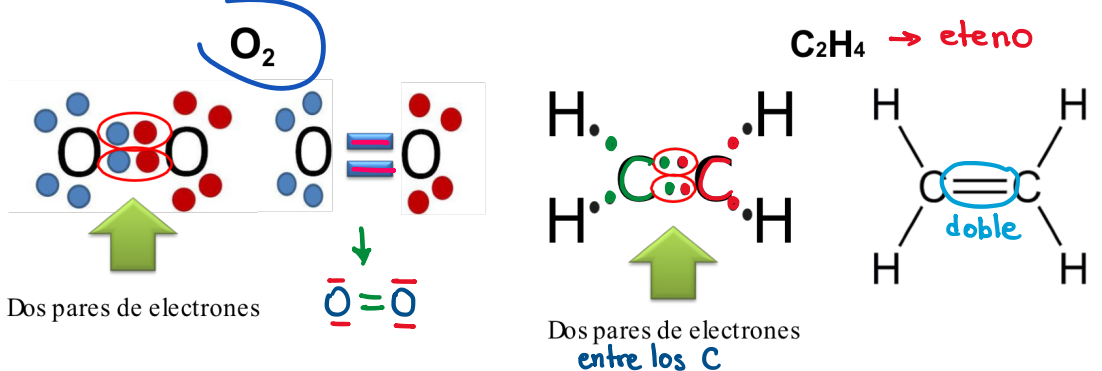
Según el par de e- compartidos: Enlace doble
Compartición de dos pares de e- entre 2 átomos enlazados.
4
New cards
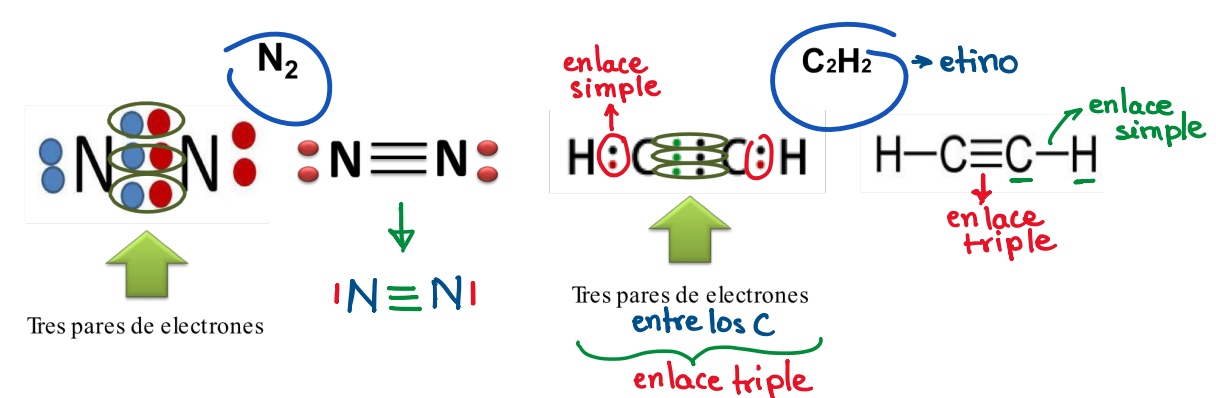
Según el par de e- compartidos: Enlace triple
Compartición de tres pares de e- entre 2 átomos enlazados.
5
New cards
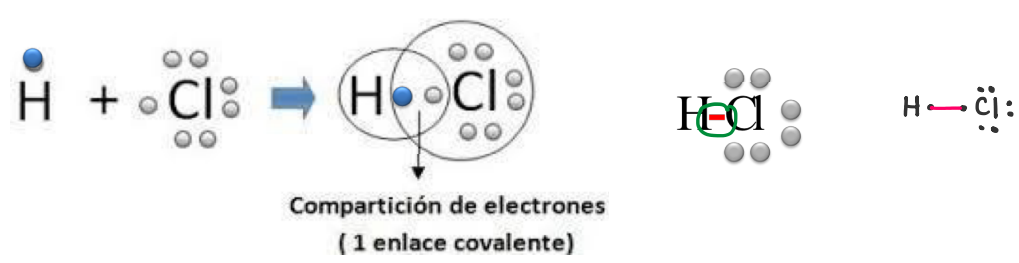
Según procedencia del par de e- compartidos: Enlace normal
Los átomos aportan electrones por igual. El enlace se representa con una línea recta.
6
New cards
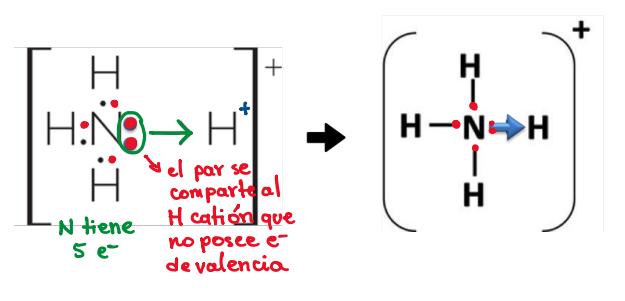
Según procedencia del par de e- compartidos: Enlace coordinado o dativo
El par de e- es aportado por el mismo átomo. Este enlace se representa con una flecha, apuntando al átomo que recibe los dos e-.
7
New cards
En la electronegatividad…
Los elementos con mayor electronegatividad atraen más e- que los elementos con menor electronegatividad.
8
New cards
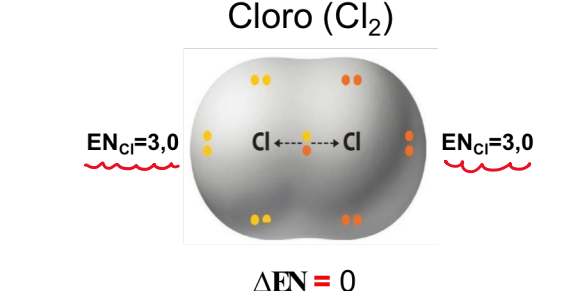
Según electronegatividad: Enlace apolar (Para toda molécula diatómica de átomos iguales)
**Características (Moléculas diatómicas):**
* Unión de átomos del mismo elemento.
* Distribución uniforme de densidad de carga electrónica.
* Distribución equitativa del par de electrones.
* Átomos con misma electronegatividad **(ΔEN = 0).**
* Unión de átomos del mismo elemento.
* Distribución uniforme de densidad de carga electrónica.
* Distribución equitativa del par de electrones.
* Átomos con misma electronegatividad **(ΔEN = 0).**
9
New cards
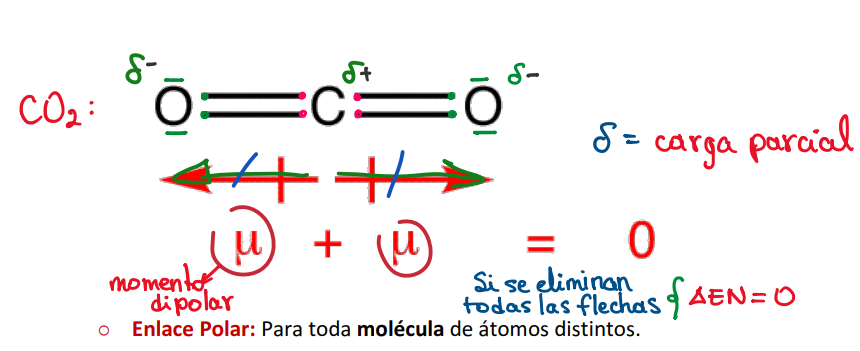
Según electronegatividad: Enlace apolar (Para otros compuestos)
**Características (Otros compuestos):**
* Unión de átomos de distintos elementos.
* Distribución pseudo uniforme de densidad de carga electrónica.
* Alta simetría estructural.
* Átomos con baja diferencia de electronegatividad **(ΔEN ≅ 0)**
* Unión de átomos de distintos elementos.
* Distribución pseudo uniforme de densidad de carga electrónica.
* Alta simetría estructural.
* Átomos con baja diferencia de electronegatividad **(ΔEN ≅ 0)**
10
New cards
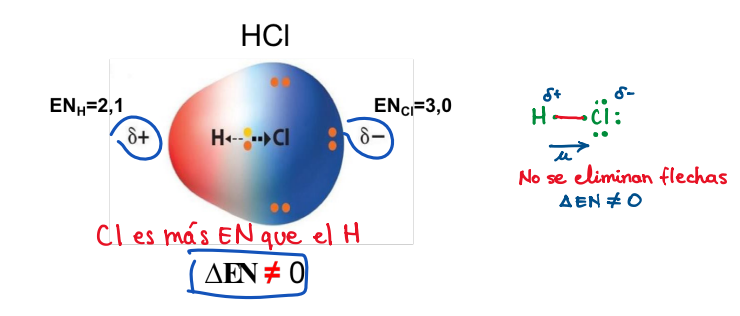
Según electronegatividad: Enlace polar
**Características:**
* Unión de átomos de distintos elementos.
* Distribución no uniforme de densidad de carga electrónica.
* Distribución desigual del par de electrones.
* Átomos con diferencia de electronegatividad un poco más alta **(ΔEN ≠ 0).**
* Unión de átomos de distintos elementos.
* Distribución no uniforme de densidad de carga electrónica.
* Distribución desigual del par de electrones.
* Átomos con diferencia de electronegatividad un poco más alta **(ΔEN ≠ 0).**
11
New cards
Según la diferencia de electronegatividades entre los átomos se puede predecir el tipo de enlace químico:
