Chapitre 4: Notion de chimie organique
1/47
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
48 Terms
Structure de Lewis
tous les atomes, y compris les H, les liaisons et les doublets ou lacunes sont représentés
Formule semi-développée
Ne fait pas apparaître les doublets liants entre les carbones et les hydrogènes
Formule topologique
Formule dans laquelle les hétéroatomes sont placés sur un squelette carboné schématisé par un ensemble de lignes brises alignées suivant la géométrie de la molécule
Formule brute
Liste tous les atomes d’une molécule dans un ordre précis: d’abord les C puis les H puis les autres atomes par ordre alphabétique? Elle ne donne aucune information sur les liaisons
Nomenclature
Juxtaposition ordonnée de plusieurs termes caractérisant la chaîne carbonée principale, l’état d’insaturation, la fonction principale et les substitutions
Comment est décomposé le nom d’une molécule?
En trois partie: Préfixe, Partie fondamentale et terminaison
1- Correspond principalement aux substituants (groupements carbonés ne faisant pas partie de la chaîne principale) et/ou groupements fonctionnels non prioritaires. Ils sont classés par ordre alphabétique et précédé d’un indice, donnant leur position sur la chaîne principale. Un préfixe multiplicateur est ajouté lorsqu’un substituant est présent plusieurs fois (di,tri…): il n’est pas pris en compté dans l’ordre alphabétique
2- Chaîne carbonée principale (généralement la plus longue) portant la fonction prioritaire
3- fonction principale et l’état de saturation/insaturation de la chaîne principale
Comment détermine-t-on la longueur d’une chaîne carbonée?
Elle est repérée par un préfixe numérique en fonction du nombre de carbone de la chaîne
Donner l’ensemble des préfixe associée au nombre de carbone de la chaîne

Hydrocarbures
Chaîne carbonée linéaire où toutes les liaisons sont simples
Alcanes + exemple
Formule brute CnH2n+2

Alkyles
Hydrocarbures saturés étant une ramification d’une chaîne principale: il s’agit de substituant/radicaux vis à vis de la chaîne principale.
Leur nomenclature: préfixe numérique+yle

Expliquer étape par étape comment on numérote et nomme une molécule
1- La chaîne principale est celle qui possède le plus de carbone. On la numérote de sorte à ce que les substituants est le plus petit indice possible
2- Les radicaux sont placés avant la chaîne principale avec une terminaison en -yl sans e
3- Les indices de position sont placés immédiatement avant la partie du nom à laquelle ils se réfèrent et sont reliés à la fonction par un tiret
4- S’il y a plusieurs indices qui se rapportent au même groupement, ils sont séparés par une virgule
5- S’il y a plusieurs radicaux, ils sont placés avant la chaîne principale par ordre alphabétique sans tenir compte des préfixe multiplicateurs
6- En cas de ramifications multiples , les chaînes latérales sont numérotées à partir du carbone qui est lié à la chaîne principale. Si nécessaire le nom de la chaîne est mis entre parenthèse
Hydrocarbures insaturés + exemples
Chaînes carbonées présentant des doubles liaisons ou des triples liaisons.
Doubles liaisons= alcènes notées C2H2n
Triple liaisons= alcynes notées CnH2n-2


Comment numéroter un hydrocarbures insaturées faire les exemples suivants
La chaîne principale n’est pas celle qui est la plus longue mais celle qui contient le plus d’insaturations (doubles ou triples liaisons)
Cependant, on suit toujours la même methodologie à savoir préfixe, partie fondamentale et terminaison
Même si c’est de la liaison triple/double dont va dépendre la numérotation de la chaîne. On l’écrit quand même à la fin c’est à dire dans la partie terminaison.
Le groupement alkyle est écrit en début de chaîne et son indice est déterminée par la liaison triple ou double
Si plusieurs liaisons doubles ou triples il y a, numéroter la molécule de telle sorte à ce que la triple liaison ait le plus petit indice possible.
ex: Pour 2 liaisons doubles en position 1 et 4, on écrira 1,4-diène
Remarque: Pour les ramifications c’est le nb total de carbone qu’il y a qui fait office de préfixe numérique.

Substituant hydrocarbure insaturé
Si substituant alcène alors terminaison= -ènyl
Si substituant alcyne alors terminaison= -ynyle
Comment formuler le nom d’un hydrocarbure monocyclique saturé?
Il se forme en accolant le préfixe cyclo au nom de l’hydrocarbure acyclique saturé
Qu’en est-il lorsque l’hydrocarbure est un radical?
il aura une terminaison -yle (-yl dans le nom)
Précisions sur les noms des hydrocarbures aromatiques
Ils peuvent avoir des noms non systématique
Comment déterminer le nom d’une molécule fonctionnalisé
1- Déterminer la fonction (ou groupe) principale
2-Déterminer la structure de base (chaîne carbonée la plus longue ou cycle)
3- Nommer les substituants
4-Numéroter
5-Assembler les noms des substituants dans l’ordre alphabétique sans tenir compte des préfixes multiplicateurs
Comment classer les différents groupes fonctionnels?
Les groupes fonctionnels sont classés par ordre de priorité lié au degré d’oxydation de chaque groupe. La fonction principale est donc celle qui a la plus haute priorité: on la désignera par son suffixe dans le nom de la molécule. Tous les autres groupes seront désignés par des préfixes
Représenter le tableau des différentes fonction chimiques par ordre de priorité décroissante (du plus prioritaire au moins prioritaire). En renseignant, la formule, le suffixe et le préfixe
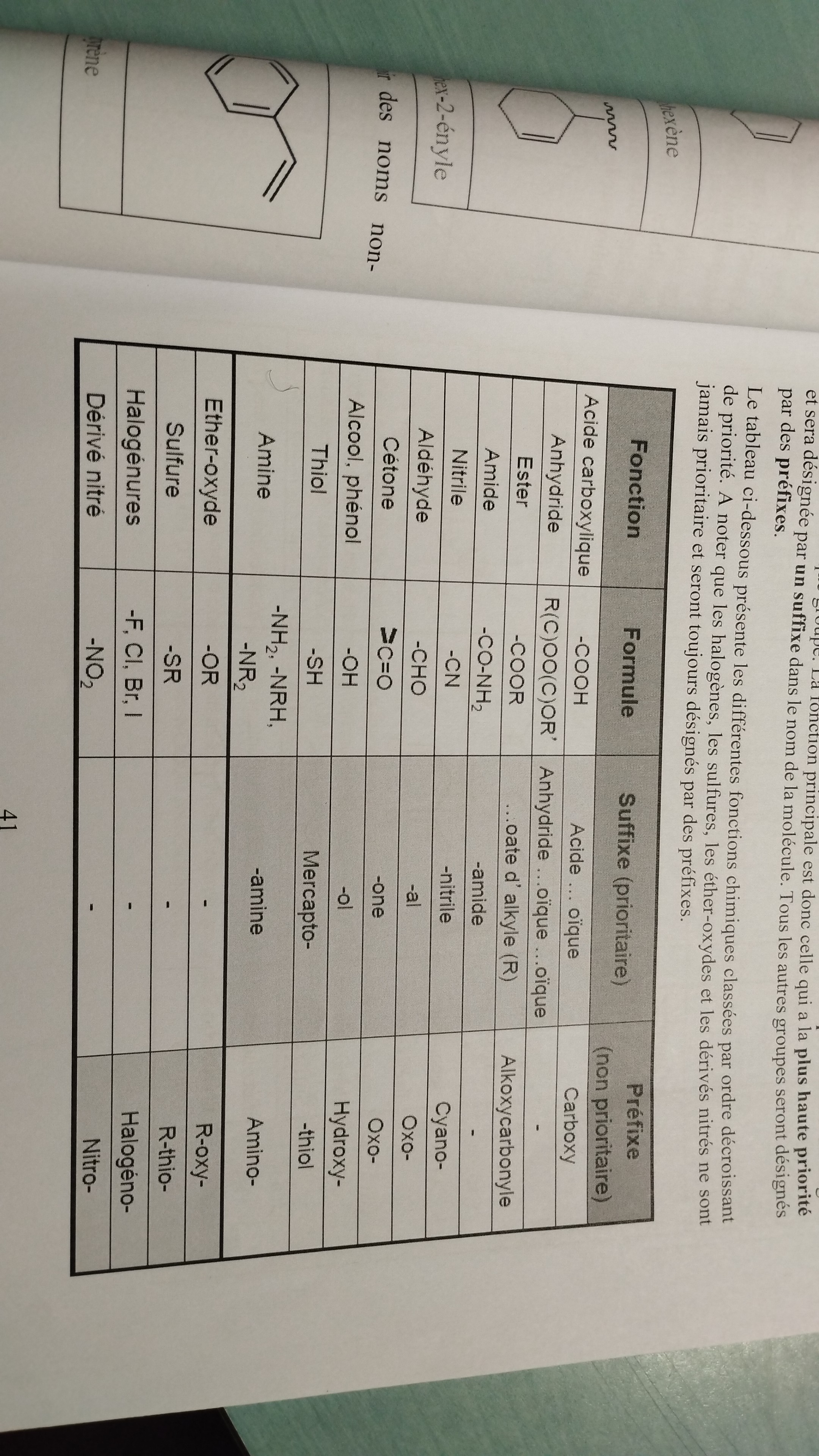
Tableau des principales fonctions chimiques avec les exemples suivants
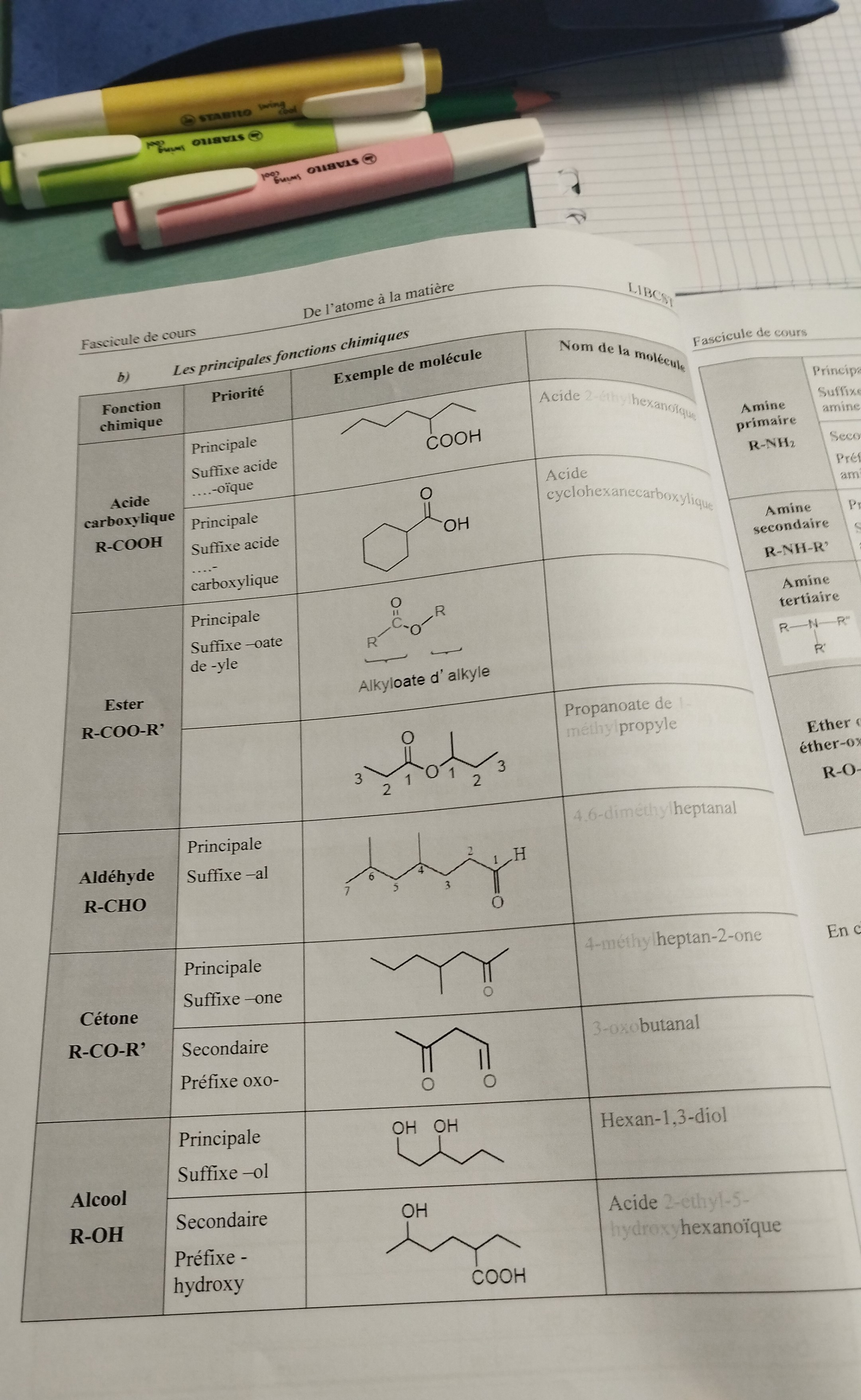
2ème partie du tableau
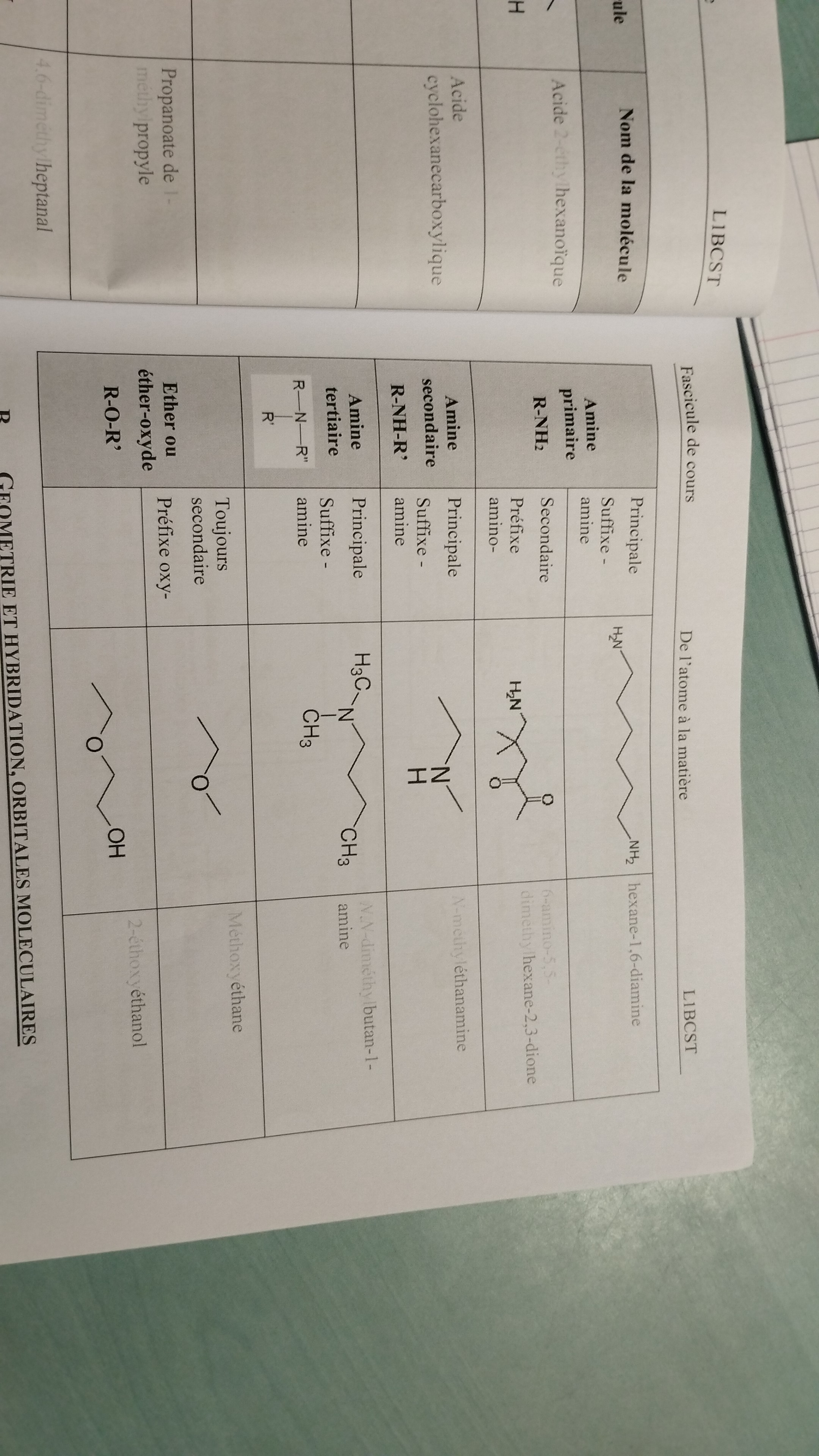
Tétravalent
Atome capable d’établir 4liaisons covalentes

liaison sigma
Ce sont les premières liaisons formées entre deux atomes.
Elles se produisent lorsque les orbitales se chevauchent directement entre les atomes liés.
Ce chevauchement peut se faire entre des orbitales s-s, s-p ou p-p.
Les liaisons sigma sont généralement plus fortes et permettent une rotation libre autour de l’axe de la liaison.

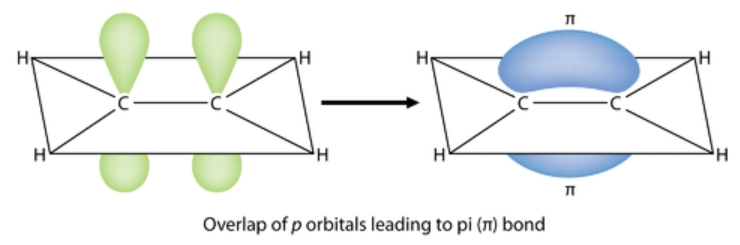
liaison pi et schématiser l’exemple du C2H2
Celles-ci se forment après une liaison sigma, généralement dans les doubles ou triples liaisons.
Elles se produisent lorsque les orbitales se chevauchent latéralement.
Les liaisons pi impliquent le chevauchement d’orbitales p.
Elles sont généralement plus faibles que les liaisons sigma et limitent la rotation autour de l’axe de la liaison.
hybridation
Mélange d’orbitales atomiques d’un même atome afin de donner lieu à un ensemble d’orbitales hybrides.
Expliquer clairement ce à quoi correspond le phénomène d’hybridation dans la réalité. On prendra l’exemple du CH4

Effet inductif
Polarisation/déplacement du nuage électronique à travers une liaison sigma. Il est le résultat de la différence d’électronégativité entre 2 atomes ou groupes d’atomes. Il est représenté par un cône sur la liaison.
Effet inductif attracteur
Noté -I, désigne la capacité de l’atome le plus électronégatif à attirer les électrons de la liaison sigma.
Effet inductif donneur
Noté +I, fait pour l’atome ou groupe d’atomes le moins électronégatif d’une liaison sigma de donner des électrons.
Quelle différence entre l’effet inductif et l’effet électronique statique? En quoi l’effet inductif est-il un effet électronique statique?
Effet électronique statique = polarisation d'une liaison due à la différence d'électronégativité entre les atomes liés
Effet inductif = propagation d'une polarisation électronique au fil des liaisons chimiques.
Car l’effet inductif est une conséquence et est généré par l’effet électronique statique
En quoi est-ce important d’avoir connaissance de cela en chimie?
Ces effets influencent la réactivité des groupes fonctionnels et la structure des molécules, ce qui est essentiel pour comprendre la chimie organique et la réaction chimique. Ils expliquent donc les propriétés réactionnelles des molécules
Enoncer l’ensemble des propriétés inhérentes à l’effet inductif.
L’effet électronique dépend de l’électronégativité des atomes mis en jeu. Ainsi, l’effet inductif -I d’un atome de fluor est plus prononcé que celui d’un atome de chlore.
L’effet électronique est transmis de proche en proche par les liaisons. Il s’affaiblit avec la distance et devient négligeable au-delà de trois liaisons, sauf s’il est relayé par une liaison multiple
L’effet inductif est additif. L’effet inductif -I du groupement CCl3 est plus fort que celui du groupement CHCl2, lui-même plus fort que celui du CH2Cl
Effet mésomère
Effet électronique dynamique, qui désigne la polarisation d’une liaison 𝛑 résultant de l’existence d’une mésomérie dissymétrique (c'est-à-dire la délocalisation des électrons 𝛑…). Cette délocalisation n’intervient pas dans toutes les molécules.
Donc, dans les faits c’est le déplacement des électrons présents dans les orbitales atomiques p qui donne lieu à la formation de liaisons multiples, de doublets non liants, de lacunes électroniques et d’électrons célibataires.
Comment représenter et déterminer les formes limites d’une molécule?
Représentation: entre crochets, elles sont séparées par une flèche (voir photo)
Comment déterminer? :
1- Les formes mésomères de l’octet sont prépondérantes
2-Il est préférable d’avoir le minimum de charges électriques. Une structure neutre a donc une contribution plus élevée à la réalité que celle faisant apparaître des charges formelles.
3- La position des charges formelles doit être en accord avec les électronégativité des atomes (bon j’en suis pas sûre, ce qui est sûr c’est charge partielle delta -/+ sur l’atome le plus/moins électronégatif)

conjugaison
On dit qu’il y a conjugaison lorsque la formule de Lewis d’une molécule présente une alternance de liaisons simples et doubles, une liaison double pouvant être remplacée par un doublet « libre », plus rarement une lacune
systèmes conjugués
systèmes polyatomiques présentant une alternance de paires d’électrons (électron pi, doublets non liants, lacune électronique) et de liaisons simples sigma
Quels sont les effets de la conjugaison (délocalisation)?
Apporte de la stabilisation
Citer l’ensemble des familles de systèmes conjugués
Elles sont au nombre de 4:
a) enchaînement pi sigma pi
b) enchaînement n (doublets non liant) sigma pi
c)enchaînement pi sigma nu (lacune électronique)
d) système aromatique
enchaînement pi sigma pi
Il s’agit d’une liaison multiple suivi d’une liaison simple suivi d’une liaison multiple.
2cas de figure:
1- La liaison multiple est une liaison multiple carbone-carbone conjuguée avec une liaison multiple également carbone-carbone. CCL: les électrons peuvent être délocalisées dans un sens ou dans l’autre car dans une molécule homonucléaire, la molécule n’est pas polarisée.
2- La liaison multiple est une liaison multiple carbone-carbone conjuguée avec une liaison multiple carbone-hétéroatome. Les électrons seront forcément délocalisés vers l’atome le plus électronégatif de la liaons multiple. Voir image.
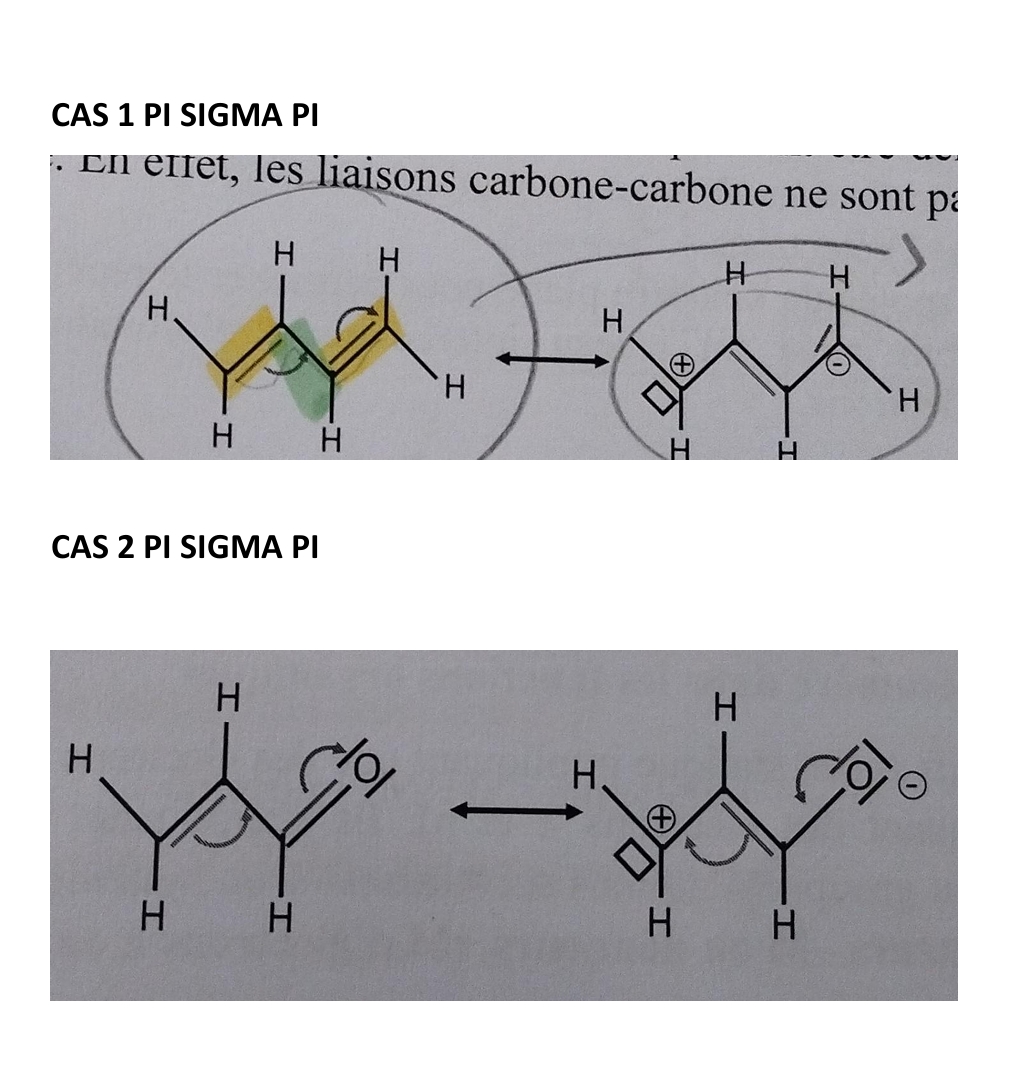
enchaînement n (doublets non liant) sigma pi
J’identifie l’enchaînement n sigma pi et j’inverse l’enchaînement dde telle sorte à avoir pi sigma n
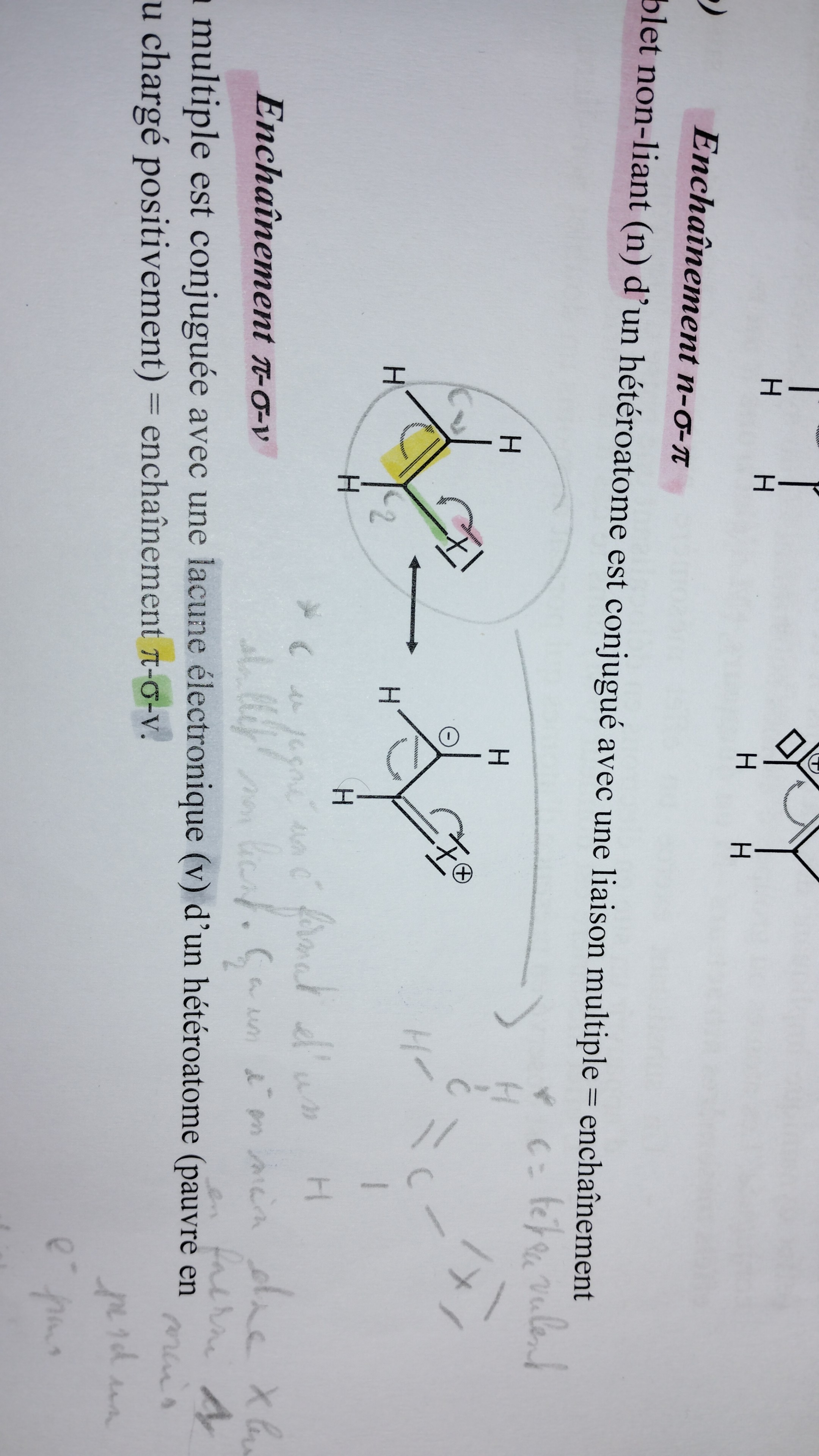
enchaînement pi sigma nu (lacune électronique)
J’identifie l’enchaînement pi sigma nu (lacune électronique) et je déplace les électrons de telle sorte à avoir nu sigma pi
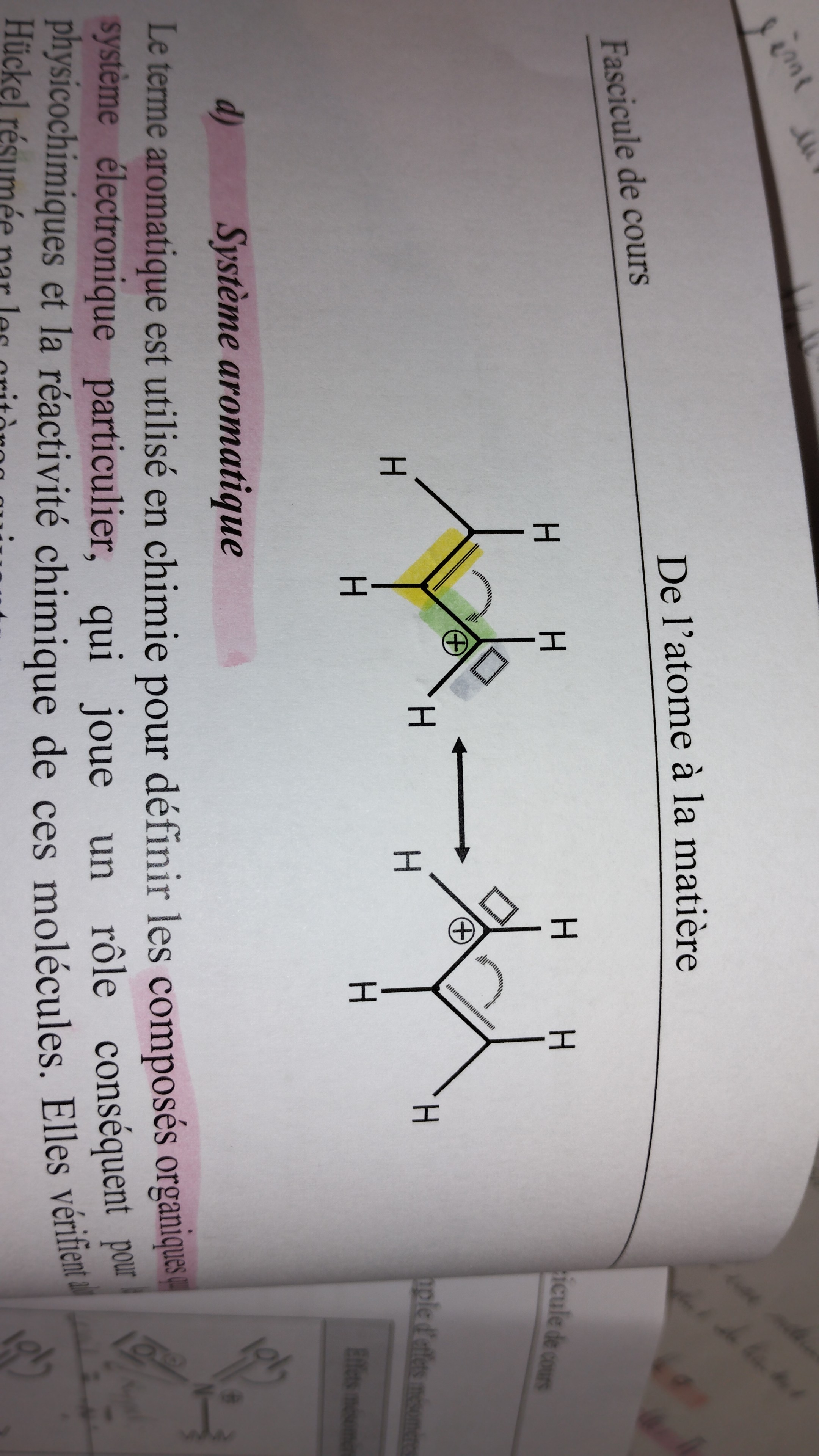
système aromatique
Composés organiques qui possèdent un système électronique particulier. Ce dernier joue un rôle important pour les conséquences physico-chimiques et la réactivité chimiques de ces molécules. Ils vérifient alors les règles de Hückel.
Citer les critères qui résument les règles de Hückel
1- Un structure aromatique est cyclique/polycyclique
2- Le nb des électrons des orbitales pi (donc liaisons multiples ou doublets non liants) sont délocalisables dans le cas de systèmes conjugués et égal à 2,6,10 ou plus. C’est la règle des (4n+2) électrons
3- La molécule doit être plane pour permettre le recouvrement latéral des orbitales p et établir ainsi un réseau interconnecté d’orbitales utilisé pour la délocalisation d’électrons.
Effet mésomère attracteur d’un substituant
Un substituant exerce un effet mésomère attracteur (-M) s’il est susceptible d’appaubvrir un site d’électrons en délocalisant une paire d’électrons
Effet mésomère donneur
On parle d’effet mésomère donneur dans le cas d’un enrichissement en électrons. Il est observé en présence d’atomes qui portent au moins un doublet non liant.
Citer les propriétés des effets électroniques
1- L’effet mésomère prédomine généralement sur l’effet inductif
2- Un effet donneur l’emporte sur un effet attracteur
3- À signe égal l’effet mésomère l’emporte sur un effet inductif +M>+I et -M>-I