TOT QUÍMICA
1/137
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
138 Terms
Defineix la primera energia d’ionització i posa’n la reacció. Quin signe té?
L’energia d’ionització és l’energia necessària per arrencar un electró d’un àtom en estat fonamental i gasos. És un procés NO espontani. Té un signe positiu perquè és endotèrmic i absorbeix energia.
X (g) →X⁺ (g) + 1e⁻
Defineix la segona energia d’ionització i posa’n la reacció. Quin signe té? Com va variant les energies d’ionització cada vegada que s’arrenca un electró? Augmenten o disminueixen?
L’energia d’ionització és l’energia necessària per arrencar un electró d’un ió en estat gasos amb càrrega +1. És un procés NO espontani. Té un signe positiu perquè és endotèrmic i absorbeix energia.
X+ (g) →X⁺² (g) + 2e⁻
L’energia d’ionització va augmentant (1r Ei > 2n Ei > 3r Ei) perquè arrencar un electró d’un ió positiu costa més. Com Més carregat positivament està l’ió, costa més vèncer l’atracció que exerceix el nucli sobre els electrons.
Defineix l’afinitat electrònica i justifica quin signe té. Escriu la reacció.
Canvi d’energia que es produeix quan un àtom neutre en estat gasós capta un electró i forma un anió en estat gasós. Té un signe negatiu perquè és un procés exotèrmic.
X (g) + 1e⁻ →X⁻ (g)
Què és l’electronegativitat?
Tendència d’un àtom a atraure electrons quan és combina
Que és el volum atòmic?
L’espai que ocupa un àtom
Defineix el radi atòmic i iònic. Quin és més gran, el radi d’un anió, d’un àtom neutre o d’un catió?
R. atòmic: metitat de la distància del nucli de 2 àtoms que formen una estructura diatòmica, un enllaç covalent o un metàl·lic.
R. iònic: radi de l’ió resultant d’un àtom quan perd o guanya electrons.
R. aniònic > r. neutre > r. catiònic
El radi aniònic és més gran que el de l’àtom neutre perquè té més electrons.
(més e⁻ → més força de repulsió i apantallament → menys força d’atracció al nucli = + volum i + radi
El radi catiònic és més petit que el de l’àtom neutre perquè té menys electrons.
(menys e⁻ →menys força de repulsió i apantallament → més força d’atracció al nucli = - volum i - radi
Què és el caràcter metàl·lic i no-metàl·lic?
Metàl·lic: facilitat de perdre electrons (forma cations)
No-metàl·lic: facilitat de guanyar electrons (forma anions)
Què és el caràcter oxidant i reductor?
Oxidant: tendència a captar electrons (forma anions)
Reductor: tendència a perdre electrons (forma cations)
(Oxidant es redueix i reductor s’oxida)
Apantallament
Disminució de la força d’atracció del nucli sobre un electró per culpa de la repulsió entre electrons
Els electrons a prop del nucli (interns) apantallen (bloquegen parcialment) la càrrega positiva que exerceix el nucli sobre els electrons de valència (els que estan a la capa exterior)
electrons de valència → a < 1
electrons interns → a = 1
ex: un electró extern, més allunyat del nucli → més apantallat (hi haurà més electrons “davant” i “al voltant” seu → atracció que exerceix el nucli sobre l’electró és menor
Carga nuclear efectiva
Càrrega positiva neta que experimenta un electró degut a l’apantallament
Z eff = Z - a
Z = n.atómic
a = apantallament
Quin element en la configuració electrònica indica a quin grup pertany l’element?
El nombre de l’últim orbital més gran (s,p,d,f). En el cas de que sigui p, s’ha de sumar 12.
Exemples:
1s2, 2s2 → s2 → grup 2
1s2 2s2 2p6 → p6 → 6+12=18 → grup 18
Quin element en la configuració electrònica indica a quin període pertany l’element?
El nivell més gran (1,2,3,4…).
Exemples:
1s2 2s2 2p6 3s2 → període 3
Excepcions del model atòmic de Lewis
H: 2
Be: 4
B: 6
P: 10
S: 12
Regla de l’octet
Els àtoms són més estables quan aconsegueixen 8 electrons en la seva capa de valència (com els gasos nobles). Els àtoms de diferents poden assolir aquesta configuració estable compartint amb altres àtoms els electrons necessaris per arribar a tenir vuit electrons al nivell de valència.
Principi d’incertesa de Heisenberg
No és possible conèixer amb exactitud la posició i la velocitat d’una partícula de manera simultània.
Hipòtesi de DeBroglie
Les partícules poden comportar-se com a ones i viceversa (naturalesa dual).
Equació de Schrödinger i concepte d’orbital
L’orbital, fruit de l’equació de Schrödinger, és la zona de l’espai entorn del nucli en la qual hi ha una gran probabilitat de trobar l’electró.
Energía reticular
Energia que s’allibera en formar un sòlid iònic a partir dels seus ions.
Nombres quàntics d’un orbital i un electró
Orbital: (n,l,m)
Electró: (n,l,m,s)
Nombre quàntic principal, secundari, magnètic i d’espín
Principal (n): grandària de l’orbital (nombre natural)
Secundari (l): forma de l’orbital (s=0, p=1, d=2, f=3)
Magnètic (m): orientació de l’orbital (-l a +l)
Espín (s): sentit de gir de l’electró (+1/2, -1/2)

La regla de Hund
Afirma que els electrons en un conjunt d’orbitals es col·loquen el màxim desaparellats possible.
Principi d’Aufbau
Els orbitals s’ocupen començant per l’orbital que té menys energia i seguit pels altres orbitals en ordre creixent d’energia.
Principi d’exclusió de Pauli
En un àtom no hi pot haver dos electrons amb els quatre nombres quàntics iguals. En un mateix orbital hi caben com a màxim dos electrons que han de tenir espins oposats.
Què és l’enllaç iònic? Esmenta les propietats de l’enllaç: són conductors d’electricitat?, com són els enllaços? Com són les xarxes cristal·lines?
Metall i no-metall
Un cedeix i l’altre capta
Propietats
conductors d’electricitat en dissolució
enllaços forts → T de fusió i ebullició altes
forma sòlids
dur però fràgil (ex: vidre)
formen xares cristal·lines compactes i neutres
Què és l’enllaç covalent? Esmenta les propietats de l’enllaç: són conductors d’electricitat?, com són els enllaços? Com són les xarxes cristal·lines?
No-metall i no-metall
comparteixen electrons
Propietats
mals conductors de calor i electricitat
enllaç feble → T ebullició i fusió baixos
tous i fràgils
substàncies cristal·lines: àtoms neutres units mitjançant enllaços covalents formant làmines bidimensionals (capes)
Què és l’enllaç metàl·lic? Esmenta les propietats de l’enllaç
Metalls i metalls
els electrons es van movent, però els cations es queden enlloc (núvol d’electrons)
tendeixen a cedir (perdre) electrons en reaccionar amb altres substàncies
Propietats
bons conductors d’electricitat
brillant
aliatges amb altres metalls (barreges homogènies)
sòlids a T ambient (excepte Hg)
Com són les forces intermoleculars? Quin tipus hi ha?
enllaç dèbil en comparació amb l’enllaç intramolecular
molècules polars i apolars
Ponts d’hidrogen
més intenses
H unit a N, O o F
Forces de van der Waals
entre molèc. polars i apolars
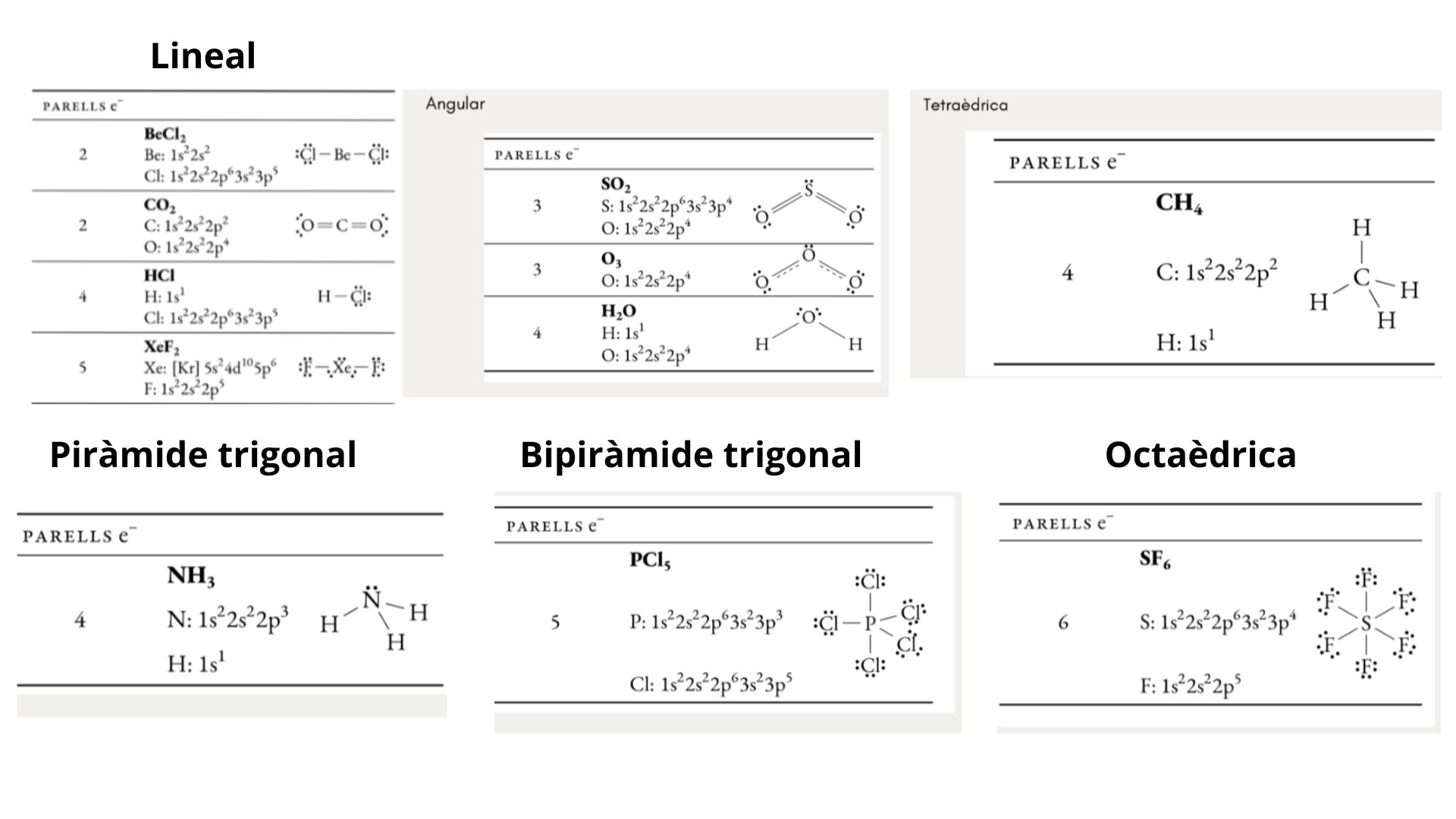
Dibuixa les següents geometries moleculars: lineal, trigonal plana, angular, tetraèdrica, piràmide trigonal, bipiràmide trigonal, octaèdrica
Explica la radiació infraroja (IR). Què volen dir els pics?
Es basa en l’ús de la part infraroja de l’espectre electromagnètic que és capaç de produir canvis vibracionals en la molècula. L’energia de la radiació provoca un salt d’energia des del nivell fonamental a un nivell excitat.
Els pics representen els canvis d’energia dels tipus de vibracions dels enllaços que conté la molècula.
Explica la ressonància magnètica de protó (RMN). Què volen dir els pics? Què és la multiplicitat?
La ressonància magnètica nuclear de protó (RMN) es basa en la interacció dels nuclis d’hidrogen amb un camp magnètic extern i una radiació d’ones de ràdio, que provoquen canvis en l’espín dels nuclis. Aquesta tècnica proporciona informació sobre la quantitat, el tipus i l'entorn químic dels protons dins una molècula.
La multiplicitat indica el nombre de pics que apareixen en un espectre RMN.
Explica l’espectrometria de masses. Què és el pic base? i el pic de l’ió molecular?
L’espectrometria de masses es basa en la producció d’ions d’un compost neutre (s’ionitza una mostra) i posteriorment, s’analitzen els ions.
Pic base: pic més alt — representa el fragment amb major abundància en la mostra (+ estable)
Pic de l’ió molecular: pic a la dreta del gràfic — massa molar del compost sense fragmentar
TRPECV
La Teoria de Repulsió de Parells d’Electrons de la Capa de València
(TRPECV) es basa en el fet que, com els electrons de valència es repel·leixen els uns als altres, aquests (els parells d’electrons) tendeixen a adoptar una disposició espacial que minimitza aquesta repulsió.
Quan s’assoleix un equilibri químic?
Quan les velocitats de la reacció directa i indirecta s’igualen i es mantenen invariables la concentració de reactius i productes

La temperatura afecta l’equilibri? (EQ)
Sí, perquè en cada temperatura s’assoleix un valor de la constant d’equilibri diferent
Explica que passa quan Qc < Kc? (EQ)
La reacció avança (→), és a dir, és una reacció directa perquè haurà d’augmentar la concentració de productes per assolir l’equlibri.
Explica el principi de Le Chatelier. Quins tipus de pertorbacions hi ha?
Si un sistema en equilibri està sotmès a una pertorbació externa, es modifiquen les condicions i el sistema es desplaça en el sentit en què es contraresti la pertorbació introduïda per poder tornar a assolir l’equilibri.
Tipus de pertorbacions: Concentració, temperatura i pressió-volum
Que passa quan Qc > Kc? (EQ)
La reacció retrocedeix (←), és a dir, és una reacció indirecta perquè haurà d’augmentar la concentració de reactius per assolir l’equilibri.
Segons el principi de Le Chatelier, que passa si s’augmenta la concentració de reactius o productes?
Reactius: La reacció es desplaça cap als productes (→) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Productes: La reacció es desplaça cap als reactius (←) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Que passa quan Qc = Kc (EQ)
La reacció/sistema està en equilibri
Segons el principi de Le Chatelier, que passa si es disminueix la concentració de reactius o productes?
Reactius: La reacció es desplaça cap als reactius (←) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Productes: La reacció es desplaça cap als productes (→) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Segons el principi de Le Chatelier, que passa si s’augmenta o es disminueix la temperatura en una reacció exotèrmica?
Augment de T: La reacció es desplaça cap als reactius.
Disminució de T: La reacció es desplaça cap als productes.
Segons el principi de Le Chatelier, que passa si s’augmenta o es disminueix la temperatura en una reacció endotèrmica?
Augment de T: La reacció es desplaça cap als productes.
Disminució de T: La reacció es desplaça cap als reactius.
Segons el principi de Le Chatelier, que passa si s’augmenta la pressió i es disminueix el volum?
El sistema es desplaça cap a on hi hagi menys mols
Segons el principi de Le Chatelier, que passa si es disminueix la pressió i s’augmenta el volum?
El sistema es desplaça cap a on hi hagi més mols
Els catalitzadors poden modificar l’equilibri?
No, només modifiquen la velocitat del sistema
Que passa quan Qs < Kps (EH)
És una dissolució insaturada, no hi ha precipitat.
Que passa quan Qs = Kps (EH)
És una dissolució saturada (equilibri, màxima quantitat de solut)
Que passa quan Qs > Kps (EH)
És una dissolució sobresaturada → forma precipitat
Efecte de l’ió comú
És el fenomen pel qual la solubilitat d’una sal disminueix quan s’afegeix a la solució un ió que ja hi és present com a resultat d’una altra substància.
Aquest efecte es basa en el principi de Le Châtelier, que diu que si augmenta la concentració dels productes, el sistema es desplaçarà cap als reactius per contrarestar la pertorbació. Per tant, es formarà més precipitat.
Solubilitat
La solubilitat és la quantitat màxima de solut que es pot dissoldre en una quantitat determinada de solució (solvent) a una certa temperatura. Per a cada temperatura s’assoleix una solubilitat diferent. (més temperatura, més solubilitat)
Teoria de les col·lisions (TC)
Per formar productes, els reactius s’han de xocar amb una correcta orientació espacial i suficient energia cinètica (L’Ek del xoc > E d’activació)
Teoria de l’estat de transició/complex activat (TET)
Abans que els reactius donin lloc als productes quan es xoquin, es forma una configuració molecular inestable de màxima energia (el complex activat).
Energia d’activació
Segons TC: Energia addicional que han d’absorbir les molècules dels reactius perquè, en xocar, es trenquin els seus enllaços i es puguin acabar formant els productes.
Segons TET: Energia addicional que han d’absorbir les molècules dels reactius perquè, en xocar, formi el complex activat i es puguin acabar formant els productes.
Com afecta la temperatura a la velocitat de la reacció?
Si augmenta la temperatura, augmenta la velocitat de reacció.
Segons TC: augment de T → augment d’energia cinètica (Ek) de les molècules dels reactius → augmenta l’energia dels xocs
Com afecta la concentració dels reactius a la velocitat de la reacció?
Si augmenta la concentració dels reactius, augmenta la velocitat de reacció.
Segons TC: augment de concentració de les molècules dels reactius → augmenta la probabilitat de xocs entre aquestes molècules
Com afecta l’estat físic dels reactius a la velocitat de la reacció?
Segons TC: v (gas) < v (líquid, dissolució) < v (sòlid)
Com afecta la naturalesa química dels reactius a la velocitat de la reacció?
Segons TET: més gran sigui el nombre d’enllaços de les molècules dels reactius i més forts siguin → Energia d’activació gran → reacció més lenta
(Si els reactius són ions en dció, normalment no cal trencar enllaços i les reaccions acostumen a ser més ràpides)
Com afecta un catalitzador a la velocitat de la reacció? Què és un catalitzador?
Un catalitzador és una substància que s’afegeix a la reacció que no es consumeix i augmenta la velocitat de la reacció. Modifiquen el mecanisme de reacció, disminuint l’energia d’activació, però no modifiquen el valor de la variació d’entalpia de la reacció.
Què és un mecanisme de reacció? Què és un intermedi de reacció? Quina etapa determina la velocitat de la reacció?
Un mecanisme de reacció és un conjunt de reaccions parcials anomenades etapes/reaccions elementals
Un intermedi de reacció és una substància que es forma en una de les etapes/reaccions elementals, però reacciona en una altra etapa. No apareix en la reacció global.
L’etapa lenta (amb energia d’activació més gran) determina la velocitat de la reacció perquè limita la concentració de reactius i productes i també determina els ordres parcials (normalment són els coeficients estequiomètrics).
Definició d’ordre de reacció
L’ordre de reacció és el número que ens diu com canvia la velocitat de la reacció quan canvia la concentració d’un reactiu.
Què vol dir que la variació d’entalpia sigui negativa? I positiva?
Variació entalpia POSITIVA: reacció endotèrmica
“ “ NEGATIVA: reacció exotèrmica
Què vol dir que la variació d’entropia sigui negativa? I positiva?
Variació d’entropia POSITIVA: reacció tendeix al desordre → desordre productes > desordre reactius
Variació d’entropia NEGATIVA: reacció tendeix a l’ordre → desordre productes < desorde reactius
Com es pot saber si una reacció és espontània o no?
Es pot saber l’espontaneïtat d’una reacció a partir de l’entalpia lliure de Gibbs
G < 0 → Espontani
G > 0 → NO espontani
G = 0 →Condicions d’equilibri
Condicions estàndard
T = 298 K
P = 1 atm
Condicions normals
T = 273 K
P = 1 atm
Isotèrmic
Temperatura constant
Isocor
Volum constant
Isobàric
Pressió constant
Adiabàtic
Sense intercanvi d’energia
Exotèrmic
Despren calor (entalpia negativa)
Endotèrmic
Absorbeix calor
Entalpia de vaportizació
Quantitat d’energia en forma de calor a pressió constant per passar d’estat líquid a estat gasós a una determinada temperatura
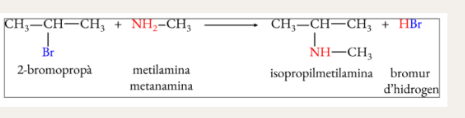
Halogenació d’alcans (substitució)

Substitució d’un halogen per un altre

Transformació d’un derivat halogenat en un alcohol (substitució)

Transformació d’un derivat halogenat en un èter (substitució)

Transformació d’un derivat halogenat en una amina primària (substitució)

Transformació d’un derivat halogenat en una amina secundària (o terciària) (subtitució)
Hidrogenació catalítica d’alquens (addició)
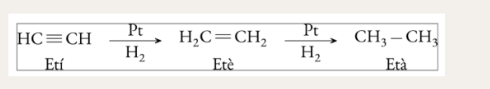
Halogenació d’alquens (addició)
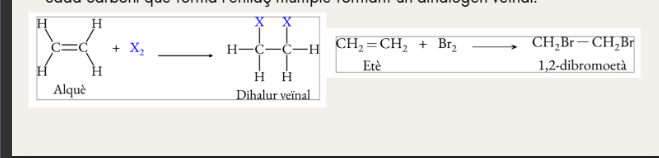
Hidrohalogenació d’alquens (addició)
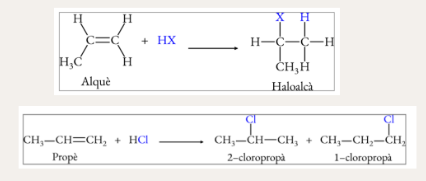
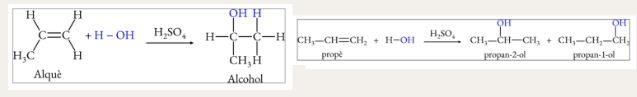
Hidratació d’alquens (addició)
Deshidrogenació (eliminació)

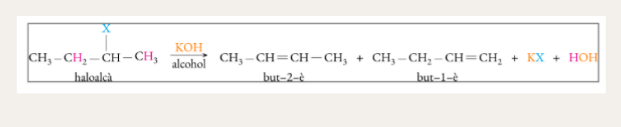
Deshidrohalogenació d’halurs d’alquil (eliminació)
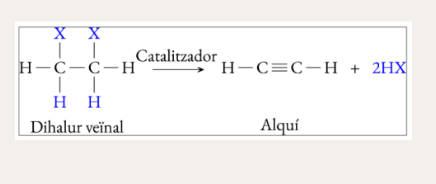
Deshidrohalogenació de dihalurs veïnals (eliminació)
Deshidratació d’alcohols (eliminació)

Oxidació-reducció (redox): alcohols primaris
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span style="font-size: 1.6rem">permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/901dc0d6-2acc-4194-97bd-8a50a419e302.png)
Oxidació-reducció (redox): alcohols secundari
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span>permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/86af5553-8e5b-4110-9f00-156d4540c1d0.png)
Oxidació-reducció (redox): alcohols terciaris
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span>permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/5e8c812d-a0ca-4348-bf1e-3e6d697e6a04.png)
Combustió

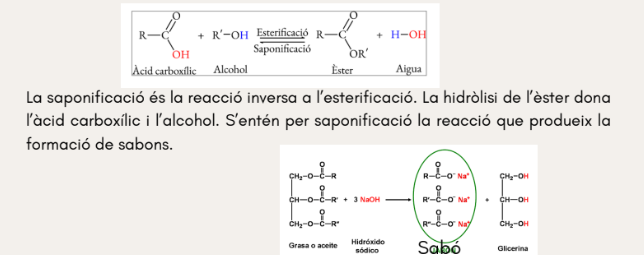
R. Condensació i hidròlisis: esterificació i saponificació
R. Condensació i hidròlisis: condensació d’alcohols

R. Condensació i hidròlisis: condensació per a donar amides

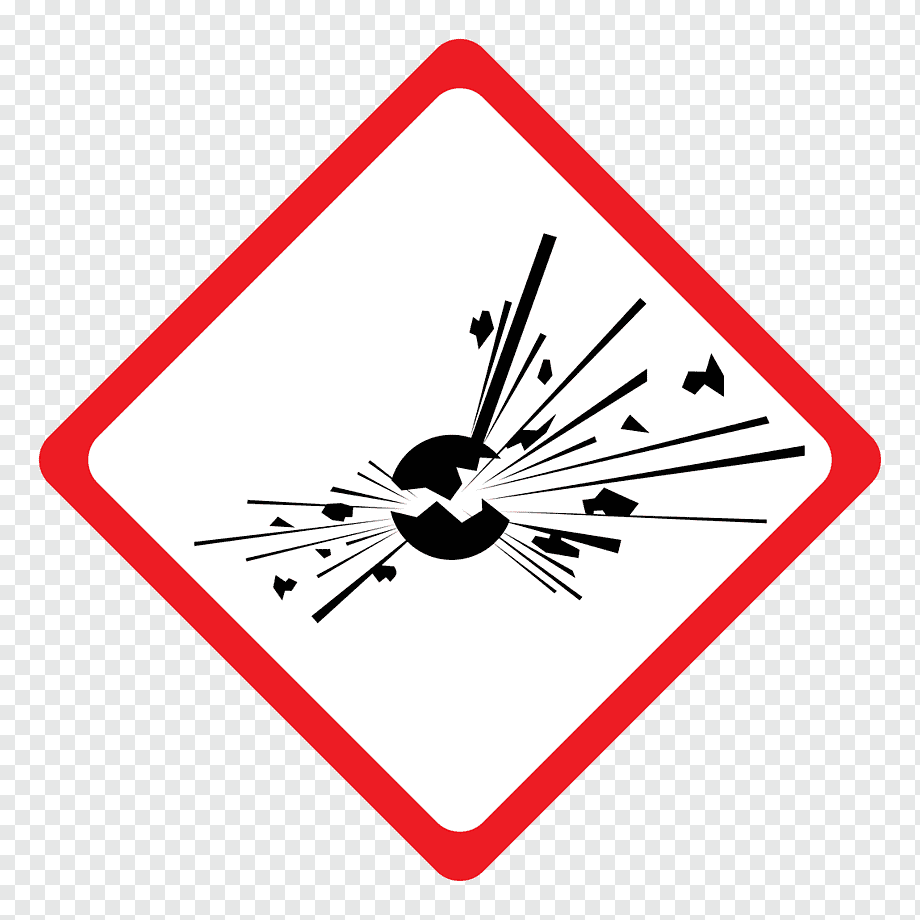
Que representa aquest pictograma i quins problemes pot causar?
EXPLOSIU
Aquest producte pot explotar al estar en contacte amb una flama, espurna, electricitat estàtica, sota l’efecte de la calor, en contacte amb altres productes, per fregaments, xocs, fricció, etc.

Que representa aquest pictograma i quins problemes pot causar?
INFLAMABLE
Aquest producte crema molt fàcilment, fins i tot per sota de 0 °C, en contacte amb una flama, una espurna, electricitat estàtica, etc. per calor o fricció, en contacte amb l’aire o aigua, o si s’alliberen gasos inflamables. Els productes amb aquest pictograma acostumen a ser en format gas, aerosol, líquid o vapor i presenten un risc d’inflamació.
La inhalació de vapors tòxics o irritants pot causar mareig i nàusees.

Que representa aquest pictograma i quins problemes pot causar?
COMBURENT
Aquest producte és ric en oxigen que en contacte amb altres substàncies, sobretot inflamables, pot provocar, avivar o agreujar un incendi o una explosió.

Que representa aquest pictograma i quins problemes pot causar?
GAS
El producte és un envàs amb gas a pressió. Alguns poden explotar amb la calor (com gasos comprimits) o poden causar cremades o ferides criogèniques, si estan a molt baixa temperatura.
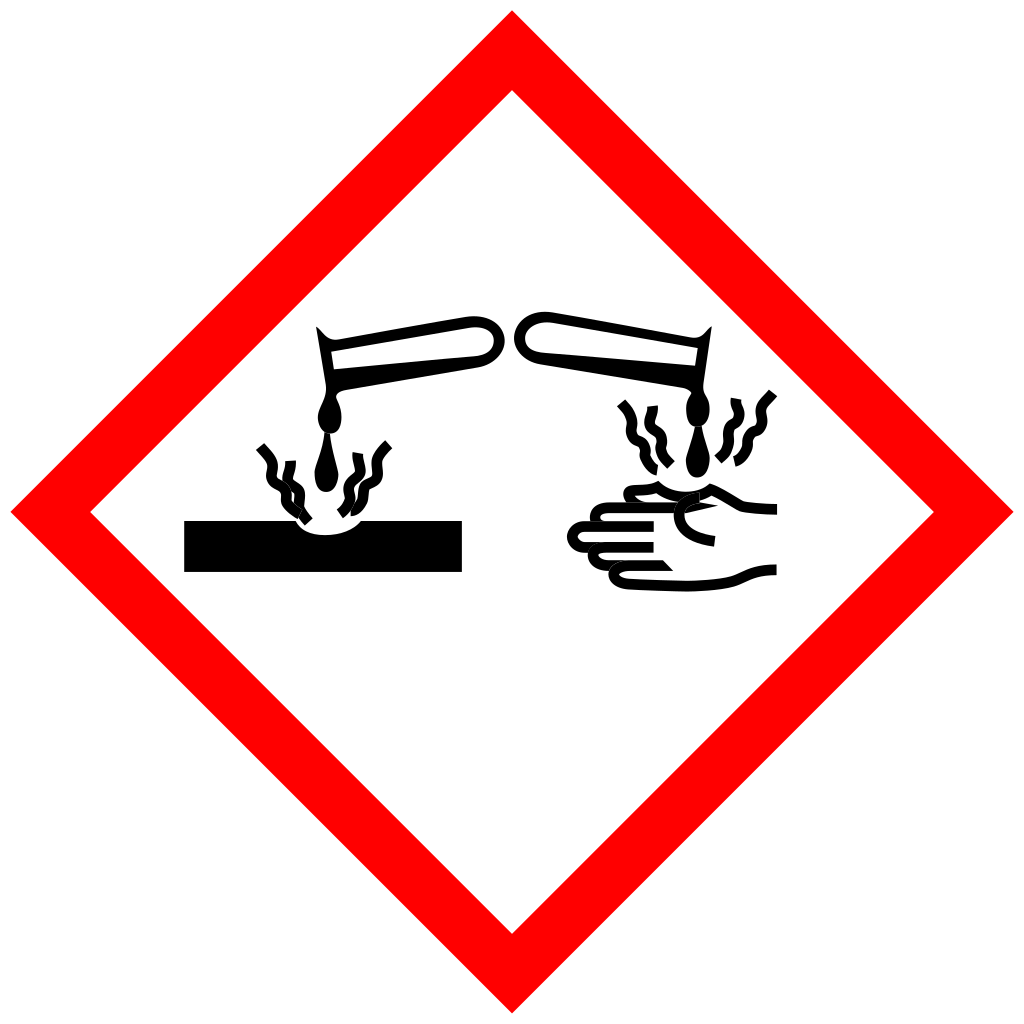
Que representa aquest pictograma i quins problemes pot causar?
CORROSIU
El producte pot atacar o destruir metalls i causar danys irreversibles a la pell, ulls o altres teixits vius, en cas de contacte o projecció.

Que representa aquest pictograma i quins problemes pot causar?
TOXICITAT AGUDA
El producte genera efectes adversos per a la salut, fins i tot en petites quantitats, pot provocar problemes aguts o crònics i inclús causar la mort. En entrar-hi en contacte es poden sentir nàusees, vòmits, mals de cap, pèrdua de coneixement…

Que representa aquest pictograma i quins problemes pot causar?
IRRITACIÓ CUTÀNIA
Contacte breu, perllongat o repetitiu amb la pell o les mucoses pot provocar una reacció inflamatòria. (irritació en ulls, gola, nas, pell, al·lèrgies, etc.)