Thermo : Chapitre 2 - Principe 0 et 1er principe de thermodynamique Cartes | Quizlet
1/22
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
23 Terms
Qu'est-ce que l'énergie interne U
Forme d'énergie propre au système
fonction d'état extensive du système isolé
exprimé en Joule (J)
On a une variation d'énergie interne :
- Pour un système fermé non soumis à un champ de forces volumiques
- Lorsque le système est macroscopiquement au repos
- Pour une transformation où le système transfère du travail et de la chaleur avec le ME
Premier principe de thermodynamique
"Il y a équivalence entre les formes d'énergie"
- L'énergie se conserve : elle ne peut ni être créer ni détruite
- L'énergie d'un système isolé est constante
- Au cours d'une transformation d'un système, la variation d'énergie totale est égale à la somme des quantités d'énergies échangées avec le Milieu Extérieur : ∆Et = Q + W
enthalpie H
- fonction d'état donc dH est une différentielle totale exacte
- notée H = U + PV = U + nRT
- ∆H > 0 = réaction endothermique
- ∆H < 0 = réaction exothermique
- Pour une transformation isotherme avec production de gaz :
∆H = ∆U + ∆n(gaz)RT
∆n(gaz) = variation du nombre de mol de gaz
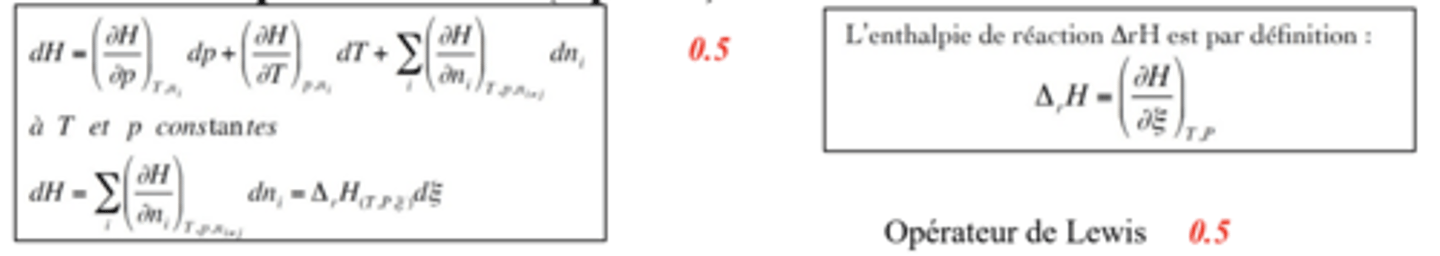
Enthalpie de réaction H
- "enthalpie de réaction supposée totale où les réactifs et les produits sont dans un état donné à une température donné
- Loi de Hess
Quel est le principe 0 de thermo
"On peut définir la température d'un corps"
Que reflète la température d'un corps
La température reflète l'agitation thermique de ses particules
A l'échelle microscopique, l'énergie est défini comme :
la somme de :
- toutes les Ec associés aux particules
-toutes les Ep associés à leurs intéractions
Caractéristiques de l'énergie (5 points)
-Concept intuitif
-Peut prendre différentes formes
-Grandeur scalaire en Joule (J)
-Fonction homogène de la masse (extensive)
-Fonction d'état
Caractéristique d'un échange d'énergie entre le système et le milieu extérieur
Peut se faire soit sous forme de Travail, soit sous forme de Chaleur, soit sous les 2 à la fois
Travail et Chaleur sont des fonctions d'état ? Pourquoi
NON
elles dépendent chacune du chemin parcouru
Qu'est-ce que le Travail W
- Façon de transférer de l'énergie entre un système et son environnement
- Toutes actions physiques permettant l'élévation d'une masse. - Communication d'un mouvement cohérent aux particules
- Inversement, quand un système fournit du travail, il tend à rendre cohérent le mouvement des particules du ME
Qu'est-ce que la Chaleur Q
- Transfert d'énergie qui provient de la différence d'énergie entre un système et son environnement.
- Lorsqu'un système chauffe, ses particules ont un mouvement incohérent (agitation thermique)
Énergies d'origine renouvelable
Formes d'énergie dont la consommation ne diminue pas la ressource à l'échelle humaine.
Formule variation d'énergie interne (2 formules)
U2 - U1 = (W + Q)
ou
U2 - U1 = (U2 - U1)i + (U2 - U1)e
Formule de la variation d'énergie interne pour une transformation élémentaire
dU = δW + δQ
W+Q est une fonction d'état ? Pourquoi
Oui
car il est indépendant du chemin parcouru par la transformation
Formule de la variation d'énergie interne pour une transformation finie
U2 - U1 = (U2 - U1)e
Formule de la variation d'énergie interne pour une transformation finie élémentaire
dU = δUe
Formule variation de travail δW
δW = -P*dV
Formule Travail pour une transformation isotherme réversible
Wrev = -nRT*ln(V2/V1)
Formule Travail pour une transformation isotherme irréversible
Wirrév = -P(V2-V1)
(Rq : P peut être P1 ou P2 en fonction duquel des 2 est constant)
De Wrev et Wirrév, lequel des 2 est le plus grand ?
Wrev > Wirrev