Chemie KA 2
1/45
Earn XP
Description and Tags
Aromaten, Kunststoffe , Reaktionsmechanismen
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
46 Terms
Eigenschaften von Benzol
wasserklar, in Wasser wenig löslich, in hydrophoben Lösungsmittel löslich
Leicht beweglich
Stark lichtbrechende Flüssigkeit
Siedet bei 80 C, fest bei 6C
Besteht aus unpolaren Molekülen da in Fett löslich
London WW
Gewinnung von Benzol
beim Verkorken von Steinkohle
Heute: über 90% aus Ölrafinieren
Wo wird Benzol verwendet ?
lange Zeit Benzin zugesetzt, da Erhöhung Klopffestigkeit (Nur 1% wegen Gesundheit)
Wichtiger Ausgangsstoff für Kunststoffe/Waschmittel
LD50-Wert
Akute Toxizität
Ermittlung der Dosis Tödlichkeit für Giftigkeit eines Stoffes
Maß für Giftigkeit= Dosis bei der 50% aller Versuchstiere sterben (LD50Wert)
AGW
Arbeitsplatzgrenzwert
Gesetzliche Grenzwerte, wie groß die durchschnittlich Konzentration bestimmter Stoffe in der Luft am Arbeitsplatz sein darf
Bis zum AGW keine Schädigung der Gesundheit, selbst bei 8 Stunden Arbeit pro Tag
BGW
Biologischer Grenzwert
— Maximal Zulässige Konzentration, bei der keine Schädigung zu erwarten ist
wie sind die Bindungsverhältnise im Benzol und was folgt daraus ?
delokalisiert → konstanter Dauerzustand
→ Elektronen nicht an C-C Doppelbindungen fixiert, sondern sind immer in Bewegung/über den ganzen Ring aus verteilt
Was folgt daraus ?
Stabilität, da energisch besonders günstig → Ursache für Reaktionsverhalten
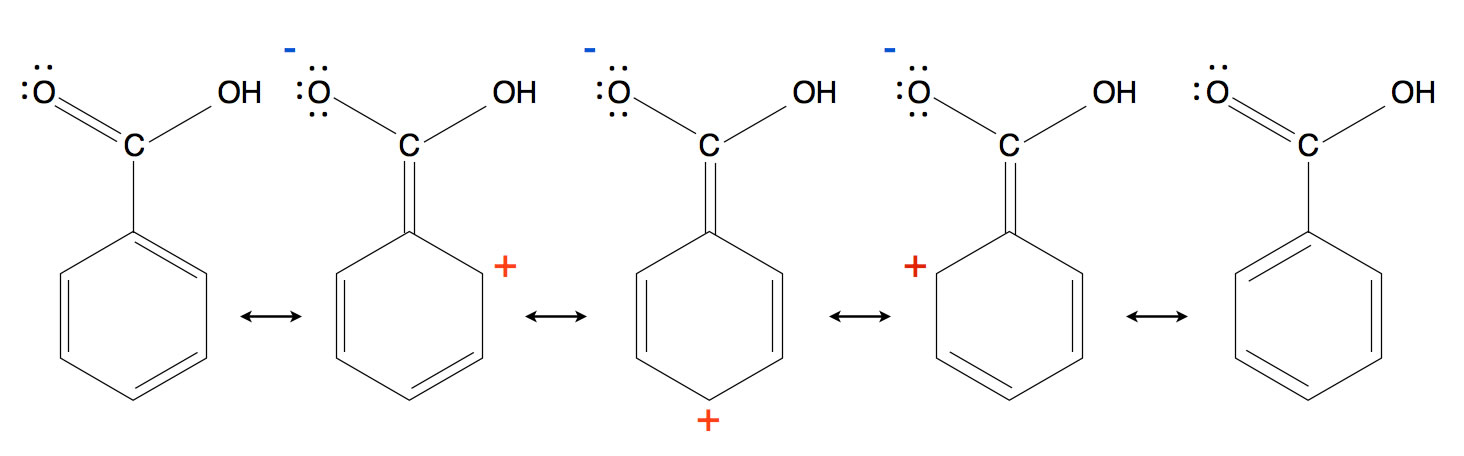
Mesomerie + mesomere Grenzformel
Wenn ein Molekül/mehratomiges Ion nicht durch eine einzige Strukturformel beschrieben werden kann → mehrere Grenzformeln
Bsp Benzol
Elektronen können sich verschieben → verschiedene Bindungsverhältnise treten auf
Mesomerie durch Mesomeriepfeil gekennzeichnet
Je mehr mesomere Grenzformeln es gibt, desto stabiler das Molekül/Ion

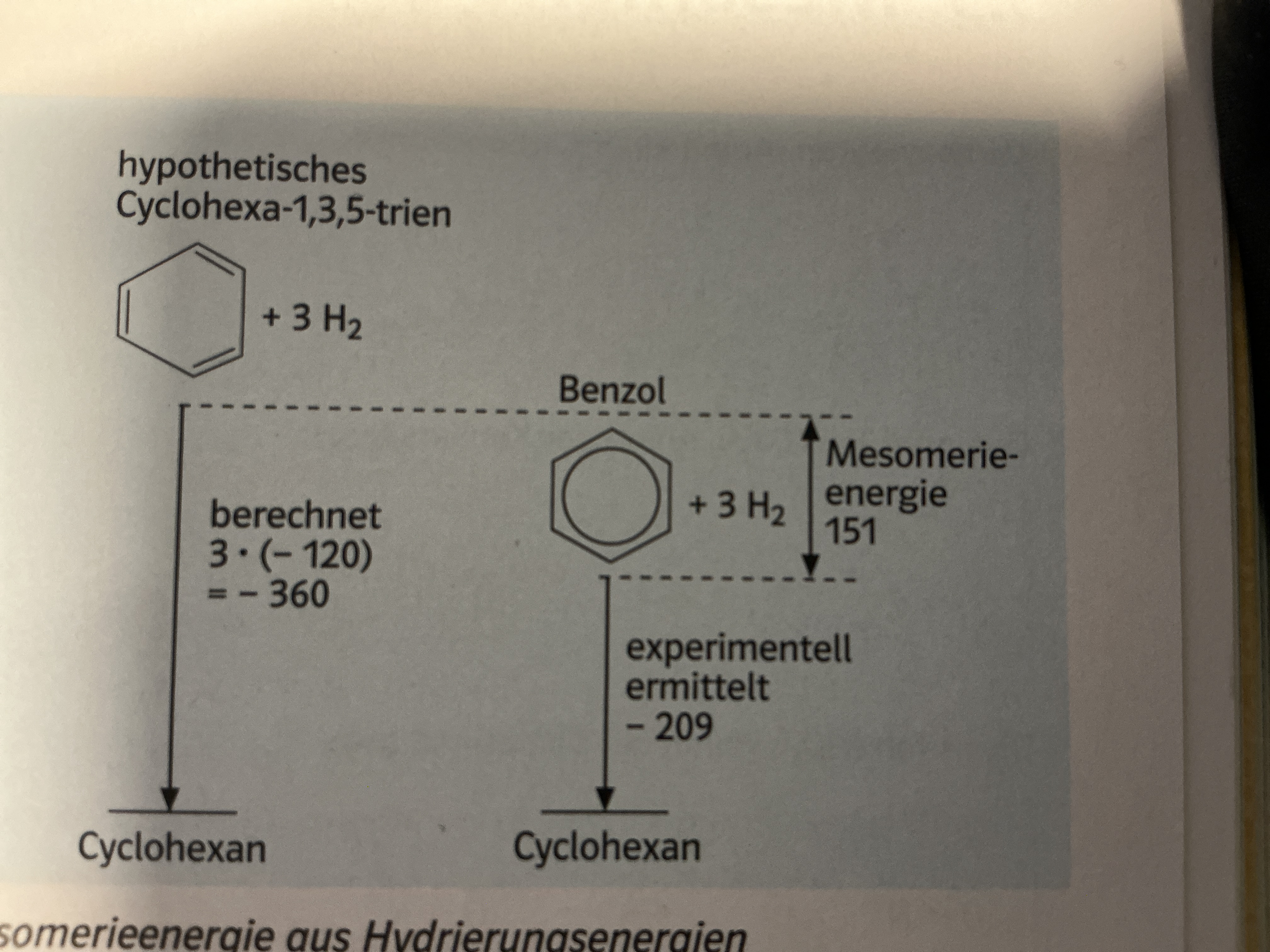
Mesomerieenergie
Energiebetrag, um den das echte Benzol Molekül gegenüber dem fiktiven Molekül gemäß einer Grenzformel als stabiler erweist
Bzw.
Die Energie, die das Molekül extra gewinnt, weil die Elektronen sich verteilen
Abbildung:
Echtes Molekül um 151 kj/mol stabiler, da delokalisierung
Aufbau Elektornen Benzol Molekül
zwischen je 2 C-Atomen ein bindendes Elektronenpaar
Weitere 6 Elektronen delokalisiert
Alle C-C Bindungen von selber Länge → regelmäßiges, ebenes Sechseck
Kennzeichen aromatischer Moleküle
Aromaten sind ebene, cyclische Moleküle
Das Ring-Molekül hat durchgehendes System aus Einfach-und Doppelbindungen mit delokalisierten Elektronen (Doppel und Einfach müssen abwechseln)
Anzahl delokalisierten Elektronenpaare ungerade (Hückel-Regel: 4n+2), n für Anzahl der Ringe
Molekül zeigt eine hohe Mesomerieenergie
Definition Aromate
hist: angenehmer Geruch
Heute: mesomeriestabilierte ebene/cyclische Moleküle
Kekulé
Vorschlag des heutigen Benzols (Oszillationstheorie)
Theorie heute überholt, jedoch C-C Bindungen von dieser Art
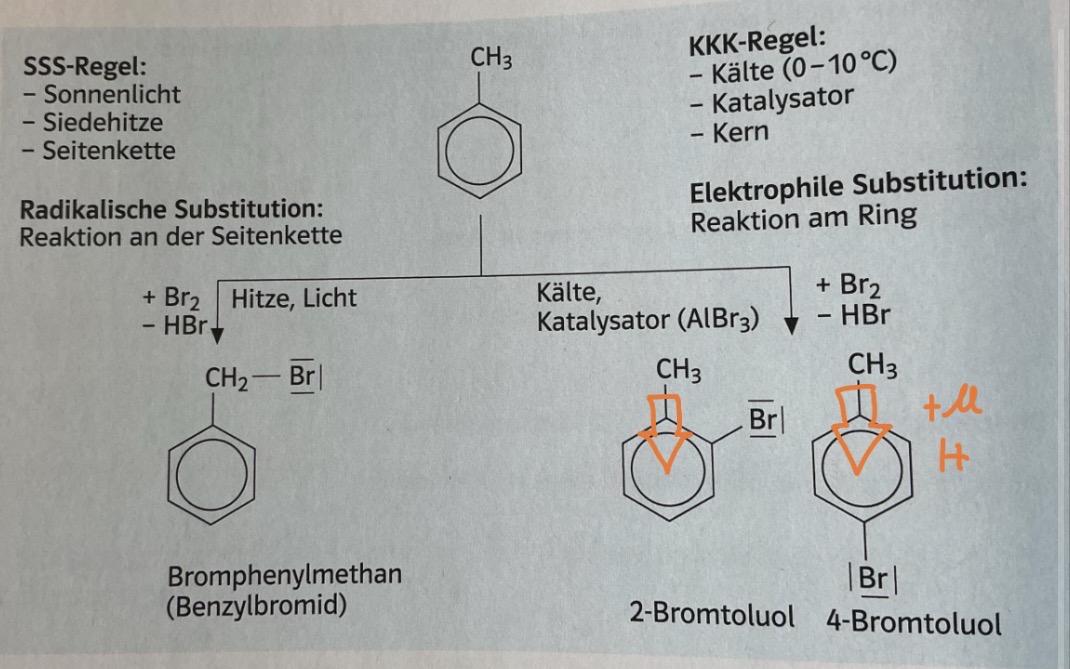
Bromierung von Benzol
Unter Anwesenheit von Eisenspänen reagiert Brom mit Benzol
Entstehung eines Gases → verfärbt Bromthymolblau gelb; Trübung der Lösung von AgNO3
Gas → Farbumschlag BTB blau → gelb; neutral → sauer
Trübung Silbernitratlösung: Halogenidnachweis → Br-
Bei der Reaktion entsteht HBr (Bromwasserstoff aq)
HBr g + H2O l ←→ Br- + H3O+ aq
Reaktionsgleichung:
C6H6 + Br2 → Kat: FeBr3 / C6H5Br + HBr (+FeBr3)
Halogenierung von Benzol + Reaktionsmechanismus
Brom zu Benzol → braune Lösung
Nach Zugabe Eisen (III)-bromid als Kat → Entfärbung LSG
→ Nachweis Bromwasserstoff
→ exotherm
→ Substitution H durch Br
Schritt: Elektrophile Angriff und heterolytische Spaltung → Br2 gleichmäßig wegen Ladungsverschiedenheiten aufgelöst, 1 Br zu Benzol, 1 zu Kat → Benzol positive Ladung da Doppelbindung zu Br geht, welcher e- braucht
Schritt: Deprontonierung/Rearomatisierung / Anenium Ion trotz delokalisierten + Ladung instabil → H wird von Kat gestohlen, dabei geht vorherige Bindung mit H zu Benzol → Aromatischer Zustand wieder da ; Kat wieder Ausgangzustand , Das H kann mit Br von Kat verbinden
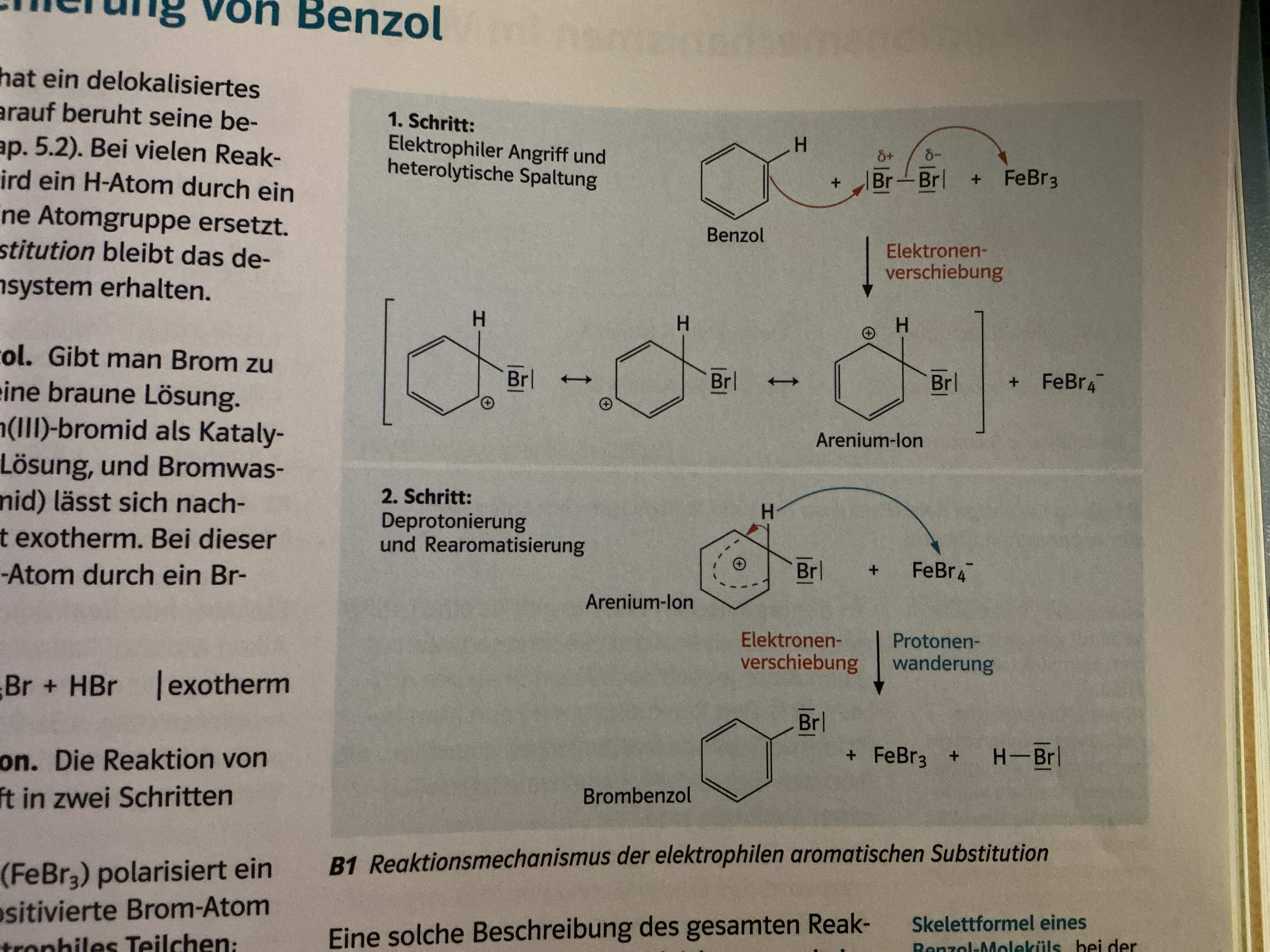
Elektrophile Substitution
Vorgehen an aromatischen Ringen
Atom wird ausgetauscht (meist H), Aromat bleibt erhalten
Substitution nur mit Kat möglich
Entstehung von Partialladungen beim Molekül des angreifenden Teilchens /Mesomerie am angegriffenen Teilchen
Angreifendes Teilchen bindet an 1 C-Atom / +Ladung beim angegriffenen Teilchen
H-Atom wird abgespalten
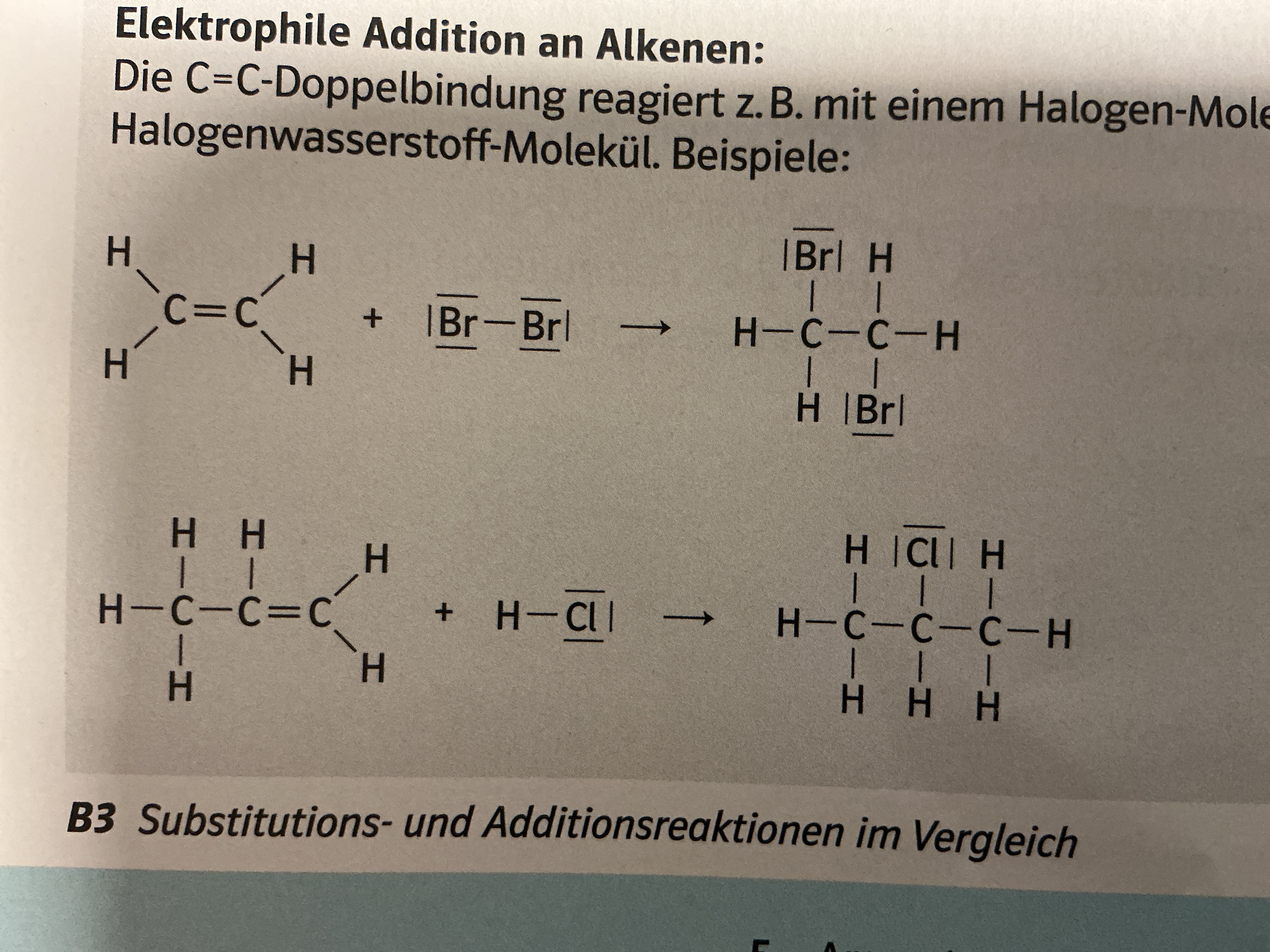
Elektrophile Addition
Vorgehen an Doppelbindungen (Alken,Ethen)
Etwas kommt hinzu → Molekül wird gesättigter
Nur mit Kat möglich , keine Mesomerie (aber Doppelbindung)
Angreifendes Teilchen bindet an 2 C-Atome , +Ladung beim angreifenden Teilchen
H-Atome bleiben
SSS/KKK Regel
SSS→ radikalische Substitution am Alkylrest // Reaktion an der Seitenkette
Sonnenlicht
Siedehitze
Seitenkette
KKK→ Elektrophile Substitution am Aromaten // Reaktion am Ring
Kälte (0-10C)
Katalysator
Kern
Stellungen am Benzolring
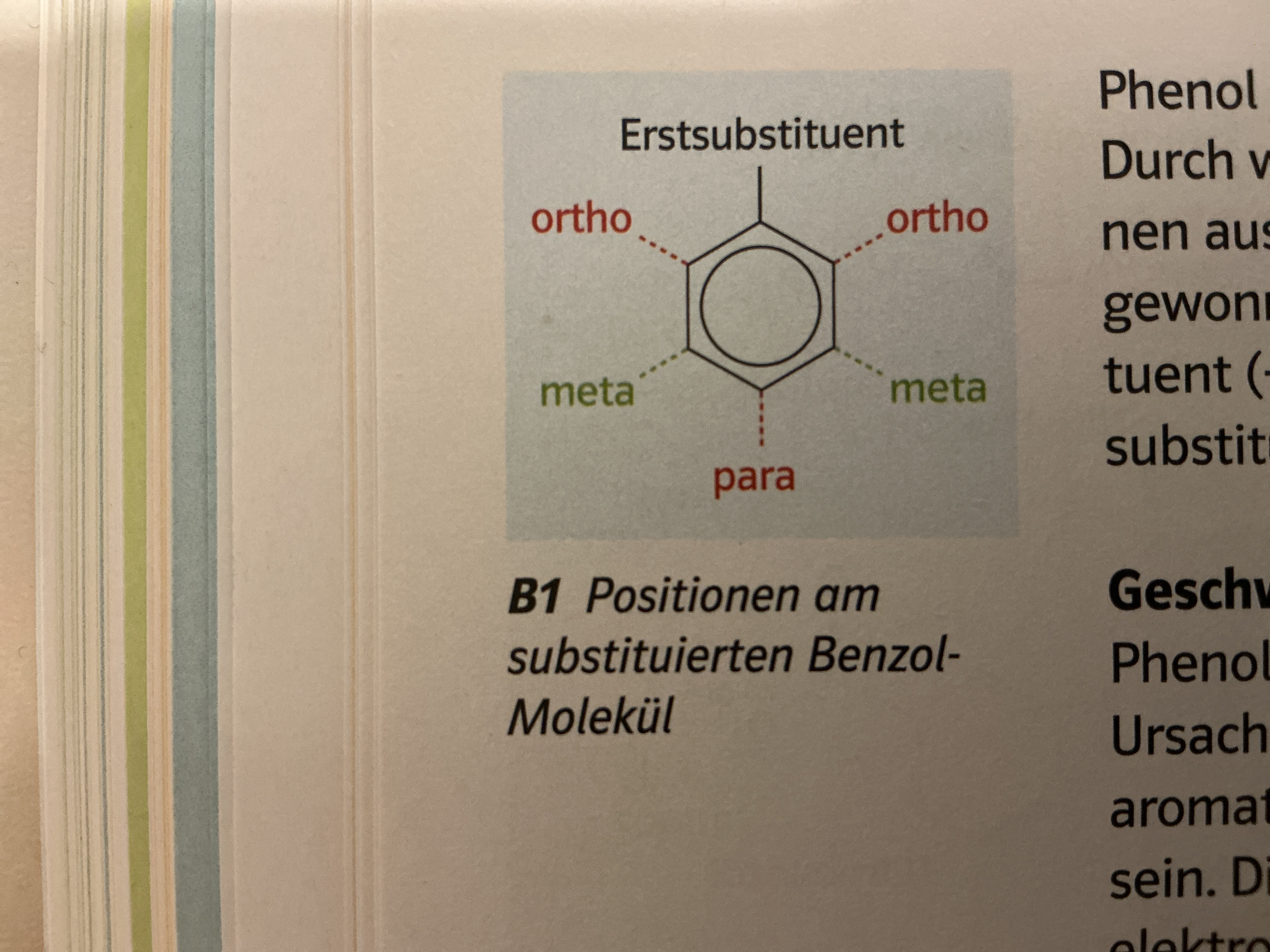
Substituenteneffekte: Induktiver Effekt (I-Effekt)
+I-Effekt: Elektronen schiebend , Alkyl (CH3)
-I Effekt: Elektronen ziehend, Cl, Br
→ Abhängig von EN
Gleichen den M-Effekten sind aber viel schwächer
Beide ortho/para dirigierend
Ändert sich Elektronendichte im Ring als Folge einer EN Differenz zum C-Atom, wird vom I-Effekt gesprochen
Substituenteneffekte mesomere Effekt (M-Effekt)
+M Effekt: positives mesomeren Effekt → Erhöhung der e- dichte im Ring (aktiviert)
Wie: e- in Ring geschoben
Substituenten → OH,NH2,OR,NR → ortho, para dirigierend
subs. Müssen freies elektronenpaar zur Verfügung haben
Elektrophile substitution
Reduziert Basenstärke , da funktionelle Gruppe elektron abgibt
-M Effekt: Elektronendichte wird im Ring erniedrigt (deaktiviert, Reaktivität reduziert)
E- wird rausgezogen aus Ring
Substituenten: NO2, CHO, COOH →+ Ladung an ortho, para
Subs benötigt doppelt oder dreifach Bindung
Kann entstehendes Anion einer Säure stabilisieren
was sind derivate?
„Abkömmlinge“ des Benzols
Verbindungen, bei denen ein oder mehrere H-Atome des Rings durch andere Atome/funktionelle Gruppen ersetzt werden
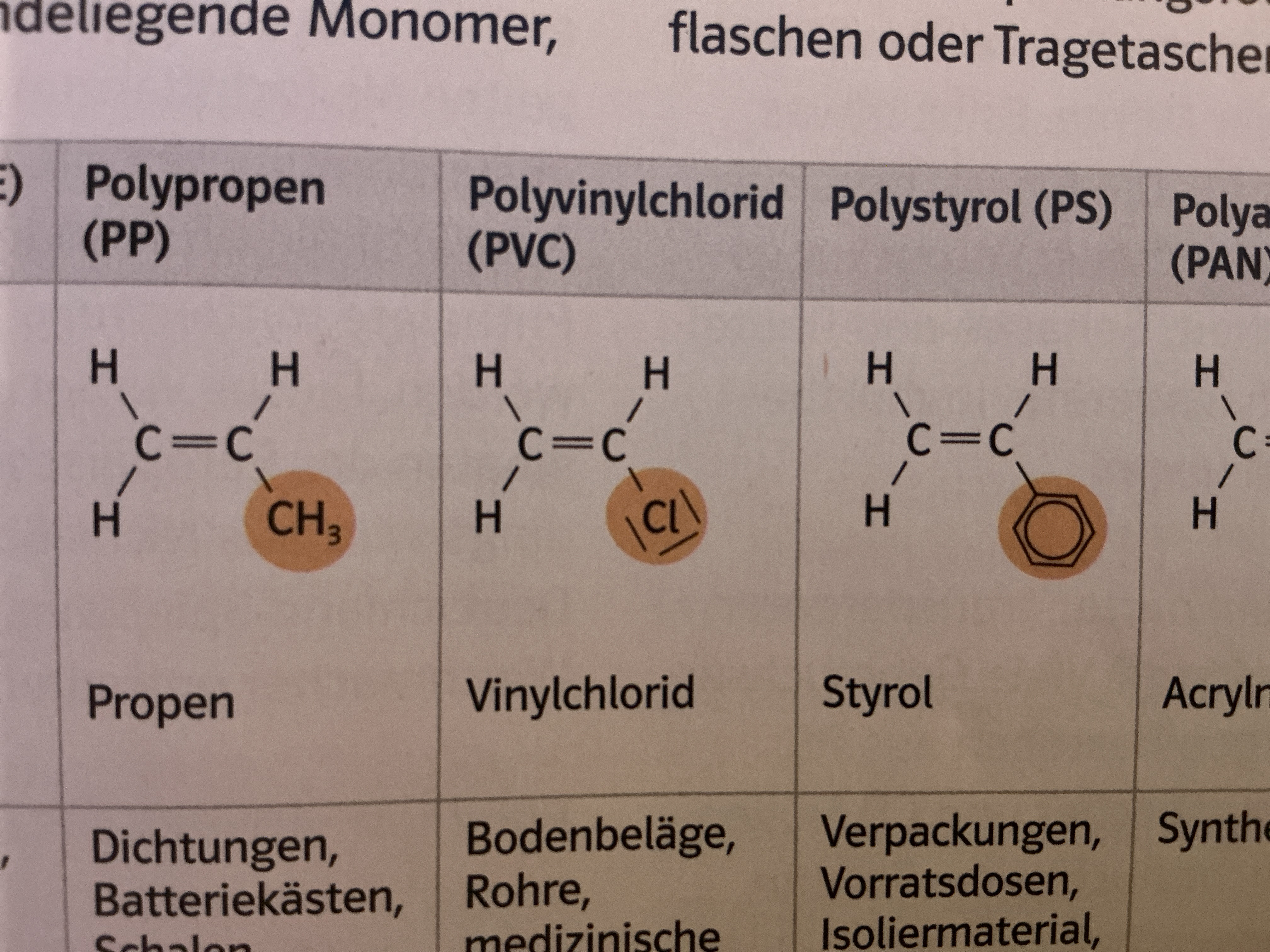
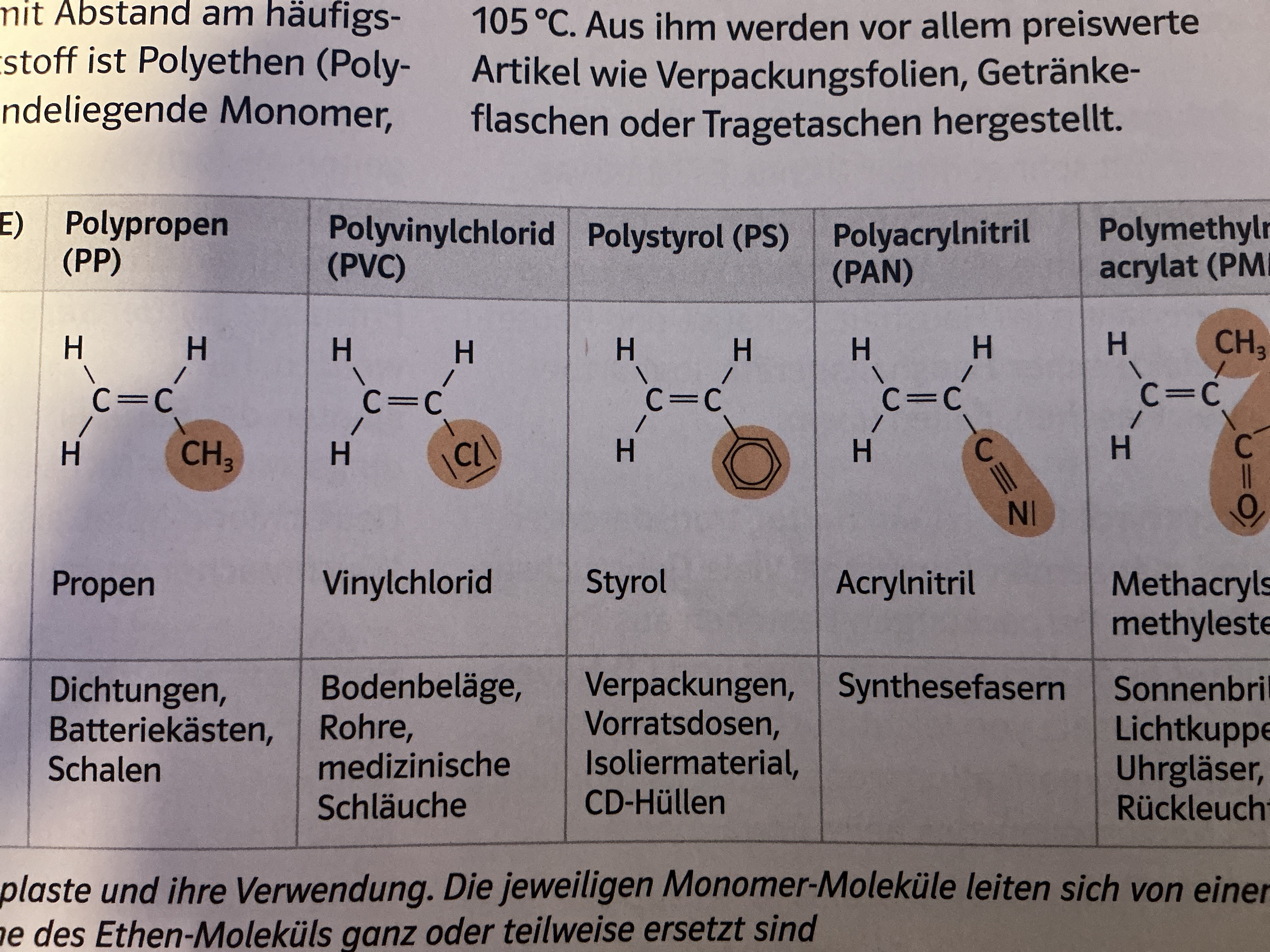
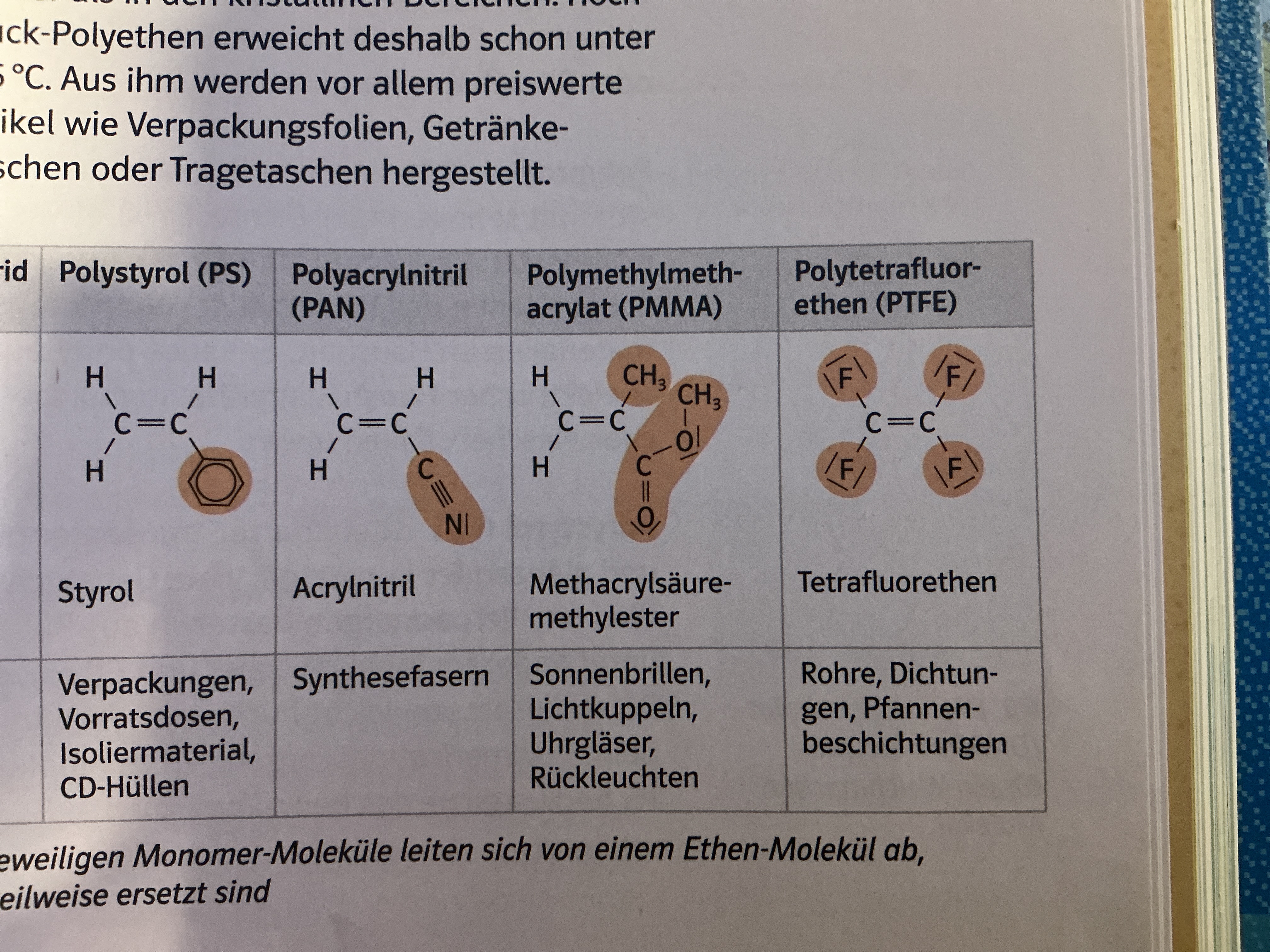
Kunststoffe
Polymere (Makromoleküle aus sich wiederholende Grundbaustein)
Werkstoffe, die künstlich oder durch Abwandlung von Naturprodukten entstehen
Polymerisate
Monomere mit C=C Doppelbindung
Radikalische Polymerisation
Z.B. PMMA, PE, PVC
Polykondensate
Polyester, Polyamide, Polycarbonate
Polykondensation
Nylon, Perlon, Polyesterfasern, PET
Monomere mit 2 funktionellen Gruppen
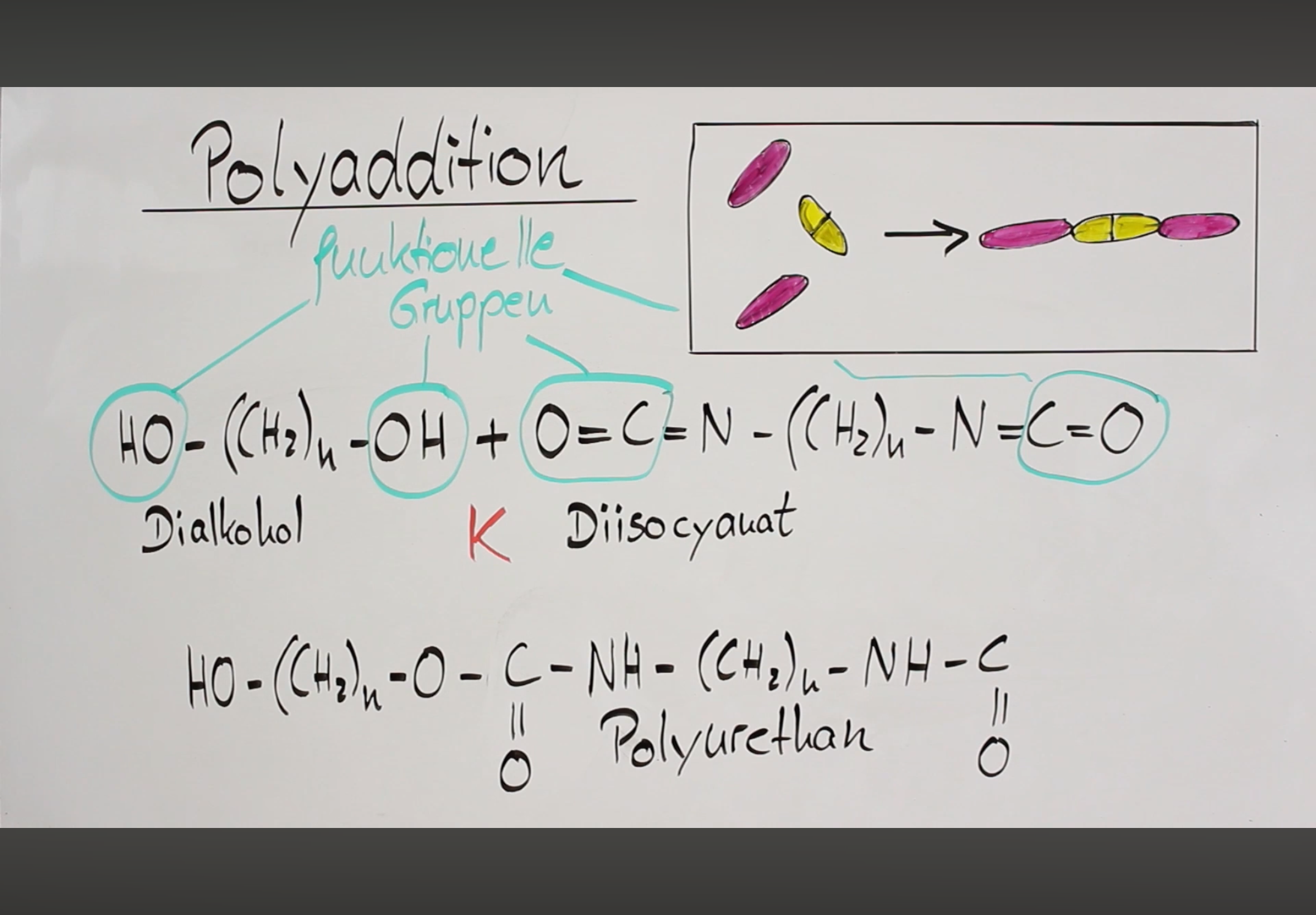
Polyaddukte
Polyurethane
Polyaddition
Schaumstoffe (Bauschaum, Dämmstoffe, Dämpfung)
Monomere mit 2 funktionellen Gruppen
Polykondensation Versuch
Glycerin reagiert mit Bernsteinsäure
(Propan 1,2,3-Triol) mit (Butan-1,4-disäure)
Reagenzglas mit 1ml Glycerin, 3,5g Bernsteinsäure wird zugeführt
Watte über Lösung, vorsichtige Erhitzung
Kristallisieren der Lösung
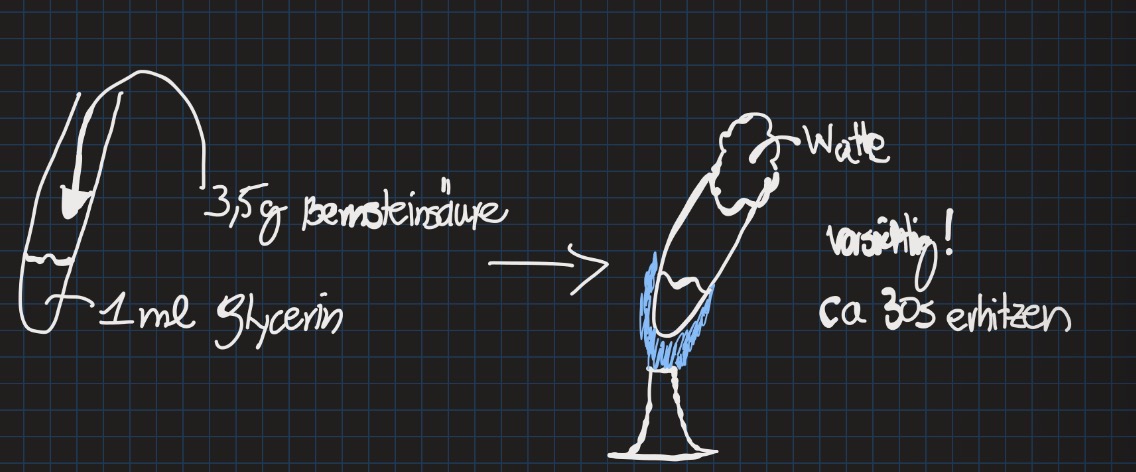
Polykondensation Reaktionsmechanismus
Monomer Moleküle mit mindestens 2 funktionellen Gruppen werden unter Abspaltung von kleineren Molekülen (H2O,HCl) zu Polymer-Molekülen verknüpft
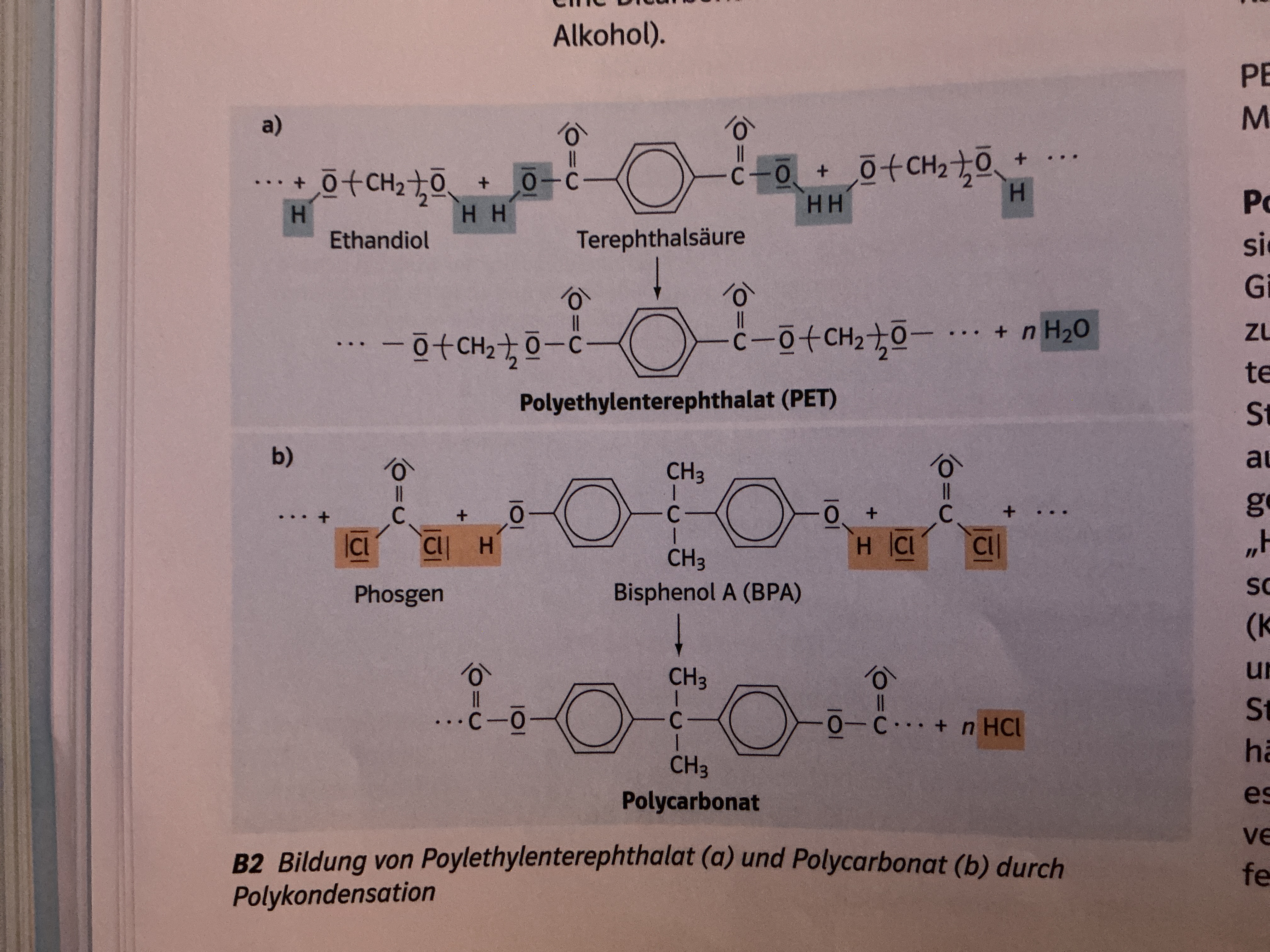
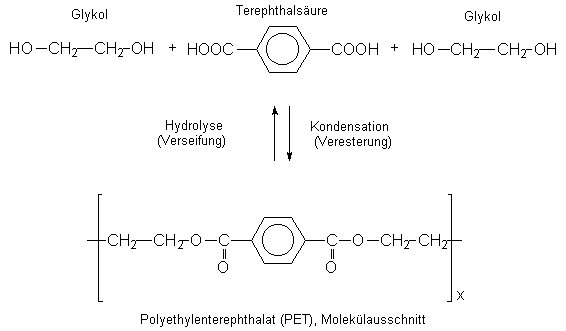
Wichtige Polyester: PET
Polyethylenterephatalat
Thermoplast
Ursprünglich → Alternativ zur Herstellung von Textilfaser
Heute → Material in Verpackungs/Textilindustrie; weltweite Bekanntheit durch Einsatz bei Produktion von Getränkeflaschen
Im Gegensatz zu Glasflaschen Bruchsicherheit, geringeres Gewicht, einfaches Handling
Herstellung aus Dicarbonsäure und Dialkohol → Verbindung zu langen Polymerketten +H2O
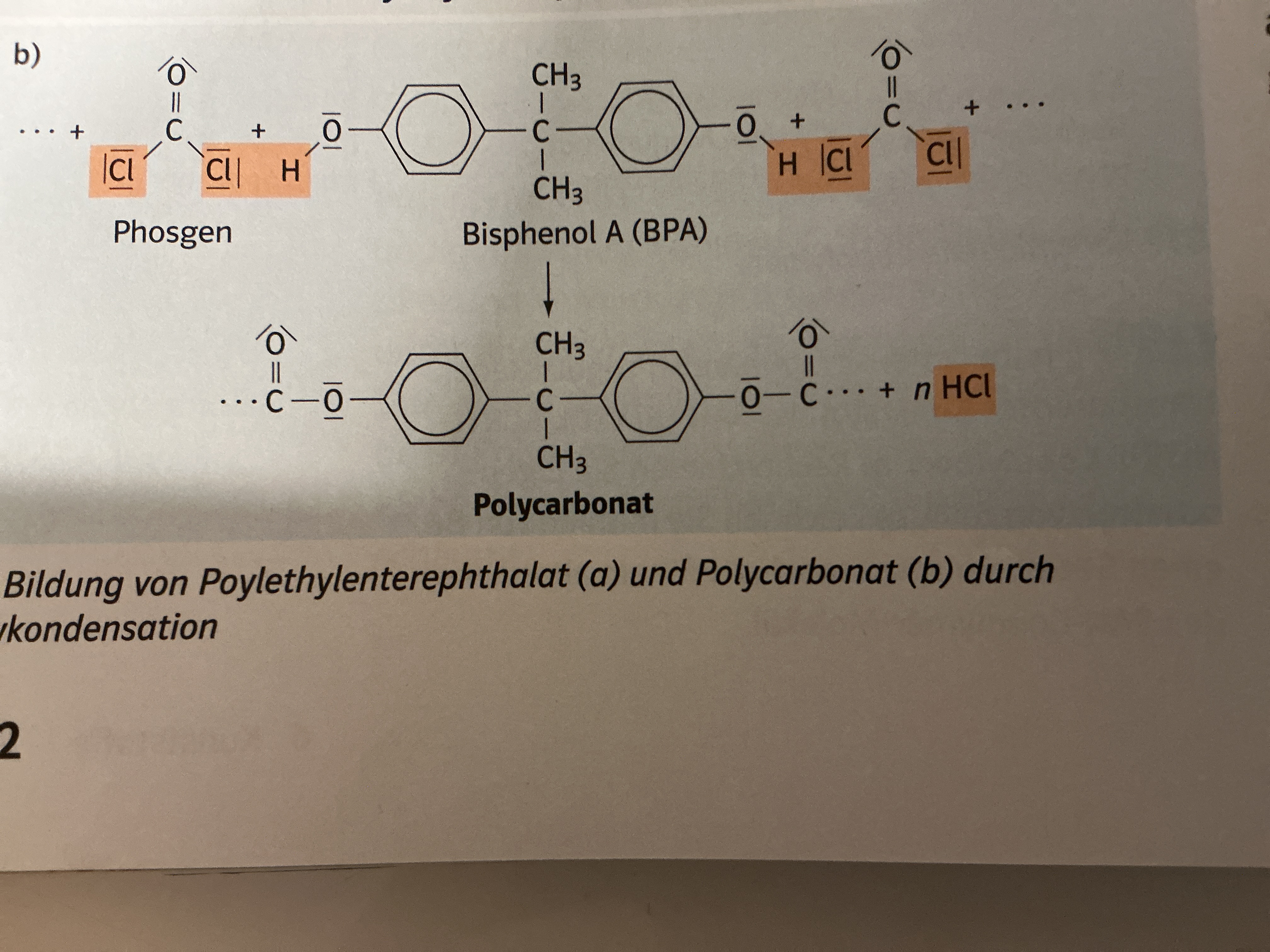
Wichtige Polyester: Polycarbonate
Ester der Kohlensäure
Ausgangsstoff für Synthese von Polymere Kunststoffen
Verwendung: Konservendosen, Trinkflaschen, Farbe,…
Verbote für Babyflaschen und Beschichtung Thermopapier
Wirkt als Hormon → kann in kleinen Mengen Schäden verursachen (Fruchtbarkeit)
Polyamide
Amidbildung entspricht der Peptidbindung
Allgemein: Diamin + Disäure → Polyamid + (n-1)H2O
Auch Reaktion im Molekül selbst möglich „inneres Amid“ wie epsilon-Caprolactam
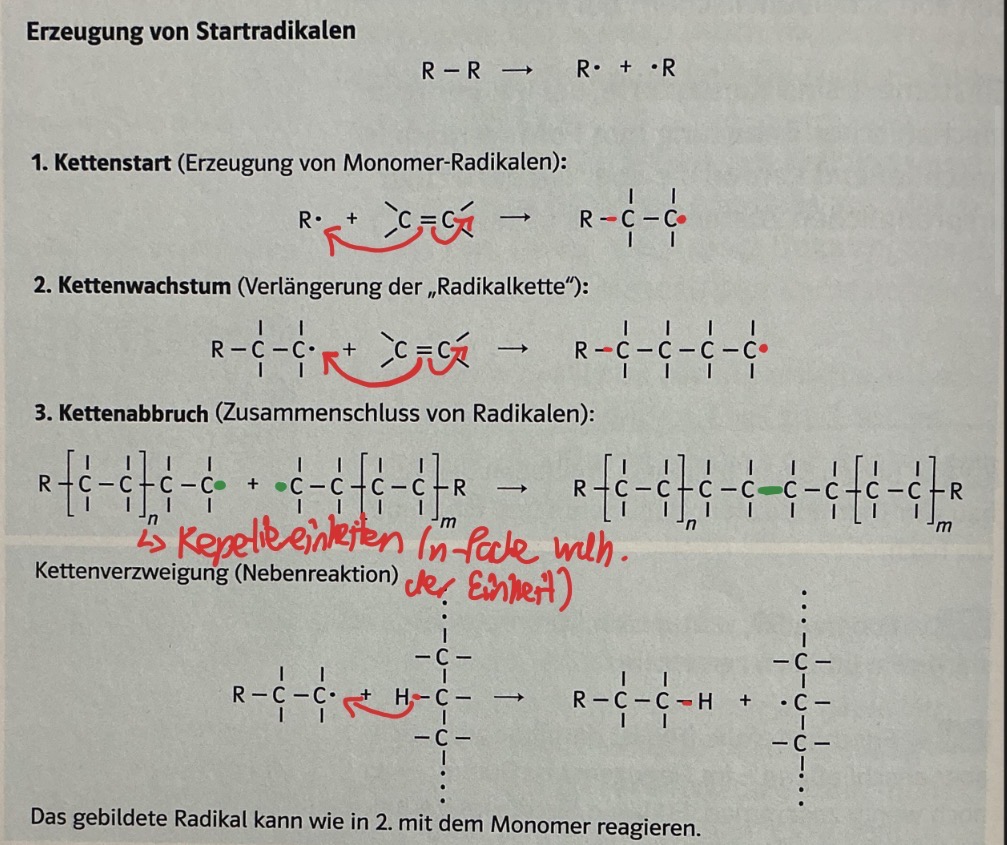
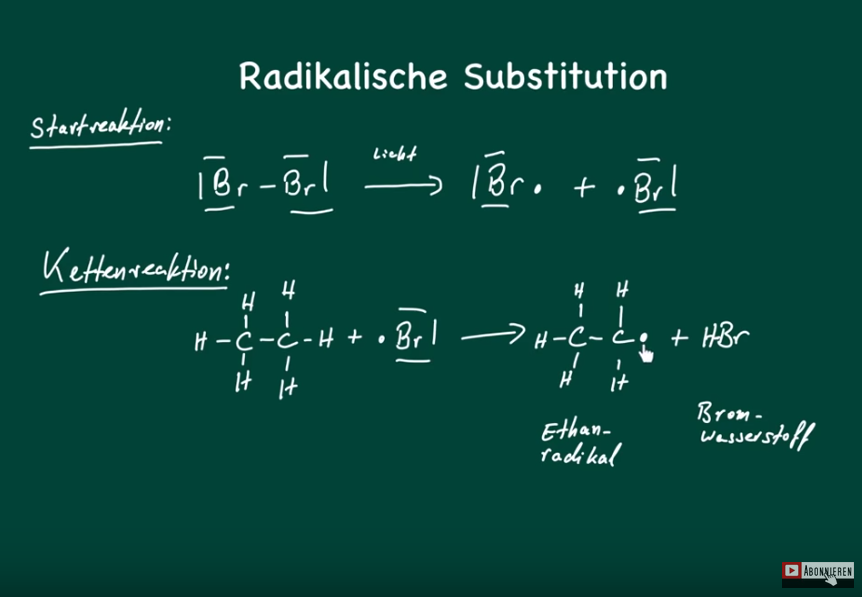
Radikalische Substitution
Erzeugung von Startradikalen
Kettenstart→ Auflösung Doppelbindung zum Radikalen
Kettenwachstum→ ein Elektron noch Platz am C-Atom (weitere Reaktion)
Kettenabbruch→ Zusmmenschluss der Radikalen
Thermoplast
warm formbar
Fest, wenig elastisch
Erweichen beim Erwärmen
„Überlappungen“ der Moleküle
Durch London/Dipol-Dipol WW//schwache H-Brücken zusammengehalten
Unvernetzt
PP,PET,PVC, PS

Duromer
hart
Fest, wenig elastisch
Kein Erweichen, sondern Zersetzung beim Erwärmen
dauerhaft chemisch vernetzt
sehr stark vernetzt
UP
Elastomere
elastisch wegen Bestreben nach Entropie
Bei Belastung Kohlenwasserstoff-Ketten geordnet, Entlastung wieder ungeordnet
Unter Zug leicht verformbar
Zersetzung beim Erwärmen
schwach vernetzt
Kautschuk
Eigenschaften PVC
glatt, undurchsichtig
Elastisch, biegsam; bricht
Dichte > H2O
Bodenbeläge, Rohre
Eigenschaften Polyesterharz
grau, glatt, undurchsichtig
Nicht biegsam, bricht sofort
Dichte > H2O
Duromer
Eigenschaften Polystyrol
durchsichtig, glatt, leicht nebelig
Bisschen biegsam, bricht
Dichte > H2O
Verpackungen, CD-Hüllen
Eigenschaften PMMA
durchsichtig, glatt
Leicht biegsam
amorphe Thermoplaste
Polyaddition
Es werden keine Nebenprodukte abgespalten
Kat zum starten
Radikalische Substitution
Angreifer: Radikal (Cl-)
Verteidiger: Alkan
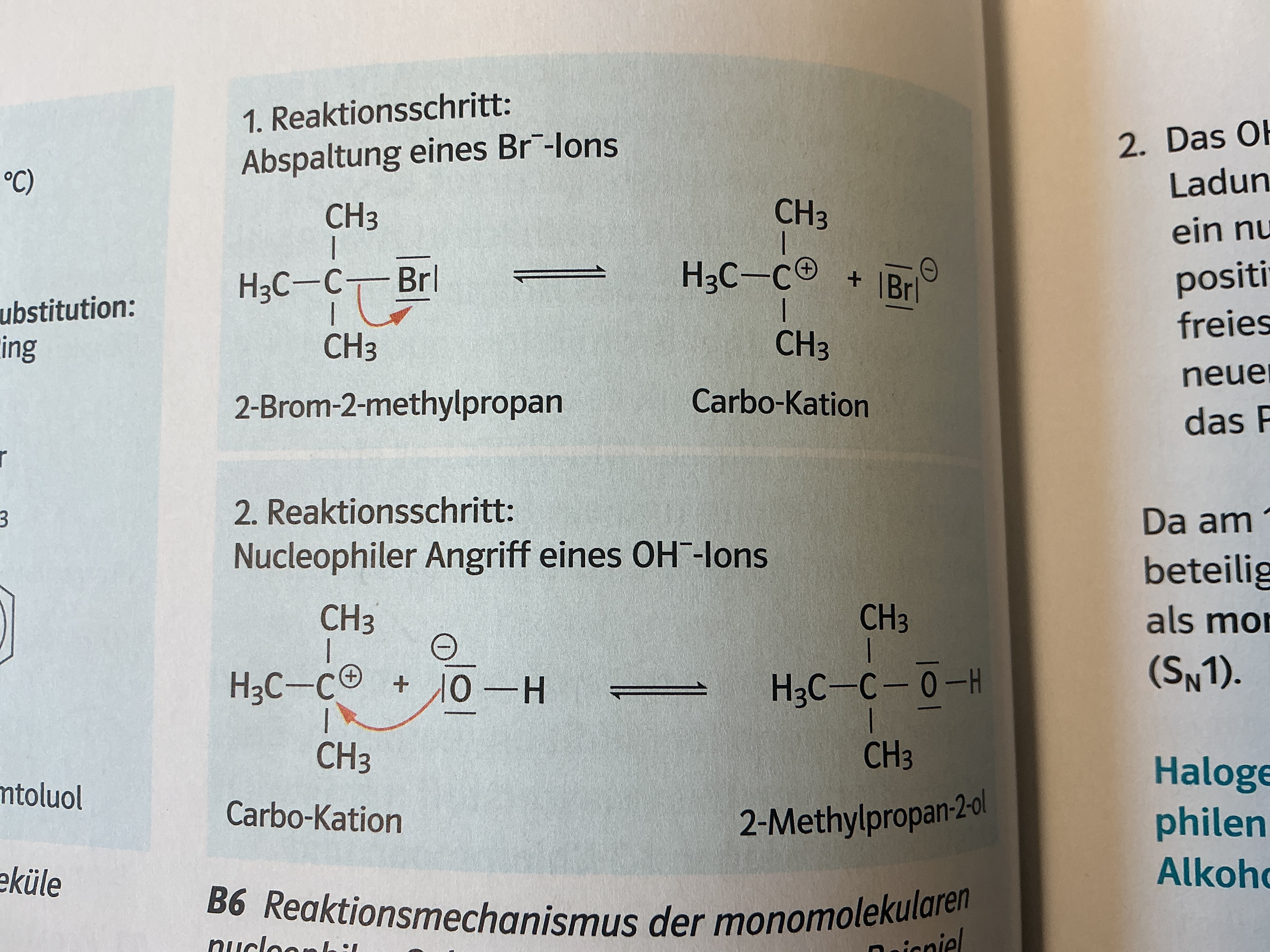
Nucelophile Substitution
Halogen spaltet von C ab → Postive Ladung C, negative Halogen
Da Im alkalischen, viele OH Moleküle (O negativ)
C + verbindet sich mit O-
Wie bei ester
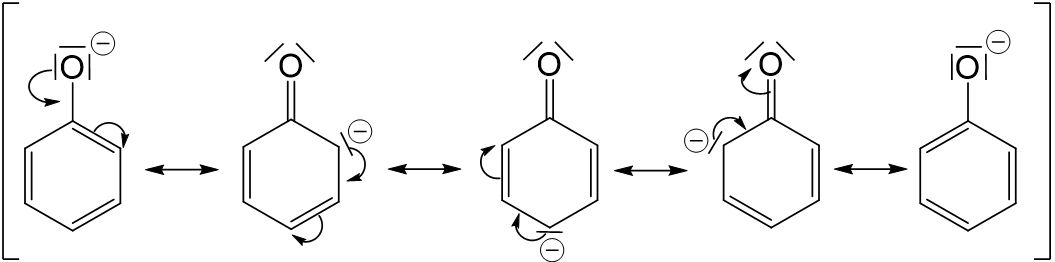
Phenol Derivat
+H3O
Anilin Grenzformel
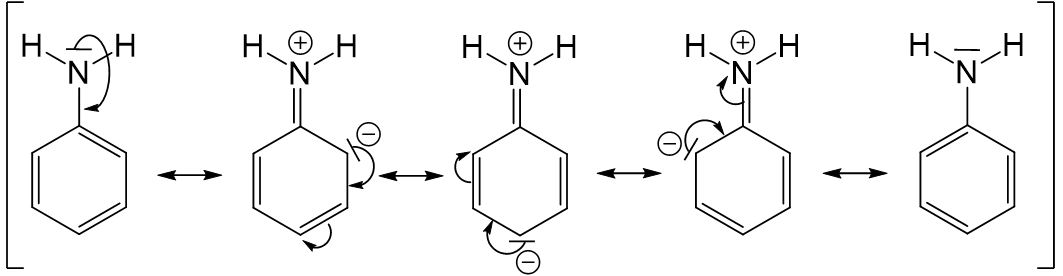
Benzoesäure Derivat