scheikunde reacties en evenwicht
1/79
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
80 Terms
vereisten van een goede springstof
uit een beperkt aantal mol vaste stof of vloeistof een groot aantal mol gas laten ontstaan
springstof bevat zelf zuurstof in stoichiometrische verhouding
exothermiciteit → grote moleculen van een vaste stof/ vloeistof opbreken in lichtere gasmoleculen (die zeer stabiel zijn) N2 is hier een goed voorbeeld van (3voudige binding is zeer stabiel)
is NH4NO3 een goede springstof en waarom? + hoe kan je het verbeteren
ammoniumnitraat is een ionische vaste stof die goed oplost in water, gebruikt als kunstmeststof (bevat stikstof!!)
NH4NO3 → N2 + 2H20 + ½ O2
komt veel mol gas vrij bij ontbinding uit een beperkt aantal mol springstof (N2 en O2 vrijgezel!!)
ANFO → oxidatie zorgt voor extra exothermiciteit (brandstof gebruikt overschot aan O2)
Al poeder toevoegen:
Al is onedel en wordt dus graag geoxideerd → extra exothermiciteit
effecten van T, druk, deeltjes toevoegen C-B
zie foto

verband kp kc en kx
kp = partueeldruk kc = molariteit kx = molaire breuk
kp = kc(rt)^deltaV
kp = kx(ptot)^deltaV
verband NH3 productie proces en chatelier braun
exotherm proces
gekatalyseerde reactie (verlaagde activatieenergie)
proces gebeurt bij hoge druk en lage temperatuur→ bevordert aanmaak reactieproducten
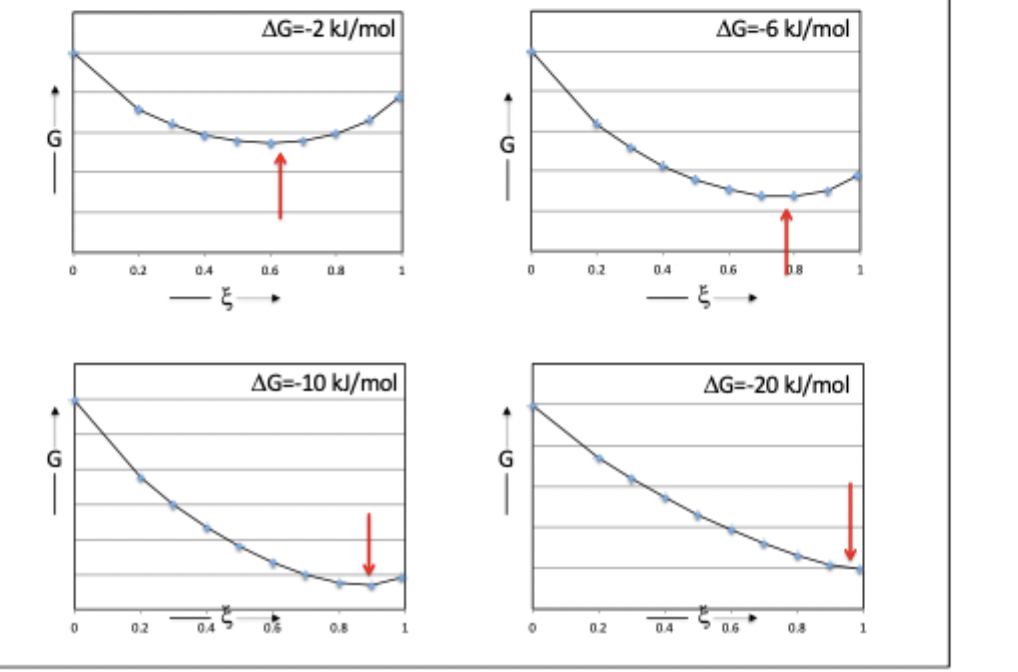
mengingsentropie grafiek
hoe kleiner (negatiever) de G, hoe verder het evenwicht (deltaG/deltaxi = 0) bij xi=1 aanleunt omdat de reactie ‘spontaner’ verloopt
verband tussen kp en delta G0
kp = exp(-deltaG0 /RT)
waarom condenseert NH3 sneller dan H2 en N2 bij T daling?
H-bruggen
polair, permanente dipolen
Wat heeft de polariteit (polair/apolair) te maken met het kook- en smeltpunt van een stof?
Polaire moleculen hebben sterkere intermoleculaire krachten (zoals dipoolkrachten of waterstofbruggen) dan apolaire moleculen. Daardoor hebben ze meer energie nodig om de bindingen tussen moleculen te verbreken. Dit leidt tot hogere kook- en smeltpunten bij polaire stoffen. Apolaire stoffen hebben enkel zwakke dispersiekrachten en dus lagere kook- en smeltpunten.
verban tussen K en Q(warmte), T
ln(k) = -deltaH0/RT + deltaS0/R
positieve helling = exotherme reactie
Arrhenius theorie
zuur produceert H3O+ in een waterig milieu
base produceert OH- in een waterig milieu
zuur base neutralisatie is de recombinatie tot water
bezwaar: zuur-base reactie zonder OH- (NH3)
brondsted lowry theorie
zuur is een protondonor (omgezet tot zijn geconjugeerd base)
base is een protonacceptor (omgezet tot zijn geconjugeerd zuur)
zuur base neutralisatie is de protonenuitwisseling
lijst sterke zuren
HClO4 HClO3 HCl HBr HI HNO3 H2SO4
lijst sterke basen
IA , IIA: Li Na K Ca
H- S2- O2-
wat bepaalt de sterkte van een zuur
hoe gemakkelijk het een proton kan afstaan
wat bepaalt de sterkte van een binair zuur
de bindingslengte en de EN waarde
hoe groter het atoom hoe makkelijker het proton afgestaan kan worden
hoe groter de EN waarde hoe makkelijker het proton afgestaan kan worden
wat bepaalt de sterkte van een oxozuur
grotere EN gebonden aan het zuurstofatoom wordt voor elektron zuiger (sterker zuur) → er ontstaat een meer polaire binding
meer aantal lone oxygens (zuurstof enkel geboren aan centraal atoom) zorgt voor sterker zuur → trekken harder aan het centraal atoom die op zijn beurt harder zal trekken aan het zuurstof gebonden aan elektron
factor 100 verschil
dan mag je verwaarlozen
als K > 100 is het een volledig opgaande reactie
buffermengsel
mengsel waarvan de pH bijzonder ongevoelig is aan beperkte toevoegingen van zelfs sterke zuren en basen
als zout in oplossing gebracht:
zwak zuur en zijn geconjugeerde base
of zwakke base en zijn geconjugeerd zuur
equivalentiepunt
Het equivalentiepunt is het moment waarop zuur en base in exact gelijke hoeveelheden gereageerd hebben, maar dat betekent niet dat de oplossing neutraal is. Bij een sterke zuur–sterke base titratie is de pH wel 7. Maar als één van de twee zwak is, blijft er een geconjugeerde base of zuur over, wat de pH beïnvloedt. Daardoor kan het equivalentiepunt zuur (pH < 7) of basisch (pH > 7) zijn.
hoe ziet een titratiecurve er uit voor zwakke /sterke zuren /basen en hoe is meervoudige zuren / base ook
Een sterke zuur–sterke base titratie geeft een abrupte sprong rond pH = 7. Bij een zwak zuur of base verloopt de curve geleidelijker, met het equivalentiepunt boven (zwak zuur) of onder (zwakke base) pH = 7. Bij meervoudige (polyprotische) zuren of basen zie je meerdere sprongen in de curve, elk bij een apart equivalentiepunt. Elke sprong komt overeen met het afstaan of opnemen van een extra proton.
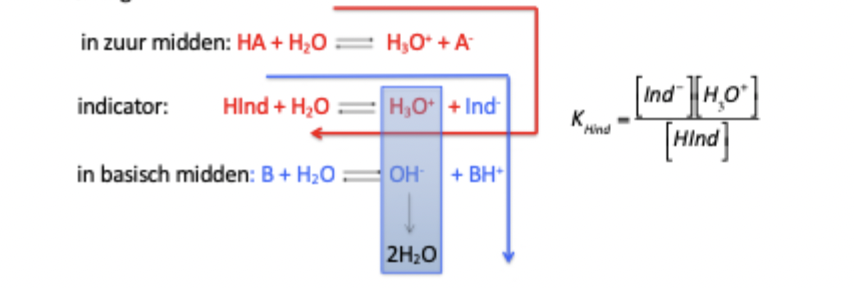
Hoe werkt een pH-kleurindicator?
Een pH-indicator is een zwak zuur of base waarvan de kleur verandert afhankelijk van de pH van de oplossing. De indicator komt in twee vormen voor: een geprotoneerde en gedeprotoneerde vorm, elk met een eigen kleur. Volgens Le Châtelier verschuift het evenwicht tussen deze vormen bij verandering van de pH. Zo ontstaat de zichtbare kleurverandering bij een bepaalde pH
lewis theorie
zuur is een elektronpaar acceptor ter vorming van een datief covalente binding
base is een elektronpaar donor
zure anhydriden
oxiden van niet-metalen zijn zuur
deze reageren met water tot oxozuren
oxiden van metalen
zijn basisch
(IA en IIA)
reageren met water tot hydroxides
de andere oxides zijn te sterk gebonden in hun ionische binding om op te lossen in water (water is een te zwak zuur), deze reageren wel als base in een zuur midden
amfotere oxiden
Al2O3 ZnO SnO2 Cr2O3
zijn basische oxiden in een zuur milieu
zijn zure oxiden in een basisch milieu
ontzwavelen van rookgassen
toepassing zuur base reactie
verbranden van stookolie en steenkool bevat zwavel vrij, na oxidatie vd brandstof wordt ook de zwavel geoxideerd. deze SO2 oxideert verder tot SO3 en uiteindelijk in contact met de atmosfeer tot H2SO3 en H2SO4 dat zuren regen maakt → reiniging rookgassen dmv besproeing met CaO (oxiden van een metaal), in wat komt dit voor als Ca(OH)2 dat een zuur base reactie zal ondergaan tot CaSO3 en H20
zure regen
SO2 of NOx oplossen in regenwolken. NH3 afkomstig uit uitlaatgassen en verbranding van brandstoffen vormen samen met water zuren H2SO4 en HNO3. dit zuur doet de pH in grond dalen waardoor ecosystemen lijden.
empirische formule van een KWS bepalen
toepassing zuur base reactie
gewogen hoeveelheid onbekend stof in een oven verbranden met overmaat O2.
H2O damp geabsorbeerd door hygroscopische stof
CO2 gas geabsorbeerd door NaOH oplossing
uit de gewichtstoename van beide ga je de formule kunnen bekomen
aardgas maken uit hernieuwbare bronnen
micro-organsimen breken organsich afval om tot CH4 en CO2, deze CO2 absorberen door NaOH oplossing → brandstof
neerslagreactie + voorwaarden
ionische recombinatiereactie
ionen van 2 oplosbare zouten vormen onoplosbaar zout als de energie die vrijkomt bij de vorming van de nieuwe intramoleculaire coulomb-krachten in de neerslagmolecules groter is dan de hydratatie-energie van de ionen.
BaSO4 toepassing
niet oplosbaar zout dat gebruikt wordt voor onderzoek, Ba is een relatief zwaar atoom en absorbeert dus beter röntgenstralen dan de weefsels in ons lichaam, daarom wordt het gebruikt als contrastof bij het maken van rontgenfoto’s. BaSO4 is niet giftig omdat het niet oplost in water → niet opgenomen in het lichaam
verband tussen S en Ks
S (oplosbaarheid) is de maximale concentratie van een opgeloste stof in een oplosmiddel bij evenwicht
Ks is de evenwichtsconstante voor de reactie waarbij een elektrolyt oplost tot een verzadigde oplossing → hoe goed lost een bepaalde stof op
heat packs
toepassing van neerslagreactie:
NaAc in water opgelost aan een concentratie die groter is dan de oplosbaarheid (door oplossing op te warmen). Na het afkoelen is dit in een onstabiel evenwicht, een klein tikje zorgt al voor een evolutie naar een stabiel evenwicht. de neerslagvormingsreactie van NaAc is exotherm en deze warmte wordt dus gebruikt om bijvoorbeeld je handen op te warmen
factoren die oplosbaarheid beïnvloeden (4)
chatelier braun gewijs:
oplosbaarheid stijgt meestal bij hogere temperaturen, want oplossen is meestal endotherm waardoor S stijgt als T stijgt
oplosbaarheid daalt bij toevoegen van een gemeenschappelijk ion. brengen hetzelfde ion in oplossing waardoor de reactie teruggedreven wordt.
oplosbaarheid stijgt door het onttrekken van één ionsoort. als een zout minder goed oplosbaar is dan een ander zout (dat is neergeslagen) dan zal het toevoegen van het minder oplosbare zout ervoor zorgen dat de ionen vrijkomen en neerslaan met het andere zout. vb PbCrO4 en PbCl2. of via een complexerend reagens.
pH laten variëren. toevoegen van een zuur in een basische oplossing of omgekeerd zal ervoor zorgen dat de zure/ basische ionen verminderen in aantal (neutralisatie) en zal de reactie naar rechts geduwd worden. (meer van een ion aanmaken: C-B)
complexe ionen
molecule die een ion kan vastgrijpen en deze zo in oplossing kan houden.
bouw: centraal metaalatoom symmetrisch omringd door ligenden in een stabiel geheel.
liganden zijn moleculen of ionen die door datief covalente bindingen gebonden zijn aan het kernatoom.
in water vormt het het aqua-complex (watermantel)
coordinerend atoom: gebonden aan centraal atoom via liganden
1A en 2A metalen worden gehydrateerd maar vormen geen complexen.
baas boven baas principe:
sterkere complexvorming kan een neerslag doen oplossen
nomenclatuur:
aantal ligenden - ligandnaam - kernatoom
ligandnaam water en ammoniak = aqua en ammine
liganden eindigend op ide = o
eindigend op iet of aat = Ito of ate
toepassing complexvorming
zeepplekken veroorzaakt door hard water
vorming van onoplosbare neerslag op kledij/ douche Ca of Mg zak neerslag vormen met de zeepmoleculen en ook met de bicarbonaten in hard water. dit bestrijden met EDTA, zal Ca-ion in oplossing houden (1A en 2A ionen vormen niet echt een complex, dit is een sterke ion-ion interactie) => niet goed voorbeeld
remediering voor corrosie: antiroestverf
ijzer verroest (Fe(OH)2 en Fe(OH)3) gevormd. je wilt dat dit proces stopt => ideale antiroestverf bevat:
-zwak zuur om roest op te lossen (Z-B neutralisatie) en om de verroesting niet verder te laten gaan.
-chelerend (complexerend) agens om de Fe-ionen vast te pakken
-polymeer om dit te fixeren
typisch zuur is oxaalzuur
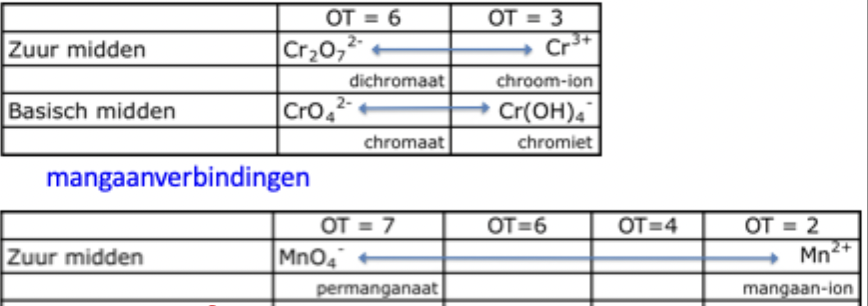
OT
F 1A
2A
Al B
H in 1A en 2A,
H2O2
FO2
KO2
OT
F = -1
1A = +1 2A = +2
Al en B = +3
H in 1A en 2A = -1
H2O2 = -1
FO2 = +1/2
KO2 = -1/2
balanceren van redoxreactie stappenplan
halfreacties neerschrijven
balanceren:
O door H2O toe te voegen, H door H+ toe te voegen, elektronen toe voegen voor lading te balanceren
controleer of aantal elektronen opgenomen of afgegeven in de halfreactie overeenkomt met de verandering in OT
vermenigvuldig eventueel met passende cte
tel halfreacties op en vereenvoudig
in zuur midden: H+ vervangen door H3O+, in basisch midden: evenveel OH- optellen als er H+ voorkomen en vereenvoudig tot H2O
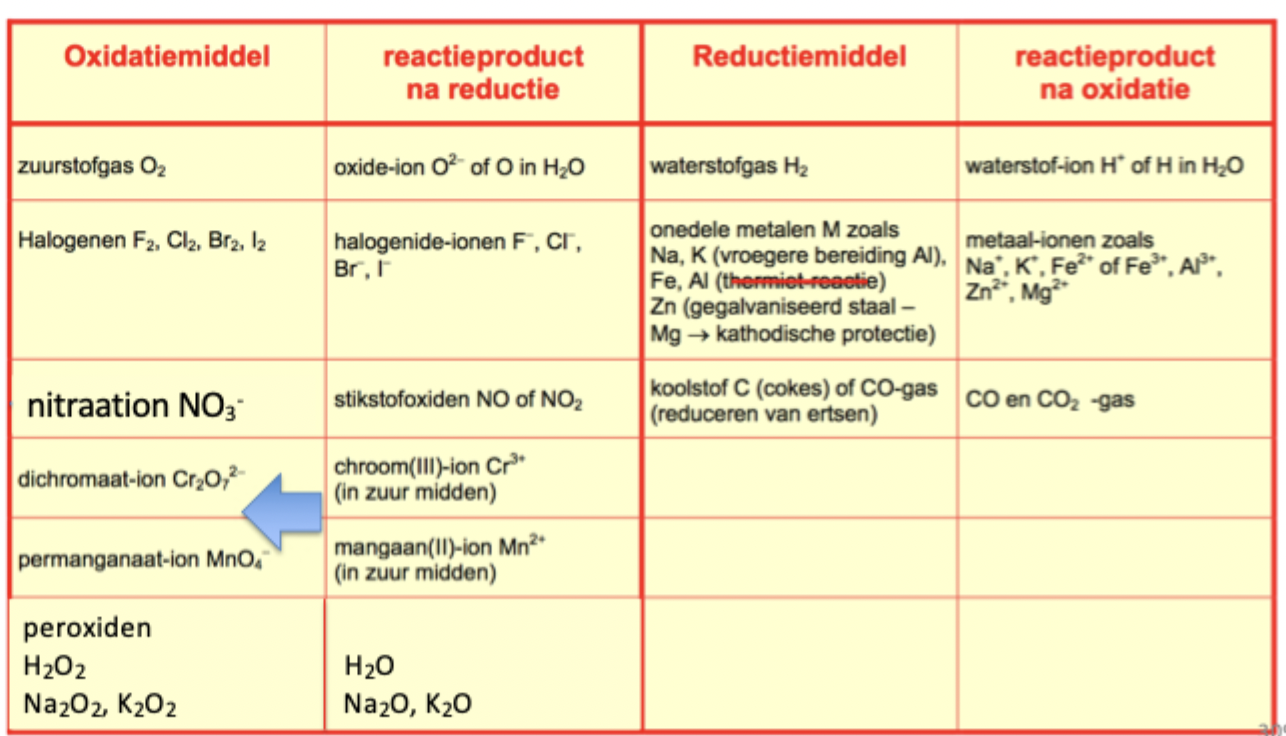
courante oxidatie-reductiemiddelen
mangaanverbindingen en chroomverbindingen in zuur en basische midden
hoe bepaal je het reducerend karakter van een metaal
door het te laten reageren met zuur → spanningsreeks metalen
spanningsreeks van metalen
hoger metaal verdrijft lager metaal
de meest elektropositieven metalen (1A 2A) reageren met koud water tot H2
de iets minder oxideerbare 2A metalen en Al en Fe reageren enkel met heet water → probleem bij blussen brand van stalen constructies. → H2 komt vrij.
de meer edele metalen kunnen enkel met sterke zuren reageren tot H2
de edele metalen reagen niet met klassieke sterke zuren '(Au, Ag,..)
zuurstof als oxidans: verbranding
oxideren brandstof tot CO2, O2 gereduceerd tot H2O. onvolledige verbranding → vorming van CO
waarom komen veel metalen in de natuur voor in hun oxidevorm
metalen met O2 (zeer oxiderend)→ meeste metalen komen in de natuur voor in hun oxidevorm
corrosie van ijzer
directe reactie van onedele metalen met O2
water zuurstof en een beschadiging in het metaal nodig
ijzer zal licht oxideren waar het beschadigd is oiv water zodat Fe2+ in oplossing gaat. de vrijgezette elektronen migreren doorheen het metaal naar een andere plaats waar zuurstof en vocht is. hier zal de zuurstof gereduceerd worden om hydroxide ionen te geven.
het ijzer ion zal diffunderen en in contact komen met de hydroxide ionen om zo een neerslag van ijzerhydroxide te vormen.
preventie van corrosie van ijzer
galvaniseren: een vorm van kathodische protectie. de staalplaat wordt bedekt met een onedeler metaal zoals Zn. dit is bestand tegen water maat onedeler en zal dus makkelijk oxideren. indien er een beschadiging van Zn is en beide metalen blootgesteld zijn aan een waterige fase zal Zn oxideren en in oplossing gaan terwijl Fe reduceert. je krijgt als neerslag Zn(OH)2
opofferingsanode: elektrisch contact tussen het te beschermen metaal en een onedeler metaal. vb.:
spuitkop van een spuitlans in koper geschroefd op een onedele Al buis => Al buis zal snel roesten. je moet dus een kunststoflaag ertussen hebben als isolatie zodat de elektronen niet kunnen migreren
tuinfakkel in inox niet laten roesten door een onedele ketting toe te voegen die zal doorroesten (in Zn bijvoorbeeld)
vertinnen
tin is edel en bestand tegen licht zure inhoud van etenswaren, als deze echter beschadigd werd ging het Fe corroderen en doorroesten (onedeler)
verzuren van wijn
oxidatieproces: ethanol wordt omgezet in ethanal (acetaldehyde) en dit wordt oiv O2 omgezet in azijnzuur en H2O
CSI
H2O2:
ontsmettingsmiddel en haarbleekmiddel (bacteriën en pigmenten kapotoxideren tot CO2) in het donker bewaren (autox-reactie). molecule kan als oxidator en reductor dienen. H2O2 → O2 en H2O dit wordt gekatalyseerd door Fe en licht
in hemoglobine zit Fe. in de luminoloplossing zit H2O2 dat een autox-reactie gaat ondergaan in contact met Fe. hierdoor wordt O2 gemaakt dat als oxidatiemiddel dient voor luminal. deze geoxideerde luminal straalt een blauw licht uit als het beschenen wordt met UV licht
javel
Cl2 kan een autox reactie ondergaan. Cl2 + H2O → HClO (oxidans)+ HCl. Cl2 is slecht oplosbaar in water. → CB: NaOH toegevoegd zodat HClO en HCl een ZB neutralisatie ondergaan ter vorming van hypochloriet-ion en chloride-ion → meer vorming van javel door het toevoegen van een base (evenwicht naar rechts C-B)
hoogovenproces
inputs : ijzererts, zand, coke, kalksteen
C wordt met zuurstof geoxideerd tot CO
CaCO3 → CO2 + CaO
CaO + SiO2 → CaSiO3 (slag)
CO + Fe2O3 → zuiver ijzer
de slag is lichter dan het ijzer en drijft er op → beschermlaag
galvanische cel
apparaat dat elektriciteit levert door een spontane redoxreactie te laten opgaan waarbij de elektronen gedwongen worden via een extern circuit te lopen
elektrolytische cel
apparaat waarin een niet-spontane redoxreactie toch opgaat doordat er elektriciteit toegediend wordt
koppelen van een lager gelegen halfreactie met een hoger gelegen halfreactie (gedwongen proces deltaG0>0 het minst positieve is)
teken de Daniel cel
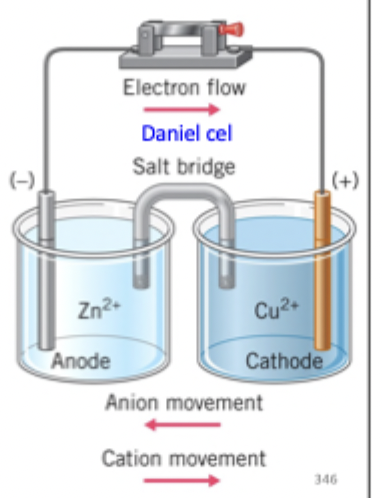
zoutbrug
nodig om circuit te vervolledigen, zorgt voor elektrische neutraliteit, buisje gevulde zoutoplossing van ionen die niet meedoen aan de redoxreactie. aniontransport naar de anode
kationtransport naar de kathode
celpotentiaal
maximale voltage dat geleverd kan worden/ hoeveel energie in een elektrolyse cel gestoken moet worden
reductiepotentiaal
neiging om elektronen op te nemen
leclanche cel
Zn MnO2 cel
de buitenkan bestaan uit Zn en is de anode waar de oxidatie plaatsvindt
de kathode bestaat uit een koolstofstaal en dient als geleider
de reductie gebeurt rond de kathode die omgeven is door een vochtige pasta van granietpoeder, mangaandioxide en ammoniumchloride. mangaandioxide omgevormd tot MnO3
nadeel: Zn omhulsel zal desintegreren als de reactie opgaat en de Zn plaat zorgt voor minder toegankelijkheid
alkaline droge cel
Zn MnO2
met Zn in poedervorm in de batterij waardoor het toegankelijker is en in basische condities waardoor Mn in meer cte concentratie aanwezig blijft
lood accumulator
heroplaadbaar
elektroden bestaan uit PbO2 en Pb-materiaal. omdat elektrolyt in beide halfcellen H2SO4 is een zoutbrug niet nodig. grote stromen mogelijk door beide elektroden als een groter aantal platen in parallel uit te voeren. sulfaationen nemen actief deel en laad en ontlading. bij ontladen worden sulfaationen verbruikt maar bij het opladen komen ze weer vrij. De zuurconcentratie hangt af van de ladingstoestand van de accu. bij een versleten accu zijn sulfaationen ingebouwd in de elektroden als loodsulfaat.
brandstofcel
elektrochemsiche cel waar de reagentia aangevoerd worden
H2 → 2H+ + 2elektronen
1/2O2 + 2H+ + elektronen → H2O
netta H2 + 1/2O2 → H2O
transport van H+ via selectief membraan
OFHC-cu
koper uit kopererts is 99% puur, onzuiverheden weghalen.
elektrolysecel bevat een zuivere en onzuivere koperelektrode ondergedompeld in een Cu2+ sulfaatoplossing. we forceren de oxidatie (koper is zit liever in gereduceerde stand) door er zelf stroom door te steken. de onzuiverheden zijn onedeler dan koper en zulle dus in oplossing blijven (Fe, Zn) andere zijn edeler en vallen als debris naar de bodem. het vrijgezette Cu2+ wordt gereduceerd aan de zuivere elektrode die in massa zal toenemen het kopersulfaat dient als elektrolyt voor ionentransport en zoutbrug.
chloor alkali proces
chloor maken uit keukenzout
4 reacties mogelijk, verandering in gibs vrije energie zo minst positief
=> elektrolyse van water tot H2 en O2 (via OH- eerst) en niet de vorming van Na-metaal en Cl2 gas!
→ onmogelijk om uit waterige oplossing Na te halen maar wel Cl2 maken door het fysiek verhinderen dat het gevormde OH- tot bij de anode geraakt (OH- → O2 + H2O) het membraan laat water en positieve ionen door (Na+) maar weert OH- ionen. Zo is het chloride ion de enige ionsoort in de buurt van de anode en kan de neutraliteit bewaard worden door migratie van Na+.
down cel
Na metaal winnen door NaCl te smelten (hoge temp want ionbinding). het Na+ ion wordt gereduceerd tot Na en het Cl- ion geoxideerd tot Cl2 gas
aluminium eigenschappen
lichter en sterker dan staal
lasbaar
roest niet door zelfherstellend hard en zuurstofdicht laagje Al2O3
amfoteer karakter van Al2O3
bij een overmaat hydroxide kan je Al3+ in oplossing krijgen (vanuit Al(OH)3 neerslag door de vorming van het aluminaat-ion door aanzuren).
bayer proces
afscheiden van Al2O3 uit bauxiet via afmonteer karakter van Al2O3. NaOH wordt toegediend bij hoge temperatuur, Al2O3 uit erts gaat in oplossing als het aluminaat ion.
oxiden en hydroxiden van andere metalen blijven onoplosbaar en vormen een rode pap (red mud) die vooral ijzeroxides in zeer basische oplossing bevat.
hall heroult proces
oplossing van Al2O3 wordt aangezuurd met CO2 (zuur oxide). Al slaat neer als Al(OH)3-oxide
neerslag wordt gedroogd door verhitting en Al2O3 oxidevorm verschijnt weer
Al2O3 is een van de sterkst gebonden oxiden → niet zomaar opwarmen en splitsen zoals NaCl. We gebruiken cryoliet dat Al2O3 kan oplossen (fluorliganden rondom weinige Al3+ dat vrijkomt) om een ZEER sterk complex te vormen. dit mengsel heeft een haalbaar smeltpunt waardoor elektrolyse kan plaatsvinden
Al3+ gereduceerd tot Al en C geoxideerd tot CO2 (O2- komt van Al2O3)
wet van Nernst
celpotentiaal berekenen van 2 halfreacties wanneer de concentraties verschillen van de standaard.
delta E = deltaE0 -RT/nF *lnQ
op welke manieren kan je H2 maken
steam reforming
elektrolyse H2O
onedel metaal + zuur → metaalzout + H2
op welke manieren kan je NO2/NO maken
NO3- reduceren
metaal + HNO3 → metaalzout + NO2 of NO
op welke manieren kan je CO2 maken
staalproductie
CaCO3 opwarmen
bayer proces
H2O2 (haarbleekmiddel)
metaalcarbonaat + zuur → zout + CO2 + H2O
oop welke manieren kan je H2S/HF maken
Na2S/FeS + sterk zuur
op welke manieren kan je NH3 maken
NH4Cl + sterke base
op welke manieren kan je O2 maken
elektrolyse
CO2 + H2O + zonlicht → O2 + koolhydraten (fotosynthese)
op welke manieren kan je SO2 maken
metaalsulfiet(CaSO3) + zuur → metaalzout + H2O + SO2
hard water + vorming druipsteengrotten + huishoud
grondwater met hoge concentratie Ca en Mg ionen in de vorm van bicarbonaten. deze slaan er als onoplosbare carbonaten met als gevolg druipsteengrotten oa. H2O + CO2 + CaCO3 ←> H2CO3 + CaCO3 ←> Ca2+ + 2HCO3-
bij de vorming is het van L naar R. zure regen reageert met kalksteen (base) tot wateroplosbare bicarbonaten dat meegevoerd wordt. hard water land in grotten waar CO2 gehalte lager is (T ligt lager). volgens C-B verschuift het evenwicht hierdoor naar links, er wordt terug CO2 vrijgezel en CaCO3 slaat neer als druipsteen.
dit komt in ons water. bij hoge T is CO2 minder oplosbaar in water, evenwicht verschuift naar L ter vorming van CaCO3, als zeep gebruikt wordt om dit te poetsen zal er grauwe neerslag gevormd worden.
ontkalken
zwak zuur of sterk zuur (industriele toepassingen) om te ontkalken
Dow proces
Mg: lichtgewicht, komt veel voor op aarde (zeewater)
bereiding van kalkmelk: CaCO3 door verhitten omzetten in CaO , in contact met water vormt dit gebluste kalk
Mg uit zeewater halen: kalkmelk (Ca(OH)2) toevoegen aan het zeewater, de Mg2+ ionen in het water vormen met OH- een neerslag en verdrijven Ca2+ uit de kalkmelk verbinding omdat Mg(OH)2 minder oplosbaar is. (kleinere atoomstraal van Mg zie PSE→ grotere aantrekking, grotere roosterenergie).
Mg(OH)2 filteren
terug omzetten tot MgCl2 door ZB neutralisatie met HCl
MgCl2 drogen door water te laten verdampen
elektrolyse stap, gesmolten MgCl2 reduceren tot Mg en Cl2 gas vormen (watervrije omgeving zoals down proces)
oplossen van goud
goud is zeer edel en niet makkelijk te oxideren. het wondermiddel is koningswater (HCl + HNO3), HNO3 is een sterk oxidatiemiddel dat goud oxideert tot Au3+ en de sterke complexeringsreatie van Au3+ ionen met Cl- liganden afkomstig van HCl slaagt er in om Au op te lossen