organische chemie hoofdstuk 3
1/195
Earn XP
Description and Tags
fysische eigenschappen
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
196 Terms
Wat is het verschil tussen intermoleculaire en intramoleculaire krachten?
Intramoleculaire krachten (F<sub>intra</sub>) zijn de bindingen tussen atomen binnenin een molecule (zoals covalente bindingen).
Intermoleculaire krachten (F<sub>inter</sub>) zijn de krachten tussen verschillende moleculen. Ze zijn meestal zwakker dan intramoleculaire krachten.
Wat gebeurt er met de bindingen bij koken of oplossen van een stof?
Bij koken of oplossen verandert de aggregatietoestand van de stof, maar de chemische samenstelling blijft gelijk.
Intramoleculaire bindingen blijven behouden.
Intermoleculaire bindingen worden verbroken.
Wat is het effect van intermoleculaire krachten op het kookpunt van stoffen?
Hoe groter de intermoleculaire kracht (F<sub>inter</sub>), hoe hoger het kookpunt van de stof. Sterkere bindingen tussen moleculen vragen meer energie (warmte) om te doorbreken.
Wat toont de deeltjesvoorstelling van vaste stof, vloeistof en gas aan over intermoleculaire krachten?
Vast: De deeltjes zitten dicht op elkaar; intermoleculaire krachten zijn sterk; deeltjes trillen op hun plaats.
Vloeibaar: Deeltjes zitten dichter bij elkaar maar kunnen bewegen; intermoleculaire krachten zijn zwakker dan in vaste stoffen.
Gas: Deeltjes zitten ver uit elkaar; intermoleculaire krachten zijn zwak of afwezig; beweging is chaotisch.
Waarom blijven moleculen bij koken nog steeds intact?
Omdat koken enkel de intermoleculaire krachten verbreekt en de intramoleculaire bindingen (die verantwoordelijk zijn voor de chemische structuur) onaangetast blijven.
Wat zijn de zwakste intermoleculaire krachten en bij welke stoffen komen ze voor?
De zwakste intermoleculaire krachten treden op tussen moleculen zonder permanente ladingsverschuivingen, zoals apolaire stoffen.
Wanneer treden grotere intermoleculaire krachten op?
Bij polair geladen moleculen met een ladingsverschuiving (dipolen) of bij moleculen met gedeeltelijke ladingen.
Wat zijn de sterkste intermoleculaire krachten?
Die tussen ionen met tegengestelde totale ladingen (zoals in ionverbindingen). Deze stoffen vormen vaak kristalroosters en zijn meestal vaste stoffen zoals zouten en metalen.
Wat is het verband tussen kookpunt, intermoleculaire krachten en energie?
Om een stof te laten koken of smelten, moeten de intermoleculaire krachten tussen de moleculen overwonnen worden. Daarvoor is energie nodig in de vorm van warmte. Hoe sterker die krachten zijn, hoe meer energie nodig is om de moleculen uit elkaar te trekken, en dus hoe hoger het kook- of smeltpunt van de stof.
Wat is de invloed van de massa van moleculen op hun kookpunt?
Hoe groter de massa, hoe meer energie (E = mv²/2) nodig is om deeltjes te laten bewegen → dus hoe hoger het kookpunt.
Welke drie intermoleculaire krachten komen aan bod in dit hoofdstuk?
Dispersiekrachten (Londonkrachten)
Dipoolkrachten
Waterstofbruggen
Wat is het verschil in energieniveau tussen het verbreken van intermoleculaire en intramoleculaire bindingen?
Het verbreken van intramoleculaire bindingen vraagt veel meer energie dan het verbreken van intermoleculaire bindingen. Daarom veranderen stoffen bij koken niet van chemische structuur (moleculen blijven intact), maar alleen van aggregatietoestand.
Waarom zijn intermoleculaire krachten belangrijk bij het verklaren van fysische eigenschappen zoals het kookpunt?
Fysische eigenschappen zoals kookpunt, smeltpunt en oplosbaarheid worden bepaald door hoe sterk moleculen aan elkaar ‘plakken’. Die plakkracht wordt geleverd door intermoleculaire krachten. Hoe sterker deze krachten, hoe meer energie er nodig is om de moleculen van elkaar los te maken.
Waarom worden intermoleculaire krachten verbroken bij koken, maar niet de intramoleculaire?
Bij koken verandert de aggregatietoestand, niet de chemische samenstelling. Alleen de krachten tussen de moleculen (intermoleculair) worden verbroken, niet de bindingen binnenin de moleculen zelf (intramoleculair).
Wat gebeurt er met de moleculaire beweging in vaste, vloeibare en gasvormige stoffen?
In vaste stoffen: de moleculen trillen op hun plaats; er is nauwelijks beweging.
In vloeistoffen: moleculen rollen en glijden over elkaar heen.
In gassen: moleculen bewegen vrij en chaotisch, met hoge snelheid en zonder vaste structuur.
Hoe hangt de afstand tussen de moleculen samen met de aggregatietoestand?
Hoe groter de afstand tussen moleculen, hoe zwakker de intermoleculaire krachten.
In vaste stoffen is de afstand het kleinst.
In gassen is de afstand het grootst, waardoor de krachten vrijwel afwezig zijn.
Hoe kan je verklaren dat gassen zo gemakkelijk samendrukbaar zijn?
In een gas is er veel ruimte tussen de deeltjes, waardoor er weinig weerstand is bij samendrukken. In vaste stoffen en vloeistoffen zitten de deeltjes al dicht op elkaar, dus is samendrukken moeilijker.
Wat zegt de deeltjesvoorstelling over de sterkte van intermoleculaire krachten in verschillende fasen?
In een vaste stof zijn de intermoleculaire krachten het sterkst: de deeltjes zitten dicht bij elkaar en bewegen nauwelijks.
In een vloeistof zijn de krachten zwakker: de deeltjes bewegen meer.
In een gas zijn ze het zwakst of afwezig: de deeltjes zijn vrij bewegend en ver uit elkaar.
Wat betekent het dat een molecule polair is?
Een polaire molecule heeft een ladingsverschuiving binnen de molecule, waardoor er een positief en een negatief uiteinde ontstaat. Dit zorgt voor sterkere intermoleculaire aantrekkingskrachten tussen moleculen (zoals dipoolkrachten of waterstofbruggen).
Waarom hebben polaire stoffen doorgaans een hoger kookpunt dan apolaire stoffen?
Polaire stoffen hebben sterkere intermoleculaire krachten (zoals dipool-dipoolinteracties of waterstofbruggen), waardoor er meer energie nodig is om ze te laten koken. Apolaire stoffen hebben zwakkere dispersiekrachten.
Wat zijn ionverbindingen en waarom hebben die zulke hoge smeltpunten?
Ionverbindingen bestaan uit positieve en negatieve ionen die elkaar sterk aantrekken in een ionrooster. Die sterke krachten (elektrostatische aantrekking) vragen veel energie om te doorbreken, wat leidt tot hoge smelt- en kookpunten.
Wat gebeurt er energetisch gezien bij het koken van een vloeistof?
De moleculen krijgen voldoende kinetische energie om de intermoleculaire krachten te overwinnen. Ze breken los van elkaar en verdampen naar de gasfase.
Waarom heeft water een relatief hoog kookpunt voor zo'n kleine molecule?
Watermoleculen vormen waterstofbruggen, een bijzonder sterke vorm van intermoleculaire aantrekkingskracht tussen de H van het ene molecule en de O van een ander. Hierdoor is veel energie nodig om deze bruggen te verbreken.
Wat wordt bedoeld met ladingsverschuiving in een molecule?
Een ladingsverschuiving ontstaat wanneer elektronen ongelijk verdeeld zijn in een binding, waardoor één atoom een (gedeeltelijke) negatieve lading krijgt en het andere een (gedeeltelijke) positieve. Dit creëert een dipool.
Waarom is het belangrijk om te weten of een molecule apolair of polair is?
Het bepaalt de soort intermoleculaire krachten (dispersie, dipool, H-brug), en dus ook eigenschappen zoals kookpunt, oplosbaarheid en smeltpunt. Polaire stoffen lossen beter op in polaire oplosmiddelen, apolaire in apolaire.
Wat gebeurt er op moleculair niveau bij het smelten van een vaste stof?
De deeltjes krijgen door verwarming meer energie en gaan heviger trillen. Zodra ze genoeg energie hebben om de sterke intermoleculaire krachten in de vaste stof te overwinnen, breken ze los van hun vaste rooster en gaan ze vrijer bewegen in de vloeibare fase.
Wat verklaart het verschil in kookpunt tussen ethanol (78 °C) en water (100 °C), ondanks dat beide waterstofbruggen vormen?
Watermoleculen vormen meer en sterkere waterstofbruggen door hun twee waterstofatomen die elk met een zuurstof kunnen binden. Ethanol heeft maar één OH-groep en vormt daardoor minder H-bruggen. Hierdoor is het kookpunt van water hoger.
Waarom is het begrip “intermoleculaire kracht” essentieel in de chemie van alledaagse stoffen?
Omdat het bepaalt of een stof:
makkelijk verdampt (zoals ether)
oplosbaar is in water (zoals suiker)
stevig is bij kamertemperatuur (zoals zout)
→ Kortom: het bepaalt gedrag van stoffen in het dagelijks leven.
Waarom blijven watermoleculen in vloeibare toestand bij kamertemperatuur?
Omdat de temperatuur nog niet hoog genoeg is om de sterke waterstofbruggen tussen de moleculen te verbreken. Er is nog onvoldoende energie om ze in gasvorm om te zetten.
Wat is het verschil tussen een fysische en een chemische verandering met betrekking tot bindingen?
Een fysische verandering (zoals smelten, verdampen) verbreekt enkel intermoleculaire bindingen; de moleculen blijven intact.
Een chemische verandering (zoals verbranding, ontleding) verbreekt intramoleculaire bindingen; de moleculen worden omgezet in nieuwe stoffen.
Wat toont de vergelijking E = ½·m·v² aan in het kader van deeltjesbeweging?
Dat de kinetische energie van een deeltje afhankelijk is van de massa en vooral van de snelheid (in het kwadraat). Dus: sneller bewegende of zwaardere deeltjes hebben meer energie en kunnen makkelijker krachten tussen moleculen overwinnen.
Waarom moet je meer warmte toevoegen om water te koken dan om ethanol te koken?
Omdat water sterkere intermoleculaire krachten heeft (waterstofbruggen), waardoor er meer energie nodig is om deze te doorbreken in vergelijking met ethanol, dat zwakkere krachten heeft.
Welke rol speelt molecuulmassa in de aantrekkingskracht tussen moleculen?
Grotere moleculen hebben een grotere elektronenwolk, wat leidt tot sterkere tijdelijke ladingsfluctuaties(dispersiekrachten). Daardoor kunnen ze sterker aan elkaar trekken, wat het kookpunt verhoogt.
Waarom zijn gassen makkelijker te comprimeren dan vloeistoffen?
Omdat de deeltjes in een gas zich veel verder van elkaar bevinden en de intermoleculaire krachten zwak of afwezig zijn. Er is dus veel lege ruimte die je kan samendrukken. In vloeistoffen zitten de deeltjes al dicht bij elkaar.
Wat zou er gebeuren als intramoleculaire bindingen zouden breken tijdens het koken?
Dan zou de stof chemisch veranderen in een andere stof, omdat de moleculen zelf uit elkaar vallen. In realiteit gebeurt dat pas bij extreme hitte (zoals bij verbranding), niet bij normaal koken.
Wat zijn dispersiekrachten?
Dispersiekrachten zijn zeer zwakke intermoleculaire krachten tussen apolaire moleculen, veroorzaakt door tijdelijke ladingsverschuivingen (tijdelijke dipolen) door verplaatsing van elektronen.
Tussen welke moleculen ontstaan dispersiekrachten?
Tussen apolaire moleculen, die normaal geen blijvende ladingsverschuiving hebben.
Wat veroorzaakt een tijdelijke dipool?
Een tijdelijke ongelijke verdeling van elektronen in een molecule, waardoor kortstondig een positief en een negatief uiteinde ontstaat.
Wat is een geïnduceerde dipool?
Een dipool die ontstaat in een tweede molecule als gevolg van het elektrisch veld van een tijdelijke dipool in een ander molecule.
Hoe ontstaat aantrekkingskracht tussen apolaire moleculen?
Via tijdelijke dipolen die elkaar beïnvloeden en zo een zwakke aantrekkingskracht genereren — de dispersiekracht.
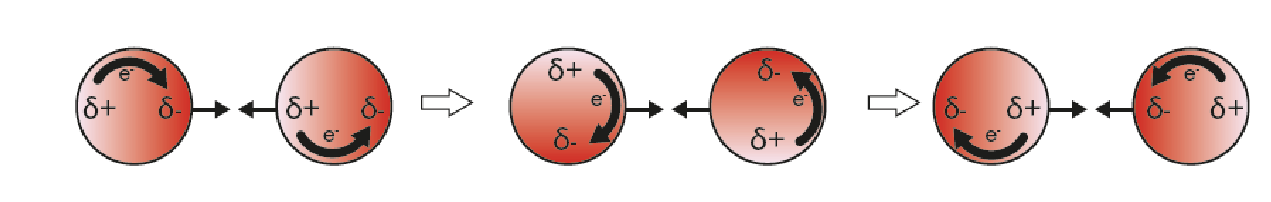
Wat stelt de afbeelding met de rode bollen met δ⁺ en δ⁻ voor?
De tijdelijke ladingsverschuiving door verplaatsing van elektronen bij apolaire moleculen. Hierdoor ontstaan zwakke aantrekking tussen moleculen via tijdelijke dipolen.
Hoe beïnvloedt de molecuulmassa de sterkte van dispersiekrachten?
Wat betekent ‘polariseerbaarheid’ in dit verband?
Hoe groter de massa (en dus het aantal elektronen), hoe groter de polariseerbaarheid, en hoe sterker de dispersiekrachten.
De mate waarin de elektronenwolk van een molecule kan vervormen. Grotere moleculen met meer elektronen zijn makkelijker te vervormen → sterkere tijdelijke dipolen.
Wat gebeurt er met dispersiekracht in de reeks CH₄ → C₂H₆ → C₃H₈ → C₄H₁₀?
De dispersiekracht neemt toe van links naar rechts, omdat de moleculen groter worden en meer elektronen bevatten.
Waarom heeft propaan een hoger kookpunt dan methaan?
Omdat propaan groter is, meer elektronen heeft en dus sterkere dispersiekrachten vertoont. Daardoor is er meer energie nodig om de moleculen van elkaar los te maken.
Wat is het verschil in kookpunt tussen n-pentaan en dimethylpropaan?
n-Pentaan kookt bij 36°C en dimethylpropaan bij 10°C. n-Pentaan heeft een langwerpige structuur met meer contactoppervlak → sterkere dispersiekrachten.
Waarom heeft n-pentaan een groter contactoppervlak dan dimethylpropaan?
Omdat n-pentaan een lineaire keten is, terwijl dimethylpropaan een vertakte structuur heeft die minder goed aansluit op andere moleculen.
Wat is het effect van vertakking op dispersiekrachten?
Meer vertakking → minder contactoppervlak → zwakkere dispersiekrachten → lager kookpunt.
Waarom kan een groter contactoppervlak leiden tot een hoger kookpunt?
Een groter contactoppervlak laat meer interactie tussen moleculen toe, dus sterkere dispersiekrachten → meer energie nodig om ze te verbreken.
Waarom zijn dispersiekrachten belangrijk in apolaire mengsels?
Omdat ze de enige vorm van aantrekking zijn tussen apolaire moleculen en dus bepalen of de stof vloeibaar of gasvormig is bij een bepaalde temperatuur.
Kunnen dispersiekrachten ooit sterker zijn dan intramoleculaire bindingen?
Bij zeer grote apolaire moleculen kunnen dispersiekrachten zo krachtig worden dat ze vergelijkbaar worden met covalente bindingen, bijvoorbeeld bij sommige grote alkanen of polymeren.
Waarom is het verschil in kookpunt tussen isomeren zoals n-pentaan en dimethylpropaan relevant?
Het toont aan dat niet alleen de molecuulformule telt, maar ook de structuur — die beïnvloedt hoe goed moleculen met elkaar kunnen interageren.
Waarom wrijven grotere moleculen beter, volgens de cursus?
Omdat ze een groter oppervlak hebben dat in contact komt met andere moleculen. Daardoor kunnen er meer tijdelijke dipolen ontstaan → sterkere dispersiekrachten.
Wat gebeurt er met de kooktemperatuur als een molecule regelmatiger gevormd is?
De kooktemperatuur stijgt, omdat regelmatige (lineaire) moleculen beter contact maken en dus sterkere dispersiekrachten hebben.
Wat is een praktische toepassing van dispersiekrachten in de industrie?
Bij het ontwerpen van oplosmiddelen, plastics of smeermiddelen kijkt men naar dispersiekrachten om te bepalen hoe stoffen zich onderling aantrekken of afstoten.
Wanneer zijn dispersiekrachten het sterkst?
Bij grote, apolaire, regelmatige moleculen met een groot contactoppervlak en veel elektronen (dus een hoge polariseerbaarheid).
Wat bepaalt in apolaire stoffen het kookpunt?
De sterkte van de dispersiekrachten, die afhankelijk zijn van molecuulgrootte, polariseerbaarheid en structuur.
Wat is het algemene besluit over de invloed van structuur op dispersiekrachten?
Grote apolaire moleculen met een groot contactoppervlak hebben sterkere dispersiekrachten dan kleinere, vertakte of grillige moleculen.
Wat zijn dipoolkrachten?
Dipoolkrachten zijn intermoleculaire krachten tussen polaire atoomverbindingen waarin een permanente dipoolaanwezig is. Er ontstaat aantrekkingskracht tussen de positieve en negatieve uiteinden (δ⁺ en δ⁻) van verschillende dipoolmoleculen.
Wat is een permanente dipool?
Een blijvende ladingsverschuiving in een molecule, waarbij één kant gedeeltelijk positief (δ⁺) en de andere gedeeltelijk negatief (δ⁻) is, door verschil in elektronegativiteit tussen atomen.
Wat is het verschil tussen dispersiekrachten en dipoolkrachten?
Dispersiekrachten zijn zwak en tijdelijk, tussen apolaire moleculen.
Dipoolkrachten zijn sterker en permanent, tussen polaire moleculen.
Waarom hebben polaire stoffen doorgaans een hoger kookpunt dan apolaire stoffen?
Omdat dipoolkrachten sterker zijn dan dispersiekrachten, waardoor meer energie (warmte) nodig is om de moleculen van elkaar te scheiden bij het koken.
Welke soort krachten werken in CH₃COONa?
CH₃COONa bevat een ionverbinding, waardoor er ion-ionkrachten zijn — veel sterker dan dipoolkrachten.
Welke krachten werken in CH₃COOH?
CH₃COOH bevat enkel polaire covalente bindingen en heeft dus dipoolkrachten tussen de moleculen.
Rangschik deze intermoleculaire krachten van sterk naar zwak: dispersiekrachten, dipoolkrachten, ion-ionkrachten.
Ion-ionkrachten
Dipoolkrachten
Dispersiekrachten
Wat is het gevolg van dipoolkrachten voor de oriëntatie van moleculen?
Dipoolmoleculen oriënteren zich gericht, zodat de positieve kant van het ene molecule naar de negatieve kant van het andere wijst.
Welke wet wordt gebruikt om de sterkte van dipoolkrachten te vergelijken?
Een aangepaste vorm van de wet van Coulomb, waarbij niet de totale ladingen maar de gedeeltelijke ladingen (δ) in rekening worden gebracht.
Waarom zijn dipoolkrachten minder krachtig dan ion-ionkrachten?
Omdat dipoolkrachten gebaseerd zijn op gedeeltelijke ladingen (δ), terwijl ion-ionkrachten tussen volledige ladingen (+1, -1, …) werken.
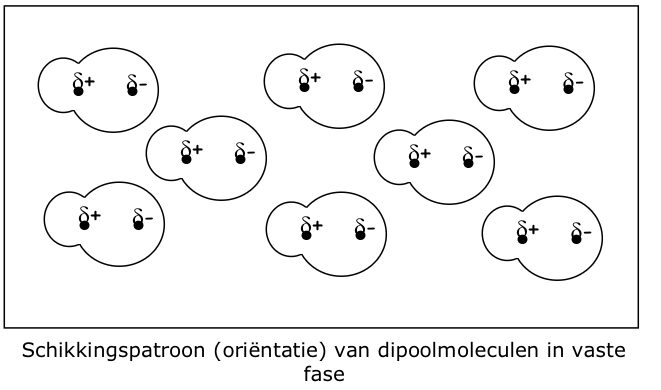
Wat stelt de tekening met de 'schikkingspatroon van dipoolmoleculen' voor?
De georiënteerde rangschikking van dipoolmoleculen in vaste fase, waarbij de δ⁺ van het ene molecule naar de δ⁻ van het andere is gericht → dit maximaliseert de aantrekkingskracht.
Wat is het belang van die oriëntatie bij dipoolkrachten?
De aantrekkingskracht is alleen effectief als de moleculen juist georiënteerd zijn; dit beperkt de kracht in vloeibare fase, maar versterkt ze in vaste fase.
Wat bedoelt men met: “de dipolen zijn georiënteerd”?
Dat de positieve kant van het ene molecule systematisch gericht is naar de negatieve kant van het andere, waardoor er richtingsgevoelige aantrekking ontstaat.
Waarom is het vergelijken van kookpunten tussen polaire stoffen niet altijd eenduidig?
Omdat naast dipoolkrachten ook andere factoren zoals molaire massa, structuur en extra krachten (zoals H-bruggen)een rol spelen.
Wat geldt algemeen over massa en dipoolkrachten?
Hoe groter de molaire massa (Mᵣ), hoe groter meestal ook de dipoolkracht en dus hoe hoger het kookpunt — tenzij andere factoren sterker doorwegen.
Wat is het verband tussen dipoolmoment en kookpunt?
Een sterker dipoolmoment betekent meestal een hogere aantrekkingskracht, wat leidt tot een hoger kookpunt.
Welke soort binding hebben CH₃F en CH₃Cl?
Beide zijn polaire atoomverbindingen en vertonen dipoolkrachten tussen hun moleculen.
Welke van CH₃F en CH₃Cl heeft de grootste molaire massa?
CH₃Cl heeft een grotere molaire massa dan CH₃F.
Welke van CH₃F en CH₃Cl heeft het hoogste kookpunt?
CH₃Cl, omdat het een hogere molaire massa heeft en daardoor sterkere dipoolkrachten en ook meer dispersiekrachten.
Waarom is CH₃F ondanks hogere elektronegativiteit geen uitzondering met hoger kookpunt?
Omdat kookpunt niet alleen bepaald wordt door elektronegativiteit, maar ook door massa en totale moleculaire interacties. CH₃Cl is zwaarder en heeft dus meer aantrekkingskracht.
Kunnen moleculen met dezelfde dipoolkracht toch verschillende kookpunten hebben?
Ja, als hun massa of structuur verschilt, beïnvloeden dispersiekrachten of oriëntatie-effecten ook het kookpunt.
Welke stof verwacht je makkelijker te laten verdampen: CH₃F of CH₃Cl?
CH₃F, omdat het een lager kookpunt heeft → minder energie nodig om vloeistof om te zetten in damp.
Waarom gebruikt men vaak meerdere stoffen met dipoolkrachten als referentie?
Omdat één factor zelden doorslaggevend is. Door meerdere vergelijkingen krijg je een betrouwbaarder beeld van hoe dipoolkrachten werken.
Wat gebeurt er met dipoolkrachten bij hogere temperaturen?
Bij hogere temperaturen bewegen moleculen sneller, waardoor hun georiënteerde schikking verstoord raakt → dipoolkrachten worden minder effectief.
Wat zijn waterstofbruggen?
Waterstofbruggen zijn intermoleculaire krachten die ontstaan tussen een waterstofatoom dat gebonden is aan een klein, sterk elektronegatief atoom (zoals O, N of F), en een vrij elektronenpaar op een ander sterk elektronegatief atoom in een ander molecule.
Tussen welke atoomcombinaties kunnen H-bruggen voorkomen?
O–H···O
N–H···N
F–H···F
Elke combinatie vereist dat H gebonden is aan O, N of F, met een vrij elektronenpaar op het andere O, N of F.
Waarom is H belangrijk in H-bruggen?
Omdat H geen interne elektronenmantel heeft: als het een elektron afstaat aan een sterk elektronegatief atoom, wordt het extreem positief geladen (δ⁺), waardoor het sterk aangetrokken wordt door een vrij elektronenpaar van een ander electronegatief atoom.
Welke structurele kenmerken zijn noodzakelijk voor H-brugvorming?
Een H-atoom gebonden aan O, N of F
Een vrij elektronenpaar op een ander O, N of F
Goede ruimtelijke oriëntatie van donor en acceptor
Hoe sterk zijn waterstofbruggen t.o.v. andere intermoleculaire krachten?
Waterstofbruggen zijn:
± 10× sterker dan dispersiekrachten
Sterker dan dipoolkrachten
Maar zwakker dan intramoleculaire covalente bindingen (ongeveer 1/6 ervan)
Rangschik deze van sterk naar zwak: covalente binding, H-brug, dipoolkracht, dispersiekracht.
Covalente binding
Waterstofbrug
Dipoolkracht
Dispersiekracht
Welke invloed hebben waterstofbruggen op het kookpunt?
Waterstofbruggen verhogen het kookpunt aanzienlijk omdat ze sterke aantrekkingskrachten vormen die veel energie vragen om te verbreken.
Waarom heeft water (H₂O) zo'n hoog kookpunt?
Omdat watermoleculen meerdere H-bruggen kunnen vormen per molecule, wat zorgt voor een sterk netwerk van intermoleculaire bindingen.
Wat verklaart het kookpuntverschil tussen CH₄ en CH₃OH?
CH₄ is apolair en vertoont alleen zwakke dispersiekrachten.
CH₃OH is polair en kan zowel dipoolkrachten als H-bruggen vormen → veel hogere kooktemperatuur.
Wat is de kookpuntrangorde van CH₄ en CH₃OH?
CH₃OH heeft een veel hoger kookpunt dan CH₄:
→ H-bruggen > dipoolkrachten > dispersiekrachten
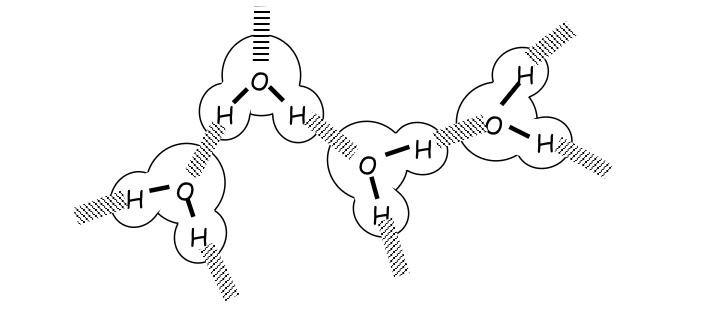
Wat toont de afbeelding met H₂O-moleculen in kring?
Dat elk waterstofatoom een H-brug vormt met een zuurstofatoom van een ander molecule, wat leidt tot een uitgebreid netwerk van waterstofbruggen in vloeibaar water.
Waarom zijn O, N en F geschikt voor H-brugvorming?
Sterk elektronegatief zijn (trekken elektronen sterk aan)
Kleine atoomstraal hebben (waardoor hun lading geconcentreerd is)
Vrije elektronenparen bezitten
Waarom kan CH₄ geen waterstofbruggen vormen?
Omdat H in CH₄ enkel aan C is gebonden, en C is niet sterk genoeg elektronegatief om een significante δ⁻-lading te creëren — dus geen H-brugmogelijkheid.
Waarom kan CH₃OH wel waterstofbruggen vormen?
Omdat het een O–H-groep bevat: H is gebonden aan een sterk elektronegatief atoom (O), en het O-atoom heeft een vrij elektronenpaar om H-bruggen met andere moleculen te vormen.
Wat betekent de vergelijking:
H-bruggen > Dipoolkrachten > Dispersiekrachten?
Dat H-bruggen de sterkste intermoleculaire binding zijn tussen neutrale moleculen, gevolgd door dipoolinteracties en daarna de veel zwakkere dispersiekrachten.
Wat betekent: θₖ(CH₃OH) > θₖ(CH₄)?
Het kookpunt van methanol (CH₃OH) is hoger dan dat van methaan (CH₄) door de aanwezigheid van H-bruggen in methanol, die veel meer energie vergen om te doorbreken.
Welke rol speelt elektronegativiteit bij H-brugvorming?
Een grote elektronegativiteit van het atoom gebonden aan H is essentieel om een sterk δ⁻-centrum te creëren dat H-brugvorming mogelijk maakt.
Wat gebeurt er met H-bruggen bij verdamping?
De H-bruggen worden verbroken wanneer de stof overgaat van vloeistof naar gas, omdat de moleculen ver genoeg van elkaar komen te liggen.
Wat bepaalt het aantal mogelijke H-bruggen in een stof?
Aantal O–H, N–H of F–H groepen (donoren)
Aantal vrije elektronenparen op O, N of F (acceptoren)
Ruimtelijke structuur en mobiliteit van moleculen