Translation och proteiner
1/51
Earn XP
Description and Tags
Translation, aminosyror, proteiner osv.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
52 Terms
Stoppkodon: UAA, UAG, UGA
Eukaryot → En 40S och en 60 S subenhet bildar en 80 S ribosom. 80% rRNA och 20 % ribosomala proteiner.
Första basen i antikodonet bestämmer antalet kodoner som kan kännas igen av tRNA.
Det minimala antalet antikodon för att läsa av 61 kodon är 32.
Varför finns Wobblande baspar?
Det ökar translationshastighet eftersom basparen är instabila → lägre energi krävs för dissociation.
Det krävs färre antikodon eftersom en tRNA-molekyl kan koda för fler aminosyror.
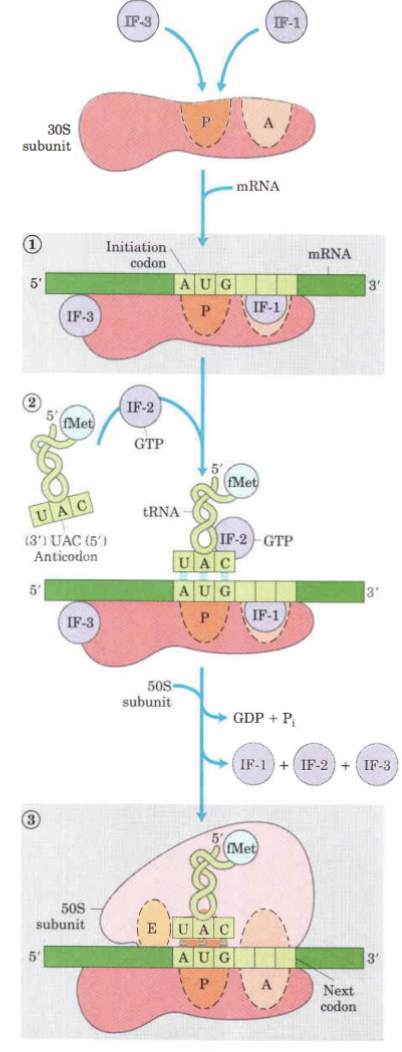
1. Initieringsfaktorerna **IF1** och IF3 binder in till 30S subenheten.
2. IF1 binder till A-site.
3. mRNA binder rätt till 30S subenhetens genom guidning av Shine-delgarno-sekvensen beläget ca 8 baspar från startkodonet.
4. AUG placerar i P-site, fMet-tRNA är den enda aminoacyl-tRNA som binder hit först.
5. GTP-bundet IF2 och fMet-tRNA binder in till preinitieringskomplexet.
6. 50S subenheten binder in samtidigt som GTP bundet till IF2 hydrolyseras och då dissocierar från komplexet.
7. Ett 70S komplex har bildats och elongering startar.
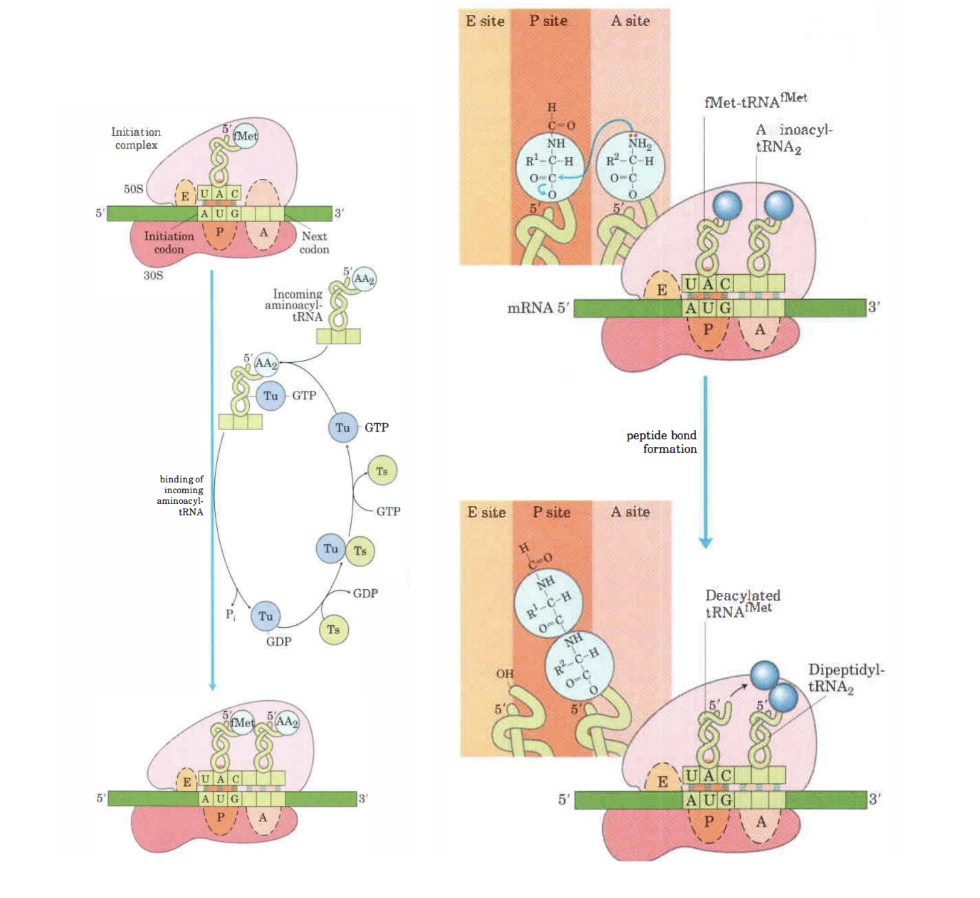
1. Bindning till inkommande aminoacyl-tRNA.
2. Skapande av peptidbindning.
3. Translokalisation.
Hur sker elongering av translation hos prokaryoter?
Aminoacyl-tRNA binder till GTP-bundet EF-Tu som sedan binder in till 70S-komplexets A-site.
EF-Tu + GTP-komplexet hydrolyseras och dissocierar.
Det bildas en peptidbinding mellan aminosyrorna genom att alfa-aminogruppen på A-site gör en nukelofil attack på karboxylgruppens aminosyran i P-site.
Det bildas en dipeptidas-tRNA i A-site. Medan tRNA i P-site blir deacylerad. Reaktionen katalyseras av peptidyltransferas (en del av 23S rRNA subenhet)
Slutligen flyttas kodonet i mRNA:ts 3’ rikting. Dipeptidyl-tRNA flyttas till P-site och den oladdade tRNA flyttas till E-site. Förflyttning katalyseras av EF-G eller translokas mha GTP som hydrolyseras.
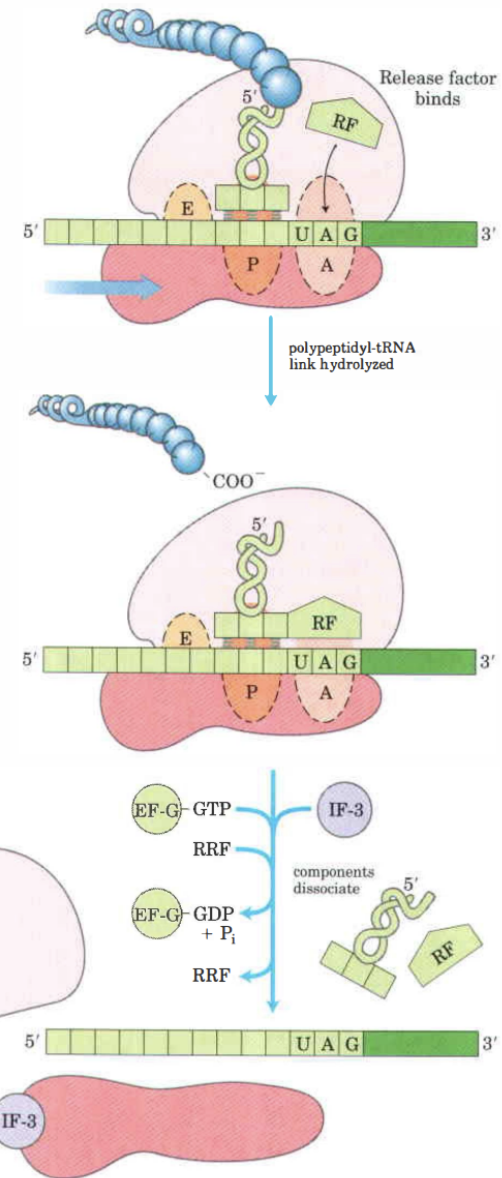
1. När stoppkodnet finns på A-site identifieras den av antingen R1 eller R2 (release factor) beroende på vilket stoppkodon det är.
2. RF’s hydrolyserar den terminerande peptidyl-tRNA-bindingen.
3. RF’s frisätter polypeptiden från P-site samt den oladdade tRNA.
4. RF’s dissocierar 70S ribosomen till 30 & 50S genom att EF-G bundet GTP hydrolyseras.
* Olika många IF’s, EF’s och RF’s
* Hastigheten
1. eIF1 och eIF3 binder in till 40S subenheten för att förhindra för tidig bindning till 60S.
2. fMet-tRNA bildar ett komplex med eIF2-bundet GTP som binder in till 40S subenheten genom att GTP hydrolyseras.
3. mRNA binder till komplexet mha initieringsfaktorer eIF4 som identifierar 5’-capen.
4. När startkodonet identifierats i P-site binder 60S subenheten in och det bildas ett 80S komplex.
5. Elongering startar.
EF-Ts = eEF1
EF-Tu = eEF1
EF-G = eEF2
\
1. eRF hydrolyserar den terminerande peptidyl-tRNA-bindingen.
2. eRF frisätter polypeptiden från P-site samt den oladdade tRNA.
3. RF’s dissocierar 80S ribosomen till 40 & 60S genom att eEF2 bundet GTP hydrolyseras.
* Katalytiska centrum för enzymer.
* Signalering (GABA, glutamat, glycin, tyrosin (adrenalin).
* Energikälla.
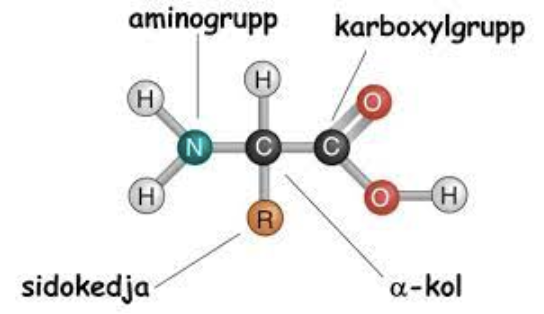
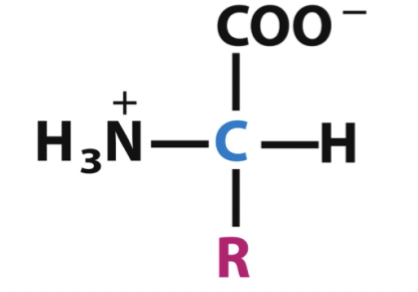
Vad är aminosyrans grundstruktur?
Alfakol.
R-grupp (sidokedja).
N-terminal: aminogrupp.
C-terminal: karboxylgrupp.
* Polära oladdade
* Aromatiska
* Postitivt laddade
* Negativt laddade
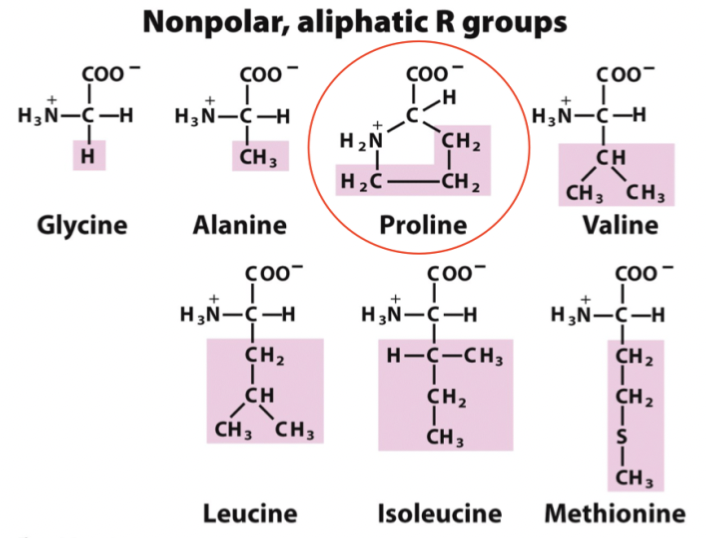
Vad är karaktäristiskt för alifatiska/opolära aminosyror?
Deras R-grupp består endast av kolväten. Undantag är metionin som har en svavelgrupp - men den förblir oladdade. Det är följande aminosyror:
Glycin
Alanin
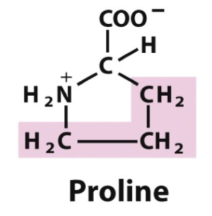
Proline
Valin
Leucin
Isoleucin
Metionin
Glada albatrosser provar meth, isen luktade valium.
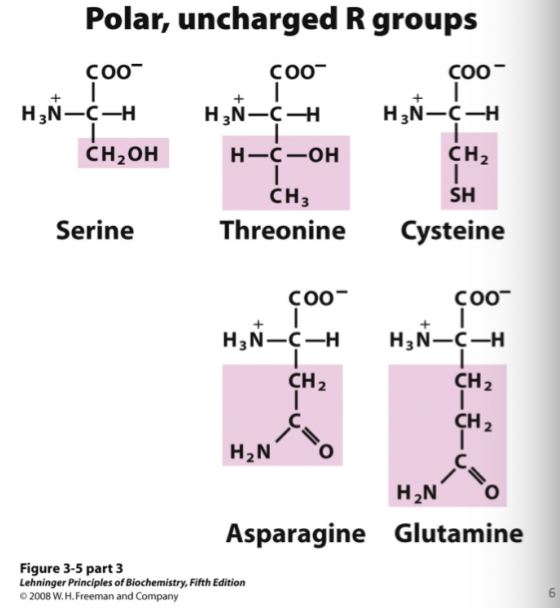
Vad är karaktäristiskt för polära oladdade aminosyror?
Deras R-grupp består av en fri OH-grupp, amingrupp eller SH-grupp:
Serin
Treonin
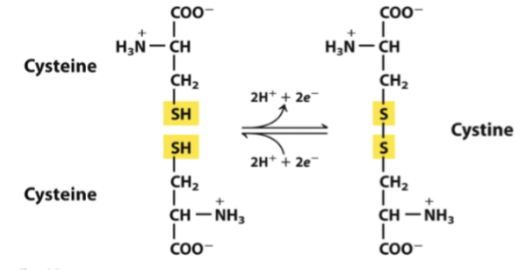
Cystein
Aspargin (amin)
Glutamin (amin)
Coola treos asp ser glutamin.
* Tyrosin
* Fenylalanin
* Tryptofan
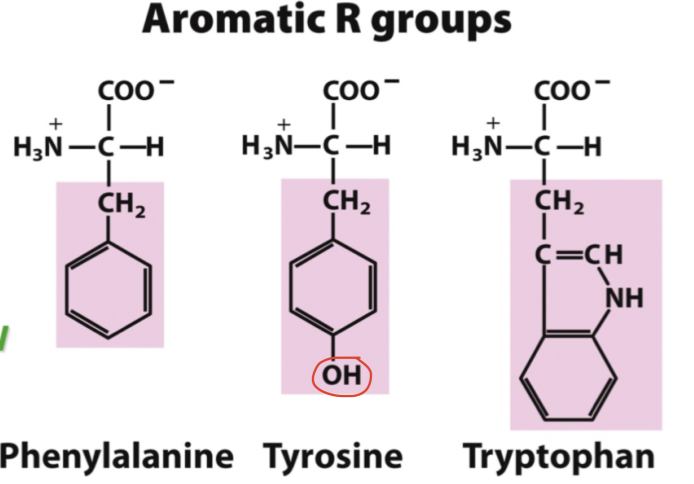
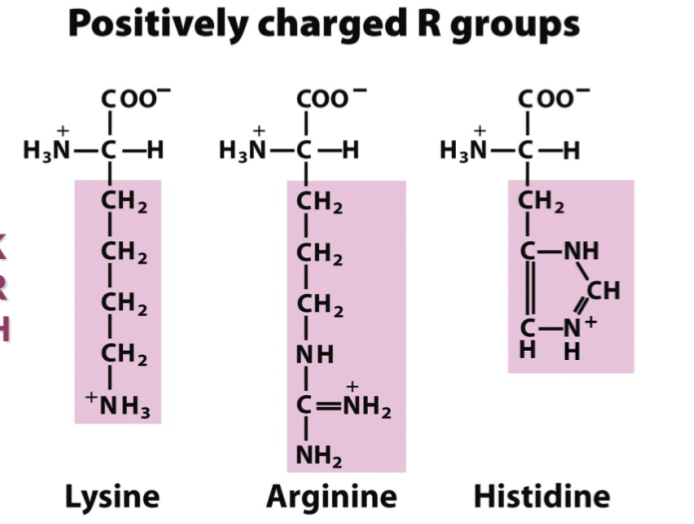
* Lysin
* Arginin
* Histidin
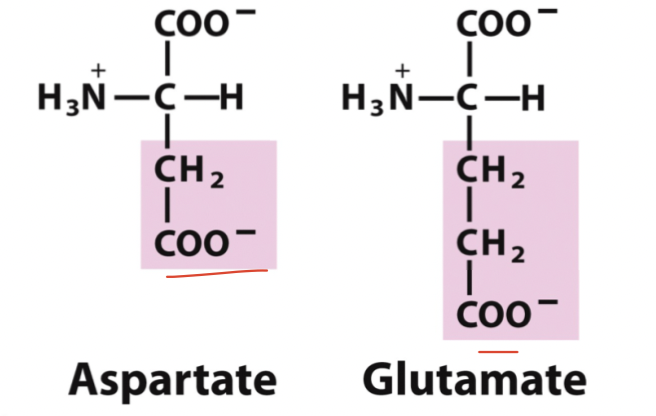
* Aspartat
* Glutamat
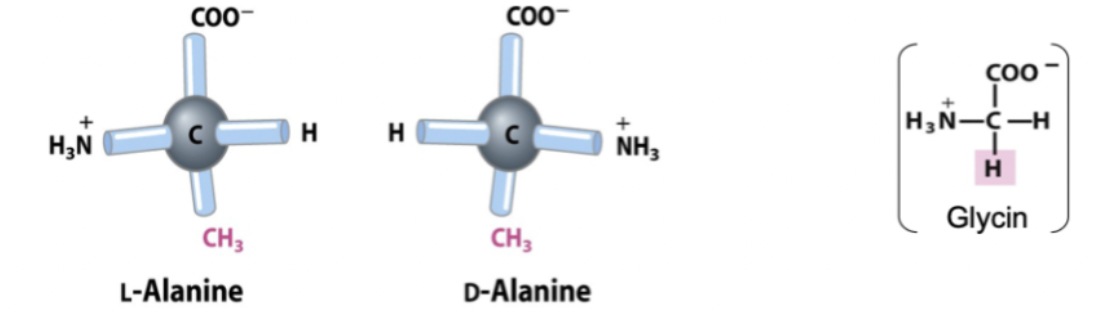
\
I naturen förekommer endast L-aminosyror hos proteiner. D-aminosyror är ovanliga.
* När pH är högre än pKa kommer aminosyran att vara deprotonerad.
Vilka 5 posttranslationella modifieringar kan aminosyror genomgå?
Fosforylering
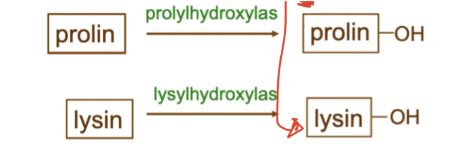
Hydroxylering
Disulfidbryggor
Karboxylering
Peptidbinding
Dessa är posttranslationella modifikationer.
* Tyrosin
* Serin
* Treonin
* **Hydroxyprolin**
* **Hydroxylysin**
Vad är karboxylering?
En posttranslationell process där koldioxid adderas med hjälp av enzymet karboxylas → det resulterar i en binding till kalcium. Kan endast ske av glutaminsyra.
Här är K-vitamin en kofaktor. Warfarin är hämmare.
Vilken aminosyra kan karboxyleras?
Glutaminsyra (ej glutamat).
Vilken aminosyra är mest benägen att bilda alfahelix?
Alanin.
* Antalet aminosyror.
* Fördelning av de 20 aminosyrorna.
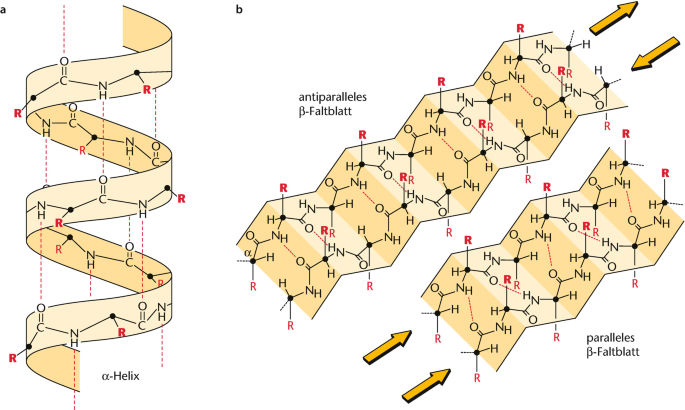
* Beta-flak: antiparallella eller parallella
* Alfa-helix: vanligt för vissa aminosyror
\
Ibland kan det uppstå “svängar” som kopplar samman alfa och beta, sker endast med prolin och glycin.
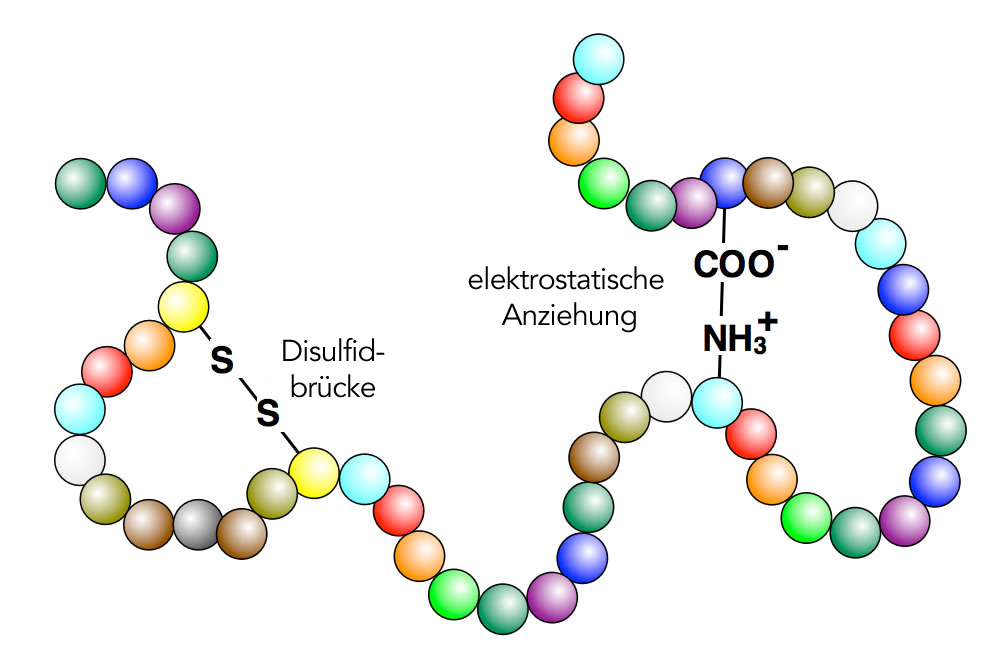
* vätebindning
* elektrostatiska interaktioner
* hydrofoba interaktioner
* van der Waals
* disulfidbryggor
* Dimer (2)
* Trimer
* Tetramer
\
→De kan vara **homodimerer** eller **heterodimerer**
\
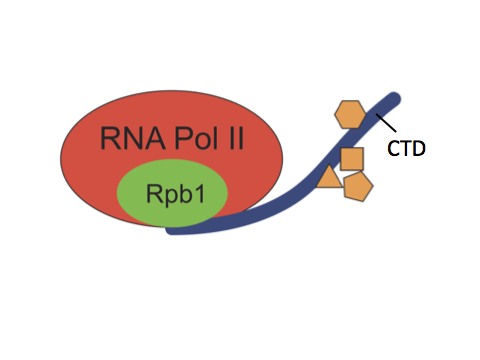
Till exempel har RNA-polymeras en CTD-domän (C-terminal domän) vars funktion är att fosforyleras/defosforyleras.
\
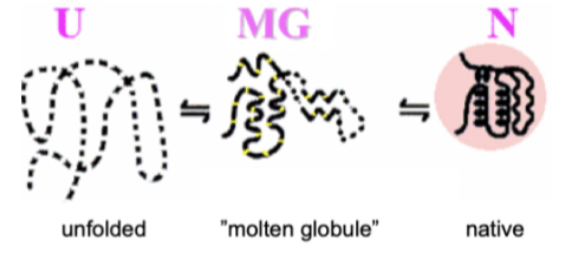
* **Hierarkisk**: Lokala sekundärstrukturer bildas för att sedan bilda domäner och slutligen proteinet.
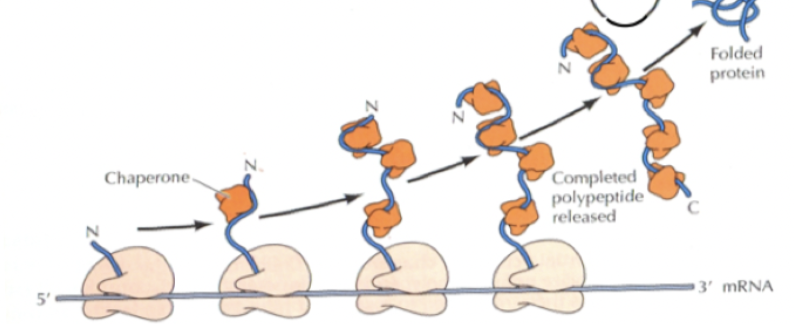
* Molekylära chaperoner (Hsp70)
* Chaperoniner
* Glykosylering
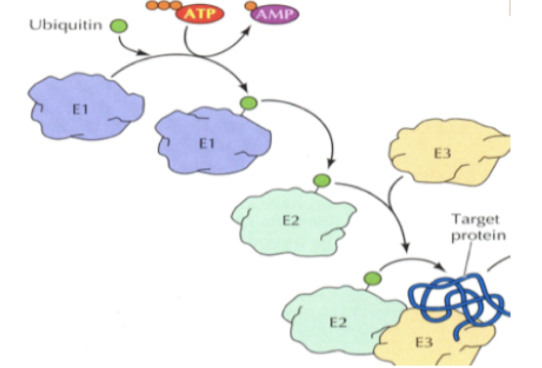
* Ubiquitinering
* Veckning
* Proteolytisk klyvning
Vad är glykosylering och varför är det nödvändigt?
Addering av en sockermolekyl för att göra proteinet mer hydrofilt och motståndskraftigt för enzymatisk nedbrytning.
Nödvändigt för:
Sortering av lysosomala proteiner
Cell-cellkommunikation
Hur sker glykosylering och var?
Addition av sockermolekyl till proteiner.
N-länkad (vanligast) → Asn (asparagin).
O-länkad → serin och treonin.
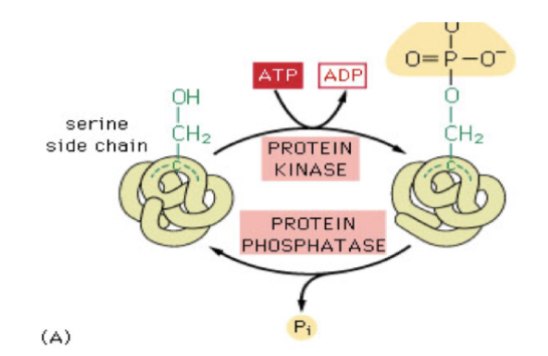
Hur sker fosforylering?
Fosforylering är den vanligaste modifikationen. Kinaser fosforylerar proteiner medan fosfataser defosforylerar.
Det sker genom at ATP donerar sin fosfatgrupp till en aminosyra med en fri OH-grupp.
Exempel: Chymotrypsinogen klys av pepsin till chymotrypsin.