CM3: Matrice extracellulaire
1/21
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
22 Terms
1. Définition
1. Qu’est-ce que la matrice extracellulaire (MEC) ?
2. Rôles
2. Quels sont les principaux rôles de la MEC ?
3. Présence et variabilité
3. Dans quels organismes vivants retrouve-t-on une MEC ou une structure équivalente ?
4. La quantité de MEC est-elle constante dans tous les tissus ?
4. Types de tissus conjonctifs selon MEC/cellules
5. Quels sont les différents types de tissu conjonctif en fonction du rapport MEC/cellules et de la composition de la MEC ?


1. Qu’est-ce que la matrice extracellulaire (MEC) ?
La MEC est un enchevêtrement de macromolécules sécrétées localement par les cellules et organisées en un réseau structuré dans l’espace extracellulaire.
Elle constitue un élément majeur du tissu conjonctif.
Elle occupe, avec le liquide interstitiel, tout l’espace compris entre les différents tissus.
👉 Elle est essentielle pour le soutien, l’organisation et la communication intercellulaire.
2. Rôles
2. Quels sont les principaux rôles de la MEC ?
Soutien de la cellule.
Protection mécanique et chimique.
Organisation tissulaire (architecture des tissus).
Migration cellulaire (guidage lors du développement ou de la réparation tissulaire).
Communication cellulaire (via des interactions ligand-récepteur comme avec les intégrines).
3. Présence et variabilité
3. Dans quels organismes vivants retrouve-t-on une MEC ou une structure équivalente ?
Elle est présente dans la plupart des organismes vivants.
Exemples : parois des cellules végétales, coquilles des mollusques, paroi cellulaire des bactéries.
👉 Chez les vertébrés, on se concentre sur la MEC du tissu conjonctif.
4. La quantité de MEC est-elle constante dans tous les tissus ?
Non, la quantité varie selon le tissu :
Très abondante : cartilage, os.
Modérée : cerveau.
👉 La proportion MEC/cellules reflète la fonction mécanique ou métabolique du tissu.
4. Types de tissus conjonctifs selon MEC/cellules
5. Quels sont les différents types de tissu conjonctif en fonction du rapport MEC/cellules et de la composition de la MEC ?
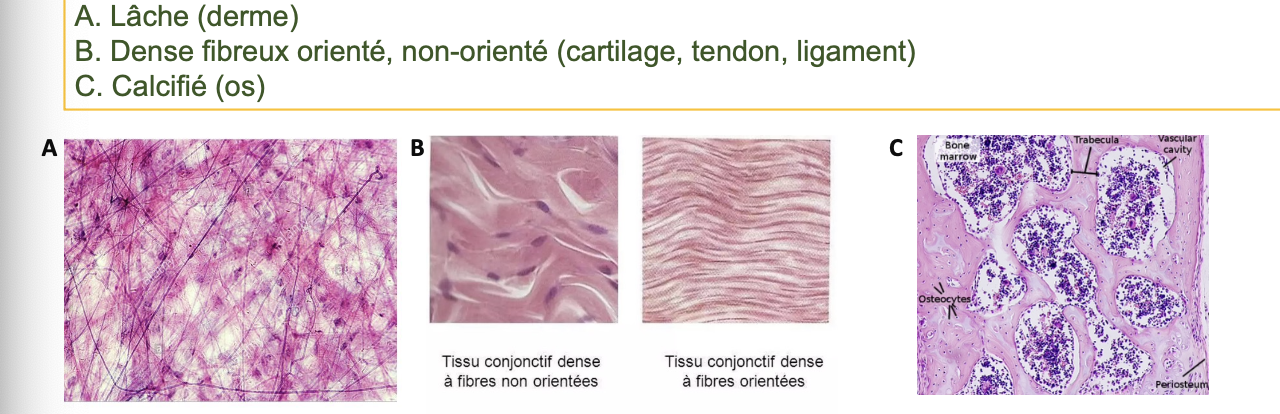
A. Lâche : ex. derme.
B. Dense fibreux : orienté ou non-orienté → ex. cartilage, tendons, ligaments.
C. Calcifié : ex. os.
Constituants de la matrice extracellulaire (MEC) — Protéines d’adhérence 1. Définition
1. Qu’est-ce qu’une protéine d’adhérence ?
2. Types de protéines d’adhérence
2. Quels sont les deux grands types de protéines d’adhérence selon leur fonction principale ?
3. Exemples principaux
3. Quels sont quatre exemples de protéines d’adhérence majeures ?
1. Définition
1. Qu’est-ce qu’une protéine d’adhérence ?
Une protéine d’adhérence est une macromolécule spécialisée qui permet aux cellules :
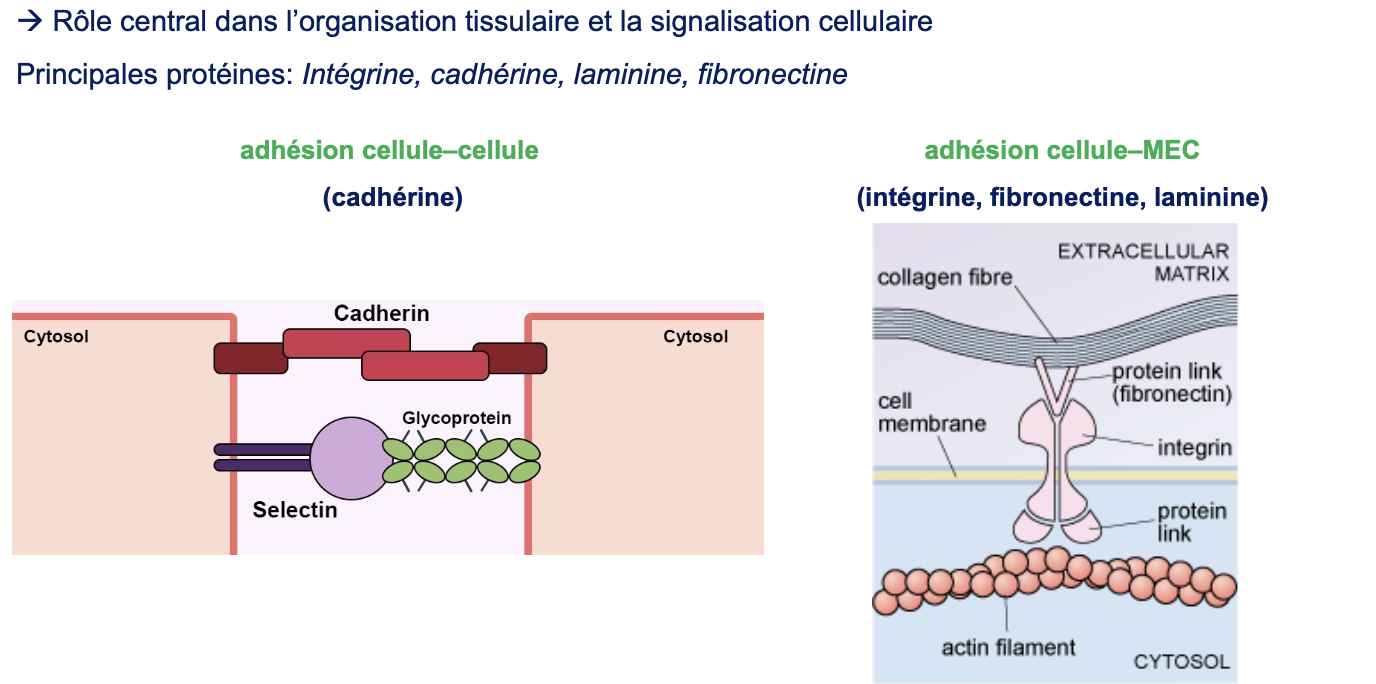
soit de s’attacher les unes aux autres (adhésion cellule–cellule),
soit de s’ancrer à la matrice extracellulaire (adhésion cellule–MEC).
👉 Elles jouent un rôle central dans le soutien mécanique, l’organisation tissulaire et la signalisation cellulaire, en transmettant des informations bidirectionnelles entre la cellule et son environnement.
2. Types de protéines d’adhérence
2. Quels sont les deux grands types de protéines d’adhérence selon leur fonction principale ?
Protéines d’adhérence cellule–cellule : médiées surtout par les cadhérines et les sélectines.
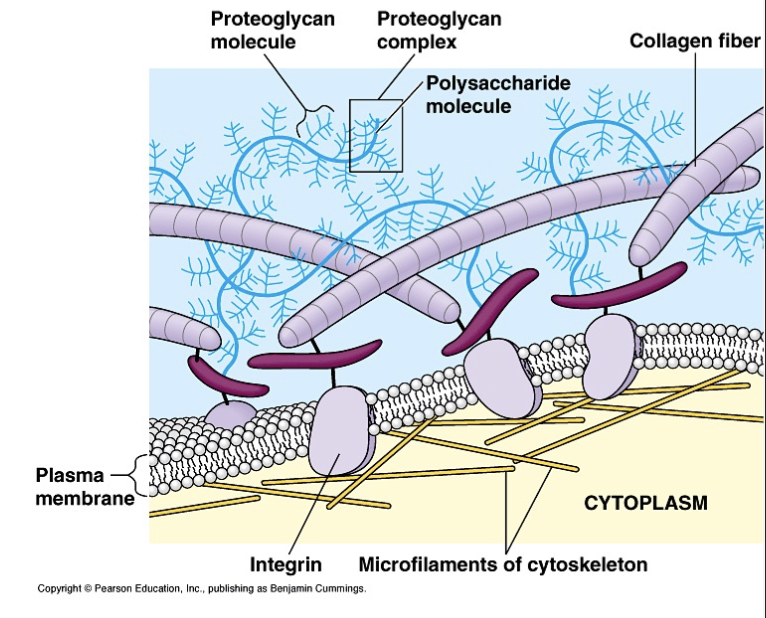
Protéines d’adhérence cellule–MEC : médiées par les intégrines, qui interagissent avec des glycoprotéines de la MEC comme la fibronectine et la laminine.
3. Exemples principaux
3. Quels sont quatre exemples de protéines d’adhérence majeures ?
Cadhérine : impliquée dans les jonctions cellule–cellule (adhérence dépendante du calcium).
Sélectine : impliquée dans les interactions transitoires cellule–cellule, par ex. migration leucocytaire.
Intégrine : assure l’ancrage cellule–MEC et la transduction de signaux mécaniques et chimiques.
Fibronectine et laminine : glycoprotéines de la MEC servant de ligands pour les intégrines, reliant la cellule aux fibres de collagène et à l’organisation matricielle.
Constituants de la matrice extracellulaire (MEC) — Protéines d’adhérence : Intégrines 1. Nature et fonction générale
1. Qu’est-ce qu’une intégrine et quel est son rôle principal ?
2. Structure
2. Quelle est la structure de base d’une intégrine ?
3. Quelles régions particulières stabilisent sa conformation tridimensionnelle ?
3. Liaison aux ligands
4. Qu’est-ce que le motif RGD et quel est son rôle ?
5. Quelles protéines de la MEC présentent ce motif RGD reconnu par les intégrines ?
4. Fonctions biologiques des intégrines
6. Quelles sont les principales fonctions de l’interaction intégrines–RGD ?
7. Que se passe-t-il en cas de mutation ou de modification des régions riches en cystéines des intégrines ?
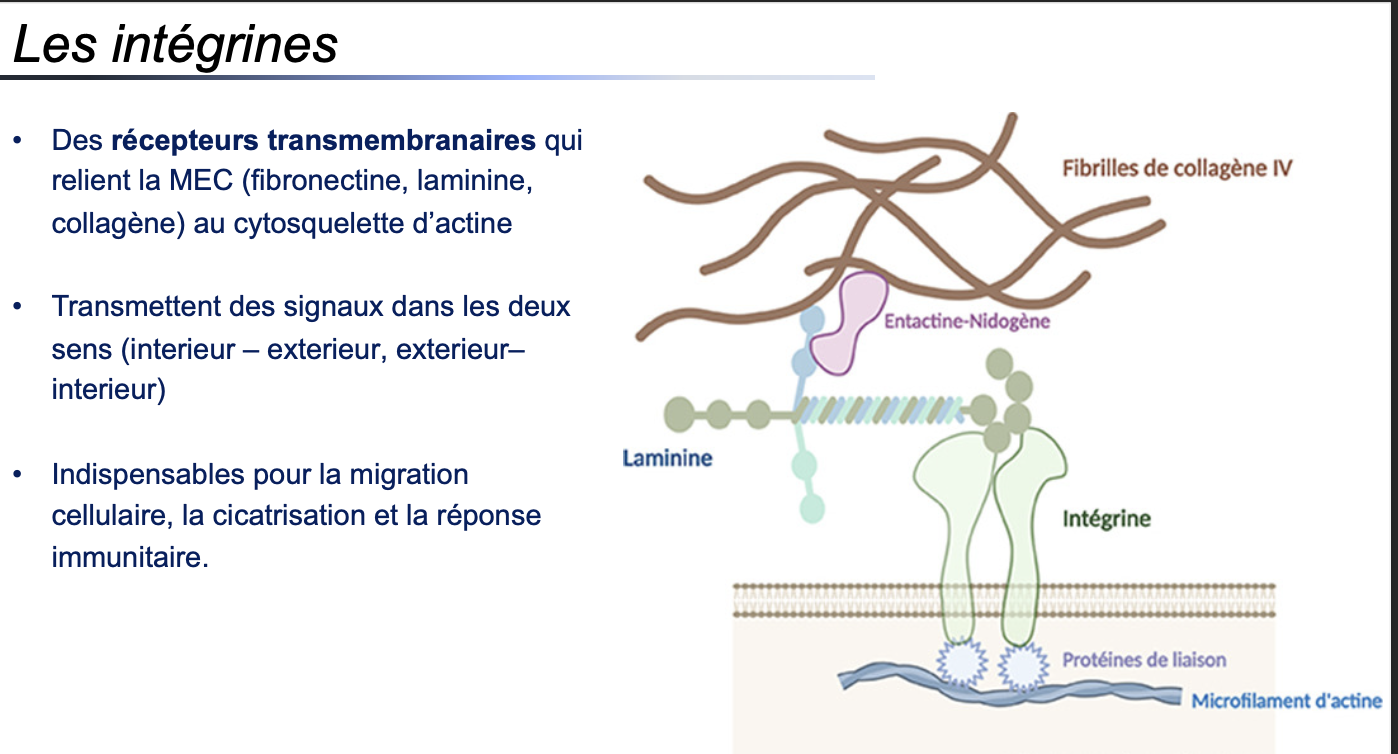

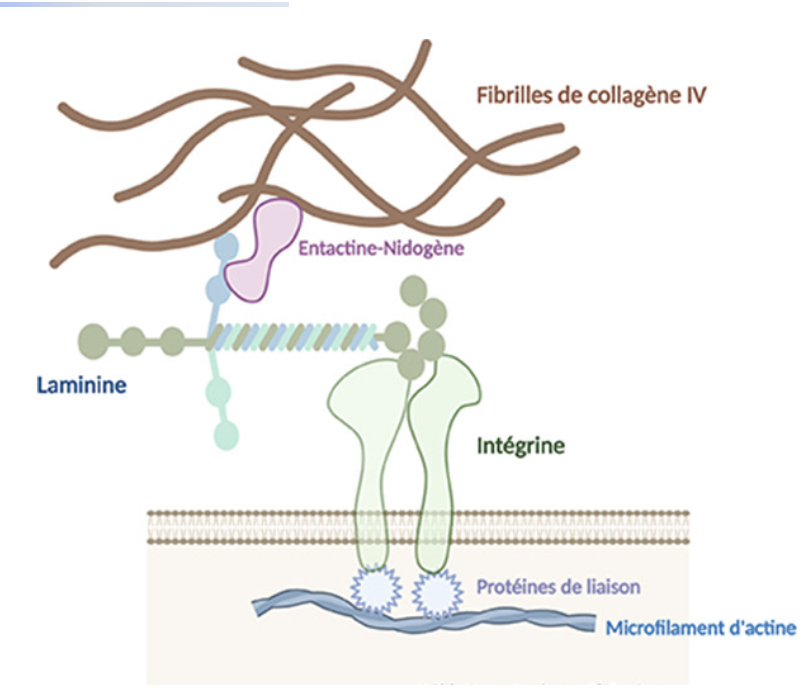
1. Nature et fonction générale
1. Qu’est-ce qu’une intégrine et quel est son rôle principal ?
Les intégrines sont des récepteurs transmembranaires hétérodimériques qui relient la MEC (fibronectine, laminine, collagène) au cytosquelette d’actine.
Elles transmettent des signaux dans les deux sens : intérieur → extérieur et extérieur → intérieur.
👉 Elles sont essentielles pour la migration cellulaire, la cicatrisation et la réponse immunitaire.
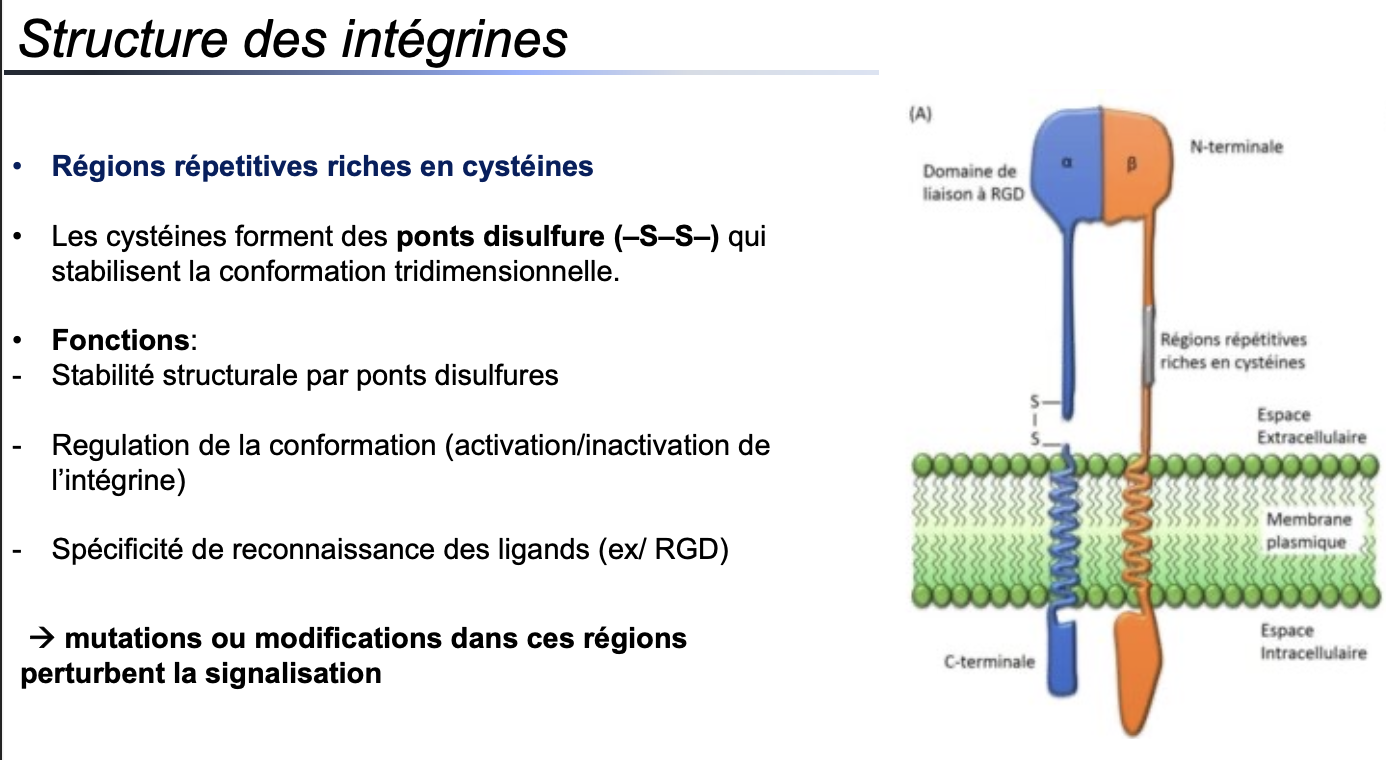
2. Structure
2. Quelle est la structure de base d’une intégrine ?
Une intégrine est un hétérodimère composé de 2 sous-unités : une α et une β.
Chaque sous-unité traverse la membrane et possède un domaine extracellulaire de reconnaissance des ligands et un domaine intracellulaire lié au cytosquelette.
3. Quelles régions particulières stabilisent sa conformation tridimensionnelle ?
Les intégrines possèdent des régions répétitives riches en cystéines, formant des ponts disulfure (–S–S–).
Ces ponts assurent :
une stabilité structurelle,
une régulation de la conformation (activation/inactivation),
une spécificité de reconnaissance des ligands.
3. Liaison aux ligands
4. Qu’est-ce que le motif RGD et quel est son rôle ?
Le motif RGD est une séquence tripeptidique (Arginine – Glycine – Aspartate).
Il sert de site de reconnaissance pour de nombreuses intégrines et permet leur interaction avec les protéines de la MEC.
5. Quelles protéines de la MEC présentent ce motif RGD reconnu par les intégrines ?
Fibronectine
Laminine
Collagène
4. Fonctions biologiques des intégrines
6. Quelles sont les principales fonctions de l’interaction intégrines–RGD ?
Adhésion cellulaire : ancrage des cellules à la MEC.
Signalisation : activation de cascades intracellulaires (FAK, Src, MAPK).
Migration cellulaire : point d’accroche pour le déplacement (embryogenèse, cicatrisation, immunité).
Survie et différenciation : la liaison intégrine–RGD influence le destin cellulaire.
7. Que se passe-t-il en cas de mutation ou de modification des régions riches en cystéines des intégrines ?
Ces altérations perturbent la signalisation, car elles modifient la conformation et la capacité de liaison aux ligands.
👉 Cela peut compromettre l’adhésion cellulaire, la migration et la survie.
Constituants de la matrice extracellulaire (MEC) — Protéines d’adhérence : Rôle des intégrines 1. Généralités
1. Quelle est la particularité de la signalisation des intégrines ?
2. Signalisation inside-out (de la cellule vers la MEC)
2. Qu’est-ce que la signalisation inside-out des intégrines et quelles sont ses étapes principales ?
3. Quelle est la conséquence de cette signalisation inside-out ?
3. Signalisation outside-in (de la MEC vers la cellule)
4. Qu’est-ce que la signalisation outside-in des intégrines et quelles sont ses étapes principales ?
5. Quelles sont les conséquences intracellulaires de la signalisation outside-in ?
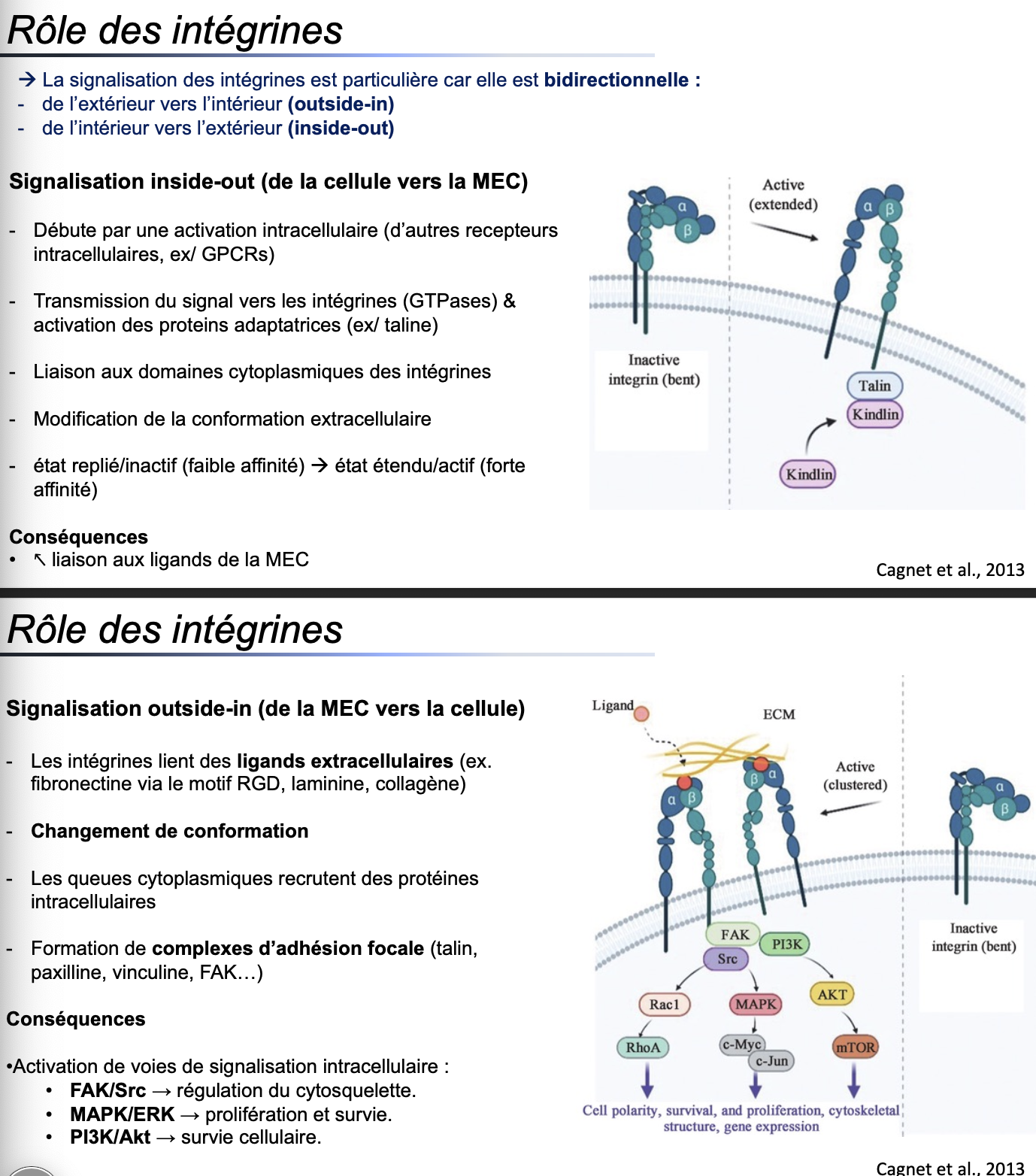
1. Généralités
1. Quelle est la particularité de la signalisation des intégrines ?
La signalisation des intégrines est bidirectionnelle :
Outside-in : de la MEC vers l’intérieur de la cellule.
Inside-out : de l’intérieur de la cellule vers la MEC.
👉 Cela leur permet de réguler à la fois l’adhésion et la signalisation cellulaire en fonction du contexte.
2. Signalisation inside-out (de la cellule vers la MEC)
2. Qu’est-ce que la signalisation inside-out des intégrines et quelles sont ses étapes principales ?
Elle débute par l’activation de récepteurs intracellulaires (ex. GPCRs).
Cette activation stimule des GTPases et recrute des protéines adaptatrices (ex. taline, kindline) sur les domaines cytoplasmiques des intégrines.
Cela induit une modification de la conformation extracellulaire des intégrines : passage d’un état replié/inactif (faible affinité) à un état étendu/actif (forte affinité).
3. Quelle est la conséquence de cette signalisation inside-out ?
Augmentation de la liaison des intégrines aux ligands de la MEC (fibronectine, laminine, collagène).
3. Signalisation outside-in (de la MEC vers la cellule)
4. Qu’est-ce que la signalisation outside-in des intégrines et quelles sont ses étapes principales ?
Les intégrines lient des ligands extracellulaires (ex. fibronectine via motif RGD, laminine, collagène).
Elles subissent un changement de conformation.
Les queues cytoplasmiques recrutent des protéines intracellulaires (taline, paxilline, vinculine, FAK).
Formation de complexes d’adhésion focale qui connectent la MEC au cytosquelette d’actine.
5. Quelles sont les conséquences intracellulaires de la signalisation outside-in ?
Activation de plusieurs voies de signalisation majeures :
FAK/Src → régulation du cytosquelette.
MAPK/ERK → prolifération et survie.
PI3K/Akt/mTOR → survie cellulaire et inhibition de l’autophagie.
👉 Ces cascades influencent la polarité cellulaire, la prolifération, la survie, la migration et l’expression génique.
Constituants de la matrice extracellulaire (MEC) — Protéines d’adhérence : Fibronectine 1. Structure et formes
1. Qu’est-ce que la fibronectine et sous quelles formes existe-t-elle ?
2. Quelle est la structure générale de la fibronectine (sous-unités, organisation) ?
2. Fonctions biologiques
3. Quelles sont les principales interactions de la fibronectine avec d’autres composants de la MEC et des cellules ?
4. Quel est son rôle dans la migration cellulaire et le remodelage de la MEC ?
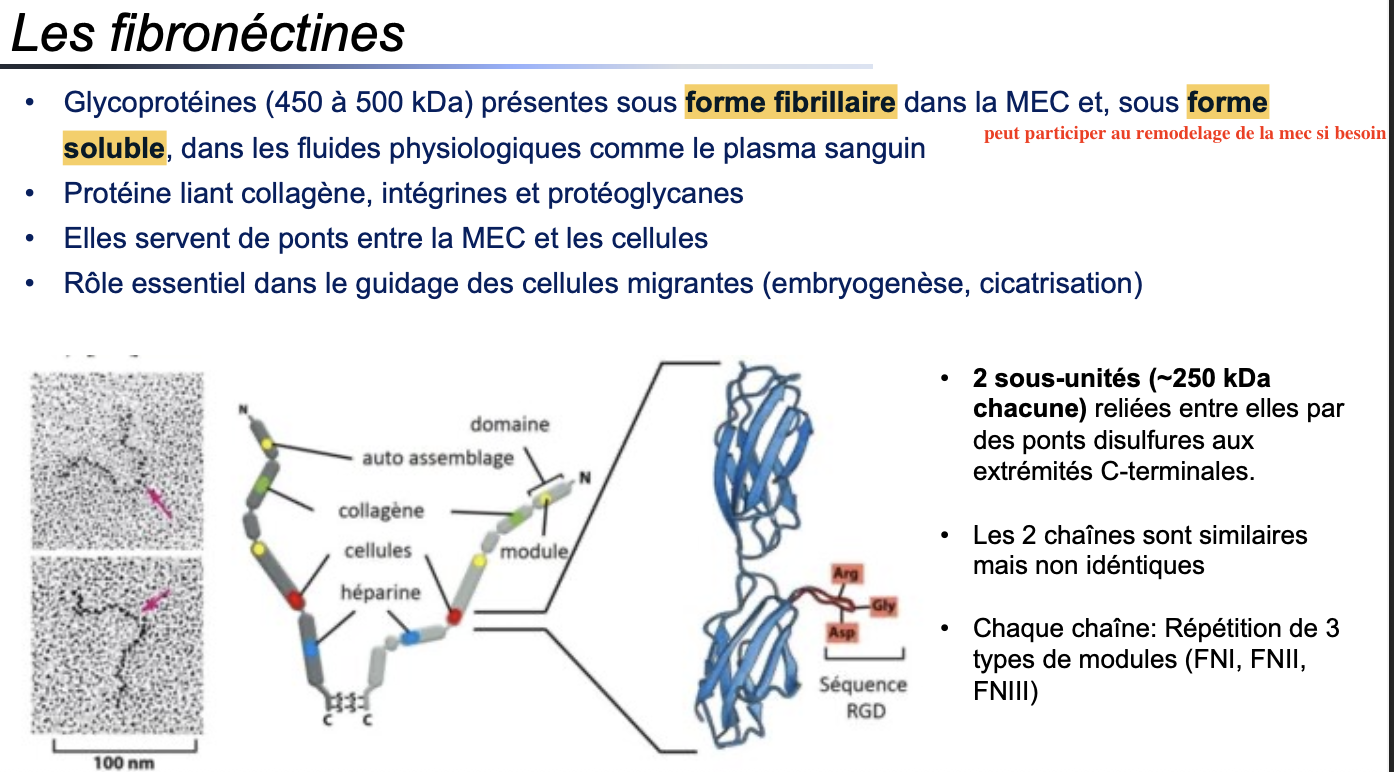
1. Structure et formes
1. Qu’est-ce que la fibronectine et sous quelles formes existe-t-elle ?
La fibronectine est une glycoprotéine de grande taille (450–500 kDa).
Elle existe sous :
une forme fibrillaire → intégrée dans la MEC (structure stable, rôle d’échafaudage).
une forme soluble → présente dans les fluides physiologiques (ex. plasma sanguin), capable de participer au remodelage de la MEC si nécessaire.
2. Quelle est la structure générale de la fibronectine (sous-unités, organisation) ?
Elle est composée de 2 sous-unités de ~250 kDa chacune.
Ces sous-unités sont reliées entre elles par des ponts disulfures aux extrémités C-terminales.
Les 2 chaînes sont similaires mais non identiques.
Chaque chaîne comporte une répétition de 3 types de modules structuraux : FNI, FNII, FNIII.
La fibronectine contient une séquence RGD (Arg-Gly-Asp), indispensable à sa liaison avec les intégrines.
2. Fonctions biologiques
3. Quelles sont les principales interactions de la fibronectine avec d’autres composants de la MEC et des cellules ?
Liaison au collagène.
Liaison aux intégrines (via le motif RGD).
Liaison aux protéoglycanes (ex. héparane-sulfate).
👉 Elle agit ainsi comme un pont entre la MEC et les cellules.
4. Quel est son rôle dans la migration cellulaire et le remodelage de la MEC ?
Elle fournit un guidage aux cellules migrantes (ex. lors de l’embryogenèse et de la cicatrisation).
La fibronectine soluble peut être réorganisée en réseau fibrillaire par les cellules, contribuant au remodelage dynamique de la MEC.
👉 Elle est donc essentielle au déplacement cellulaire, à la réparation tissulaire et au maintien de l’organisation tissulaire.
Constituants de la matrice extracellulaire (MEC) — Protéines d’adhérence : Domaines fonctionnels de la fibronectine 1. Organisation structurale
1. Quels sont les principaux domaines fonctionnels de la fibronectine et comment sont-ils organisés ?
2. Sites de liaison spécifiques
2. Quel domaine de la fibronectine permet l’ancrage au collagène ?
3. Quel domaine permet l’interaction avec l’héparine et les protéoglycanes ?
4. Quel domaine permet la liaison aux intégrines et quelle séquence est impliquée ?
5. Quel domaine est impliqué dans la liaison à la fibrine et quelle est son importance physiologique ?
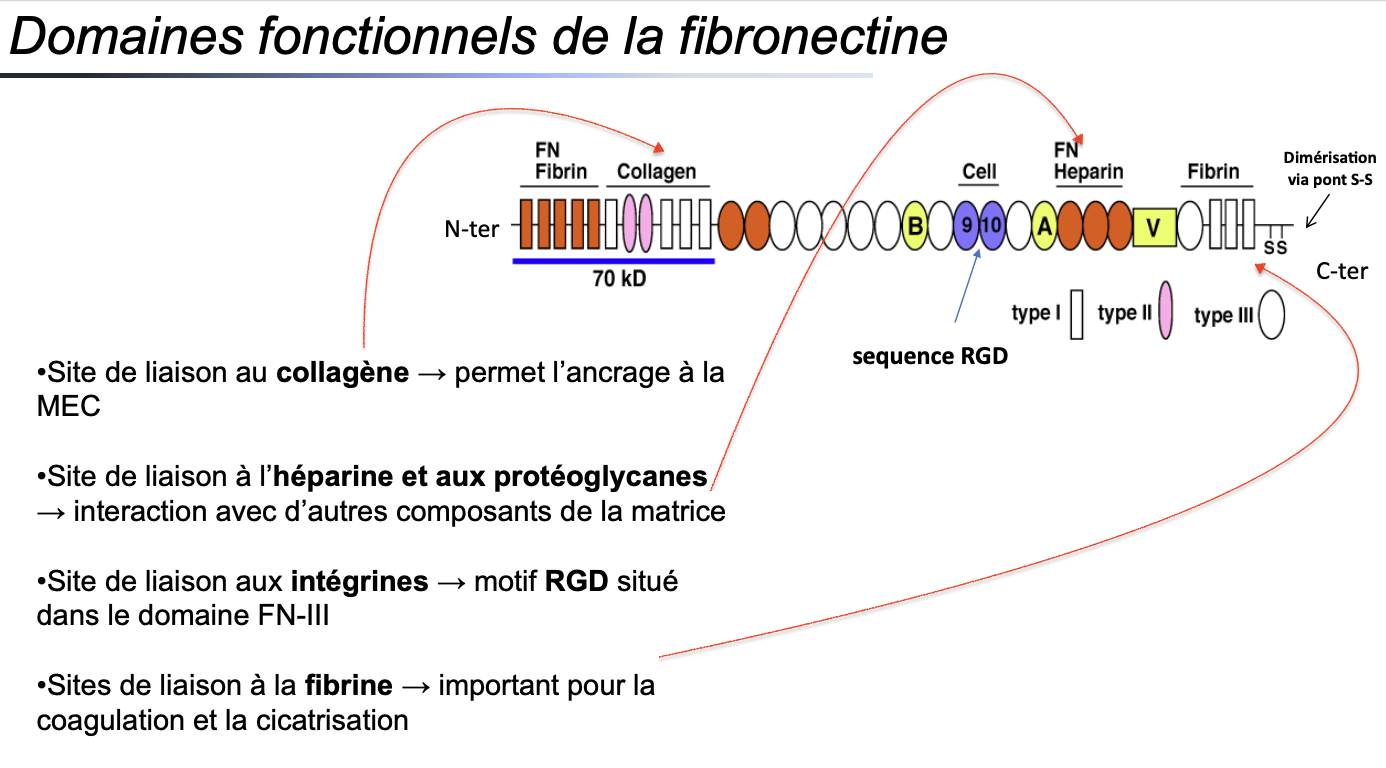
1. Organisation structurale
1. Quels sont les principaux domaines fonctionnels de la fibronectine et comment sont-ils organisés ?
La fibronectine est une glycoprotéine modulaire composée de répétitions de 3 types de modules : type I, II et III.
Chaque module correspond à un domaine de liaison spécifique.
L’organisation suit un axe N-terminal → C-terminal avec des sites distincts pour : le collagène, l’héparine/protéoglycanes, les intégrines et la fibrine.
Les deux sous-unités de fibronectine sont reliées par des ponts disulfures (–S–S–) au niveau du C-terminal.
2. Sites de liaison spécifiques
2. Quel domaine de la fibronectine permet l’ancrage au collagène ?
Le domaine de liaison au collagène se situe dans la partie N-terminale.
👉 Il assure l’ancrage de la fibronectine à la MEC via les fibres de collagène.
3. Quel domaine permet l’interaction avec l’héparine et les protéoglycanes ?
La fibronectine possède des sites de liaison à l’héparine et aux protéoglycanes.
👉 Cela permet une interaction avec d’autres composants de la matrice et favorise l’organisation du réseau extracellulaire.
4. Quel domaine permet la liaison aux intégrines et quelle séquence est impliquée ?
Le motif RGD (Arg-Gly-Asp) est situé dans le domaine type III (FN-III).
👉 Ce motif est reconnu spécifiquement par les intégrines, permettant l’adhérence cellule–MEC et la signalisation bidirectionnelle.
5. Quel domaine est impliqué dans la liaison à la fibrine et quelle est son importance physiologique ?
La fibronectine possède des sites de liaison à la fibrine, également situés dans la région terminale.
👉 Cette interaction est cruciale pour la coagulation sanguine et la cicatrisation (stabilisation du caillot, remodelage tissulaire).
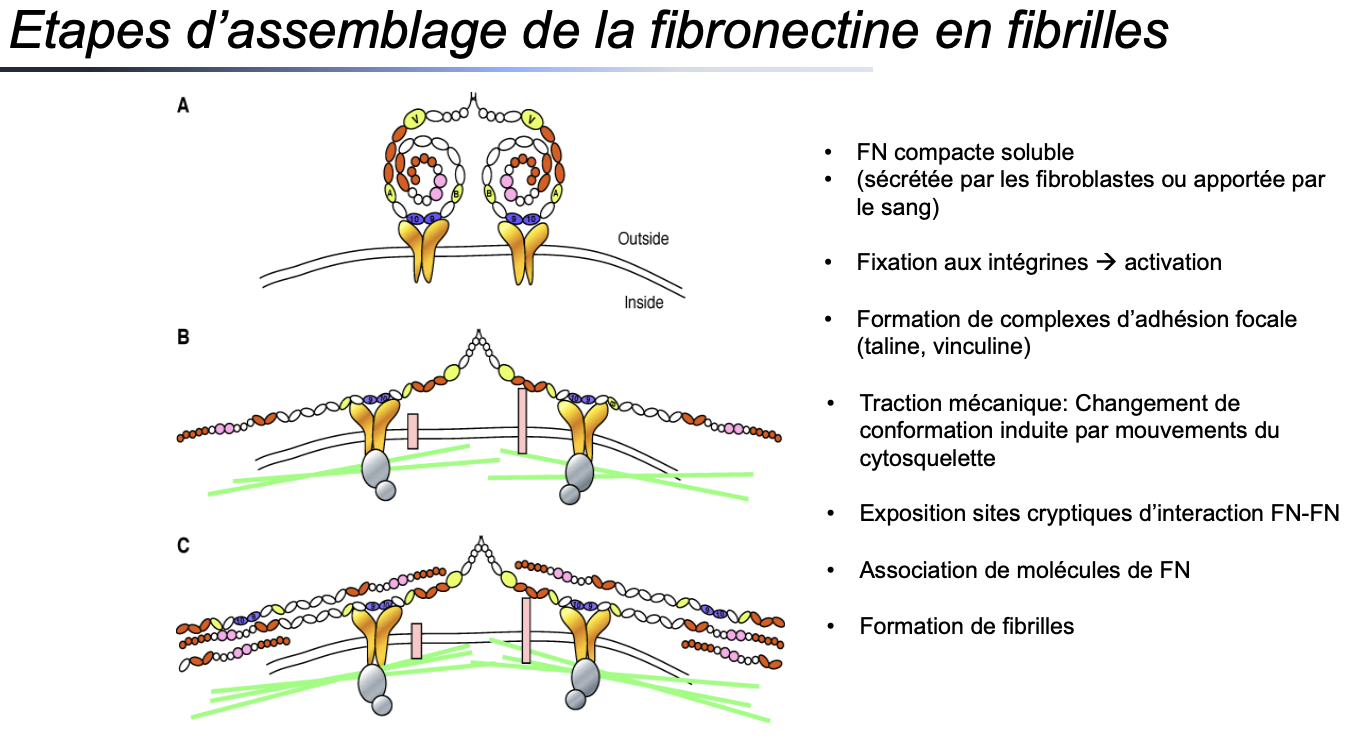
2- Constituants de la matrice extracellulaire (MEC)
• Protéines d’adhérance: Etapes d’assemblage de la fibronectine en fibrilles?
2 Constituants de la MEC — Protéines d’adhérence : Laminine
Questions
Qu’est-ce qu’une laminine et où se trouve-t-elle majoritairement ?
Quelle est la structure d’une laminine (sous-unités, organisation) ?
Quel est le rôle principal des laminines dans la MEC ?
Quels types d’interactions les laminines établissent-elles avec les cellules et autres constituants de la MEC ?
Donne un exemple de trimère de laminine chez l’homme.

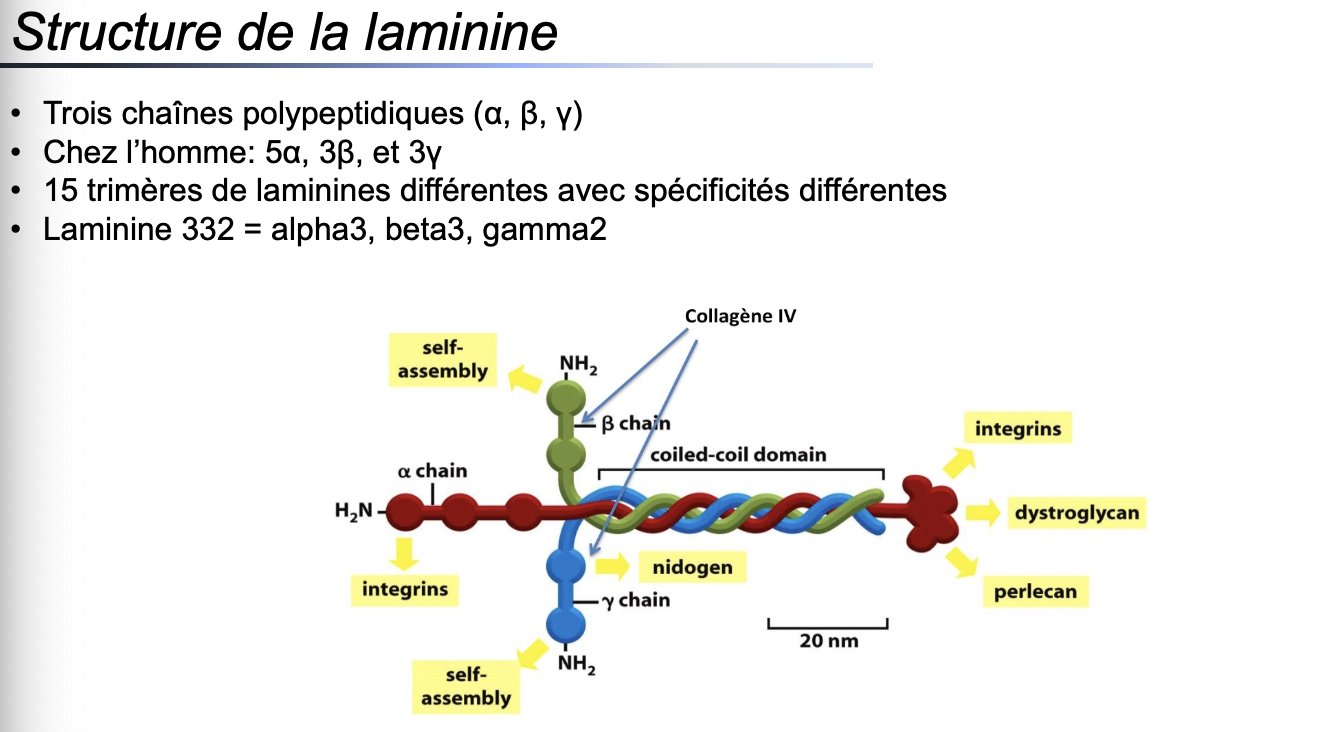
1. Qu’est-ce qu’une laminine et où se trouve-t-elle majoritairement ?
Les laminines sont une famille de glycoprotéines de grande taille (400–1000 kDa) présentes principalement dans les membranes basales des tissus. Elles jouent un rôle d’interface entre les tissus conjonctifs et les cellules des tissus épithéliaux ou parenchymateux.
2. Quelle est la structure d’une laminine (sous-unités, organisation) ?
Les laminines sont des hétérotrimères composés de trois chaînes polypeptidiques distinctes : α, β et γ.
Chaque molécule adopte une structure en forme de croix avec un domaine central en coiled-coil.
Ces chaînes sont associées par auto-assemblage.
Chez l’homme, on retrouve 5 chaînes α, 3 chaînes β et 3 chaînes γ, permettant la formation d’environ 15 combinaisons différentes.
3. Quel est le rôle principal des laminines dans la MEC ?
Les laminines assurent la liaison et l’ancrage des cellules à la MEC. Elles interviennent dans l’organisation des membranes basales, la polarité cellulaire, la migration cellulaire, ainsi que la différenciation tissulaire.
4. Quels types d’interactions les laminines établissent-elles avec les cellules et autres constituants de la MEC ?
Avec les cellules : via les intégrines et les dystroglycanes, elles transmettent des signaux bidirectionnels.
Avec d’autres constituants de la MEC : elles interagissent avec le collagène IV, le nidogène, le perlecan, ainsi que des protéoglycanes et glycosaminoglycanes.
5. Donne un exemple de trimère de laminine chez l’homme.
Un exemple est la laminine 332, composée des chaînes α3, β3 et γ2. Elle est essentielle dans l’adhésion cellule–MEC, notamment dans la peau et l’épithélium.
2- Constituants de la matrice extracellulaire (MEC) Protéines d’adhérence : Cadhérines
Questions :
Quelles sont les fonctions principales des cadhérines dans les interactions cellule-cellule ?
Quelle est la nature des cadhérines (type de protéine, dépendance ionique) ?
Quelles sont les conséquences d’une baisse de concentration en cadhérine ?
Quelle est la structure des cadhérines (domaines extracellulaire, transmembranaire, cytoplasmique) ?
Comment les cadhérines sont-elles reliées au cytosquelette d’actine ?
Qu’est-ce que les jonctions adhérentes et comment sont-elles formées ?
Quels sont deux exemples de cadhérines spécifiques et leur rôle ?
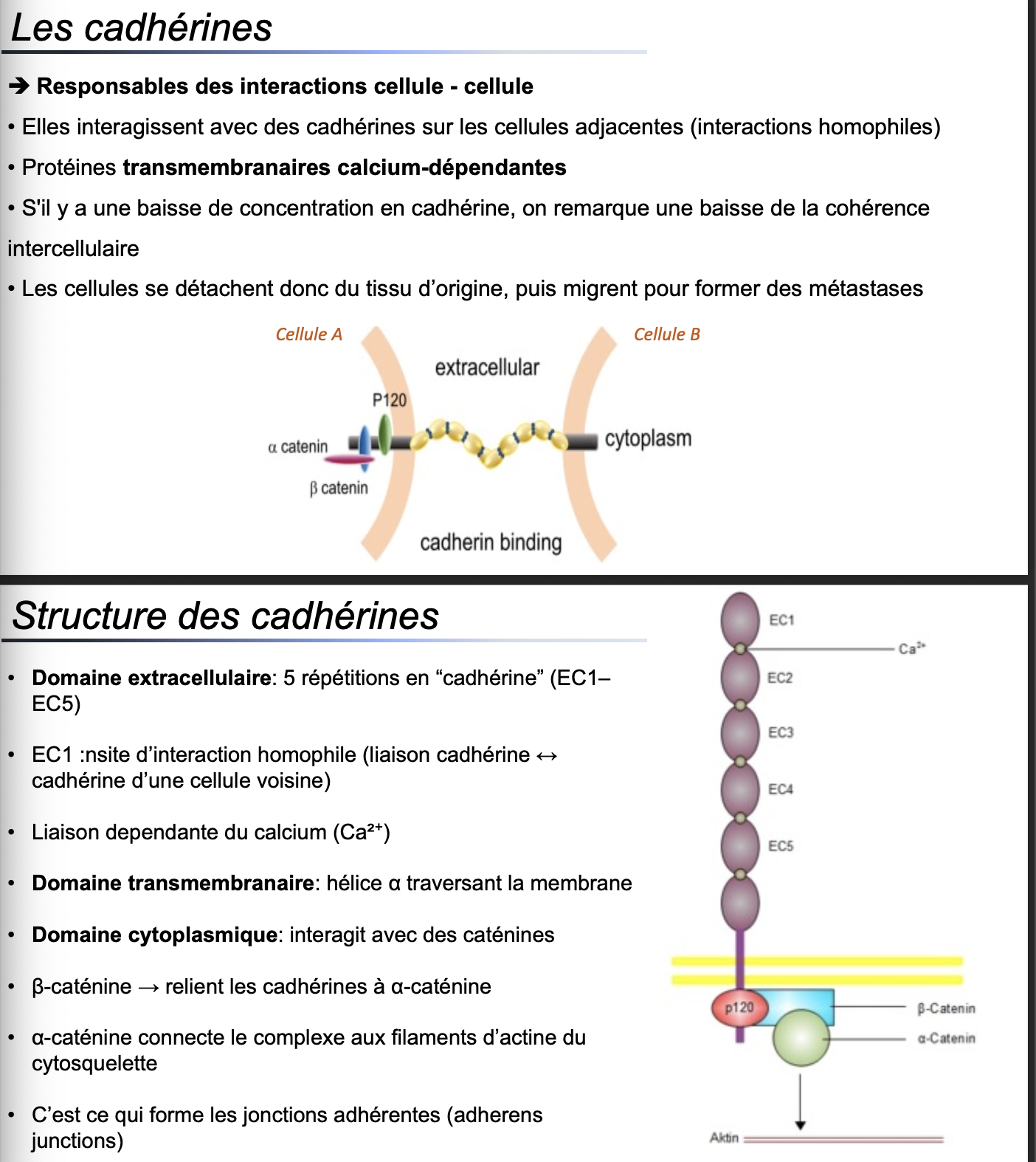

Fonctions principales
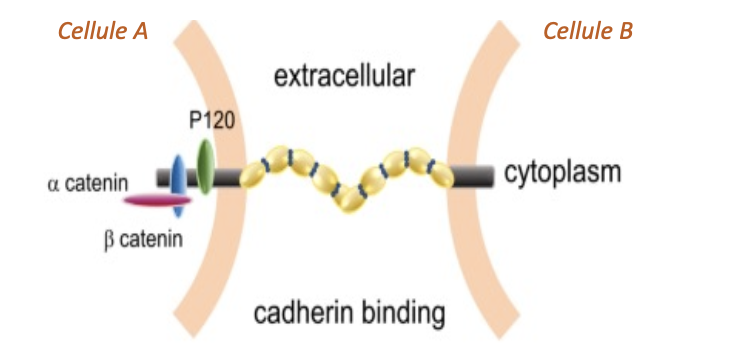
Les cadhérines sont responsables des interactions cellule-cellule. Elles assurent la cohésion intercellulaire en établissant des liaisons homophiles avec les cadhérines présentes sur les cellules voisines.Nature des cadhérines
Ce sont des protéines transmembranaires calcium-dépendantes. La présence de Ca²⁺ est indispensable pour stabiliser leur structure et permettre l’adhésion intercellulaire.Conséquences d’une baisse de cadhérine
Une diminution de la concentration en cadhérine réduit la cohésion intercellulaire. Les cellules peuvent se détacher du tissu d’origine, favorisant la migration et la formation de métastases dans le contexte tumoral.Structure des cadhérines
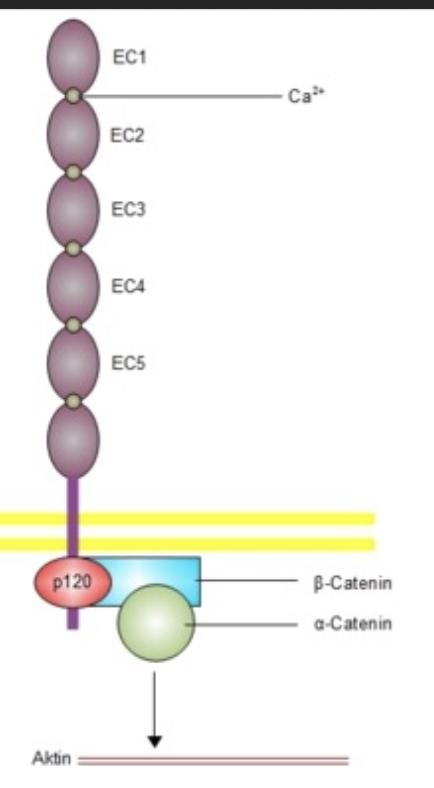
Domaine extracellulaire : 5 répétitions appelées « EC1-EC5 » ; EC1 permet une interaction homophile (liaison cadhérine ↔ cadhérine d’une cellule voisine).
Domaine transmembranaire : hélice α traversant la membrane.
Domaine cytoplasmique : interagit avec des protéines adaptatrices intracellulaires (caténines).
Lien avec le cytosquelette d’actine
La β-caténine relie les cadhérines à l’α-caténine, laquelle connecte l’ensemble aux filaments d’actine du cytosquelette. Ce couplage permet une adhésion solide et dynamique entre cellules.Jonctions adhérentes
Les cadhérines et leur complexe avec les caténines et l’actine forment les jonctions adhérentes (adherens junctions). Ces jonctions sont essentielles pour la cohésion des tissus épithéliaux et la transmission de signaux mécaniques.Exemples de cadhérines spécifiques
E-cadhérine : exprimée dans les cellules épithéliales, elle est un marqueur tumoral important dans certains cancers.
VE-cadhérine : présente dans les cellules endothéliales, elle permet leur cohésion et est indispensable à leur survie.
2- Constituants de la matrice extracellulaire (MEC) Substance fondamentale (amorphe) : Protéoglycanes
Questions :
Qu’est-ce que la substance fondamentale de la MEC et quelle est sa composition principale ?
Quels sont les rôles biologiques de la substance fondamentale ?
Qu’est-ce qu’un protéoglycane et quelle est sa structure générale ?
Qu’est-ce qu’un glycosaminoglycane (GAG) ?
Quelles sont les propriétés principales des GAGs ?
Comment les GAGs participent-ils à la résistance mécanique des tissus ?
Donne des exemples de protéoglycanes et de GAGs.
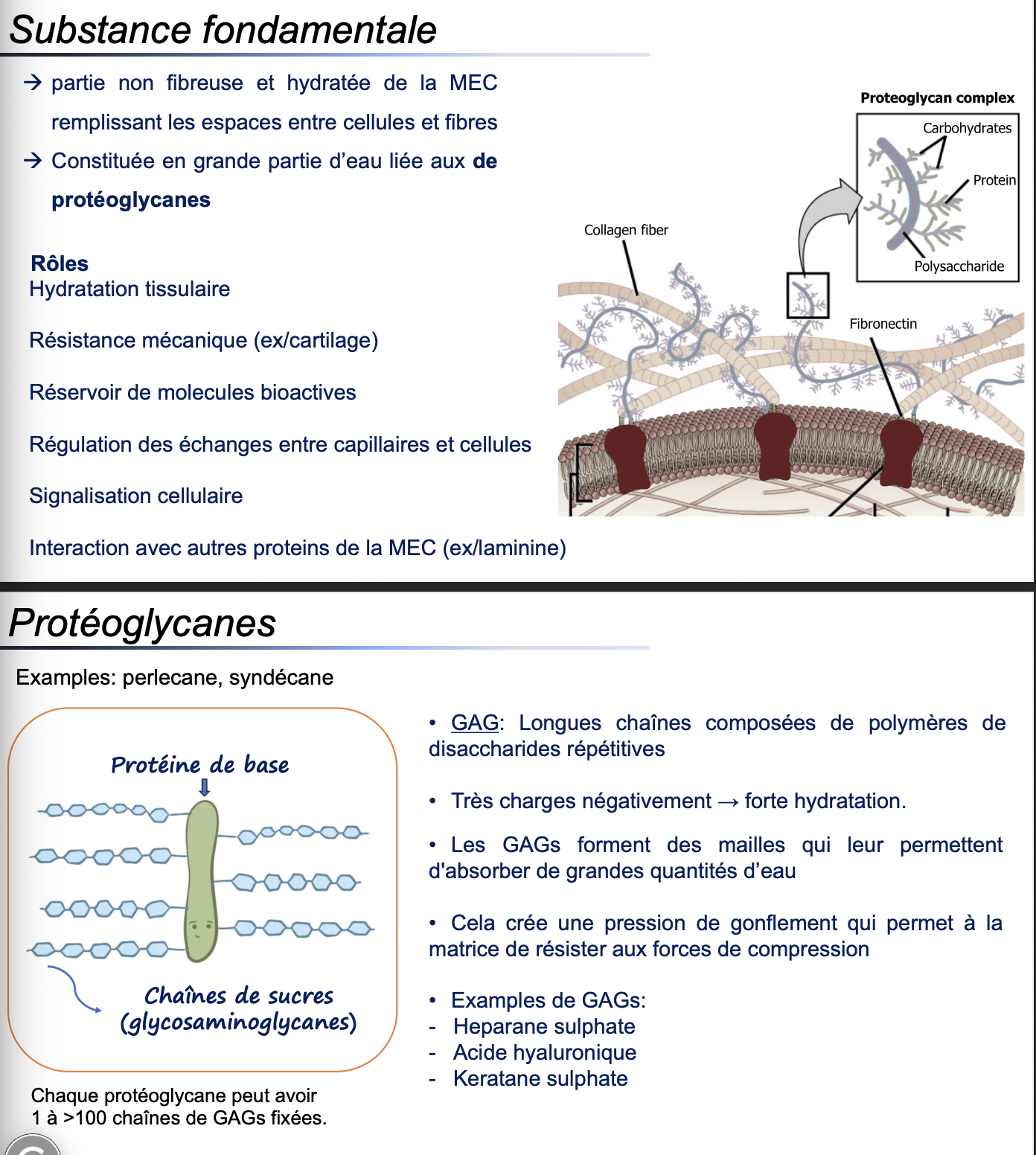
Substance fondamentale
C’est la partie non fibreuse, amorphe et hydratée de la MEC, remplissant les espaces entre les cellules et les fibres. Elle est constituée en grande partie d’eau liée aux protéoglycanes, ce qui lui donne une consistance de gel.Rôles biologiques
Hydratation tissulaire par rétention d’eau
Résistance mécanique (ex. : compression du cartilage)
Réservoir de molécules bioactives (facteurs de croissance, cytokines)
Régulation des échanges entre capillaires et cellules
Signalisation cellulaire (via récepteurs et interactions protéiques)
Interactions avec d’autres protéines de la MEC (ex. laminine, collagène)
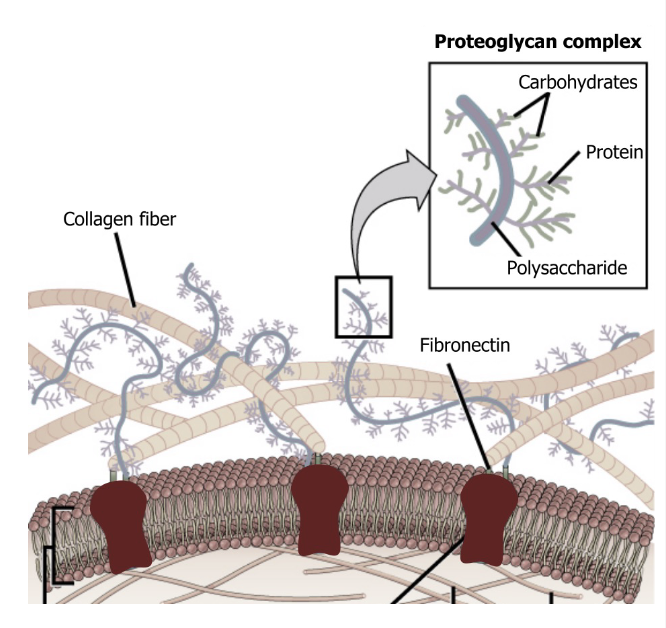
Protéoglycane
Molécule formée d’une protéine de base à laquelle sont fixées de 1 à >100 chaînes de glycosaminoglycanes (GAGs) sulfatés ou non. Ils constituent la majeure partie de la substance fondamentale.Glycosaminoglycane (GAG)
Ce sont de longues chaînes linéaires de disaccharides répétés, souvent sulfatés.Propriétés des GAGs
Très chargés négativement → attirent les cations (Na+) et donc l’eau
Créent une forte hydratation de la matrice
Forment des mailles réticulées qui piègent l’eau et d’autres molécules
Rôle mécanique des GAGs
L’absorption d’eau génère une pression de gonflement qui permet à la MEC de résister aux forces de compression, en particulier dans les cartilages articulaires.Exemples
Protéoglycanes : perlecane, syndécane
GAGs : héparane sulfate, acide hyaluronique, kératane sulfate
2- Constituants de la MEC • Protéines fibreuses : Collagène ❓ Partie QUESTIONS
Quelle proportion de la masse protéique humaine est constituée de collagène ?
Où le collagène est-il le plus abondant ?
Quelle est la forme des fibres de collagène ?
Combien existe-t-il de types de collagène chez l’homme et lequel est le plus fréquent ?
Quelle est la structure de base d’une molécule de collagène ?
Quels acides aminés sont caractéristiques du collagène et quelle est leur fonction ?
Pourquoi le collagène est-il très résistant à l’étirement ?
Quels types de liaisons stabilisent la structure du collagène ?

1. Le collagène représente environ 25 % de la masse totale des protéines humaines, ce qui en fait la protéine la plus abondante de l’organisme.
2. Il est particulièrement abondant dans la peau et les os, où il confère résistance mécanique et élasticité.
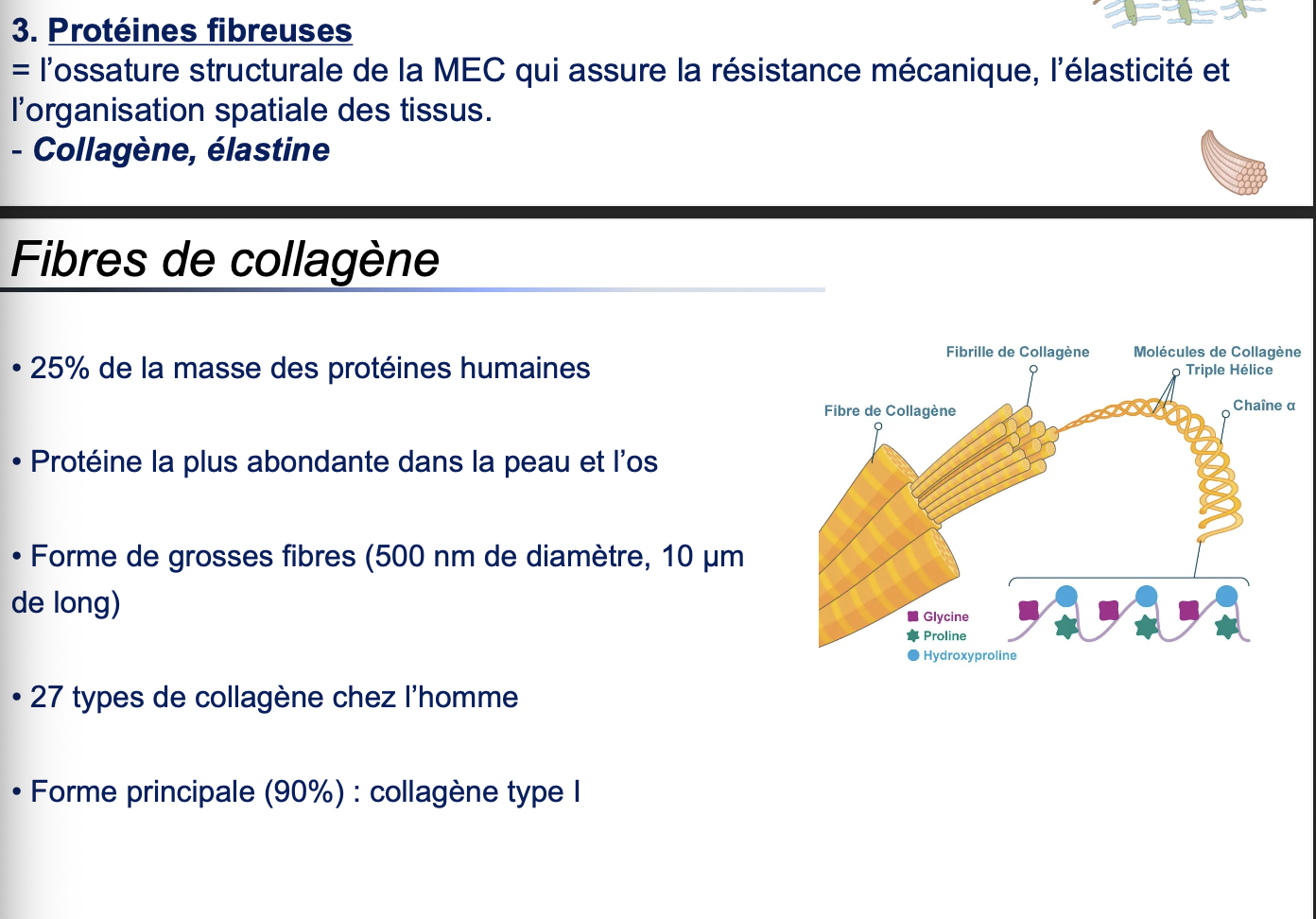
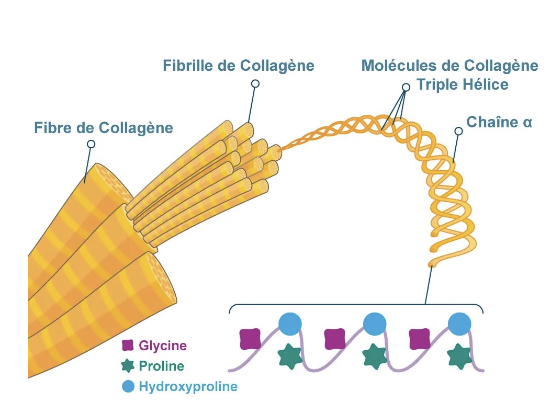
3. Les fibres de collagène sont de grosses fibres mesurant environ 500 nm de diamètre et pouvant atteindre 10 µm de long.
4. On compte 27 types de collagène chez l’homme. Le type I est le plus fréquent, représentant environ 90 % du collagène total.
5. Chaque molécule de collagène est formée de 3 chaînes polypeptidiques α enroulées en une triple hélice compacte.
6. Le collagène est riche en glycine, proline et hydroxyproline :
La glycine (acide aminé très petit) permet un enroulement serré de la triple hélice.
La proline et l’hydroxyproline introduisent des coudes et rigidifient la structure.
7. La forte résistance à l’étirement vient de la séquence répétée Gly–Pro–HydroxyPro, qui favorise la stabilité et la rigidité de l’hélice.
8. La structure est stabilisée par :
des liaisons hydrogène (assurées par l’hydroxyproline et l’hydrolysine),
des liaisons covalentes inter-chaînes (après hydroxylation et glycosylation).
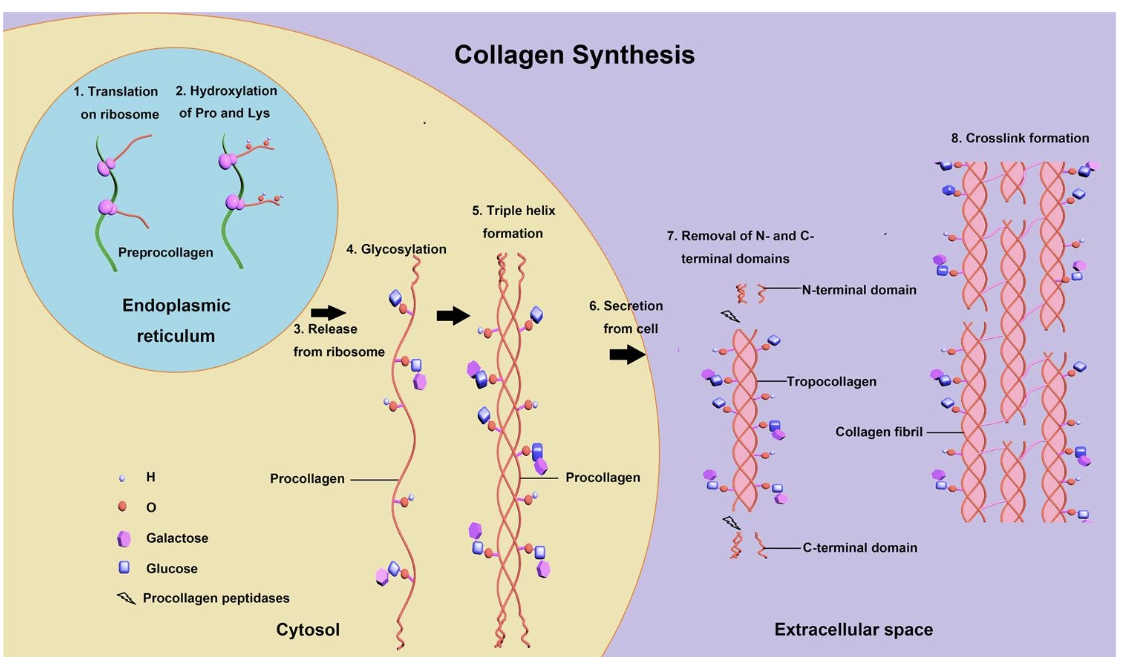
2- Constituants de la matrice extracellulaire (MEC)
• Protéines fibreuses Synthèse du Collagène?
2- Constituants de la MEC • Protéines fibreuses : Élastine ❓ Partie QUESTIONS
Quel est le rôle principal de l’élastine dans la MEC et où est-elle particulièrement abondante ?
Quelle proportion de l’aorte sèche est composée d’élastine ?
Quelle est la comparaison de l’élasticité de l’élastine avec un matériau artificiel comme le caoutchouc ?
Quelles maladies ou phénomènes physiologiques sont associés à une dégradation de l’élastine ?
Quelle est la composition en acides aminés de l’élastine et sa particularité vis-à-vis du collagène ?
Quels sont les deux types de segments structuraux de l’élastine et leurs rôles ?
Quelle est la conformation spatiale typique des molécules d’élastine ?
Quel type de liaisons stabilisent les fibres d’élastine ?
Pourquoi les fibres de collagène accompagnent-elles souvent les fibres d’élastine dans les tissus ?
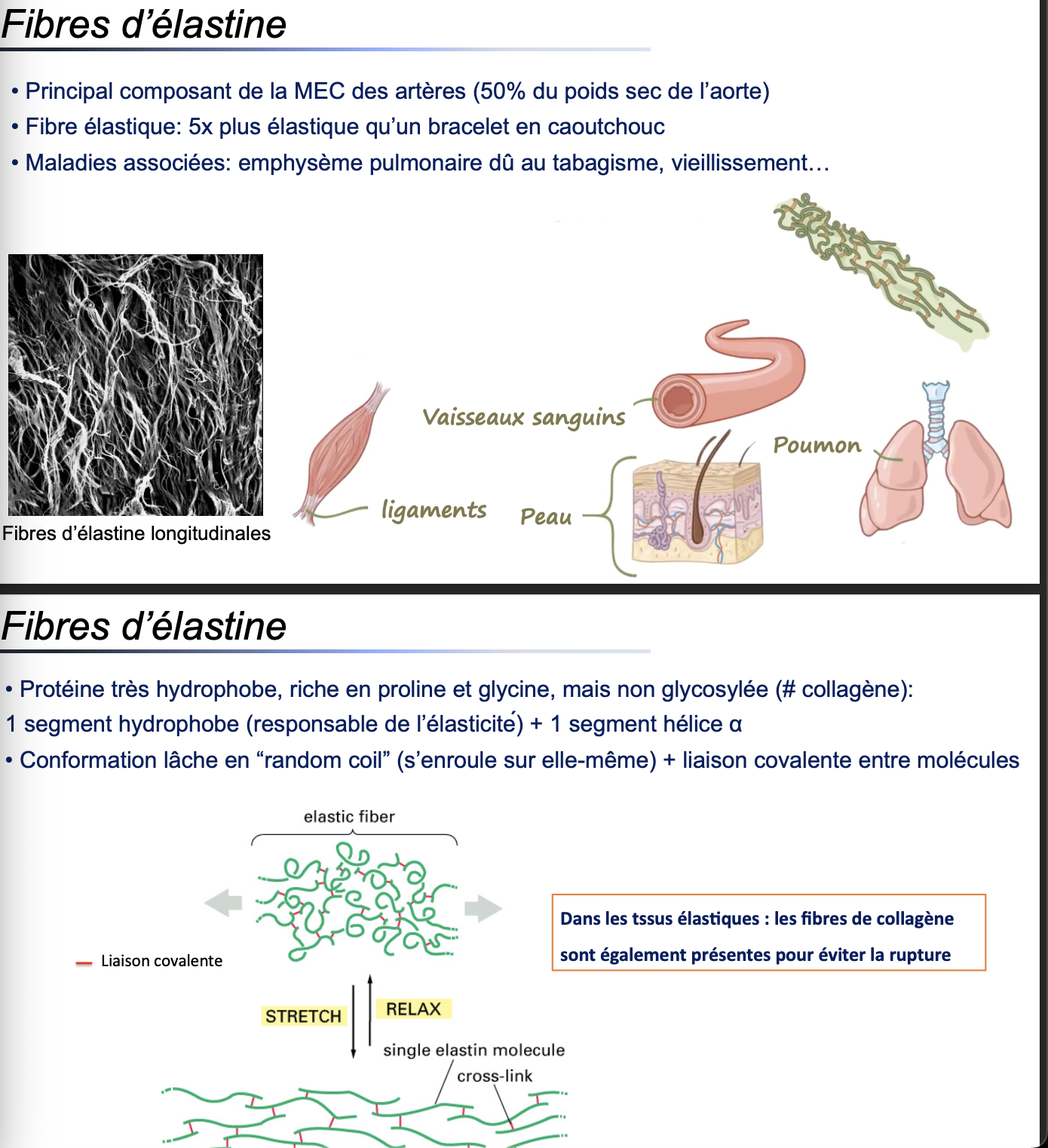
1. L’élastine confère élasticité et résilience aux tissus. Elle est particulièrement abondante dans les artères, les poumons, la peau et les ligaments.
2. L’élastine représente environ 50 % du poids sec de l’aorte.
3. Les fibres d’élastine sont environ 5 fois plus élastiques qu’un bracelet en caoutchouc.
4. Leur dégradation ou altération est liée à l’emphysème pulmonaire (tabagisme), au vieillissement et à certaines pathologies dégénératives.
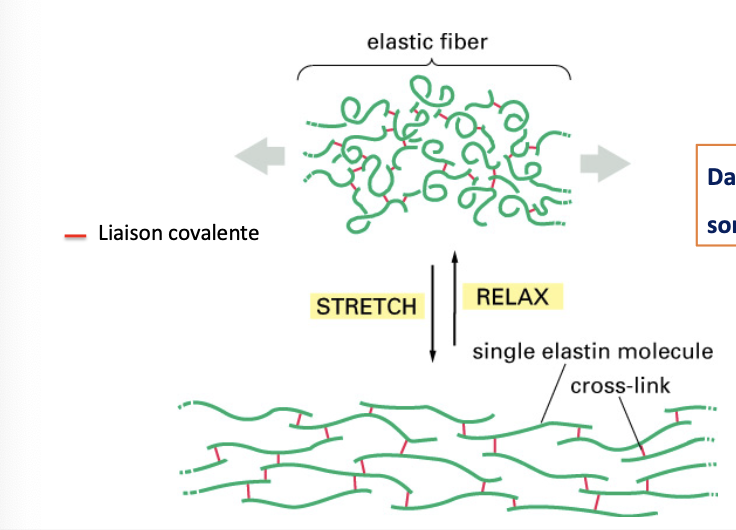
5. L’élastine est une protéine hydrophobe, riche en proline et glycine, mais non glycosylée (contrairement au collagène).
6. Elle comporte :
un segment hydrophobe → responsable de l’élasticité,
un segment en hélice α → contribuant à la structure.
7. Les molécules d’élastine adoptent une conformation lâche en “random coil” (s’enroulent sur elles-mêmes), ce qui favorise l’élasticité.
8. Les fibres d’élastine sont stabilisées par des liaisons covalentes entre molécules (cross-links).
9. Dans les tissus élastiques (ex : aorte, poumon), les fibres de collagène sont présentes en complément afin de prévenir la rupture en limitant l’extension excessive.
3- Matrices extracellulaires spécialisées Partie QUESTIONS A. Lame basale
Qu’est-ce que la lame basale et où se trouve-t-elle ?
Quelle est sa composition principale ?
Quelles sont les fonctions de la lame basale ?
Quels sont les trois modes d’organisation de la lame basale ?
Quels sont les constituants moléculaires spécifiques de la lame basale et leur rôle ?
B. Matrice cartilagineuse
Quelle est la composition principale de la matrice cartilagineuse ?
Quelle est sa fonction essentielle ?
C. Matrice osseuse
Quelle est la composition de la matrice osseuse ?
Quel est le rôle du collagène et des sels minéraux dans la matrice osseuse ?
A. Lame basale
Définition et localisation :
La lame basale est une couche spécialisée de la MEC, fine et organisée. Elle se trouve :
sous les épithéliums,
autour de certaines cellules (adipocytes, fibres musculaires, cellules de Schwann).
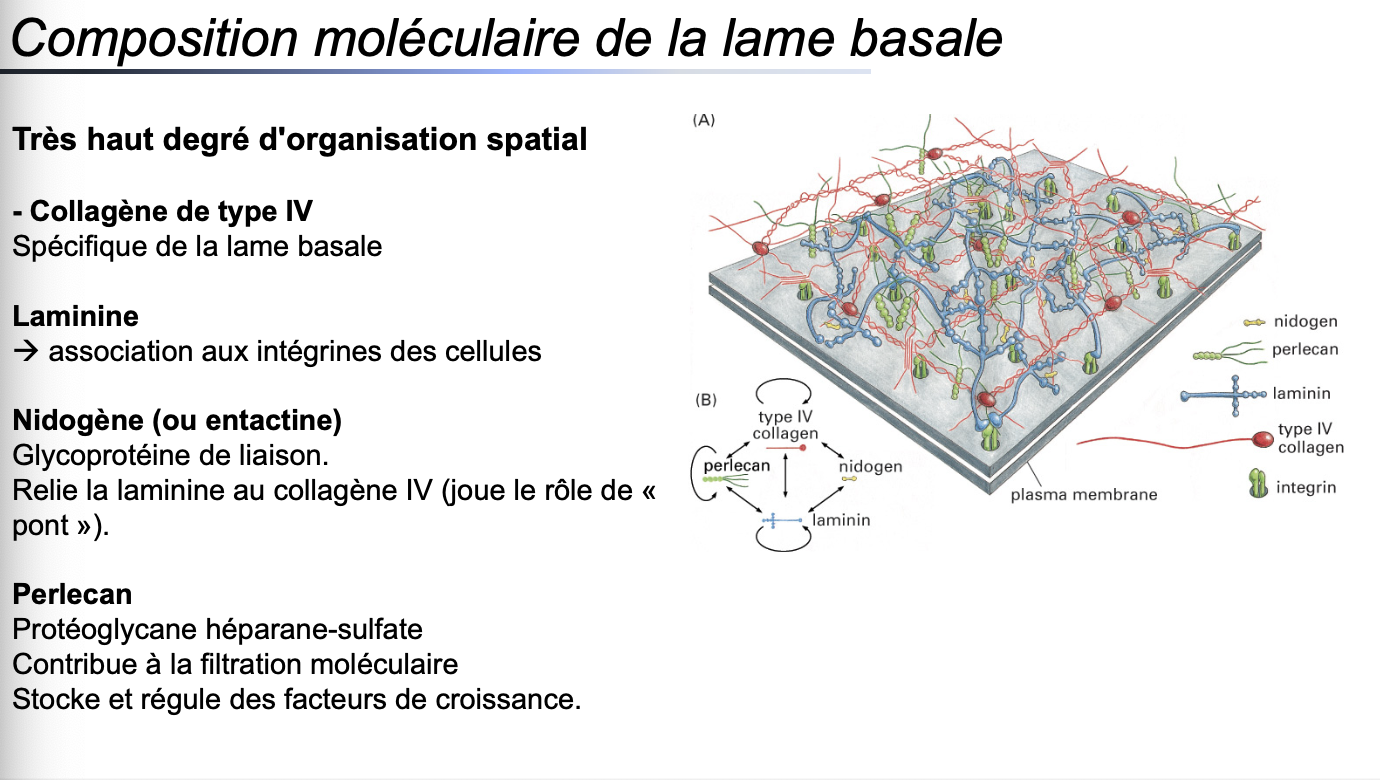
Composition principale :
Elle est constituée principalement de collagène de type IV, laminine et protéoglycanes (ex. perlecan).Fonctions :
Support mécanique immédiat des cellules,
Filtration sélective (ex. glomérule rénal),
Délimitation des compartiments tissulaires (épithélium ↔ conjonctif),
Rôle dans la régénération et la signalisation cellulaire.
Modes d’organisation :
À la base de tous les épithéliums,
Autour de cellules (adipocytes, cellules de Schwann, cellules musculaires squelettiques),
Entre deux couches cellulaires (ex. glomérule rénal, placenta).
Constituants moléculaires spécifiques :
Collagène IV : structure réticulaire spécifique de la lame basale.
Laminine : glycoprotéine de liaison aux intégrines.
Nidogène (entactine) : glycoprotéine liant la laminine au collagène IV.
Perlecan : protéoglycane héparane-sulfate, contribue à la filtration moléculaire et stocke des facteurs de croissance.
B. Matrice cartilagineuse
Composition :
Très riche en protéoglycanes (ex. aggrécane),
Contient surtout du collagène de type II.
Fonction :
La forte teneur en protéoglycanes (chargés négativement) attire l’eau → permet résistance à la compression (indispensable au cartilage articulaire).
C. Matrice osseuse
Composition :
Collagène de type I (90 % de la matrice organique),
Sels minéraux : phosphate de calcium et hydroxyapatite.
Rôle :
Le collagène type I assure la résistance mécanique et la flexibilité.
Les sels minéraux (hydroxyapatite) apportent la dureté et rigidité, permettant de résister aux forces de compression.

4 - REMODELAGE DE LA MEC ❓ QUESTIONS A. Principes généraux
Qu’entend-on par remodelage de la MEC et pourquoi est-il essentiel ?
Quels sont les deux grands mécanismes qui contrôlent le remodelage de la MEC ?
B. Dégradation contrôlée de la MEC
Quelles enzymes assurent la dégradation contrôlée de la MEC ?
Qu’est-ce que les métalloprotéinases matricielles (MMPs) et de quoi dépendent-elles ?
Comment les MMPs sont-elles produites et activées ?
Par quels mécanismes les MMPs sont-elles régulées ?
C. Rôles physiologiques et pathologiques
Quels sont les principaux rôles physiologiques des MMPs ?
Quels sont les rôles pathologiques des MMPs ?

A. Principes généraux
Le remodelage de la MEC correspond à l’ensemble des mécanismes qui modifient en permanence la composition, l’organisation et les propriétés mécaniques de la matrice extracellulaire. Il est essentiel car la MEC n’est pas statique : elle est constamment synthétisée, dégradée et réorganisée pour permettre la croissance, la réparation et l’adaptation des tissus.
Deux grands mécanismes :
Synthèse de nouveaux composants : collagène, élastine, fibronectine, protéoglycanes (produits par fibroblastes, chondrocytes, ostéoblastes, cellules musculaires lisses).
Dégradation contrôlée : par des enzymes protéolytiques (sérine-protéases, ex. plasmine, et surtout métalloprotéinases de la matrice - MMPs).
B. Dégradation contrôlée de la MEC
Les enzymes principales sont :
Sérine-protéases (comme la plasmine).
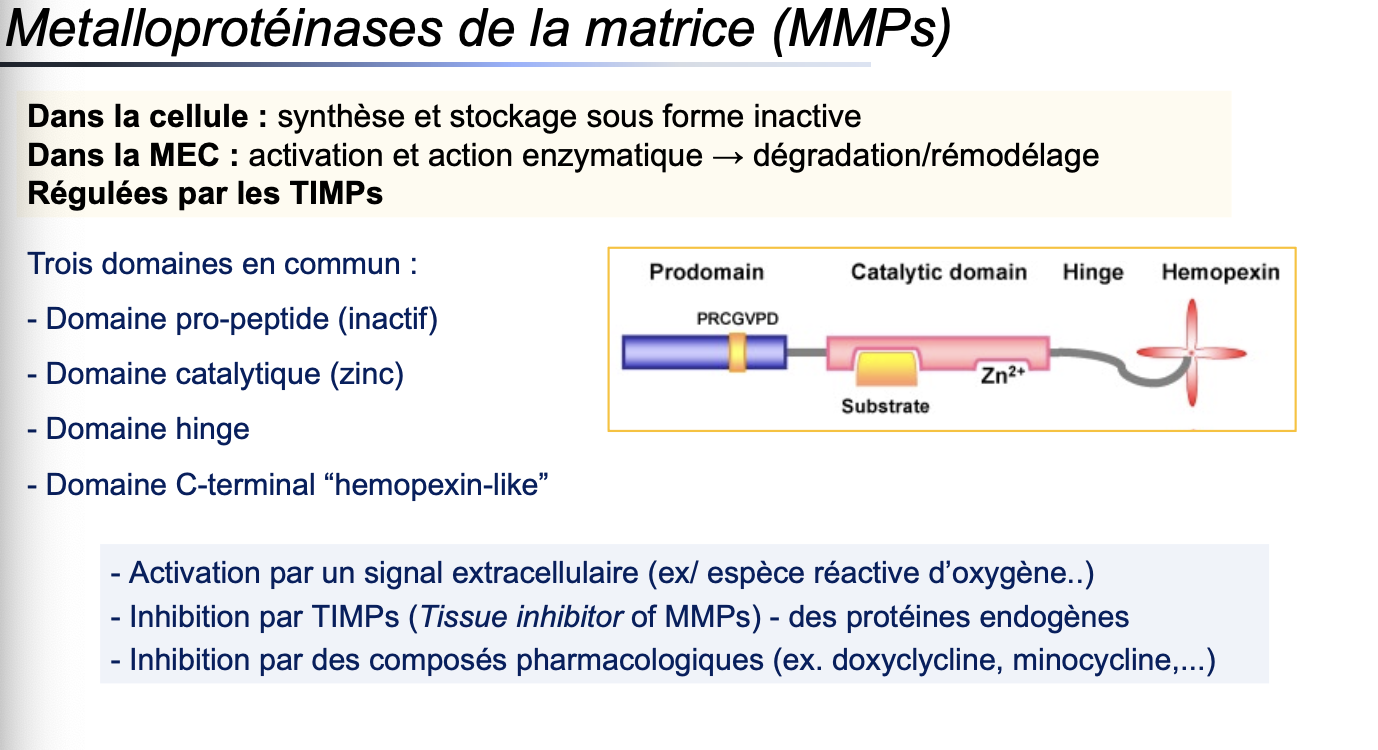
Métalloprotéinases de la matrice (MMPs) : endopeptidases spécifiques de la MEC.
Les MMPs sont des endopeptidases zinc-dépendantes, capables de dégrader divers composants de la MEC (collagénases, gélatinases, élastases). Elles jouent un rôle central dans le remodelage.
Les MMPs sont produites par de nombreuses cellules sous forme de pro-enzymes inactives (zymogènes). Elles sont ensuite sécrétées dans l’espace extracellulaire où elles sont activées par clivage protéolytique.
Régulation des MMPs :
Activation par des signaux extracellulaires (ex. espèces réactives de l’oxygène).
Inhibition endogène par les TIMPs (Tissue Inhibitors of Metalloproteinases).
Inhibition pharmacologique (ex. doxycycline, minocycline).
C. Rôles physiologiques et pathologiques
Rôles physiologiques des MMPs :
Remodelage tissulaire normal.
Développement embryonnaire.
Migration cellulaire.
Angiogénèse.
Réparation des tissus.
Rôles pathologiques des MMPs :
Progression tumorale et cancer (dissémination, métastases).
Maladies inflammatoires chroniques : arthrite rhumatoïde, sclérose en plaques.
Maladies neurodégénératives : maladie d’Alzheimer.
5. Rôles pathologiques de la MEC Questions
A. Syndromes héréditaires
Quelles sont les caractéristiques principales du syndrome d’Ehlers-Danlos et quelle est son origine moléculaire ?
Quelles sont les manifestations cliniques du syndrome de Marfan et quelle est la protéine impliquée ?
B. Maladies acquises
3. Quelle est la cause du scorbut et comment affecte-t-il la MEC ?
4. Quelles sont les conséquences de la fibrose et quel est son mécanisme principal ?
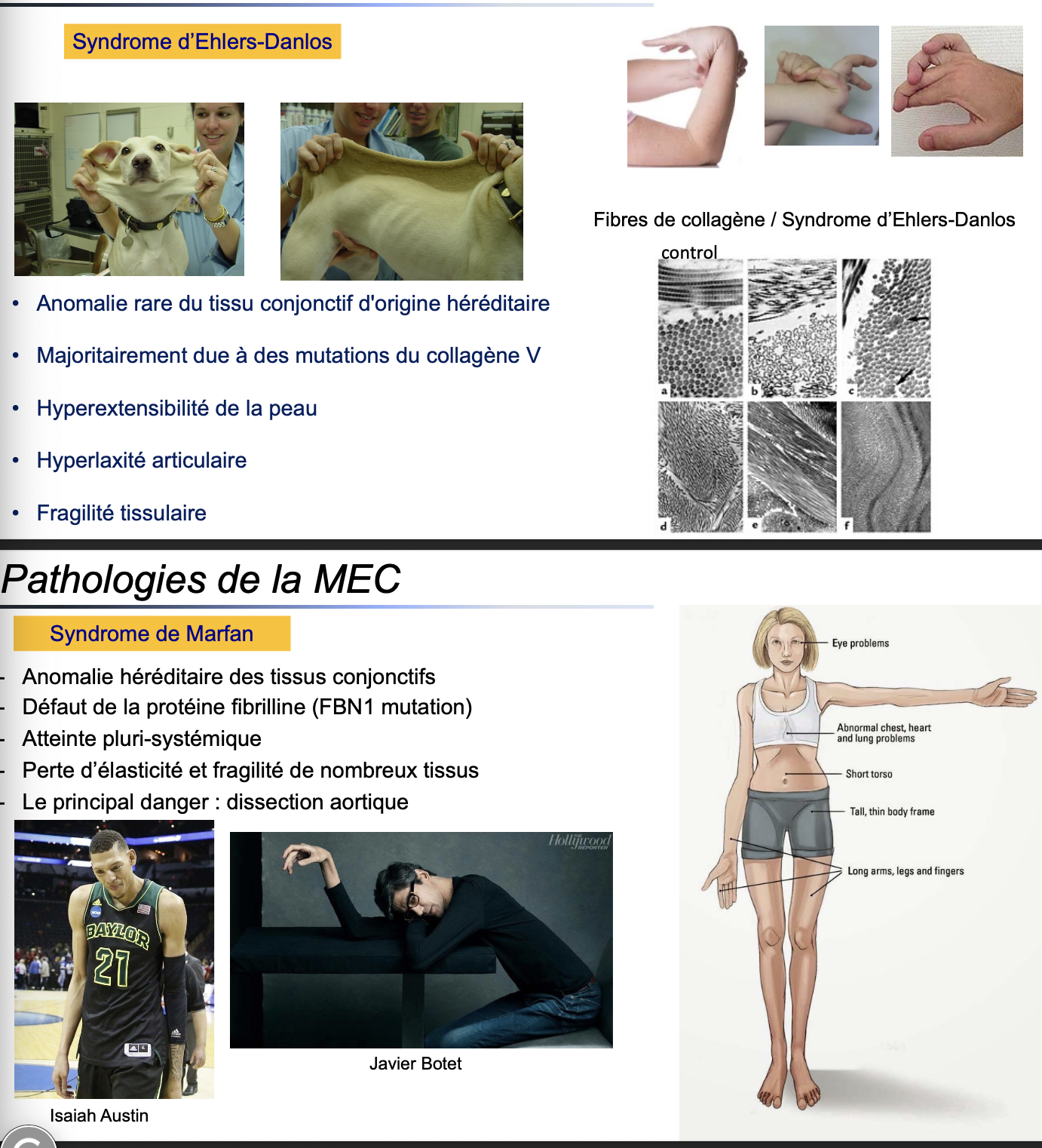
A. Syndromes héréditaires
Syndrome d’Ehlers-Danlos (SED)
Quoi ? Maladie rare du tissu conjonctif, d’origine génétique.
Quand ? Se manifeste dès l’enfance/adolescence, évolue à vie.
Où ? Affecte la peau, les articulations et les tissus conjonctifs.
Comment ? Majoritairement causé par des mutations dans le collagène V, entraînant un défaut dans la fibrillogenèse.
Pourquoi ? La structure du collagène est anormale → fragilité du tissu conjonctif.
Conséquences cliniques : hyperextensibilité cutanée, hyperlaxité articulaire, fragilité des tissus, cicatrisation anormale.
Syndrome de Marfan
Quoi ? Maladie héréditaire affectant les tissus conjonctifs.
Quand ? Débute dès la naissance, s’aggrave avec le temps.
Où ? Atteinte pluri-systémique : squelette, yeux, appareil cardiovasculaire.
Comment ? Mutation du gène FBN1, codant pour la fibrilline-1, composant essentiel des fibres élastiques.
Pourquoi ? La perte de fibrilline entraîne une fragilité et perte d’élasticité de nombreux tissus.
Conséquence majeure : risque élevé de dissection aortique (principale cause de mortalité).
B. Maladies acquises
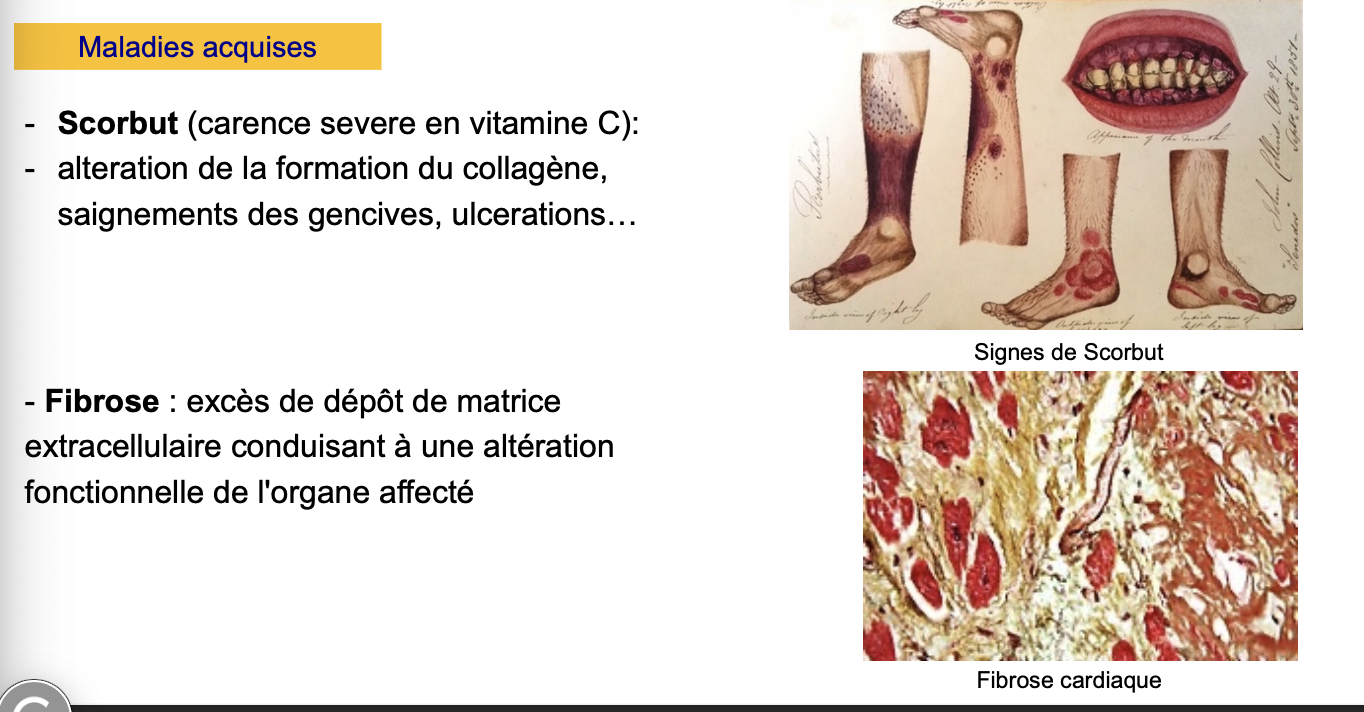
Scorbut
Quoi ? Maladie de carence sévère en vitamine C.
Quand ? Se développe après plusieurs semaines/mois de carence.
Où ? Affecte les tissus riches en collagène (peau, gencives, vaisseaux).
Comment ? La vitamine C est un cofacteur indispensable de la prolyl-hydroxylase et de la lysyl-hydroxylase, enzymes qui stabilisent le collagène par hydroxylation.
Pourquoi ? Sans hydroxylation, le collagène est instable et mal assemblé.
Conséquences cliniques : saignements des gencives, ulcérations, fragilité vasculaire, retard de cicatrisation.
Fibrose
Quoi ? Pathologie acquise caractérisée par un excès de dépôt de MEC.
Quand ? Survient souvent après une inflammation chronique ou une lésion tissulaire répétée.
Où ? Dans de nombreux organes (foie, poumon, cœur, rein).
Comment ? Production excessive de collagène et autres composants de MEC par les fibroblastes activés ou myofibroblastes.
Pourquoi ? Le tissu devient rigide et perd sa fonction.
Conséquences cliniques : altération fonctionnelle de l’organe (ex. fibrose pulmonaire → insuffisance respiratoire, fibrose cardiaque → insuffisance cardiaque).