UAA5-liaison chimique et configuration spatiale des espèces chimiques
1/72
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
73 Terms
Numéro de la famille
=nombre d’électron sur la dernière couche
État excité
=élément chauffé dont les électrons occupe les couches plus éloignés
État fondamental
=contraire d’excité, restitue l’énergie sous forme lumineuse
Différentes couleurs dépendent
De la nature de l’élément
Isotope
=même nombre de proton, mais un nombre différents de neutrons
Acide est
Capable de capter un doublet
Base est
Capable de donner un doublet
Liaisons covalentes pures
Deux éléments de même force liés (les mêmes)
10*-10 =
Angström
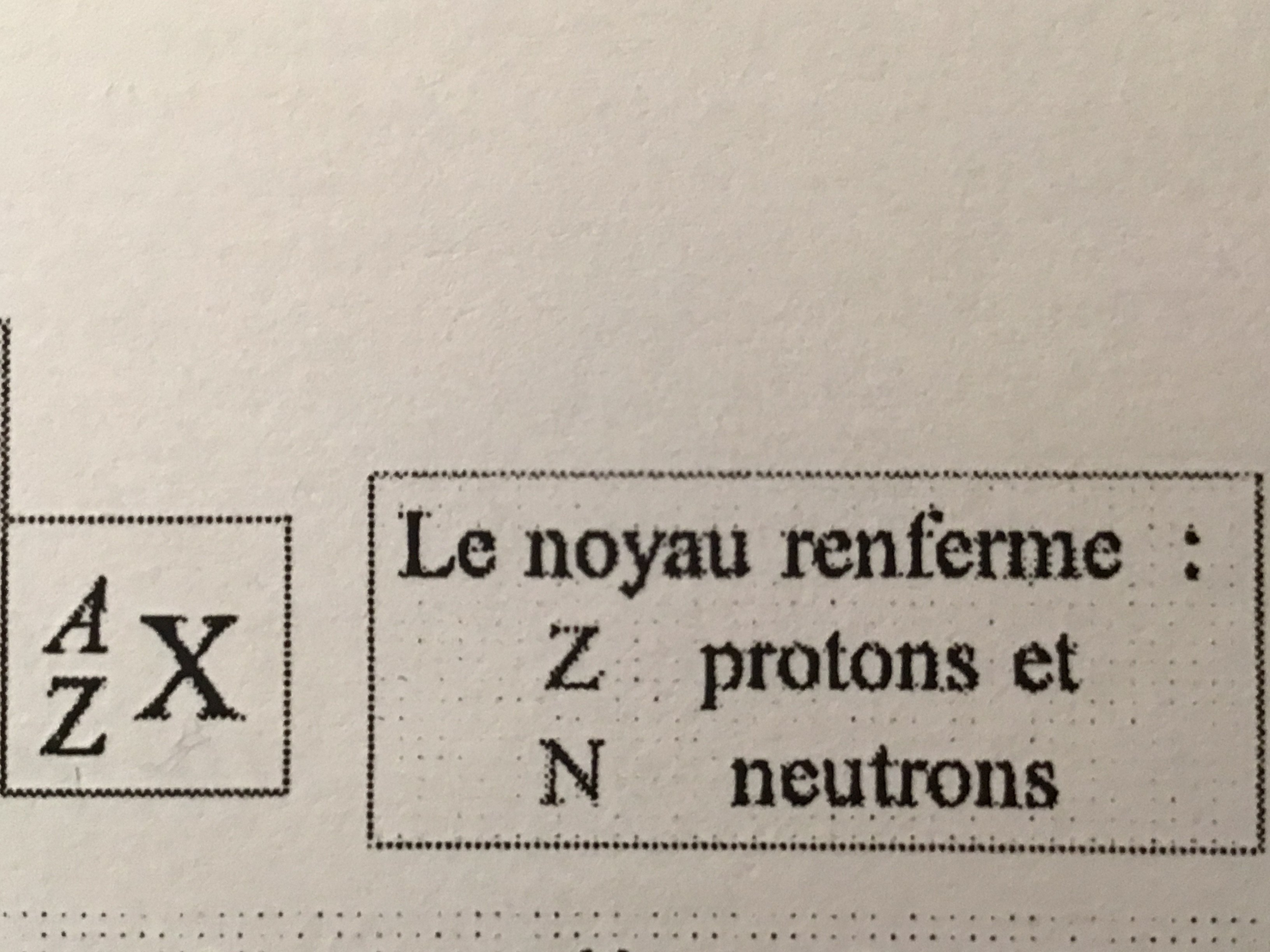
Z =
Proton
N =
Neutron
A =
Z + N → nucléon (nombre de masse)
Proton, charge
1,6 × 10*-19 coulombs
Proton, masse
1,6724 × 10*-27 kg
Neutron, charge
0 coulombs
Neutron, masse
1,6747 × 10*-27 kg
Électron, charge
1,6 × 10*-19 coulombs
Électron, masse
9,11 × 10*-31 kg
Orbites stationnaires
= lieu des électrons sans émission d’énergie
Schéma de Lewis
Représentation simplifiée de la répartition des électrons sur la dernière couches en croix
Même famille
= même schéma de Lewis
Représentation de Lewis
Représentation simplifiée de la répartition des électrons sur la dernière couches autour du symbole
Alcalins, lewis

Alcalinoterreux, lewis

Terreux, lewis

Carbonide, lewis

Azotites, lewis

Chalcogènes, lewis

Halogènes, lewis

Gaz rares, lewis

Alcalins, éléments
H, Li, Na, K,
Alcalinoterreux, éléments
Be, Mg, Ca
Terreux, éléments
B, Al
Carbonides, éléments
C, Si
Azotites, éléments
N, P
Chalcogènes, éléments
O, S, Se, Te
Halogènes, éléments
F, Cl, Br, I
Gaz rares, éléments
He, Ne, Ar
Gaz rares, particularités
Stables, inertes chimiquement, très peu présent (sauf Hélium)
Substance moléculaire, aspect
N’est pas conducteur + structure cristal moléculaire
Substances ioniques, conductivité
Conducteur (ions de signe contraire)
Différence des électronégativités supérieure à 1,7
Substance ionique
Différence des électronégativités inférieure à 1,7
Substance covalente /moléculaire
Métal
Donne ses électrons → ion positif (cation)
Non-métal
Gagne des électrons → ion négatif (anion)
Hydratation
Ajouter de l’eau
Liaison ionique
Attraction de 2 ions (de famille I, II, III et VI, VII)de charges opposée qui forment un solide cristallin neutre
Substances ioniques, état
À 20°C et 1atm elle est solide
Solvatation
Ajouter un solvant
Substances ioniques, solubilité
Non soluble dans l’eau à 25°C
Substances ioniques, caractère
Cassantes car beaucoup de forces d’attractions donc la moindre pression repousse les électrons les uns des autres
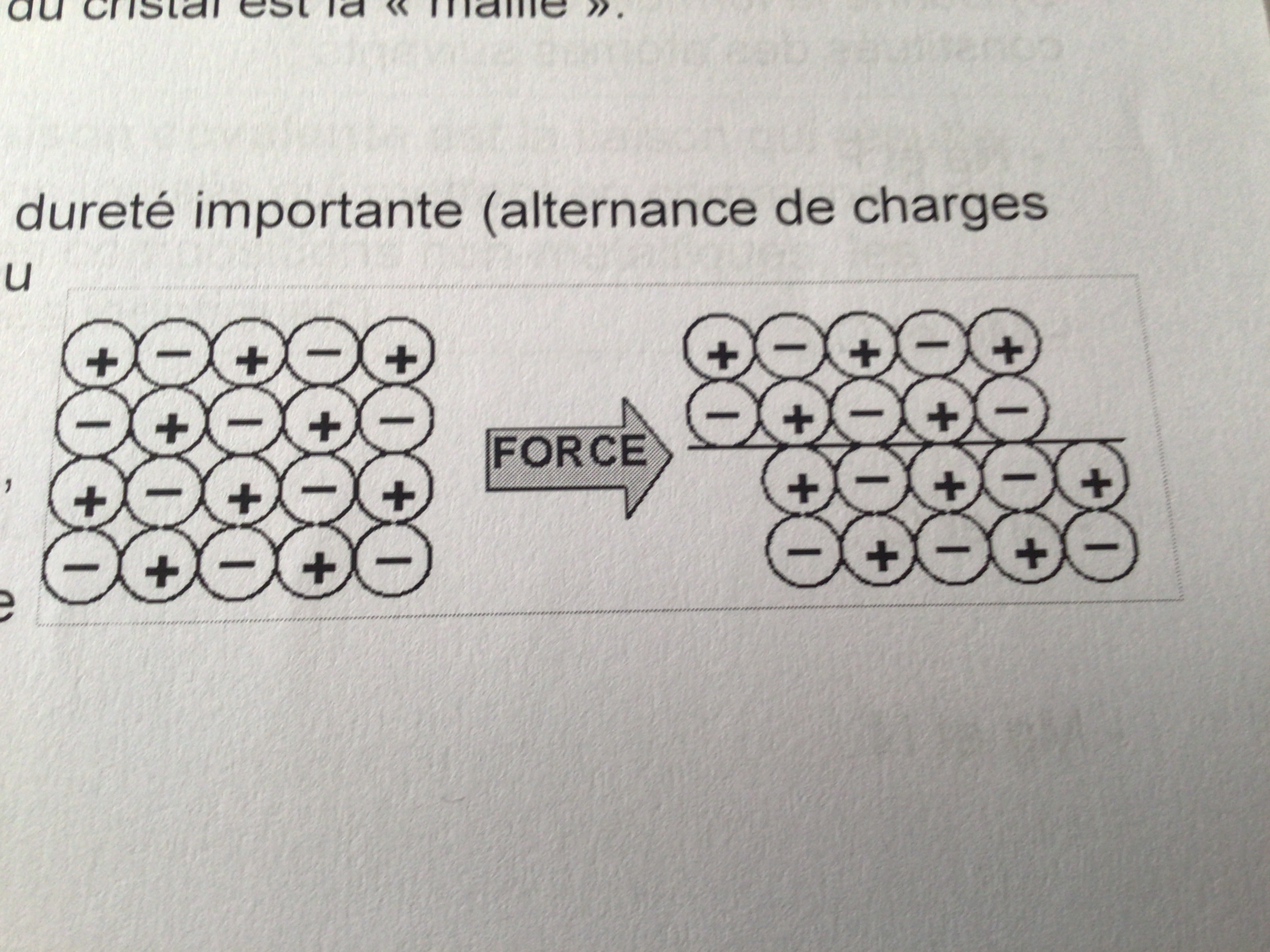
Substances ioniques, usage
Marais salants, charcuteries, sel pour adoucisseurs d’eau
Liaisons covalentes, lewis
Doublets d’électrons mit en commun par des éléments non-ionisé
Molécule polaire/ dipôle électrique
Molecules qui à l’état liquide subissent l’influence d’un corps électrisé
Molécule apolaire
Molécules qui à l’état liquide ne subissent pas l’influence d’un corps électrisé
Théorie de Gillespie
AXnEm → n-m= représentation géométrique 3D
A:atome central
N:nombre d’atome lié à l’atome central A
m:nombre de doublets libres (non liant) de l’atome central
Électrons liants
Mise en commun de 2 électrons opposant la répulsion électrique afin d’atteindre la structure électronique du gaz rare le plus proche
Un ion a
8 électrons sur sa couche périphérique
Attraction électrostatique
Deux ions de chargent opposés qui s’attirent
Liaisons polarisées
Deux éléments de forces différentes liés formant des charges partielle (delta + ou -)
Charge partielle négative
Éléments qui attire (électronégativité la plus grande)
Charge partielle positive
Éléments attiré (électronégativité plus petite)
Covalence parfaite
Mise en commun de 2 électrons célibataires dont l’électronégativité est la même
Covalence polarisée
Mise en commun de 2 électrons dont l’électronégativité est différente
Un solide atomique covalent
Solides dont les liaisons sont covalentes, ils ont une température de fusion élevées et se constituent sous forme de cristaux
Valence
Nombre de liaisons qu’un élément réalise
À 20°C et 1 atm
Les substances covalentes peuvent être des solides, liquides, et gaz →dépend de l’importance de l’attraction intermoléculaire
Attraction intermoléculaire
Augmente avec la masse des molécules
Pont H
Attraction électrique entre H et O dans l’eau
Liaison métalique
Forte liaison des métaux
Allotropique
Disposition différente des molécules (diamant, graphite, fullèren)
T.P.
(AxBy)°n
→x dA + y dB = n