Kemija - kolokvij 1
1/20
Earn XP
Description and Tags
tko iz domacih nalog vprasanja =_=
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
21 Terms
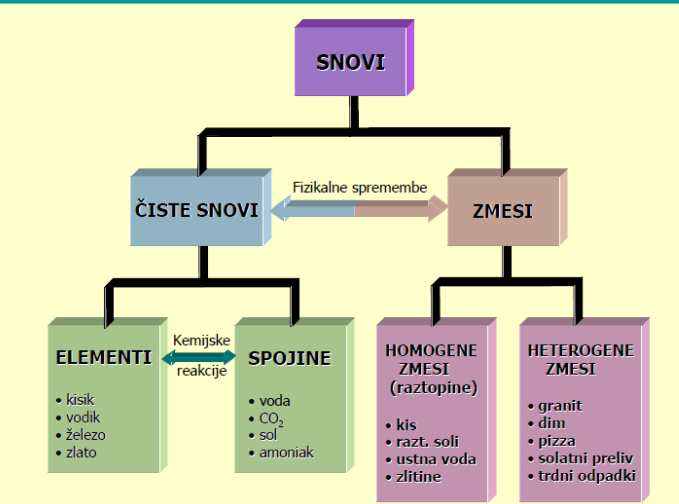
Kakšne vrste snovi poznamo in kako jih delimo?
Za vsako vrsto snovi navedite vsaj en primer.
Snovi, delimo na čiste snovi in zmesi. Čiste snovi vključujejo elemente in spojine, medtem ko zmesi vključujejo homogene in heterogene zmesi.
Element: Železo(Fe)
Spojina: Voda (H20)
Homogena zmes: Cola
Heterogena zmes: olje v vodi
Naštejte vsaj 3 fizikalne lastnosti snovi in 3 kemijske lastnosti snovi.
FIZIKALNE: Gostota, barva, vrelišče, vonj, okus
KEMIJSKE: Kislost, Bazičnost, oksidant, reducent, inertna snov

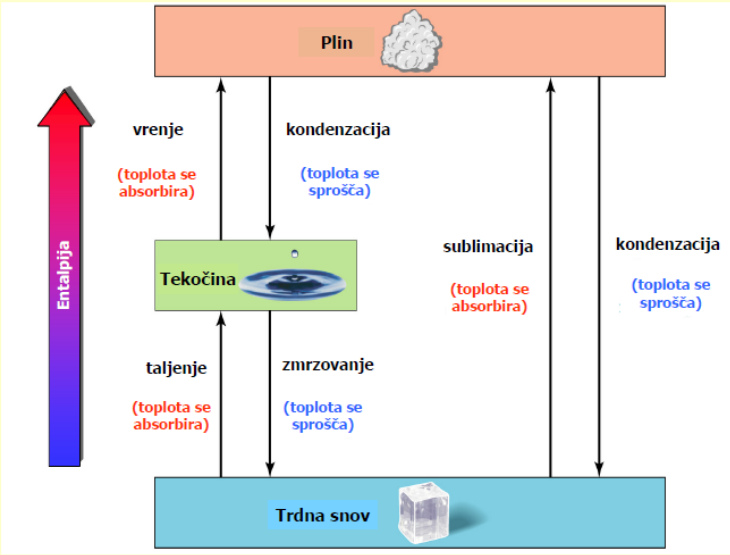
Kaj moramo storiti, da neko snov iz plinastega agregatnega stanja prevedemo v trdno agregatno stanje? Kako ta proces imenujemo?
Da snov iz plinastega agregatnega stanja preide v trdno agregatno stanje, jo moramo ohlajati, da se toplota sprošča.
Pri tem plin najprej kondenzira v tekočino, nato se tekočina strdi (zmrzne) v trdno snov.
Proces imenujemo kondenzacija in zmrzovanje.
Kakšna je razlika med homogeno in heterogeno snovjo?
Homogene snovi oziroma homogen sistem nastopajo vedno v eni fazi, imajo delce velikosti manjše od 10⁻⁹ m, in sem spadajo plinske zmesi, prave raztopine ter zlitine.
Heterogene snovi oziroma heterogen sistem so sestavljene iz več homogenih snovi (faz) in zato predstavljajo večfazne sisteme. Velikost njihovih delcev je večja od 10⁻⁷ m, nimajo pa točno določenih fizikalnih in kemijskih lastnosti.

Kakšne vrste fizikalni pojavi (spremembe) lahko spremljajo kemijske reakcije?
sprememba barve,
nastanek ali izločanje plina,
nastanek usedline,
sprememba vonja,
sprememba temperature,
nastanek svetlobe.
Te spremembe kažejo, da je med reakcijo prišlo do nastanka novih snovi z drugačnimi lastnostmi.
Kako bi ločili sestavine iz:
zmesi olja in vode;
raztopine sladkorja v vodi.
Predlagajte metodo za ločevanje in ugotovite na osnovi katere fizikalne lastnosti bi ločevanje potekalo?
1. Zmes olja in vode:
Metoda ločevanja: Lij ločnik
Fizikalna lastnost: Gostota in nepolarnost/polarnost (neresljivost). Olje in voda sta med seboj neraztopni (imata različno polarnost) in imata različni gostoti, zato se olje (manjše gostote) dvigne na vrh.
2. Raztopina sladkorja v vodi:
Metoda ločevanja: Izhlapevanje
Fizikalna lastnost: Vrelišče (ali topnost). Sladkor je netočljiv (nehlapljiv) pri temperaturi vrelišča vode, zato voda izpari, sladkor pa ostane v obliki kristalov.
Kakšno spremembo (fizikalno ali kemijsko) predstavljajo naslednji procesi:
gorenje drv;
mešanje oglja in sladkorja;
mešanje vode in alkohola;
alkoholno vrenje mošta.
gorenje drv; KEMIJSKA
mešanje oglja in sladkorja; FIZIKALNA
mešanje vode in alkohola; FIZIKALNA
alkoholno vrenje mošta. KEMIJSKA
Velikost atoma je reda velikosti (pravilno obkroži):
a) 10-7 m b) 10-10 m c) 10-15 m d) 10-18 m
b) 10-10 m
Velikost atomskega jedra je reda velikosti (pravilno obkroži):
a) 10-7 m b) 10-10 m c) 10-15 m d) 10-18m e) 10-21 m
c) 10-15 m

Atom joda: 53 elektronov, 53 protonov in 74 nevtronov (127-53)
Atom zlata:79 elektronov, 79 protonov in 118 nevtronov (197-79)


Razlikujeta pa se v masnem številu (79 in 81) to pomeni, da imata različno število nevtronov.
(se vedn enako protonov in elektronov)
Atoma broma imenujemo izpotopa (ker mata enako protonov, razlicno nevtronov)
1) Kaj je skupno vsem elementom, ki so v isti skupini periodnega sistema (npr. v 6. skupini) ?
Koliko elektronov imajo na zadnjem energijskem nivoju?
V isti skupini - enako število valenčnih (zunanjih) elektronov
6 skupina - 6 valenčnih elektronov (zunanjih)
Kako se imenujejo elektroni, ki so v zadnji, zunanji lupini (energijskem nivoju) v atomu?
Valenčni elektroni


S katero skupino elementov se bodo najraje spajali elementi II. skupine periodnega sistema?
Z 6. skupino elementov (al mors napisat VI. sej nvm)
Kaj nastane, če nevtralen atom sprejme en elektron?
Kako se takšen delec imenuje?
Ali se velikost takšnega delca poveča ali zmanjša z ozirom na nevtralen atom?
Če nevtralen atom sprejme en elektron, dobi negativni naboj, saj ima zdaj več elektronov kot protonov.
Nastane delec, imenovan anion.
Velikost delca se poveča, ker dodatni elektron poveča medsebojno odbijanje med elektroni in zmanjša privlak med jedrom in elektroni.
Kako se spreminja velikost in elektronski privlak (elektronegativnost) elementov v periodnem sistemu? S čem je to povezano?
Z leve proti desni: atomi postajajo manjši
Od zgoraj navzdol: atomi postajajo večji
Z leve proti desni: elektronegativnost narašča
Od zgoraj navzdol: elektronegativnost pada
Obe lastnosti sta povezani s privlakom med jedrom in elektroni.
Močnejši kot je privlak jedra, manjši je atom in večja je elektronegativnost.
Kako nastane ionska vez? Navedite dva primera za takšno vez.
Primera:
NaCl (natrijev klorid)
CaO (kalcijev oksid)

Kako nastane kovalentna vez? Navedite dva primera za takšno vez.
Kovalentna vez nastane med dvema nekovinama, ki si delita enega ali več parov elektronov, da dosežeta stabilno elektronsko zgradbo (polno zunanjo lupino)
Primera:
Molekula vode (H₂O)
Molekula kisika (O₂)
Katere medmolekulske vezi poznamo?
Razvrstite jih po jakosti od najmočnejše do najšibkejše.
Razvrščene:
Vodikove vezi
Indukcijske vezi
Orientacijske vezi
Disperzijske vezi
Napišite primer vodikove vezi.
H20