Kemi (prov 1)
1/34
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
35 Terms
Vad är det för skillnad på begreppen GRUNDÄMNE och KEMISK FÖRENING?
Grundämnen är molekyler som bara består av atomer med samma antal protoner d.v.s. atomer av samma atomslag. Kemiska föreningar är molekyler som består av flera olika atomslag d.v.s. två eller fler grundämnen.
Vad är det för skillnad mellan ett RENT ÄMNE och en BLANDNING?
Rena ämnen (kemiska föreningar och grundämnen) Består bara av ett ämne, d.v.s. bara en kemisk förening/ett grundämne. Blandningar består av minst två olika ämnen.
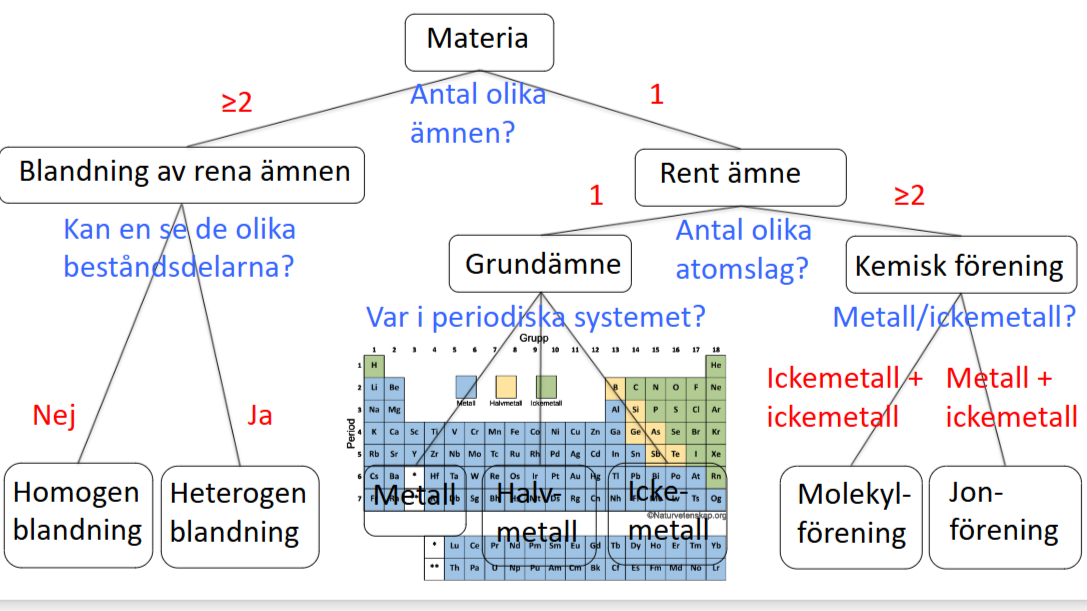
Det finns två huvudtyper av blandningar, vilka? Vad skiljer dem åt?
Homogena och heterogena blandningar. I en heterogen blandning kan man fortfarande se de olika beståndsdelarna. I en homogen blandning är så väl blandade och jämnt utspridda att man inte kan urskilja beståndsdelarna ens i mikroskop.
Det finns två huvudtyper av kemiska föreningar, vilka? + egenskaper?
Molekylföreningar och jonföreningar. Molekylföreningar består av två ickemetaller medan jonföreningar består av en ickemetall och en metall. Jonföreningar består även av två atomjoner som sedan tar ut varann och får en neutral laddning. Jonföreningar är spröda (skikt med joner förskjuts med en atom och repellerar varann, spricker) leder ström (elektronmoln)
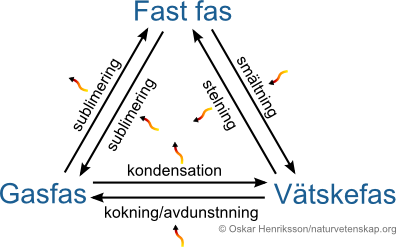
Vad är AGGREGATIONSFORM och vad menas med FASÖVERGÅNG?
Aggregationsform/aggregationstillstånd är de tre(+plasma) olika tillstånd ett ämne kan befinna sig i beroende på dess temperatur. Fasövergång är när ett ämne går över från en aggregationsform till en annan.
Vad är det för skillnad på en fysikalisk förändring och en kemisk förändring?
Att blanda, lösa upp, smälta eller koka något är exempel på fysikaliska förändringar. Det är fortfarande samma ämne och det är oftast ganska lätt att få tillbaka ämnet i den form vi startade med. (Ämnet ändrar endast AGGREGATIONSFORM) Den andra typen av förändring är kemisk förändring, där ämnen omvandlas till andra ämnen.
Vad menas med REAKTANTER och PRODUKTER i en KEMISK REAKTION?
REAKTANTER är de ursprungliga ämnena i en kemisk reaktion, de som finns från början. PRODUKTER är de ämnena som bildas av reaktanterna:
reaktant + reaktant —> produkt
atomkärnans sammansättning
xZy x: masstal (summan av protoner + neutroner i kärnan) anger ifall ämnet är en isotop (variant atomkärna m. samma antal protoner men olika antal neutroner) y: atomnummer (antal protoner i kärnan) anger vilket ämne z: kemisk beteckning
bohrs atommodell
(1) K- skalet fylls till 2 (fullt)
(2) L-skalet fylls till 8 (fullt)
(3) M-skalet fylls till 8 (ej fullt)
(4) N-skalet fylls till ungefär 2 elektroner (ej fullt)
(5) M-skalet fylls till 18 elektroner (därefter fullt)
(6) N-skalet fylls till 8 elektroner (ej fullt)
grupper & perioder
grupper (y-axel) - de vertikala kolumnerna i det periodiska systemet. ämnen i samma grupp har lika många valenselektroner (elektroner i det yttersta skalet). ämnen med samma mängd valenselektroner har även liknande reaktioner med andra ämnen. antal protoner (/massa) ökar neråt. Ju fler protoner ett ämne har desto fler elektroner, så ämnet får fler elektronskal ju längre ned det är (atomradien ökar) valenselektronerna avskärmas av antalet skal och avges lättare ju längre nedåt /tyngre de är, vilket betyder att de reagerar kraftigare (+längre) med andra ämnen. (När grupp 1 reagerar släpper de ifrån sig en e–. Ju längre bort från den positiva kärnan den yttersta elektronen är, desto lättare har den att sticka!)
perioder (x-axel) - de horisontella kolumnerna i det periodiska systemet. ämnen i samma period har lika många elektronskal. antal protoner (/massa) ökar mot höger, i varje period har ämnet till höger en proton mer i sin atomkärna. antalet protoner och elektroner är desamma i varje grundämne, därför är även antalet elektroner en mer i ämnet till höger i varje period.
effektiv kärnladdning
hur starkt valenselektronerna attraheras av atomkärnan. mer protoner → ökad attraktionskraft → elektroner dras närmare kärnan → mindre atom i storlek (atomradie minskar) hur många plussladdningar som verkar på atomens valenselektroner; x protoner minus alla e- förutom valens.
antalet valenselektroner i ett ämne
antalet valenselektroner anges av vilken grupp ämnet är i och vilket skal valenselektronerna befinner sig i anges av vilken period det ligger i. ex: grupp 1 = 1 valenselektron, period 1 = skal K.
elektronegativitet
en atoms förmåga att attrahera andra atomers elektroner till sig själv. Högre elektronegativitet →större förmåga att attrahera elektroner. påverkar bindningar. elektronegativitet minskar uppifrån och ned och ökar vänster till höger. Ämnen längst till höger har alla elektroner de behöver och är inte med på skalan.
metallers och ickemetallers placering i det periodiska systemet
Metallerna finns i periodiska systemets vänstra och centrala del, och metallegenskaperna minskar ju längre till höger vi kommer i en period. Metaller är mer ofta än inte längre ned i det periodiska systemet. Metaller har alltså ofta inte mycket elektronegativitet, då den minskar upp → ner och höger → vänster. Metallegenskaperna minskar i samma takt elektronegativiteten ökar. (detta har med elektronmolnet att göra)
exciterat tillstånd
när en elektron förflyttas till ett yttre elektronskal och högre energitilltånd på grund av en viss mängd(våglängd) tillförd energi (elektromagnetisk strålning) En atom absorberar energi från en extern källa, till exempel ljus eller elektrisk ström. Denna energi absorberas av en av atomens elektroner. Elektronen flyttar till en högre energinivå, vilket är längre bort från atomkärnan. Detta är det exciterade tillståndet.
exciteringsenergi
den energi som går åt för att flytta en elektron från ett elektronskal till ett annat
joniseringsenergi
den energi som går åt för att en elektron skall kunna lossna alldeles från atomen
formel för omvandlingar mellan molmassa, substansmängd och massa
M (molmassa [g/mol] = atommassa [u]) =m(massa [g])/n (substansmängd = antal mol [mol])
atomjoner bildade av övergångsmetaller
koppar(I)jon - Cu+
koppar(II)jon - Cu2+
järn(II)jon - Fe2+
järn(III)jon - Fe3+
silverjon - Ag+
zinkjon - Zn+
sammansatta joner

jonbindning
bindningen mellan jonerna i en jonförening; när valenselektoner från en atom (låg elektronegativitet. metall) attraheras av en annan atom (hög elektronegativitet, inte metall)(för en jonförening är metall + ickemetall) (interlinked) och de reagerar och blir joner och det blir en jonförening
elektronövergång
när en elektron hoppar från en atom till en annan och därmed bildar ett över- och underskott, dvs en positiv och negativ jon. den här reaktionen kan ske ibland mellan en icke-metall och en metall när de båda inte är joner men ska bilda jonförening.
kovalent bindning (+annat namn?)
när två elektroner delas mellan 2 atomer. om t.ex. den ena har 7 valenselektroner och den andra har 1 valenselektron så blir det armkrok (delat elektronpar) så att de tillsammans har 8 valenselektroner, dvs ett fullt yttre skal. detta är eftersom ämnet “vill” bli stabilt, och fria elektroner (1 par elektroner dvs 2 st dvs en full orbital) är stabilare än oparade elektroner (ensamma elektroner, t.ex. den 7nde i exemplet eller den 1sta i den andra i exemplet). Kallas även molekylbindning eller elektronparbindning. Dessa bindningar sker mellan 2 atomer med en liten skillnad i elektronegativitet (ickemetall+ickemetall), till skillnad från i jonföreningar.
skillnad på molekylformel och formelenhet?
formelenheten är ett ämnes atomsammansättning i enklaste form. för molekyler är formelenheten och molekylformeln densamma, men jonföreningar består av joner och inte molekyler, och därmed skiljer sig begreppen. Formelenhet är som ett paraplybegrepp med molekylformel därunder.
metallbindningen
alla rena metaller har metallbindning. Detta innebär att atomernas elektroner alla är delokaliserade och existerar istället i ett gemensamt elektronmoln (pga den svaga elektronegativiteten som innebär att elektronerna “sitter löst”) där de rör sig fritt och därmed kan leda ström och värme. Detta är även anledningen till att metaller är böjbara, då lagren i bindningarna kan förskjutas utan att 1 elektron + 1 elektron / 1 proton + 1 proton reagerar och repelleras från varann, vilket bryter ämnet itu. elektronmolnet ger även metall metallglansen.
ädelgasstruktur
en elektronstruktur som gör att attraktionskraften från atomkärnan är för svag för att en kemisk bindning ska uppstå (8 valenselektroner i skalet)
uppbyggnaden hos legeringar
två metaller. homogena blandningar
atom
den minsta delen av ett grundämne. består av en kärna med positivt laddade protoner och neutrala neutroner, med negativt laddade elektroner runtom. Elektriskt neutrala atomer har lika många elektroner som protoner.
jon
en elektriskt laddad partikel som bildas när en atom eller grupp av atomer avger eller tar upp elektroner. består av en plusladdad atomkärna, och runt omkring kärnan kretsar minusladdade elektroner. medan atomen innehåller lika många plusladdningar som minusladdningar finns det inte lika många plusladdningar och minusladdningar i en jon.
molekyl
minst två atomer som är sammanbundna med en eller flera kemiska bindningar
elektronformler
visar hur många valenselektroner ett ämne har.
redovisning av molberäkning
berätta vad du ska beräkna
lika många värdesiffror i svaret som i frågan
avrunda inte någonting förrens du ska besvara frågan
skriv ut alla fakta, ex om du ska räkna ut vad 2 mol järn väger, skriv att m = M * n och att M(Fe) = whatev n(Fe) = whatev.
pos o neg joner
pos: mindre för 1 elektron e ju borta, metall
neg: större för de har ju en till alpha atom, icke metall
elektronformler (kom ihåg grejs)
jonföreningars sammansättning: laddningarna ska balansera ut varann -3+3 osv. Antal joner ingår ej i namn. Sulfid oxid florid klorid bromid jodid. Fe³+ e järn(III) gäller alla sådana
Flera likadana sammansatta joner i en formelenhet ska ha en parantes runt ex (NO³)² fast nt däruppe yk
Oktettregeln
När en atom har 8 vakenseöektron3r är den som mest stabil tumme upp