Online-Analytik2
1/103
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
104 Terms
Vergleichen Sie die Messmethoden Inline, Online, Atline und Offline hinsichtlich ihres apparativen Aufwands, der Probenhandhabung und potenzieller Nachteile. Nennen Sie für jede Methode eine Beispielanwendung.
Im Bereich der Online-Analytik von Fermentationsprozessen werden verschiedene Messmethoden unterschieden: Inline, Online, Atline und Offline. Diese unterscheiden sich hinsichtlich ihres apparativen Aufwands, der Probenhandhabung und potenzieller Nachteile.
Hier ist ein detaillierter Vergleich:
Inline-Messung
Probenhandhabung: Bei der Inline-Messung erfolgt keine Probenahme aus dem Reaktorsystem. Die Messung kann sowohl invasiv (z.B. durch Sonden, die in den Reaktor eingeführt werden) als auch nicht-invasiv erfolgen.
Apparativer Aufwand & Nachteile: Inline-Messungen erfordern typischerweise Sonden. Klassische Bioreaktoren haben nur eine begrenzte Anzahl von Ports, was die Anzahl der möglichen Inline-Messungen limitiert. Zudem können Störgrößen wie Biofilm, Blasen und Schaum die Messung beeinträchtigen.
Beispielanwendung: Die Durchlichtmessung zur Biomassebestimmung mittels in den Bioreaktor eingeführter Sonden ist ein Beispiel für eine Inline-Anwendung. Auch die Online-Mikroskopie kann als Inline-Variante direkt im Reaktor verbaut sein. pH- und pO2-Messungen in Mikrotiterplatten (MTPs) können mittels am Boden immobilisierter Sensorspots (Optoden) erfolgen, die in der Flüssigkeit verbleiben.
Online-Messung
Probenhandhabung: Bei der Online-Messung wird eine Probe aus dem System entnommen und anschließend wieder in das System zurückgeführt, oft über einen "Bypass". Der Begriff "Online-Analytik" dient hierbei als Überbegriff.
Apparativer Aufwand & Nachteile: Online-Messungen erfordern zusätzlichen apparativen Aufwand und können mit potenziell erhöhten Volumina und Kosten verbunden sein. Ein Hauptproblem bei Probenschleifen und Bypässen sind Transportlimitierungen wie schlechte Durchmischung und Sauerstofflimitierung. Dies kann zu einer Veränderung der Messwerte führen, sodass keine Übereinstimmung zwischen Probe und Reaktorinhalt besteht. Sauerstofflimitierung kann beispielsweise bereits nach etwa 3 Sekunden in einem Bypass auftreten. Solche Transportlimitierungen sind besonders häufig in großtechnischen Anlagen zu beobachten.
Beispielanwendung: Die Online-Kalorimetrie unter Verwendung eines Chip-Kalorimeters ist ein Beispiel hierfür, bei der die Probe aus dem Fermenter in eine Messkammer gepumpt wird. Auch die Online-Mikroskopie kann im Bypass erfolgen. Im Schüttelkolben gibt es Lösungen wie Sensorspots an einem Träger, der mit der Flüssigkeit rotiert, oder Sensorpillen, die sich mit der Flüssigkeit bewegen.
Atline-Messung
Probenhandhabung: Bei der Atline-Messung wird eine Probe aus dem System entnommen, analysiert und anschließend verworfen.
Apparativer Aufwand & Nachteile: Diese Methode erfordert zusätzlichen Aufwand. Ein Nachteil ist, dass sich die Messwerte zwischen der Probenahme und der eigentlichen Messung ändern können.
Beispielanwendung: Die vorliegenden Quellen geben keine spezifische Beispielanwendung für die Atline-Messung an. Basierend auf der Definition könnte eine beispielhafte Anwendung die Entnahme einer Probe für eine schnelle Laboranalyse (z.B. mittels eines tragbaren Spektrometers direkt neben dem Prozess), bei der die Probe nach der Messung entsorgt wird und nicht in den Reaktor zurückkehrt, sein.
Offline-Messung
Probenhandhabung: Bei der Offline-Messung werden Proben für eine spätere Analyse außerhalb des laufenden Systems entnommen.
Apparativer Aufwand & Nachteile: Offline-Messungen verursachen zusätzlichen Aufwand und Kosten. Die Informationsgewinnung ist zeitlich verzögert. Ein wesentlicher Nachteil ist, dass es typischerweise nachts und am Wochenende zu einer Datenlücke kommt, da keine Proben entnommen werden. Die klassische Probenahme in regelmäßigen Zeitintervallen ist oft nicht sinnvoll, da sie wichtige Prozessänderungen verpassen kann. Diese Methode ist arbeitsintensiv, fehleranfällig, kostenintensiv, abhängig von der durchführenden Person und kann die Kultur durch die invasive Probenahme beeinflussen, insbesondere bei geringen Volumina.
Beispielanwendung: Die klassische OD-Messung (Optische Dichte) zur Biomassebestimmung, bei der die Proben zur Analyse typischerweise verdünnt werden, ist ein Beispiel für eine Offline-Methode. Auch die traditionelle Mikroskopie zur Bestimmung von Zellparametern, die eine Probenahme und damit Zeitverzögerungen erfordert, ist eine Offline-Anwendung.
Vergleichen Sie das Messprinzip eines pH-Elektrodenpaars mit dem eines galvanischen Elements. Erläutern Sie, warum beim pH-Messsystem kein Stromfluss erwünscht ist und wie dies technisch realisiert wird.
Galvanisches Element:
• Zweck: Ein galvanisches Element wandelt chemische Energie in elektrische Energie um. Es dient als erste künstliche Quelle elektrischer Energie.
• Aufbau: Es verwendet Elektroden 1. Art, bei denen ein Metall in eine Lösung seines eigenen Salzes taucht (z.B. Kupfer in Kupfersulfat).
• Messprinzip: Die Potenzialdifferenz entsteht durch die unterschiedliche Lösungstension verschiedener Metalle in einem Elektrolyten.
• Stromfluss: Im galvanischen Element fließt ein realer Strom.
• Nachteil: Durch den Stromfluss wird die Elektrode mit der Zeit verbraucht.
pH-Messsystem (Potentiometrische pH-Wert-Messung):
• Zweck: Das Ziel ist die Messung einer Potenzialdifferenz, die ausschließlich durch den pH-Wert der Lösung beeinflusst wird. Es soll keine Energieumwandlung stattfinden.
• Aufbau: Es verwendet Elektroden 2. Art, die aus einem Metall bestehen, das mit einem schwer löslichen Metallsalz überzogen ist (z.B. Ag/AgCl-Elektroden).
• Komponenten: Ein pH-Messsystem besteht aus einer Messelektrode (meist eine pH-sensitive Glasmembran) und einer Bezugselektrode (mit konstantem Potenzial, z.B. Ag/AgCl-Elektrode).
• Potenzialbildung: Das Potenzial bildet sich an der Gelschicht der Glasmembran durch den Ionenaustausch von Alkali-Ionen und Wasserstoff-Ionen.
• Stromfluss: Beim pH-Messsystem soll kein Strom fließen.
Wesentliche Unterschiede im Überblick:
• Stromfluss: Galvanisches Element erzeugt Stromfluss; pH-Messung verhindert Stromfluss.
• Elektrodentyp: Galvanisches Element nutzt Elektroden 1. Art; pH-Messung nutzt Elektroden 2. Art.
• Verbrauch der Elektrode: Galvanisches Element verbraucht die Elektrode; pH-Messung vermeidet Verbrauch.
• Messgröße: Galvanisches Element misst Potenzialdifferenz aus Lösungstension; pH-Messung misst Potenzialänderung durch pH-Wert.
Warum kein Stromfluss erwünscht ist und wie dies technisch realisiert wird
Warum kein Stromfluss erwünscht ist:
• Bei der Messung des pH-Wertes soll eine Potenzialdifferenz gemessen werden, die nicht durch den Verbrauch der Elektrode beeinflusst wird.
• Wenn ein Strom fließen würde, käme es zu elektrochemischen Reaktionen an den Elektroden, die das Elektrodenmaterial verbrauchen würden. Dies würde die Messung unzuverlässig machen, da sich die Elektrodeigenschaften über die Zeit ändern würden und das Signal nicht mehr ausschließlich vom pH-Wert abhinge.
• Die Messung soll eine Potenzialänderung widerspiegeln, nicht den Stromfluss selbst.
Wie dies technisch realisiert wird:
• Um den Stromfluss zu verhindern, wird ein hochohmiges Voltmeter verwendet.
• Gemäß dem Ohm'schen Gesetz ($U = R \cdot I$) führt ein sehr hoher Widerstand (R) im Messkreis dazu, dass der Stromfluss (I) gegen Null geht, selbst wenn eine Potenzialdifferenz (U) vorhanden ist.
• Dadurch wird sichergestellt, dass das System während der Messung nicht verändert oder die Elektroden verbraucht werden, und nur die tatsächliche Potenzialdifferenz, die mit dem pH-Wert korreliert, erfasst wird.
Welche Einflussfaktoren können zu Fehlmessungen der Clark-Elektrode führen und wie lassen sich diese technisch begrenzen? Erklären Sie das Prinzip der fluoreszenzbasierten pO₂-Messung anhand des Fluoreszenz-Quenching. Welche Rolle spielt dabei der sogenannte Stokes-Shift?
Die Clark-Elektrode ist ein amperometrisches Messsystem zur Bestimmung des Sauerstoffpartialdrucks (pO₂). Sie misst die Stromstärke, die durch die Reduktion von Sauerstoff an einer Platin-Kathode und die Oxidation von Silber an einer Silber-Anode entsteht. Diese Stromstärke ist idealerweise nur vom Sauerstoffpartialdruck abhängig.
Mehrere Faktoren können jedoch zu Fehlmessungen führen:
1. Sauerstoffverbrauch der Elektrode: Die Clark-Elektrode verbraucht Sauerstoff durch die Reduktionsreaktion an der Kathode. Daher muss Sauerstoff kontinuierlich zum Sensor nachgeliefert werden.
◦ Auswirkung: Die Messung ist stark von der Strömungsgeschwindigkeit und der Viskosität der Messlösung abhängig. Eine unzureichende Nachlieferung führt zu einem Konzentrationsgefälle über die Membran und kann Messergebnisse verfälschen, wenn die Sauerstoffkonzentration im Elektrolytraum nicht Null ist (diffusionskontrollierte Reaktion).
◦ Technische Begrenzung: Dies wird durch ständige Bewegung des Mediums (z.B. Rühren in einem Bioreaktor) oder durch kontinuierlichen Fluss der Messlösung über die Membran gewährleistet.
2. Fehlerhafte Polarisationsspannung: Die Clark-Elektrode benötigt eine angelegte Polarisationsspannung.
◦ Auswirkung: Ist die Spannung zu niedrig, kommt es zu keiner vollständigen Umsetzung des Sauerstoffs. Ist sie zu hoch, können unerwünschte Nebenreaktionen auftreten. Nur im sogenannten Plateaubereich der Strom-Spannungs-Kurve ist pO₂ der einzige Einfluss auf die gemessene Stromstärke.
◦ Technische Begrenzung: Die Polarisationsspannung muss korrekt gewählt und stabil gehalten werden, um sicherzustellen, dass die Reaktion diffusionskontrolliert abläuft und keine Nebenreaktionen stören. Vor der Messung muss die Elektrode über einen Zeitraum von Stunden bis zu einem Tag polarisiert werden.
3. Selektivität der Membran: Eine dünne Membran trennt den Elektrodenraum vom Messgut.
◦ Auswirkung: Die Membran muss selektiv für Sauerstoff sein, um andere Reaktionen an den Elektroden zu verhindern, die das Messergebnis verfälschen könnten.
◦ Technische Begrenzung: Die Auswahl eines geeigneten Membranmaterials (z.B. PTFE), das nur für Sauerstoff durchlässig ist, gewährleistet die Selektivität.
4. Membrandicke und Diffusion:
◦ Auswirkung: Die Diffusion des Sauerstoffs durch die Membran ist temperaturabhängig. Auch die Schichtdicken des Diffusionsvorgangs (Membran → Elektrolyt, Elektrolyt → Elektrode) sind relevant für die Ansprechzeit.
◦ Technische Begrenzung: Die Schichtdicken werden durch die Membran konstant gehalten und sollten möglichst klein sein, um eine schnelle Ansprechzeit zu gewährleisten. Eine konstante Temperaturkontrolle des Messmediums ist ebenfalls wichtig.
5. Ablagerungen und Gasblasen:
◦ Auswirkung: Gasblasen können sich unter der Membran festsetzen und die Messung stören. Zudem scheidet sich Silberchlorid (AgCl) an der Anode ab, was die Funktion der Elektrode beeinträchtigt.
◦ Technische Begrenzung: Regelmäßige Reinigung der Elektrode ist erforderlich, um Ablagerungen zu entfernen. Eine korrekte Installation und Positionierung der Sonde im Reaktor hilft, die Bildung von Gasblasen unter der Membran zu vermeiden.
6. Kalibrierung:
◦ Auswirkung: Die Messung liefert einen Strom, der vom pO₂ abhängt. Um diesen in verwertbare Daten umzuwandeln, ist eine Kalibrierung erforderlich. Eine falsche Kalibrierung, wie im Beispiel einer "BITTE NICHT NACHMACHEN!"-Anweisung in den Quellen, kann zu unzuverlässigen Daten führen.
◦ Technische Begrenzung: Die Kalibrierung muss vor der Anwendung und unter den tatsächlichen Fermentationsbedingungen (z.B. Rührerdrehzahl, Druck, Temperatur, Medium) erfolgen, um präzise und zuverlässige Ergebnisse zu erzielen.
Es ist wichtig zu beachten, dass die Clark-Elektrode den Sauerstoffpartialdruck, nicht die Konzentration misst, was bedeutet, dass die Zugabe von Salzen die Konzentration des gelösten Gases ändert, aber nicht dessen Partialdruck.
Prinzip der fluoreszenzbasierten pO₂-Messung (Optode) und die Rolle des Stokes-Shifts
Die fluoreszenzbasierte pO₂-Messung, oft mittels Optoden realisiert, basiert auf dem Prinzip des Lumineszenz-Quenchings.
1. Messprinzip des Fluoreszenz-Quenchings:
◦ Ein Indikatorfarbstoff (Fluorophor), typischerweise ein metallorganischer Komplex wie ein Rutheniumkomplex (z.B. RuDPP), ist in einem Silikon-Spot (Optode) immobilisiert.
◦ Dieser Farbstoff wird mit Licht einer bestimmten Wellenlänge (Anregungslicht, z.B. 610–630 nm) angeregt.
◦ Nach der Anregung emittiert der Farbstoff Lumineszenz (Emissionslicht, z.B. 760–790 nm).
◦ Wenn Sauerstoff (als Quencher) vorhanden ist, wird ein Teil der vom Farbstoff absorbierten Energie auf den Sauerstoff übertragen. Dies führt zu einer Abnahme der Emissionsintensität und/oder einer Verkürzung der Lumineszenzabklingzeit (der Zeit, die das emittierte Licht benötigt, um abzuklingen). Dieser Effekt wird als "Quenching" bezeichnet.
◦ Die Fluoreszenz-Quenching ist proportional zum Sauerstoffpartialdruck. Die Beziehung wird durch die Stern-Volmer-Gleichung beschrieben, die den Zusammenhang zwischen der Lumineszenzintensität (oder -abklingzeit) in Anwesenheit und Abwesenheit von Sauerstoff darstellt.
◦ Die Messung kann durch Auswertung der Abklingzeit (Pulsanregung) oder des Phasenwinkels (Phasenaufgelöste Bestimmung) des emittierten Lichts erfolgen. Diese Methoden sind vorteilhaft, da sie unabhängig von der Lichtintensität und der Detektorsensitivität sind. Optoden sind besonders sensitiv bei niedrigen Sauerstoffpartialdrücken.
2. Rolle des Stokes-Shifts:
◦ Der Stokes-Shift beschreibt die Wellenlängenverschiebung zwischen dem absorbierten Anregungslicht und dem emittierten Fluoreszenzlicht. Das emittierte Licht hat eine längere Wellenlänge (und damit geringere Energie) als das absorbierte Licht.
◦ Diese Verschiebung ist für jedes Fluorophor charakteristisch.
◦ Die Rolle des Stokes-Shifts ist grundlegend für die optische Messung von Fluoreszenz selbst. Sie ermöglicht es, das schwächere Fluoreszenzsignal vom wesentlich stärkeren Anregungslicht zu unterscheiden. Ohne diesen Energieverlust (und damit Wellenlängenverschiebung) wäre eine präzise Detektion des emittierten Lichts schwierig, da es vom dominierenden Anregungssignal überlagert würde. Beim Fluoreszenz-Quenching erlaubt der Stokes-Shift die klare Trennung von Anregungs- und Emissionslicht, bevor die Sauerstoffabhängigkeit des Emissionssignals quantifiziert wird.
Wie funktioniert eine infrarotbasierte pCO₂-Messung? Welche physikalische Eigenschaft von CO₂ wird dabei genutzt, und was ist der Vorteil gegenüber der Severinghaus-Elektrode?
Funktionsweise der infrarotbasierten pCO₂-Messung
Das Messprinzip basiert darauf, dass CO₂ ein infrarot-aktives Gas ist. Das bedeutet, es zeigt eine Änderung seines Dipolmoments, wenn es Infrarotstrahlung absorbiert. Jedes infrarot-aktive Molekül besitzt einen charakteristischen "Fingerprint" im Infrarotspektrum.
Bei der Messung wird CO₂-Gas mit Infrarotlicht einer spezifischen Wellenlänge (typischerweise um 4 µm) bestrahlt. Die Zunahme des CO₂-Partialdrucks führt zu einer Abnahme der Intensität des durchgelassenen Lichts. Die Intensitätsabnahme ist proportional zur CO₂-Konzentration. Die Messung erfolgt in der Regel im Vergleich zu einer Referenz.
Es gibt verschiedene technische Umsetzungen dieser Messung:
• Opto-pneumatischer / URAS-Analysator: Bei diesem Prinzip wird nicht absorbierte Reststrahlung in eine Empfängerkammer geleitet, die den zu messenden Analyten (CO₂) enthält. Durch vollständige Absorption kommt es zu abwechselnder Erwärmung und Abkühlung, was eine Druckänderung verursacht. Diese Druckdifferenz ist proportional zum Konzentrationsunterschied zwischen Mess- und Referenzküvette und wird in ein messbares Signal umgewandelt.
• Photoakustische Spektroskopie: Hierbei wird Lichtenergie in Schall umgewandelt. Das Gas wird mit Licht einer für CO₂ spezifischen Wellenlänge (IR) bestrahlt. Durch Lichtmodulation (An/Aus) alterniert der Druck, wodurch eine Schallwelle mit einer bestimmten Frequenz erzeugt wird. Diese Druckwelle, die proportional zum CO₂-Partialdruck ist, wird über ein Mikrofon gemessen.
In der Online-Analytik von Fermentationsprozessen kann die infrarotbasierte CO₂-Messung direkt in der Elektrode erfolgen, wo ein Farbstoff in einer gaspermeablen Messmatrix immobilisiert ist und seine Absorption mit dem pCO₂ im Medium korreliert. Es existieren auch kombinierte Systeme, die gleichzeitig CO₂ und O₂ im Abgasstrom messen.
Physikalische Eigenschaft von CO₂
Die genutzte physikalische Eigenschaft von CO₂ ist seine IR-Aktivität. Dies bedeutet, dass das CO₂-Molekül bei der Absorption von Infrarotstrahlung eine Änderung seines Dipolmoments aufweist. Diese Eigenschaft ist nicht auf CO₂ beschränkt, sondern gilt auch für andere mehratomige Moleküle wie H₂O, CH₄ und N₂O, wobei jedes Molekül einen spezifischen "Fingerprint" besitzt.
Vorteil gegenüber der Severinghaus-Elektrode
Die infrarotbasierte pCO₂-Messung bietet gegenüber der Severinghaus-Elektrode mehrere Vorteile:
• Messprinzip der Severinghaus-Elektrode: Die Severinghaus-Elektrode basiert auf einer pH-Elektrode, die von einem Carbonatpuffer umgeben und mit einer gasselektiven Silikonmembran (oft mit PTFE überzogen) überzogen ist. CO₂ diffundiert durch diese Membran und reagiert im Elektrolytraum mit Wasser, wodurch sich der pH-Wert ändert. Die gemessene Spannungsänderung ist dann proportional zur Protonenkonzentration und damit zum pCO₂.
• Limitierungen der Severinghaus-Elektrode:
◦ Sättigung des Puffers: Bei CO₂-Drücken über 2 bar geht die Messkurve in eine Gerade über, was den Messbereich auf bis zu 1 bar CO₂ begrenzt.
◦ Interferenzen: Die Messung kann durch andere Substanzen wie Schwefelwasserstoff (H₂S) oder Ammoniak gestört werden.
◦ Kalibrierungsaufwand: Eine Kalibrierung ist mit Prüfgasen oder Abgasanalyse notwendig.
• Vorteile der infrarotbasierten Messung:
◦ Selektivität und weniger Interferenzen: Da infrarotbasierte Methoden den spezifischen "Fingerprint" jedes Gases nutzen, sind sie in der Regel weniger anfällig für Interferenzen durch andere Substanzen, die die chemische Gleichgewichtsreaktion der Severinghaus-Elektrode stören könnten.
◦ Driftstabilität und Präzision: Insbesondere bei der photoakustischen Spektroskopie sind die verwendeten Mikrofone extrem driftarm, was zu einer präziseren Messung führt. Dies ist ein Vorteil gegenüber Systemen, die regelmäßige Kalibrierungen und Ausgleiche von Abweichungen erfordern.
◦ Vielseitigkeit: Die IR-Technologie kann auch andere infrarot-aktive Gase erkennen, was in komplexen Gasgemischen (z.B. in Gasfermentationen) von Vorteil sein kann.
Welche Rolle spielt Sauerstoff bei der Interpretation des Redoxpotentials? Warum reicht in bestimmten Fermentationen eine reine pO₂-Messung nicht aus?
Sauerstoff spielt eine dominierende Rolle bei der Interpretation des Redoxpotentials, insbesondere in aeroben Fermentationen. Das Redoxpotential (Eh) ist ein Summenparameter, der von der Gesamtheit aller Redox-Paare im System abhängt und die insgesamt verfügbaren Elektronen widerspiegelt. Obwohl es von verschiedenen Faktoren wie dem pH-Wert und unbekannten Metaboliten beeinflusst wird, ist der Einfluss von Sauerstoff in aeroben Fermentationen meist der wichtigste. Ein abweichender Trend zwischen dem Redoxpotential und dem pO₂-Wert kann sogar auf eine Stoffwechselumstellung hinweisen.
In bestimmten Fermentationen reicht eine reine pO₂-Messung nicht aus, da sie Limitierungen aufweist, insbesondere bei sehr niedrigen Sauerstoffkonzentrationen.
Gründe, warum eine pO₂-Messung nicht immer ausreicht:
• Ungenügende Auflösung im mikroaerophilen Bereich:
◦ Konventionelle pO₂-Elektroden, wie die Clark-Elektrode oder Fluoreszenzsonden (Optoden), können bei sehr geringen Sauerstoffpartialdrücken an ihre Auflösungsgrenzen stoßen.
◦ Die Clark-Elektrode misst den Sauerstoffpartialdruck und ist abhängig von Strömung und Viskosität des Messguts. Sie erfordert Polarisierung und Kalibrierung unter Fermentationsbedingungen.
◦ Optoden basieren auf Fluoreszenz-Quenching, bei dem die Lumineszenzintensität proportional zum Sauerstoffpartialdruck abnimmt. Sie sind besonders für geringe Partialdrücke geeignet, haben aber eine begrenzte Lebensdauer durch Ausbleichen des Farbstoffs.
◦ Das Redoxpotential hingegen kann selbst bei sehr niedrigen Gelöstsauerstoffkonzentrationen, die von Clark-Elektroden nicht mehr aufgelöst werden können (z.B. unter 0,5 % pO₂), noch Unterschiede erfassen.
• Beispiele und Anwendungsfälle:
◦ Leucin-Produktion mit Brevibacterium lactofermentum: Die Leucinproduktion variierte stark im Bereich um 0 % pO₂. Die geringe Auflösung der klassischen pO₂-Messungen war hier unzureichend. Das Redoxsignal zeigte jedoch, dass die Kultur im mikroaerophilen Bereich (Redoxpotential Eh > –110 mV) am besten produzierte. Dies ermöglichte eine Unterscheidung zwischen mikroaerophilem Bereich und tatsächlicher Sauerstofflimitierung, was mit konventionellen pO₂-Messungen nicht möglich war.
◦ Xylanase-Produktion mit Bacillus amyloliquefaciens: In einer kontinuierlichen Fermentation zeigte die Xylanaseproduktion einen oszillierenden Verlauf. Eine hohe Xylanaseproduktion fand nur im Anfangsbereich der Sauerstofflimitierung statt. Bei einem pO₂ unter 0,5 % ist eine Messung und Regelung mit dem Redoxpotential erforderlich, da die Clark-Elektrode oder Fluoreszenzsonde hier an ihre Grenzen stößt. Durch die Regelung des Redoxsignals über die Rührerdrehzahl konnte die Xylanasekonzentration stabilisiert werden und fiel nicht mehr ab.
• Spezifische Probleme in Schüttelkolben:
◦ Konventionelle Fermenter-Elektroden sind in Schüttelkolben nicht ideal, da sie die Flüssigkeitsbewegung stark beeinflussen und die definierten Bedingungen stören können.
◦ In Kulturen mit Sauerstofflimitierung, die häufig in Schüttelkolben auftreten, ist der gelöste Sauerstoff nahe Null, was die Messung fehlerhaft macht.
Zusammenfassend lässt sich sagen, dass das Redoxpotential als empfindlicherer Summenparameter gerade in Bereichen niedriger Sauerstoffkonzentrationen eine detailliertere Einsicht in den metabolischen Zustand einer Fermentation ermöglicht, die über die reine pO₂-Messung hinausgeht und für eine optimierte Prozessführung essenziell sein kann.
Ein Bioreaktor wird mit Luft (yO₂,in = 0,2095; yCO₂,in = 0,00035) bei einer volumenspezifischen Gasflussrate von 1,0 vvm betrieben. Im Abgas misst man yO₂,out = 0,03 und yCO₂,out = 0,065. Berechnen Sie den Respirationsquotienten (RQ) dieser Kultur.

Welche Komponenten des thermomagnetischen Sauerstoffanalysators (Magnetwind-Analysator) sind besonders empfindlich gegenüber äußeren Einflüssen, und wie wird dies konstruktiv berücksichtigt?
Der thermomagnetische Sauerstoffanalysator, auch bekannt als Magnetwind-Analysator, misst die Sauerstoffkonzentration, indem er die paramagnetische Eigenschaft von Sauerstoff nutzt. Bestimmte Komponenten dieses Analysators sind besonders empfindlich gegenüber äußeren Einflüssen, was konstruktiv berücksichtigt wird:
• Magnetfeld und Heizspule (Messkammer): Die Suszeptibilität (Maß für die Stärke des Paramagnetismus) von Sauerstoff ist temperaturabhängig und sinkt mit steigender Temperatur. Das bedeutet, Temperaturschwankungen in der Messkammer könnten das Messergebnis verfälschen.
◦ Konstruktive Berücksichtigung: Die Messkammer ist in ein temperaturstabilisiertes Gehäuse eingebaut. Die Temperatur im Gehäuse wird durch Heizelemente und einen Temperatursensor konstant gehalten.
• Messgasvolumenstrom: Der Messgasfluss durch das Messrohr kühlt die Heizspule ab, und die Strömungsgeschwindigkeit, die proportional zur Sauerstoffkonzentration ist, hängt vom Volumenstrom ab. Die Messgeräte sind sehr empfindlich gegenüber schwankenden Messgasvolumenströmen.
◦ Konstruktive Berücksichtigung: Der Messgasvolumenstrom muss genau geregelt werden.
• Messrohr: Das Messrohr, in das der Sauerstoff hineingezogen wird, muss in einer bestimmten Ausrichtung stabil sein.
◦ Konstruktive Berücksichtigung: Das Messrohr muss gerade sein, was oft durch eine eingebaute Wasserwaage sichergestellt wird.
Der Analysator zeichnet sich dadurch aus, dass er keine beweglichen Teile hat. Die Empfindlichkeit der Heizspule ist Teil einer Wheatstone-Brücke, deren Widerstandsänderung proportional zur Geschwindigkeit der Strömung im Messrohr und damit zur Sauerstoffkonzentration ist.
Für welche Konzentrationsbereiche und Anwendungen ist die λ-Sonde besonders geeignet? Begründen Sie.
Die λ-Sonde (Zirconiumdioxid-Sonde) ist besonders gut für die Messung von Sauerstoff in Gasströmen geeignet, insbesondere für geringe O₂-Partialdrücke.
Begründung für die Eignung bei geringen O₂-Partialdrücken:
Das Messprinzip der λ-Sonde basiert auf der Differenz des Sauerstoffpartialdrucks zwischen einem Referenzgas (meist Luft mit 20,95 % O₂) und dem Messgas (Abgasstrom), welche zu einer messbaren Potentialdifferenz führt. Dabei wird Zirconiumdioxid (ZrO₂) als Festkörper-Elektrolyt verwendet, in dem Sauerstoffionen (O²⁻) beweglich sind. Diese Bewegung wird durch das Einbringen von Fremdionen (Dotierung) ermöglicht, die Gitterdefekte verursachen.
Die entscheidende Begründung für ihre Eignung bei niedrigen Konzentrationen ist, dass "Je geringer pO₂ im Abgas, desto höher das treibende Konzentrationsgefälle", was wiederum zu einer höheren Signalspannung führt. Die Beziehung zwischen der gemessenen Spannung (U) und den Partialdrücken ist logarithmisch:
$U = \frac{R \cdot T}{4 \cdot F} \cdot \ln \frac{p_{O_2,Luft}}{p_{O_2,Abgas}}$
Dies bedeutet, dass ein sinkender pO₂-Wert im Messgas zu einer steigenden Signalspannung führt, was eine präzisere Messung bei niedrigen Sauerstoffkonzentrationen ermöglicht.
Anwendungsbereiche:
Historisch wurde die λ-Sonde in den 1960er Jahren erstmals zur Messung von Sauerstoff in Gasströmen beschrieben und in den 1970er Jahren für den Einsatz in Autos weiterentwickelt, wo sie die Stöchiometrie zwischen Kraftstoff und Sauerstoff (Lambda-Wert) bestimmt. Im Kontext der Online-Analytik von Fermentationsprozessen wird die λ-Sonde zur O₂-Analyse im Abgas eingesetzt, was essenziell für die Berechnung von Sauerstofftransferraten (OTR), Kohlenstoffdioxidtransferraten (CTR) und dem Respirationsquotienten (RQ) ist.
Weitere relevante Eigenschaften:
• Die Diffusion von Sauerstoffionen in Zirconiumdioxid ist temperaturabhängig, weshalb die Sonde bei einer hohen Betriebstemperatur von etwa 600 °C arbeitet, die durch eine Widerstandsheizung konstant gehalten wird.
• Die Messung ist eine elektrochemische Methode und nutzt das Prinzip einer galvanischen Zelle.
𝑈 = 𝑅 ∙ 𝑇/ 4 ∙ 𝐹 ∙ ln 𝑝𝑂2,𝐿𝑢𝑓𝑡/𝑝𝑂2,𝐴𝑏𝑔𝑎�
Erläutern Sie das Prinzip der photoakustischen CO2-Messung. Warum ist die Modulation der Lichtquelle wichtig?
Messprinzip:
1. Das zu messende Gas (hier CO₂) wird mit Licht bestrahlt. Für CO₂ wird dabei Infrarotlicht (IR-Bereich) verwendet, da CO₂ ein IR-aktives Gas ist und bei Wellenlängen um ~4 µm absorbiert.
2. Durch die Lichtabsorption erwärmt sich das Gas kurzzeitig.
3. Die Absorption führt zu einer Druckänderung im Messgas.
Bedeutung der Modulation der Lichtquelle:
Die Modulation (Ein- und Ausschalten) der Lichtquelle ist entscheidend, weil sie einen oszillierenden Druck erzeugt, der sich als Schallwelle mit einer bestimmten Frequenz manifestiert.
• Diese Modulation erzeugt eine spezifische "Tonhöhe" für jedes Gas, da die Oszillation von einem sogenannten "Chopper-Rad" abhängt.
• Die erzeugte Schallwelle (Druckwelle) ist proportional zum CO₂-Partialdruck.
• Diese Druckwelle kann dann über ein Mikrofon gemessen werden.
Vorteile der photoakustischen Methode:
• Die verwendeten Mikrofone sind extrem driftarm, was eine präzise Messung ermöglicht.
• Sie kann Teil eines kombinierten Systems sein, das auch einen magnetoakustischen Sauerstoffanalysator umfasst, um simultan CO₂ und O₂ im Abgasstrom zu messen.
Erläutern Sie das Prinzip der Massenspektrometrie und beschreiben Sie die Funktionsweise eines Quadrupol-Massenanalysators. Welche Rolle spielen dabei die Gleich- und Wechselspannung an den Elektroden?
Die Massenspektrometrie ist eine analytische Methode, die das Masse-zu-Ladung-Verhältnis (m/z) von Molekülen misst. Dieses Verhältnis ist dimensions- und einheitenlos. Die Ergebnisse werden typischerweise als Spektrum dargestellt, das die Intensität der Ionen über ihrem m/z-Verhältnis aufträgt.
Der grundlegende Ablauf einer massenspektrometrischen Analyse umfasst drei Hauptschritte:
1. Ionenerzeugung: Die Moleküle der Probe werden in einen Strahl geladener Ionen umgewandelt. Dies geschieht in der Ionenquelle. Ein gängiges Verfahren ist die Elektronenstoß-Ionisation (EI), bei der Analyten mit Elektronen beschossen werden, um Ionisation oder Fragmentierung zu verursachen. Die Probe muss dafür im gasförmigen Zustand vorliegen.
2. Ionenseparation: Die erzeugten Ionen werden nach ihrem Masse-zu-Ladung-Verhältnis (m/z) getrennt. Dies ist die Aufgabe des Massenanalysators.
3. Ionendetektion: Die getrennten Ionen werden gezählt oder ihr Ionenstrom wird gemessen. Der Detektor registriert die Intensität der Ionen und liefert das Massenspektrum.
Funktionsweise eines Quadrupol-Massenanalysators
Der Quadrupol-Massenanalysator besteht aus vier parallel angeordneten Metallstäben, die als Elektroden dienen. Diese Stäbe haben typischerweise einen Durchmesser von etwa 1 cm und sind 15-20 cm lang. Gegenüberliegende Stäbe sind jeweils an denselben Pol einer Wechselspannungsquelle (Vcosωt) angeschlossen, und zusätzlich wird eine Gleichspannung (U) darüber gelegt.
Ionen werden in den Raum zwischen den Stäben hinein beschleunigt (entlang der z-Achse). Die Spannungen an den Stäben werden so angepasst, dass das Verhältnis von Wechsel- und Gleichspannung konstant bleibt. Dies ist entscheidend, um Ionen nach ihrem m/z-Verhältnis zu filtern.
Rolle von Gleich- und Wechselspannung:
Die Kombination aus Gleich- und Wechselspannung erzeugt ein dynamisches elektrisches Feld, das wie ein komplexer Filter wirkt:
• Wechselspannung (AC-Spannung):
◦ Die Wechselspannung bewirkt eine oszillierende Bewegung der Ionen im transversalen Feld zwischen den Stäben.
◦ In der positiven Phase der Wechselspannung neigen die Ionen zur Mitte hin, in der negativen Phase divergieren sie nach außen.
◦ Leichte Ionen reagieren stärker auf die schnell wechselnde Spannung als schwere Ionen. Sie werden instabil, kollidieren eher mit den Stäben und werden neutralisiert oder aus dem Vakuum entfernt.
◦ Dieser Effekt wirkt als "Hochpass"-Filter, der nur Ionen oberhalb eines bestimmten m/z-Wertes durchlässt.
• Gleichspannung (DC-Spannung):
◦ Die Gleichspannung zwischen benachbarten Elektroden erzeugt ein statisches Feld, das die Ionen je nach Polung anzieht oder abstößt.
◦ Schwere Ionen mit längerer Verweilzeit im Feld reagieren stärker auf die Gleichspannung.
◦ Dieser Effekt wirkt als "Tiefpass"-Filter, der nur Ionen unterhalb eines bestimmten m/z-Verhältnisses durchlässt.
Zusammenspiel und Funktion:
Für ein Ion, das den Detektor erreichen soll, muss es sowohl den Hochpass- als auch den Tiefpass-Filter passieren können. Durch die kontrollierte Änderung der Gleich- und Wechselstrompotentiale können Ionen unterschiedlicher m/z-Verhältnisse nacheinander auf stabile Flugbahnen (Trajektorien) gebracht werden. Ionen außerhalb des bestimmten m/z-Bereichs kollidieren mit den Stäben und werden neutralisiert.
Quadrupole sind im Vergleich zu Sektorfeldanalysatoren preiswerter, kompakter und robuster. Sie bieten zudem kurze Scanzeiten von unter 100 ms für ein vollständiges Massenspektrum.
Erläutern Sie, welche Faktoren die Sauerstofflöslichkeit in Fermentationsmedien beeinflussen und wie sich eine kurzfristige Erhöhung der Rührerdrehzahl auf den Sauerstoffpartialdruck (pO2) und den Sauerstoffgehalt im Abgas (yO2) auswirkt.
Die Löslichkeit von O₂ im Medium (also die maximal mögliche Konzentration, cO2∗c^*_{O_2}cO2∗) hängt von mehreren Einflüssen ab:
Temperatur: Mit steigender Temperatur nimmt die Gaslöslichkeit in Flüssigkeiten ab (heißes Wasser löst weniger O₂ als kaltes).
Druck: Nach dem Henry-Gesetz steigt die Löslichkeit proportional zum Partialdruck des Gases (Überdruck im Fermenter → mehr O₂ löslich).
Salzgehalt & Medienzusammensetzung: Salze, Zucker, Proteine etc. senken die O₂-Löslichkeit („salting out“-Effekt).
pH und Schaumbildner: beeinflussen die Oberflächenspannung und damit die Gasübergangseffizienz, allerdings weniger die eigentliche Löslichkeit.
Gasphase-Zusammensetzung: Je höher der O₂-Anteil in der Zuluft, desto höher der O₂-Partialdruck und damit die Sättigungskonzentration.
Eine kurzfristige Erhöhung der Rührerdrehzahl in einer Fermentation, während die Begasung konstant bleibt, hat spezifische Auswirkungen auf den Sauerstoffpartialdruck (pO₂) in der Flüssigphase und den Sauerstoffgehalt im Abgas (yO₂):
• Auswirkung auf den Sauerstoffpartialdruck (pO₂) in der Flüssigphase:
◦ Eine schlagartige Erhöhung der Rührerdrehzahl führt zu einer Erhöhung des volumetrischen Sauerstofftransferkoeffizienten (kLa) und der Sauerstofftransferrate (OTR).
◦ Dies bewirkt einen Anstieg des Sauerstoffpartialdrucks (pO₂) in der Flüssigkeit. Die Brühe wird quasi mit Sauerstoff „aufgeladen“.
◦ Nachdem ein neues Gleichgewicht erreicht wurde, bleibt der pO₂ auf einem höheren konstanten Niveau. Ein Beispiel zeigt, wie der pO₂ von 14 % bei langsamer Rührung auf 60 % ansteigen kann, wenn die Rührerdrehzahl erhöht wird.
• Auswirkung auf den Sauerstoffgehalt im Abgas (yO₂):
◦ Bei einer Erhöhung der Rührerdrehzahl kommt es zu einem kurzzeitigen Absinken des Sauerstoffanteils im Abgas (yO₂).
◦ Dies ist darauf zurückzuführen, dass der Sauerstoff stattdessen in die Flüssigphase übergeht, um dort den pO₂ zu erhöhen.
◦ Die Änderungen im Abgas sind dabei extrem gering, was eine sehr genaue Abgasanalyse erfordert.
Diese Methode der kurzfristigen Drehzahländerung wird genutzt, um die Sauerstofflöslichkeit des Fermentationsmediums zu bestimmen, wobei angenommen wird, dass sich die biologische Aktivität (Sauerstoffaufnahmerate) während des Shifts nicht ändert.
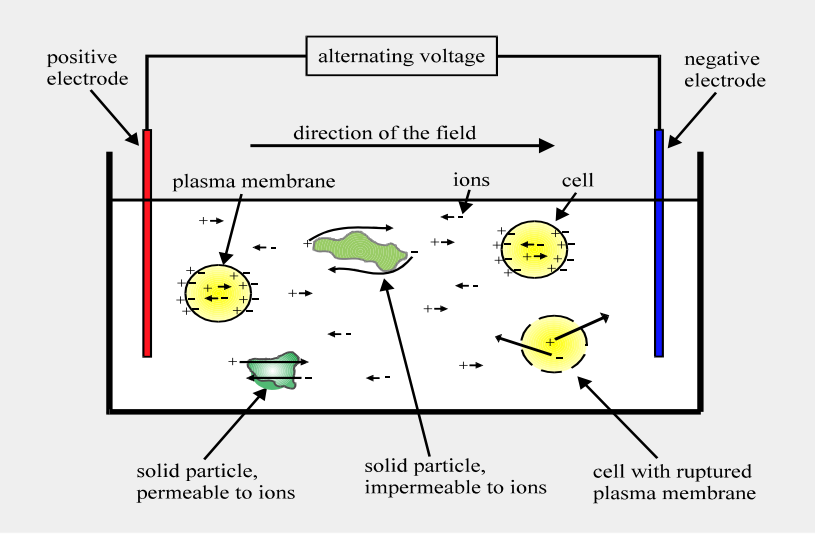
Erläutern Sie, die kapazitive Messmethode zur Biomassebestimmung anhand einer Skizze und welche physikalische Eigenschaft der Zellen eine Messung ermöglicht.
Die kapazitive Messmethode zur Biomassebestimmung beruht auf der dielektrischen Eigenschaft von Zellen, insbesondere ihrer Zellmembranen, die es ihnen ermöglicht, als Kondensatoren in einem elektrischen Feld zu wirken.
Prinzip der kapazitiven Messung:
1. Zellen als Kondensatoren: Die isolierenden Zellmembranen (Lipiddoppelschichten) bilden elektronische Kondensatoren auf beiden Seiten der Zelle. Wenn ein elektrisches Feld angelegt wird, werden die beweglichen Ionen innerhalb und außerhalb der Zelle beeinflusst, was zu einer Ladungstrennung führt und die Zellen als Dipole polarisiert. Dadurch wirken die Zellen selbst wie zusätzliche Kondensatoren.
2. Messung der Kapazität: Die Kapazität (C) eines Kondensators ist von dessen Geometrie und dem Abstand der Elektroden abhängig (C = Q/U, wobei Q die Ladungsmenge und U die Spannung ist). In der kapazitiven Biomassemessung wird eine Wechselspannung bei niedrigen Frequenzen (0,2 bis 10 MHz) angelegt. Mit steigender Zellzahl (Biomasse) erhöht sich die Gesamt-Kapazität des Systems, da die Zellen wie parallel geschaltete Kondensatoren wirken (Cgesamt = C1 + C2 + C3 + ...).
3. β-Dispersion: Mit steigender Frequenz fällt die gemessene Kapazität ab. Dies wird als β-Dispersion bezeichnet. Die Größe dieses Kapazitätsabfalls (∆C) wird zur Quantifizierung der Biomasse verwendet. Eine Kapazität bei sehr hohen Frequenzen (C∞) korrespondiert mit der Hintergrundkapazität des Wassers im Medium. Um C∞ zu eliminieren, wird typischerweise bei einer niedrigen (f-low) und einer hohen Frequenz (f-high) gemessen.
Physikalische Eigenschaft der Zellen: Die Messung wird durch die isolierenden, dielektrischen Eigenschaften der Zellmembranen ermöglicht. Diese Lipiddoppelschichten sind in der Lage, Ladung zu speichern und sich in einem elektrischen Feld zu polarisieren, wodurch die Zellen selbst als Kondensatoren fungieren. Diese Methode misst hauptsächlich die vitale Biomasse, da nur intakte Zellmembranen diese dielektrischen Eigenschaften aufweisen. Feste Partikel, die keine Zellmembranen besitzen, beeinflussen die Messung in der Regel nicht.
Skizze (Konzept):
Die Biomassesonde besteht typischerweise aus vier Metallelektroden (z.B. aus Platin). Die beiden äußeren Elektroden erzeugen das elektrische Feld, während die beiden inneren Elektroden die Ladungstrennung (und damit die Kapazität) messen. Diese Vier-Elektroden-Anordnung hilft, die Elektrodenpolarisation zu reduzieren.
Anregung (AC-Spannung) Messung (Kapazität)
+--------------------+ +--------------------+
| | | |
(+) | Äußere Elektrode | | Innere Elektrode | (-)
| +----------+----------+ |
| | | | |
| | Zelle(n) als Kondensator(en) | |
| | | | |
(-) | Äußere Elektrode | | Innere Elektrode | (+)
| | | |
+--------------------+ +--------------------+
Elektrisches Feld Messfeld
Erläutern Sie, den Einfluss der Zellmorphologie und -konzentration auf die Kapazität.
Einfluss der Zellmorphologie
Größe der Zellen:
Größere Zellen besitzen eine größere Membranfläche → stärkerer Beitrag zur gemessenen Kapazität.
Form der Zellen:
Kugelige Hefezellen erzeugen ein anderes Polarisationsverhalten als längliche oder filamentöse Bakterien/Pilze.
Filamentöse Mikroorganismen (Myzel, Hyphen) können das elektrische Feld anders durchdringen → Signal ist weniger proportional zur Biomasse und schwerer zu kalibrieren.
Zellaggregation (Pellets, Cluster):
Verminderte effektive Oberfläche, inhomogene Feldverteilung → Messsignal kann verfälscht oder unterschätzt sein.
Einfluss der Zellkonzentration
Niedrige Konzentration:
Kapazität steigt linear mit der Zellzahl → gute Korrelation zwischen Signal und Biomasse.
Hohe Konzentration:
Zellen stören sich gegenseitig im elektrischen Feld („shielding effect“).
Ab einem gewissen Punkt tritt eine Sättigung des Signals auf: die Kapazität steigt nicht mehr proportional zur Biomasse.
Sehr hohe Dichten (Hochzelldichte-Kulturen):
Erhöhte Leitfähigkeit des Mediums + Polarisationsüberlagerungen → Messsignal kann verfälscht werden.
Einfluss der Zellkonzentration
• Erhöhung der Gesamtkapazität: Wenn ein elektrisches Feld angelegt wird, wirken die Zellen als Dipole, werden polarisiert und fungieren als zusätzliche Kondensatoren. Mit steigender Zellzahl (Biomasse) erhöht sich die Gesamt-Kapazität des Systems, da die Zellen wie parallel geschaltete Kondensatoren wirken (Cgesamt = C1 + C2 + C3 + ...).
• Anwendbarkeit bei hohen Konzentrationen: Die Methode ist besonders gut für die Bestimmung von hohen Biomassekonzentrationen geeignet.
Einfluss der Zellmorphologie (Zellgröße und Zellbestandteile)
Die Zellmorphologie, einschließlich Zellgröße und die internen elektrischen Eigenschaften der Zelle, hat einen signifikanten Einfluss auf die gemessene Kapazität:
• Zellgröße (Radius): Das Kapazitätsinkrement (∆C), das für die Biomassequantifizierung verwendet wird, hängt von der Zellkonzentration (N), dem Zellradius (r) und der Kapazität pro Einheits-Membranfläche (Cm) ab, gemäß der Beziehung ∆C ~ N ∙ r^4 ∙ Cm. Dies bedeutet, dass größere Zellen pro Einzelzelle eine deutlich höhere Kapazität beitragen. Die Kapazität hängt auch vom "äquivalenten Zellradius" ab.
• Leitfähigkeit des Zytoplasmas und Membraleigenschaften: Die elektrischen Eigenschaften der Plasmamembran sowie die Leitfähigkeit des Zytoplasmas beeinflussen die charakteristische Frequenz (fc), bei der der Kapazitätsabfall (β-Dispersion) auftritt.
◦ Beispielsweise haben grampositive Bakterien aufgrund ihres hohen Kaliumgehalts eine hohe zytoplasmatische Leitfähigkeit, was zu höheren fc-Werten führt.
◦ Bei konstanter Mediums-Leitfähigkeit steigt fc mit sinkendem Zellradius.
• Organismusspezifische Kalibrierung: Da sich die Zellmorphologie (und damit die Beziehung zwischen Kapazität und Biomasse) zwischen verschiedenen Organismen unterscheidet, muss die Messung organismusspezifisch kalibriert werden. Es kann vorkommen, dass bei gleicher Zellzahl die Kapazität bei Hefe größer ist, während bei gleicher Biomassekonzentration (Masse) die Kapazität bei Bakterien größer sein kann.
• Annahme der Zellgröße: Für eine genaue Biomassebestimmung mit dieser Methode wird angenommen, dass sich die Zellgröße während der Fermentation nicht ändert. Falls dies doch der Fall ist, kann der Effekt bei gut charakterisierten Prozessen über die Kalibrierung berücksichtigt werden.
• Intrazelluläre Produkte: Die kapazitive Messung ist unabhängig von intrazellulären Produkten (z.B. Öl), die in der Zelle akkumuliert werden und typische Biomassemessungen (wie optische Dichte oder Biotrockenmasse) stören können. Dies ermöglicht eine genaue Biomassemessung auch in solchen Fällen.
Skizzieren Sie ein 2D Fluoreszenzspektrum und zeichnen Sie jeweiligen sichtbaren Bereiche ein (mit Fluorophoren; notieren Sie auch die Wellenlängenkombinationen).

Erläutern Sie, das Prinzip der Fringssonde anhand einer Skizze. Wie verhalten sich Widerstand und Leitfähigkeit zueinander.
Die Frings-Sonde ist ein Inline-Messinstrument, das zur Detektion von Alkoholen wie Ethanol und Methanol sowie anderen volatilen Substanzen in Fermentationsprozessen eingesetzt wird.
Prinzip der Frings-Sonde (mit konzeptioneller Skizze)
Stellen Sie sich die Sonde als ein zylindrisches Gehäuse vor, das in die Messlösung (Fermentationsbrühe) eintaucht.
Konzeptioneller Aufbau:
• Messlösung: Die äußere Umgebung der Sonde, in der sich die zu messenden Alkohole befinden.
• Membran: An der Spitze der Sonde befindet sich eine spezielle Silikonmembran (oft auf einem Teflonträger und mit Membranschutz), die gaspermeabel ist und die zu messenden Substanzen selektiv durchlässt, während sie die Flüssigkeit zurückhält.
• Messkammer/Gasführung: Hinter der Membran befindet sich eine kleine Kammer, die kontinuierlich von einem Trägergas (Sauerstoff) durchströmt wird. Hierhin diffundieren die Alkohole durch die Membran.
• Halbleiter-Gassensor: Innerhalb dieser Messkammer befindet sich der zentrale Sensor, typischerweise aus Zinnoxid (SnO2) oder Zinkoxid (ZnO). Dieser Sensor ist ein Halbleitergassensor und arbeitet bei hohen Betriebstemperaturen von 200 bis 600 °C, die notwendig sind, um Elektronen ins Leitungsband des Halbleiters zu überführen.
• Kabel/Anschlüsse: Die Sonde verfügt über Anschlüsse für das Trägergas sowie elektrische Kabel zur Messung des Sensorsignals.
Funktionsprinzip:
1. Zustand ohne Analyt (nur Trägergas): Das Trägergas (Sauerstoff) strömt über die Oberfläche des SnO2-Sensors. Sauerstoff-Moleküle adsorbieren an der SnO2-Oberfläche und nehmen dabei Elektronen aus dem Leitungsband des Halbleiters auf. Dies führt zu einem stabilen (hohen) elektrischen Widerstand des Sensors, nachdem sich ein initialer Aufheiz- und Stabilisierungszustand eingestellt hat.
2. Zustand mit Analyt (Ethanol): Wenn reduzierende Gase, wie Ethanol, durch die Membran in die Messkammer diffundieren, adsorbieren auch sie an der SnO2-Oberfläche. Dort reagiert das Ethanol mit den Sauerstoff-Ionen, die an den Sensor gebunden sind (z.B. C2H5OH + 6 O- → 2 CO2 + 3 H2O + 6 e-). Bei dieser Reaktion werden Elektronen freigesetzt, die in das Leitungsband des Halbleiters zurückkehren.
Verhalten von Widerstand und Leitfähigkeit
Die Freisetzung von Elektronen in das Leitungsband des Halbleiters führt zu einer Zunahme der elektrischen Leitfähigkeit des Sensors. Gleichzeitig sinkt der elektrische Widerstand des Sensors. Die gemessene Größe ist der Sensorwiderstand, der somit direkt mit der Konzentration des reduzierenden Gases korreliert.
Zusammenfassend lässt sich sagen, dass Widerstand und Leitfähigkeit zueinander invers proportional sind. Eine Zunahme der Konzentration des Analyten (z.B. Ethanol) führt zu einer chemischen Reaktion auf der Sensoroberfläche, die Elektronen freisetzt. Dies erhöht die Leitfähigkeit und verringert den Widerstand des Halbleiters, was als Messsignal erfasst wird.
Vor- und Nachteile
• Vorteile: Die Sonde ist vergleichsweise kostengünstig, weist geringe Ansprechzeiten auf, kann einen breiten Bereich von Gasen messen und hat eine lange Lebensdauer.
• Nachteile: Sie besitzt eine vergleichsweise geringe Sensitivität und Selektivität (insbesondere SnO2) und ist empfindlich gegenüber Umgebungsänderungen wie der Sauerstoffkonzentration.

Erläutern Sie, warum Online Mikroskopie wichtig ist im Vergleich zur Offline Mikroskopie. Gibt es mögliche Limitationen in der Online Mikroskopie?
Online-Mikroskopie bietet im Vergleich zur Offline-Mikroskopie erhebliche Vorteile, weist jedoch auch bestimmte Limitationen auf.
Bedeutung der Online-Mikroskopie im Vergleich zur Offline-Mikroskopie
Die traditionelle Offline-Mikroskopie erfordert eine Probenahme aus dem System. Dies bringt mehrere Nachteile mit sich:
• Zeitliche Verzögerung: Die Information über den Prozess ist nicht in Echtzeit verfügbar.
• Probenveränderung: Die Entnahme der Probe kann zu Veränderungen im Messwert führen.
• Manueller Aufwand: Die Probenahme und manuelle Analyse ist arbeitsintensiv.
• Diskontinuierliche Überwachung: Es sind nur Momentaufnahmen des Prozesses möglich.
Die Online-Mikroskopie hingegen überwindet diese Nachteile und bietet entscheidende Vorteile für die Bioprozessentwicklung:
• Echtzeit-Einblicke in biologische Prozesse: Sie ermöglicht eine kontinuierliche Beobachtung von Zellen während der Kultivierung. Dies erlaubt die frühzeitige Erkennung von Morphologie-Änderungen, Aggregation oder Kontaminationen.
• Verbessertes Prozessverständnis und -kontrolle: Durch die Online-Messung können Zusammenhänge zwischen Zellmorphologie und Prozessparametern wie pH-Wert, gelöstem Sauerstoff (DO) oder Substratkonzentration hergestellt werden. Dies ermöglicht die Ableitung von Steuerstrategien basierend auf mikroskopischen Daten.
• Höhere Datenqualität und bessere Entscheidungen: Eine höhere zeitliche Auflösung führt zu präziseren Modellen und Vorhersagen. Kritische Zeitpunkte im Zellwachstum oder der Produktbildung können so besser erkannt werden.
Mögliche Limitationen in der Online-Mikroskopie
Trotz ihrer Vorteile ist die Online-Mikroskopie mit verschiedenen Herausforderungen und Limitationen verbunden:
• Herausforderung der Bildqualität: Eine zentrale Schwierigkeit ist die Erzeugung scharfer Bilder der Partikel/Zellen ohne Bewegungsunschärfe. Dies ist besonders bei strömenden Flüssigkeiten relevant. Die zwei Hauptprinzipien zur Bewältigung sind der Probeneinschluss (mechanisch beruhigte Probe) oder die Nutzung kurzer Blitzbeleuchtung (Prinzip der Schärfentiefe).
• Komplexität der Bildauswertung: Insbesondere beim Prinzip der Schärfentiefe ist die Auswertung der Bilder komplexer, da Informationen aus unterschiedlichen Ebenen und mit unterschiedlicher Unschärfe vorliegen. Untrainierte Deep Neural Networks (DNNs), die zur automatischen Bildanalyse eingesetzt werden, können zu verfälschten Größenverteilungen führen, indem sie Zellen erkennen, wo keine sind. Bei komplexen Morphologien, wie filamentösen Organismen, können untrainierte DNNs auch nicht hinreichend genau sein (z.B. durch Überlagerung oder Fehlerkennung von Pellets).
• Einfluss auf die Kultur und Sterilität: Obwohl das Prinzip der Schärfentiefe einen geringeren Einfluss auf die Kultur hat, sind bei der Inline-Messung Sonden direkt im Reaktor verbaut. Bei Online-Messungen erfolgt die Analyse oft in einem Bypass, der nicht immer vollständig sterilisierbar ist.
• Kosten und Implementierungsaufwand: Moderne Online-Mikroskopie-Systeme können teuer sein und erfordern einen gewissen Platzbedarf und Integrationsaufwand.
• Anpassung an die Anwendung: Die Auswahl der Sonde oder des Mikroskops ist abhängig von den spezifischen Anforderungen (z.B. Messbereich, Druck, Temperatur, Auflösung). Die optimale Beleuchtung muss je nach Anwendung angepasst werden, um qualitativ gute Bilder zu erhalten.
Vergleichen Sie die beiden Prinzipien der Online Mikroskopie
In der Online-Mikroskopie gibt es zwei fortgeschrittene Prinzipien, die für die Echtzeit-Überwachung in Bioprozessen zum Einsatz kommen: das Prinzip des Probeneinschlusses und das Prinzip der Schärfentiefe.
Prinzip des Probeneinschlusses
• Grundlagen und Aufbau: Bei diesem Prinzip wird das zu mikroskopierende Volumen mechanisch eingeschlossen und beruhigt. Dies ermöglicht die Aufnahme scharfer Bilder und die Arbeit mit einem definierten Probenvolumen. Der Prototyp eines Inline-Mikroskops mit mechanischem Probeneinschluss verfügt über ein Probenahme- und Beleuchtungssystem in einem äußeren Tubus. Ein innerer Tubus, der die Linse enthält (die nicht hitzestabil ist), kann zum Autoklavieren entfernt werden. Das Medium fließt frei durch eine Lücke zwischen Objektträger und Deckglas. Für die Probenahme wird diese Lücke geschlossen, indem das Beleuchtungssystem zum Deckglas bewegt wird und ein Silikon-Elastomer den Raum abdichtet.
• Funktionsweise: Die Probe wird für die Dauer der Mikroskopie (etwa 2 Sekunden) in einem abgeschlossenen Raum mechanisch eingeschlossen. Dies gewährleistet eine beruhigte Flüssigkeit und ein definiertes Probenvolumen.
• Vorteile: Es liefert klare und scharfe Bilder. Die "fixierte" Probe verhält sich ähnlich wie bei einem "normalen" Mikroskop. Es ermöglicht die Stabilität und den Schutz der Probe.
• Nachteile: Es beeinflusst die Kultur.
Prinzip der Schärfentiefe
• Grundlagen und Aufbau: Dieses Prinzip nutzt eine sehr kurze Blitzbeleuchtung, um eine Abfolge von Standbildern zu erzeugen, wodurch Bewegungsunschärfe vermieden wird. Ein entscheidendes Merkmal ist die unterschiedlich starke Abbildungs-Unschärfe je nach Abstand des Objekts zum Objektiv. Eine unscharfe Zelle erscheint beispielsweise größer und verschwommener und hat tendenziell einen geringeren Kontrast als eine scharfe Zelle. Die Fermentationsbrühe fließt kontinuierlich durch einen kleinen Spalt zwischen Belichtungsleiter und Quarzglas.
• Auswertung: Die Unschärfe eines Partikels ist eine Funktion seines Abstands von der Position der scharfen Bildfokussierung. Für die quantitative Auswertung wird eine Obergrenze für die Ausprägung der Unschärfe in den Bildern festgelegt (definiert, wie scharf eine Zelle sein muss, um gezählt zu werden). Die virtuelle Festlegung des Probenvolumens durch die Bildverarbeitung ermöglicht quantitative Messungen ohne mechanische Abgrenzung des Probenvolumens. Die Beleuchtung muss je nach Anwendung angepasst werden, um qualitativ gute Bilder zu erhalten.
• Vorteile: Es hat einen geringeren Einfluss auf die Kultur. Es erlaubt eine Echtzeitanalyse, da die Probe dynamisch ist.
• Nachteile: Die Auswertung der Bilder ist komplexer, da Informationen aus unterschiedlichen Ebenen und mit unterschiedlicher Unschärfe vorliegen. Untrainierte Deep Neural Networks (DNNs) können zu verfälschten Größenverteilungen führen, indem sie Zellen erkennen, wo keine sind. Bei filamentösen Organismen können untrainierte DNNs auch nicht hinreichend genau sein, beispielsweise durch Überlagerung oder Fehlerkennung von Pellets.
Vergleich der Prinzipien
Merkmal | Prinzip des Probeneinschlusses | Prinzip der Schärfentiefe |
Bildqualität | Klare und scharfe Bilder, da die Probe mechanisch beruhigt wird. | Informationen aus unterschiedlichen Ebenen führen zu Unschärfe. |
Probenhandhabung | Mechanischer Einschluss der Probe in einem definierten Volumen. | Kontinuierlicher Fluss der Fermentationsbrühe durch einen Spalt. |
Beleuchtung | System ist in einem äußeren Tubus verbaut. | Kurze Blitzbeleuchtung zur Vermeidung von Bewegungsunschärfe. |
Einfluss auf Kultur | Die Methode hat einen Einfluss auf die Kultur. | Hat einen geringeren Einfluss auf die Kultur. |
Bildauswertung | Einfacher, da die Probe "fixiert" ist. | Komplexer aufgrund unterschiedlicher Unschärfen und Ebenen. |
Anwendungsbereich | Ermöglicht "fixierte" Proben ähnlich dem normalen Mikroskop. | Besser geeignet für die Echtzeitanalyse von dynamischen Proben. |
DNN-Genauigkeit | Nicht direkt erwähnt, aber die klare Bildgebung legt höhere Genauigkeit nahe. | Untrainierte DNNs können verfälschte Ergebnisse liefern und sind bei komplexen Morphologien möglicherweise nicht genau genug. |
Erläutern Sie, die Unterschiede der beiden Bilanzierungsmethoden anhand von Skizzen.
Die Online-Kalorimetrie ist eine Methode zur Prozessüberwachung in Fermentationsprozessen, die die Messung der metabolischen Wärmeproduktion ermöglicht. Im Bereich der Reaktorkalorimetrie gibt es zwei Hauptmethoden zur Bilanzierung der Wärme, die sich in ihren Prinzipien und Anwendungen unterscheiden: die Bilanzierung über die Wärmekapazität des Kühlwassers und die Bilanzierung mittels Wärmedurchgang.
Beide Methoden zielen darauf ab, die biologische Wärmeleistung (Qbio) zu bestimmen, die eine direkte Kopplung mit dem Stoffwechsel erlaubt und somit schnelle Informationen liefert. Ein Reaktorkalorimeter ist jedoch ein thermodynamisch komplexes System mit zahlreichen Wärmequellen und -senken, die erfasst, berechnet oder vernachlässigt werden müssen. Dazu gehören der Leistungseintrag durch den Rührer (P), Evaporation (QEvap), Wärmeverlust an die Umgebung (QVerlust) und Lösungsenthalpien (z.B. durch pH-Anpassung oder Feedzugabe).
Da ich keine Skizzen zeichnen kann, werde ich die relevanten Aufbauten und Elemente beschreiben, die in einer Skizze dargestellt wären.
1. Bilanzierung über die Wärmekapazität des Kühlwassers
Prinzip und Aufbau: Dieses Verfahren beruht auf der Messung der Wärme, die durch das Kühlwasser abgeführt wird. Der Wärmeabfluss wird direkt über die Temperaturdifferenz des Kühlwassers am Ein- und Ausgang des Kühlmantels sowie dessen Massenstrom bestimmt.
Skizzenbeschreibung: Stellen Sie sich einen Fermenter mit einem umgebenden Kühlmantel vor.
• Ein Kühlwasserzulauf führt das Kühlwasser in den Kühlmantel ein. Diese Leitung ist mit Tj,in (Temperatur am Kühlmanteleingang) gekennzeichnet.
• Das Kühlwasser strömt durch den Kühlmantel, nimmt dabei Wärme auf und verlässt den Mantel über einen Rücklauf, gekennzeichnet mit Tj,aus (Temperatur am Kühlmantelausgang).
• Ein Messgerät, typischerweise ein Durchflusssensor, misst den Massenstrom (𝑚̇) des Kühlwassers.
• Temperatursensoren sind am Kühlwasserzulauf und am Rücklauf angebracht, um Tj,in und Tj,aus zu erfassen.
Formel: Die Wärmeleistung (𝑞̇) wird wie folgt berechnet: 𝑞̇ = (𝑚̇ ∙ 𝑐𝑝 ∙ (𝑇𝑗,𝑎𝑢𝑠 − 𝑇𝑗,𝑖𝑛)) / 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟
Erläuterung der Variablen:
• 𝑞̇: Die übertragene Wärmeleistung [W/m³]
• 𝑚̇: Massenstrom des Kühlwassers [kg/h]
• 𝑐𝑝: Wärmekapazität des Kühlwassers [J/(kg·K)]
• 𝑇𝑗,𝑎𝑢𝑠: Temperatur am Kühlmantelausgang [K]
• 𝑇𝑗,𝑖𝑛: Temperatur am Kühlmanteleingang [K]
• 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟: Reaktorvolumen [m³]
Anwendung und Limitationen:
• Entscheidend ist die Temperaturdifferenz (𝑇𝑎𝑢𝑠 − 𝑇𝑒𝑖𝑛) zwischen Ein- und Ausgang des Kühlwassers. Eine genaue Messung dieser kleinen Differenz ist kritisch.
• Der Massenstrom kann nur in geringem Maße reduziert werden.
• Diese Methode ist besonders einsetzbar bei großer Wärmeproduktion, da hier die Temperaturdifferenz deutlicher ausfällt.
2. Bilanzierung mittels Wärmedurchgang
Prinzip und Aufbau: Diese Methode basiert auf dem Wärmedurchgang durch die Reaktorwand und berücksichtigt den Wärmedurchgangskoeffizienten (U) der Wand sowie die Fläche und die Temperaturdifferenz zwischen Reaktorinhalt und Kühlmantel.
Skizzenbeschreibung: Stellen Sie sich einen Reaktorinnenraum mit einer Temperatur TR (Reaktortemperatur) vor, der von einem Kühlmantel umgeben ist.
• Der Kühlmantel enthält Kühlwasser, dessen mittlere Temperatur als 𝑇𝐽̅ (mittlere Temperatur Kühlwassermantel) angenommen wird.
• Die Wärmeübertragung erfolgt von innen nach außen durch die Reaktorwand. Die Wand selbst hat eine bestimmte Dicke (δ) und Wärmeleitfähigkeit (λ).
• In der Skizze wären Pfeile zu sehen, die den Wärmestrom von TR durch die Reaktorwand zum Kühlwasser im Mantel (TJ) symbolisieren.
• Der Kühlwasserkreislauf im Mantel wird rezirkuliert, und Kühlwasser wird bei Bedarf nachdosiert.
Formel: Die Wärmeleistung (𝑞̇) wird hier berechnet als: 𝑞̇ = (𝑈 ∙ 𝐴 ∙ (𝑇𝑅 − 𝑇𝐽̅)) / 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟
Erläuterung der Variablen:
• 𝑞̇: Die übertragene Wärmeleistung [W/m³]
• 𝑈: Wärmedurchgangskoeffizient [W/(m²·K)]
◦ Dieser Koeffizient berücksichtigt den Wärmeübergang vom Medium zur Innenwand (𝛼𝑖), die Wärmeleitung durch die Innenwand (δ/λi, wobei δ die Wanddicke und λi die Wärmeleitfähigkeit der Wand ist), und den Wärmeübergang von der Innenwand zum Kühlwasser (𝛼𝑎). Die Gesamtformel für U ist 1/𝑈 = 1/𝛼𝑖 + 𝛿/λ𝑖 + 1/𝛼𝑎.
◦ U kann berechnet werden (bei sehr gut bekannten Systemen) oder messtechnisch bestimmt werden (was zusätzlichen apparativen Aufwand erfordert).
• 𝐴: Austauschfläche [m²]
• 𝑇𝑅: Temperatur des Reaktors [K]
• 𝑇𝐽̅: Mittlere Temperatur des Kühlwassermantels [K]
• 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟: Reaktorvolumen [m³]
Anwendung und Limitationen:
• Diese Methode eignet sich auch für Prozesse mit geringerer Wärmeproduktion, da sie auf dem Wärmedurchgang basiert und nicht zwingend auf große Temperaturdifferenzen im Kühlwasser angewiesen ist.
• Die Bestimmung des Wärmedurchgangskoeffizienten U kann komplex sein und erfordert entweder genaue Kenntnisse des Systems oder zusätzliche Messungen.
Vergleich der beiden Bilanzierungsmethoden
Merkmal | Bilanzierung über Wärmekapazität des Kühlwassers | Bilanzierung mittels Wärmedurchgang |
Messprinzip | Misst die Wärmemenge, die vom Kühlwasser aufgenommen wird. | Misst den Wärmestrom durch die Reaktorwand. |
Primäre Messgrößen | Massenstrom und Temperaturdifferenz des Kühlwassers. | Temperaturdifferenz zwischen Reaktor und Kühlmantel, Wärmedurchgangskoeffizient. |
Anwendungsbereich | Gut geeignet für Prozesse mit hoher Wärmeproduktion. | Auch für Prozesse mit geringerer Wärmeproduktion geeignet. |
Kühlwasserführung | Oft hoher Kühlwasserdurchsatz. | Kühlwasser wird rezirkuliert, bei Bedarf nachdosiert. |
Komplexität der Parameter | Direktere Messung des Wärmeabflusses, |
|
Genauigkeit bei kleinen Effekten | Erfordert präzise Temperaturmessung bei kleinen Differenzen. | Potenziell besser für geringe Wärmeabgabe durch direktere Betrachtung des Wärmestroms durch die Wand. |
Beide Methoden liefern wichtige Daten für das Prozessverständnis und die Kontrolle in Bioprozessen, und die Auswahl hängt von den spezifischen Anforderungen und der Ausprägung der Wärmeproduktion im jeweiligen Fermentationsprozess ab
![<p>Die Online-Kalorimetrie ist eine Methode zur Prozessüberwachung in Fermentationsprozessen, die die Messung der metabolischen Wärmeproduktion ermöglicht. Im Bereich der Reaktorkalorimetrie gibt es zwei Hauptmethoden zur Bilanzierung der Wärme, die sich in ihren Prinzipien und Anwendungen unterscheiden: die Bilanzierung über die Wärmekapazität des Kühlwassers und die Bilanzierung mittels Wärmedurchgang.</p><p>Beide Methoden zielen darauf ab, die <strong>biologische Wärmeleistung (Qbio)</strong> zu bestimmen, die eine direkte Kopplung mit dem Stoffwechsel erlaubt und somit schnelle Informationen liefert. Ein Reaktorkalorimeter ist jedoch ein thermodynamisch komplexes System mit zahlreichen Wärmequellen und -senken, die erfasst, berechnet oder vernachlässigt werden müssen. Dazu gehören der Leistungseintrag durch den Rührer (P), Evaporation (QEvap), Wärmeverlust an die Umgebung (QVerlust) und Lösungsenthalpien (z.B. durch pH-Anpassung oder Feedzugabe).</p><p>Da ich keine Skizzen zeichnen kann, werde ich die relevanten Aufbauten und Elemente beschreiben, die in einer Skizze dargestellt wären.</p><p><strong>1. Bilanzierung über die Wärmekapazität des Kühlwassers</strong></p><p><strong>Prinzip und Aufbau:</strong> Dieses Verfahren beruht auf der Messung der Wärme, die durch das <strong>Kühlwasser</strong> abgeführt wird. Der Wärmeabfluss wird direkt über die Temperaturdifferenz des Kühlwassers am Ein- und Ausgang des Kühlmantels sowie dessen Massenstrom bestimmt.</p><p><strong>Skizzenbeschreibung:</strong> Stellen Sie sich einen <strong>Fermenter mit einem umgebenden Kühlmantel</strong> vor.</p><p>• Ein <strong>Kühlwasserzulauf</strong> führt das Kühlwasser in den Kühlmantel ein. Diese Leitung ist mit <code>Tj,in</code> (Temperatur am Kühlmanteleingang) gekennzeichnet.</p><p>• Das Kühlwasser strömt durch den Kühlmantel, nimmt dabei Wärme auf und verlässt den Mantel über einen <strong>Rücklauf</strong>, gekennzeichnet mit <code>Tj,aus</code> (Temperatur am Kühlmantelausgang).</p><p>• Ein Messgerät, typischerweise ein <strong>Durchflusssensor</strong>, misst den <strong>Massenstrom (𝑚̇)</strong> des Kühlwassers.</p><p>• <strong>Temperatursensoren</strong> sind am Kühlwasserzulauf und am Rücklauf angebracht, um <code>Tj,in</code> und <code>Tj,aus</code> zu erfassen.</p><p><strong>Formel:</strong> Die Wärmeleistung (𝑞̇) wird wie folgt berechnet: <code>𝑞̇ = (𝑚̇ ∙ 𝑐𝑝 ∙ (𝑇𝑗,𝑎𝑢𝑠 − 𝑇𝑗,𝑖𝑛)) / 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟</code></p><p><strong>Erläuterung der Variablen:</strong></p><p>• <code>𝑞̇</code>: Die übertragene Wärmeleistung [W/m³]</p><p>• <code>𝑚̇</code>: Massenstrom des Kühlwassers [kg/h]</p><p>• <code>𝑐𝑝</code>: Wärmekapazität des Kühlwassers [J/(kg·K)]</p><p>• <code>𝑇𝑗,𝑎𝑢𝑠</code>: Temperatur am Kühlmantelausgang [K]</p><p>• <code>𝑇𝑗,𝑖𝑛</code>: Temperatur am Kühlmanteleingang [K]</p><p>• <code>𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟</code>: Reaktorvolumen [m³]</p><p><strong>Anwendung und Limitationen:</strong></p><p>• <strong>Entscheidend ist die Temperaturdifferenz (𝑇𝑎𝑢𝑠 − 𝑇𝑒𝑖𝑛)</strong> zwischen Ein- und Ausgang des Kühlwassers. Eine genaue Messung dieser kleinen Differenz ist kritisch.</p><p>• Der Massenstrom kann nur in geringem Maße reduziert werden.</p><p>• Diese Methode ist <strong>besonders einsetzbar bei großer Wärmeproduktion</strong>, da hier die Temperaturdifferenz deutlicher ausfällt.</p><p><strong>2. Bilanzierung mittels Wärmedurchgang</strong></p><p><strong>Prinzip und Aufbau:</strong> Diese Methode basiert auf dem <strong>Wärmedurchgang durch die Reaktorwand</strong> und berücksichtigt den Wärmedurchgangskoeffizienten (U) der Wand sowie die Fläche und die Temperaturdifferenz zwischen Reaktorinhalt und Kühlmantel.</p><p><strong>Skizzenbeschreibung:</strong> Stellen Sie sich einen <strong>Reaktorinnenraum</strong> mit einer Temperatur <code>TR</code> (Reaktortemperatur) vor, der von einem <strong>Kühlmantel</strong> umgeben ist.</p><p>• Der <strong>Kühlmantel</strong> enthält Kühlwasser, dessen mittlere Temperatur als <code>𝑇𝐽̅</code> (mittlere Temperatur Kühlwassermantel) angenommen wird.</p><p>• Die <strong>Wärmeübertragung</strong> erfolgt von innen nach außen durch die Reaktorwand. Die Wand selbst hat eine bestimmte Dicke (<code>δ</code>) und Wärmeleitfähigkeit (<code>λ</code>).</p><p>• In der Skizze wären <strong>Pfeile</strong> zu sehen, die den Wärmestrom von <code>TR</code> durch die Reaktorwand zum Kühlwasser im Mantel (<code>TJ</code>) symbolisieren.</p><p>• Der <strong>Kühlwasserkreislauf</strong> im Mantel wird <strong>rezirkuliert</strong>, und Kühlwasser wird <strong>bei Bedarf nachdosiert</strong>.</p><p><strong>Formel:</strong> Die Wärmeleistung (𝑞̇) wird hier berechnet als: <code>𝑞̇ = (𝑈 ∙ 𝐴 ∙ (𝑇𝑅 − 𝑇𝐽̅)) / 𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟</code></p><p><strong>Erläuterung der Variablen:</strong></p><p>• <code>𝑞̇</code>: Die übertragene Wärmeleistung [W/m³]</p><p>• <code>𝑈</code>: Wärmedurchgangskoeffizient [W/(m²·K)]</p><p> ◦ Dieser Koeffizient berücksichtigt den Wärmeübergang vom Medium zur Innenwand (<code>𝛼𝑖</code>), die Wärmeleitung durch die Innenwand (<code>δ/λi</code>, wobei <code>δ</code> die Wanddicke und <code>λi</code> die Wärmeleitfähigkeit der Wand ist), und den Wärmeübergang von der Innenwand zum Kühlwasser (<code>𝛼𝑎</code>). Die Gesamtformel für U ist <code>1/𝑈 = 1/𝛼𝑖 + 𝛿/λ𝑖 + 1/𝛼𝑎</code>.</p><p> ◦ U kann berechnet werden (bei sehr gut bekannten Systemen) oder messtechnisch bestimmt werden (was zusätzlichen apparativen Aufwand erfordert).</p><p>• <code>𝐴</code>: Austauschfläche [m²]</p><p>• <code>𝑇𝑅</code>: Temperatur des Reaktors [K]</p><p>• <code>𝑇𝐽̅</code>: Mittlere Temperatur des Kühlwassermantels [K]</p><p>• <code>𝑉𝑅𝑒𝑎𝑘𝑡𝑜𝑟</code>: Reaktorvolumen [m³]</p><p><strong>Anwendung und Limitationen:</strong></p><p>• Diese Methode eignet sich auch für <strong>Prozesse mit geringerer Wärmeproduktion</strong>, da sie auf dem Wärmedurchgang basiert und nicht zwingend auf große Temperaturdifferenzen im Kühlwasser angewiesen ist.</p><p>• Die <strong>Bestimmung des Wärmedurchgangskoeffizienten U kann komplex sein</strong> und erfordert entweder genaue Kenntnisse des Systems oder zusätzliche Messungen.</p><p><strong>Vergleich der beiden Bilanzierungsmethoden</strong></p><table style="min-width: 75px;"><colgroup><col style="min-width: 25px;"><col style="min-width: 25px;"><col style="min-width: 25px;"></colgroup><tbody><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Merkmal</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Bilanzierung über Wärmekapazität des Kühlwassers</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Bilanzierung mittels Wärmedurchgang</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Messprinzip</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Misst die Wärmemenge, die vom Kühlwasser aufgenommen wird.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Misst den Wärmestrom durch die Reaktorwand.</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Primäre Messgrößen</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Massenstrom und Temperaturdifferenz des Kühlwassers.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Temperaturdifferenz zwischen Reaktor und Kühlmantel, Wärmedurchgangskoeffizient.</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Anwendungsbereich</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Gut geeignet für Prozesse mit <strong>hoher Wärmeproduktion</strong>.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Auch für Prozesse mit <strong>geringerer Wärmeproduktion</strong> geeignet.</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Kühlwasserführung</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Oft hoher Kühlwasserdurchsatz.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Kühlwasser wird rezirkuliert, bei Bedarf nachdosiert.</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Komplexität der Parameter</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Direktere Messung des Wärmeabflusses, <code>cp</code> ist bekannt.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><code>U</code> muss bekannt oder bestimmt werden, was komplex sein kann.</p></td></tr><tr><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p><strong>Genauigkeit bei kleinen Effekten</strong></p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Erfordert präzise Temperaturmessung bei kleinen Differenzen.</p></td><td colspan="1" rowspan="1" style="border-block: 1px solid rgb(232, 234, 237); border-inline: 1px solid rgb(232, 234, 237); border-spacing: 0px; padding-block: 0.25rem; padding-inline: 0.25rem;"><p>Potenziell besser für geringe Wärmeabgabe durch direktere Betrachtung des Wärmestroms durch die Wand.</p></td></tr></tbody></table><p>Beide Methoden liefern wichtige Daten für das Prozessverständnis und die Kontrolle in Bioprozessen, und die Auswahl hängt von den spezifischen Anforderungen und der Ausprägung der Wärmeproduktion im jeweiligen Fermentationsprozess ab</p><p></p>](https://knowt-user-attachments.s3.amazonaws.com/81dc03d7-aae8-419b-9b16-15e7eb3e1e10.png)
Erläutern Sie, das RAMOS-Messprinzip. Wie wird der Messzyklus anlagentechnisch umgesetzt?
Das RAMOS-System (Respiration Activity MOnitoring System) dient der Online-Messung von Gastransferraten, insbesondere der Sauerstofftransferrate (OTR) und der Kohlenstoffdioxidtransferrate (CTR), sowie des respiratorischen Quotienten (RQ) in Fermentationsprozessen in Schüttelkolben und Mikrotiterplatten (MTPs). Es ermöglicht detaillierte Aussagen über das metabolische Verhalten der untersuchten Kulturen.
RAMOS-Messprinzip
Das Messprinzip des RAMOS-Systems basiert auf einem alternierenden Zyklus aus Spül- und Messphasen.
1. Spül-Phase (I):
◦ Während dieser Phase wird der Gasraum des Kultivierungsgefäßes (z.B. Schüttelkolben) kontinuierlich mit frischer Luft oder einem anderen Begasungsstrom gespült.
◦ Dies stellt sicher, dass sich die Gaszusammensetzung im Kopfraum des Kolbens dem zugeführten Gas annähert.
2. Mess-Phase (II):
◦ Nach der Spülphase wird der Gasfluss zum Kolben vorübergehend unterbrochen, wodurch der Kolben gasdicht verschlossen wird.
◦ Während dieser Phase wird die Änderung der Sauerstoff- und Kohlenstoffdioxidpartialdrücke (pO2, pCO2) im Kopfraum des Kolbens kontinuierlich mittels integrierter Sensoren gemessen.
◦ Ein elektrochemischer Sauerstoffsensor erfasst die Partialdruckänderung von O2, während ein Differenzdrucksensor die Partialdruckänderung von CO2 misst.
◦ Die Transferraten der Gase werden aus diesen Partialdruckänderungen über die Zeit berechnet.
Berechnung der Transferraten: Die OTR (Oxygen Transfer Rate) und CTR (Carbon Dioxide Transfer Rate) werden anhand der Änderung des Partialdrucks während der Messphase berechnet:
• OTR = (ΔpO2 / Δt) * (VRaum / (R * T * VKultur))
• CTR = (ΔpCO2 / Δt) * (VRaum / (R * T * VKultur))
Wo:
• ΔpO2 / Δt: Änderung des Sauerstoffpartialdrucks pro Zeit
• ΔpCO2 / Δt: Änderung des Kohlenstoffdioxidpartialdrucks pro Zeit
• VRaum: Volumen des Gasraums über der Kultur
• R: Allgemeine Gaskonstante
• T: Temperatur
• VKultur: Volumen der flüssigen Kultur
Diese Formeln erlauben die Erfassung auch extrem geringer Transferraten durch Verlängerung der Messphase. Das System kann mit zusätzlichen Gassensoren (z.B. für Wasserstoff oder Methan) erweitert werden.
Anlagentechnische Umsetzung des Messzyklus
Die anlagentechnische Umsetzung des Messzyklus im RAMOS-System (und ähnlichen TOM-Systemen) erfolgt durch eine intelligente Gasführung und -regelung, die den alternierenden Wechsel zwischen Spül- und Messphase ermöglicht.
Eine schematische Darstellung der anlagentechnischen Umsetzung würde die folgenden Elemente umfassen:
• Schüttelkolben/MTP-Wells: Dies sind die Kultivierungsgefäße, in denen die Fermentation stattfindet. RAMOS-Systeme sind für 8 (oder 16) Schüttelkolben ausgelegt, während µRAMOS für 48-Well-MTPs und µTOM für 96-Well-MTPs entwickelt wurden.
• Gaseinlass (Air): Eine Leitung führt das Begasungsgas (z.B. Luft) in das System ein.
• Gasventile/Schaltmatrix: Ein zentrales Element ist ein automatisches Ventilsystem, das den Gasfluss steuert. Es ermöglicht:
◦ Das Gaszuführen (Spülen) in den Kopfraum der Kolben.
◦ Das Abdichten (Verschließen) des Kopfraums während der Messphase, um die Akkumulation der produzierten Gase (CO2) und den Verbrauch von O2 zu ermöglichen.
◦ Das Umschalten zwischen den einzelnen Kolben, da das System typischerweise mehrere Kolben nacheinander misst (Multiplexing).
• Gassensoren: Direkt im Gasstrom oder im Kopfraum der Kolben sind Sauerstoff- und Kohlenstoffdioxid-Sensoren (z.B. elektrochemische Sensoren oder Differenzdrucksensoren) integriert, um die Partialdruckänderungen zu erfassen.
• Datenverarbeitungseinheit: Die von den Sensoren erfassten Signale werden an eine Steuer- und Auswertungseinheit gesendet. Diese Einheit:
◦ Steuert die Ventilzyklen (Spül- und Messzeiten).
◦ Erfasst und speichert die Rohdaten der Partialdruckänderungen.
◦ Berechnet die OTR, CTR und RQ in Echtzeit anhand der entsprechenden Formeln.
◦ Visualisiert die Daten, um dem Nutzer einen sofortigen Einblick in die metabolische Aktivität der Kulturen zu geben.
Das gesamte System ist so konzipiert, dass es eine nicht-invasive Messung ermöglicht, da keine Proben aus dem Reaktorsystem entnommen werden müssen. Dies minimiert die Beeinflussung der Kultur, insbesondere bei geringen Volumina.
Erläutern Sie, das RAMOS-Messprinzip. Wie wird der Messzyklus anlagentechnisch umgesetzt?
Das RAMOS-System (Respiration Activity MOnitoring System) dient der Online-Messung von Gastransferraten, insbesondere der Sauerstofftransferrate (OTR) und der Kohlenstoffdioxidtransferrate (CTR), sowie des respiratorischen Quotienten (RQ) in Fermentationsprozessen in Schüttelkolben und Mikrotiterplatten (MTPs). Es ermöglicht detaillierte Aussagen über das metabolische Verhalten der untersuchten Kulturen.
RAMOS-Messprinzip
Das Messprinzip des RAMOS-Systems basiert auf einem alternierenden Zyklus aus Spül- und Messphasen.
1. Spül-Phase (I):
◦ Während dieser Phase wird der Gasraum des Kultivierungsgefäßes (z.B. Schüttelkolben) kontinuierlich mit frischer Luft oder einem anderen Begasungsstrom gespült.
◦ Dies stellt sicher, dass sich die Gaszusammensetzung im Kopfraum des Kolbens dem zugeführten Gas annähert.
2. Mess-Phase (II):
◦ Nach der Spülphase wird der Gasfluss zum Kolben vorübergehend unterbrochen, wodurch der Kolben gasdicht verschlossen wird.
◦ Während dieser Phase wird die Änderung der Sauerstoff- und Kohlenstoffdioxidpartialdrücke (pO2, pCO2) im Kopfraum des Kolbens kontinuierlich mittels integrierter Sensoren gemessen.
◦ Ein elektrochemischer Sauerstoffsensor erfasst die Partialdruckänderung von O2, während ein Differenzdrucksensor die Partialdruckänderung von CO2 misst.
◦ Die Transferraten der Gase werden aus diesen Partialdruckänderungen über die Zeit berechnet.
Berechnung der Transferraten: Die OTR (Oxygen Transfer Rate) und CTR (Carbon Dioxide Transfer Rate) werden anhand der Änderung des Partialdrucks während der Messphase berechnet:
• OTR = (ΔpO2 / Δt) * (VRaum / (R * T * VKultur))
• CTR = (ΔpCO2 / Δt) * (VRaum / (R * T * VKultur))
Wo:
• ΔpO2 / Δt: Änderung des Sauerstoffpartialdrucks pro Zeit
• ΔpCO2 / Δt: Änderung des Kohlenstoffdioxidpartialdrucks pro Zeit
• VRaum: Volumen des Gasraums über der Kultur
• R: Allgemeine Gaskonstante
• T: Temperatur
• VKultur: Volumen der flüssigen Kultur
Diese Formeln erlauben die Erfassung auch extrem geringer Transferraten durch Verlängerung der Messphase. Das System kann mit zusätzlichen Gassensoren (z.B. für Wasserstoff oder Methan) erweitert werden.
Anlagentechnische Umsetzung des Messzyklus
Die anlagentechnische Umsetzung des Messzyklus im RAMOS-System (und ähnlichen TOM-Systemen) erfolgt durch eine intelligente Gasführung und -regelung, die den alternierenden Wechsel zwischen Spül- und Messphase ermöglicht.
Eine schematische Darstellung der anlagentechnischen Umsetzung würde die folgenden Elemente umfassen:
• Schüttelkolben/MTP-Wells: Dies sind die Kultivierungsgefäße, in denen die Fermentation stattfindet. RAMOS-Systeme sind für 8 (oder 16) Schüttelkolben ausgelegt, während µRAMOS für 48-Well-MTPs und µTOM für 96-Well-MTPs entwickelt wurden.
• Gaseinlass (Air): Eine Leitung führt das Begasungsgas (z.B. Luft) in das System ein.
• Gasventile/Schaltmatrix: Ein zentrales Element ist ein automatisches Ventilsystem, das den Gasfluss steuert. Es ermöglicht:
◦ Das Gaszuführen (Spülen) in den Kopfraum der Kolben.
◦ Das Abdichten (Verschließen) des Kopfraums während der Messphase, um die Akkumulation der produzierten Gase (CO2) und den Verbrauch von O2 zu ermöglichen.
◦ Das Umschalten zwischen den einzelnen Kolben, da das System typischerweise mehrere Kolben nacheinander misst (Multiplexing).
• Gassensoren: Direkt im Gasstrom oder im Kopfraum der Kolben sind Sauerstoff- und Kohlenstoffdioxid-Sensoren (z.B. elektrochemische Sensoren oder Differenzdrucksensoren) integriert, um die Partialdruckänderungen zu erfassen.
• Datenverarbeitungseinheit: Die von den Sensoren erfassten Signale werden an eine Steuer- und Auswertungseinheit gesendet. Diese Einheit:
◦ Steuert die Ventilzyklen (Spül- und Messzeiten).
◦ Erfasst und speichert die Rohdaten der Partialdruckänderungen.
◦ Berechnet die OTR, CTR und RQ in Echtzeit anhand der entsprechenden Formeln.
◦ Visualisiert die Daten, um dem Nutzer einen sofortigen Einblick in die metabolische Aktivität der Kulturen zu geben.
Das gesamte System ist so konzipiert, dass es eine nicht-invasive Messung ermöglicht, da keine Proben aus dem Reaktorsystem entnommen werden müssen. Dies minimiert die Beeinflussung der Kultur, insbesondere bei geringen Volumina.
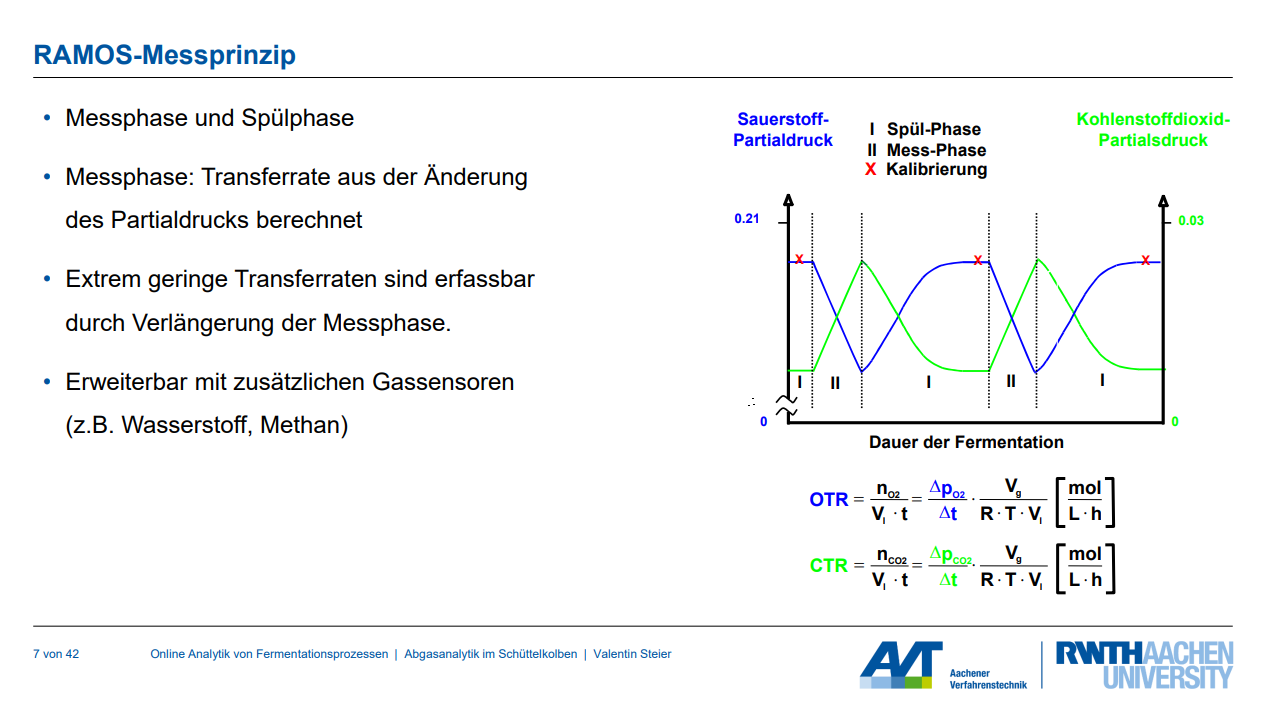
Hauptbestandteile der Einstabmesskette beschriften (10 Lücken, 5
Punkte
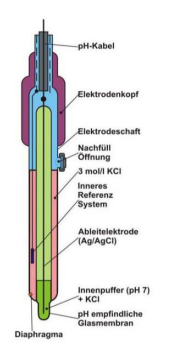
Mit welcher Gleichung lässt sich der Zusammenhang zwischen pH und gemessener
Spannung beschreiben? Gleichungsparameter benennen.
Die NERNST-Gleichung beschreibt das Elektrodenpotential und ist die grundlegende Gleichung für elektrochemische Messungen, einschließlich der pH-Messung:
E = E0 + (R ⋅ T / (n ⋅ F)) ⋅ ln(C1 / C2)
Die Parameter dieser Gleichung sind:
• E: Das Elektrodenpotential.
• E0: Das Standardelektrodenpotential, das vom jeweiligen Redox-Paar abhängt.
• R: Die universelle Gaskonstante (8.314 J/K/mol).
• T: Die Temperatur in Kelvin.
• n: Die Anzahl der übertragenen Elektronen.
• F: Die Faraday-Konstante (96485 C/mol).
• C1, C2: Streng genommen beschreiben diese die Aktivitäten von Ionen (nicht die Konzentrationen). Im Kontext der pH-Messung beziehen sie sich auf die Wasserstoffionen-Aktivität.
Die NERNST-Gleichung verdeutlicht die Temperaturabhängigkeit der Messung.
2. Vereinfachte Gleichung für pH-Meter
Für die praktische Anwendung und Kalibrierung von pH-Metern wird eine vereinfachte, lineare Beziehung zwischen der gemessenen Spannung und dem pH-Wert verwendet:
E = EAS - S ⋅ pH
Die Parameter dieser Gleichung sind:
• E: Die gemessene Spannung (Potentialdifferenz).
• EAS: Die Asymmetrie (auch als Asymmetriepotential oder Nullpunktverschiebung bekannt). Dies ist die Spannung, die eine Elektrode in einer Pufferlösung mit einem pH-Wert von 7 (oder einem anderen Referenz-pH-Wert, je nach Kalibrierung) anzeigen würde, wenn sie ideal wäre. Dieses Potential sollte theoretisch konstant sein, muss aber praktisch regelmäßig kalibriert werden.
• S: Die Steilheit (oder Sensitivität) der Elektrode. Sie gibt an, wie stark sich die Spannung pro pH-Einheit ändert. Der theoretische Wert beträgt bei 25°C ca. -59 mV pro pH-Einheit (S ≈ -59 mV/pH). Die Steilheit hängt von der Temperatur ab.
Von welchem Faktor bei einer Fermentation ist der pH-Wert außerdem abhängig?
Der pH-Wert in einer Fermentation ist, neben den bereits erwähnten Parametern der Messgleichung (wie der Temperaturabhängigkeit, die in der NERNST-Gleichung durch T repräsentiert wird), von verschiedenen Faktoren des Fermentationsprozesses abhängig:
• Verbrauch von Substraten: Der pH-Wert kann sich durch den Verbrauch der im Medium vorhandenen Substrate ändern.
• Bildung von Produkten und Metaboliten: Die während der Fermentation gebildeten Produkte oder Metaboliten können den pH-Wert der Kultur beeinflussen. Beispielsweise führt die Bildung von Acetat als Overflow-Metabolit zu einem Absinken des pH-Wertes. Wenn das Acetat später verstoffwechselt wird, steigt der pH-Wert der Kultur wieder an.
• Wachstumsrate des Organismus: Eine Änderung der Wachstumsrate korreliert mit einer Änderung des pH-Verlaufs.
• Medienzusammensetzung: In Komplexmedien können charakteristische pH-Verläufe beobachtet werden.
• Prozesskontrolle und -regelung: In Fed-Batch-Prozessen ist eine pH-Regelung mittels Zugabe von Lösungen (z.B. über mikrofluidische Kanäle) unerlässlich, was impliziert, dass der pH-Wert ohne solche Maßnahmen variieren würde.
Diese Faktoren sind entscheidend für das Verständnis des metabolischen Zustands und Verhaltens der Kulturen während eines Fermentationsprozesses.
Folgendes: Während der Fermentation geht plötzlich das Voltmeter ihrer pH-
Elektrode kaputt. Sie schließen ein neues an, was müssen sie dabei beachten und
warum?
Rekalibrierung der pH-Elektrode (bzw. des gesamten Messsystems):
◦ Was ist zu beachten? Auch wenn es sich scheinbar nur um das Voltmeter handelt, ist es in modernen pH-Messsystemen so, dass das pH-Meter (das das Voltmeter beinhaltet) die spezifischen Kalibrierungsparameter der angeschlossenen Elektrode nutzt. Daher muss das gesamte Messsystem nach dem Anschluss eines neuen Voltmeters unbedingt neu kalibriert werden.
◦ Warum? Der Zusammenhang zwischen dem gemessenen Potential (Spannung E) und dem pH-Wert wird durch die Gleichung E = EAS - S ⋅ pH beschrieben. Hierbei sind:
▪ EAS (Asymmetrie): Dies ist das Asymmetriepotential, eine idealerweise konstante Spannung, die die Elektrode in einer Pufferlösung mit pH 7 (oder einem anderen Referenz-pH-Wert) anzeigen würde. Dieses Potential ist elektrodenspezifisch und muss praktisch regelmäßig kalibriert werden.
▪ S (Steilheit): Dies ist die Sensitivität der Elektrode, die angibt, um wie viele Millivolt sich die Spannung pro pH-Einheit ändert (theoretisch ca. -59 mV/pH bei 25°C). Die Steilheit hängt von der Temperatur ab.
◦ Diese Parameter (EAS und S) sind elektrodenspezifisch und auch von der Temperatur abhängig. Moderne pH-Meter berechnen den pH-Wert automatisch unter Berücksichtigung dieser Werte. Ein neues Voltmeter (bzw. ein neues pH-Meter) hat diese spezifischen Kalibrierdaten der vorhandenen pH-Elektrode nicht "gespeichert". Daher muss eine erneute Kalibrierung mit Pufferlösungen mit bekanntem pH-Wert durchgeführt werden, um die korrekte Asymmetrie und Steilheit für die Kombination aus Ihrer Elektrode und dem neuen Messgerät zu ermitteln. Ohne Rekalibrierung wären die gemessenen pH-Werte ungenau oder schlicht falsch.
Zusammenfassend ist die Hauptaufgabe beim Austausch des Voltmeters, sicherzustellen, dass das neue Gerät hochohmig ist, und vor allem, das gesamte pH-Messsystem (Elektrode + neues Voltmeter/pH-Meter) neu zu kalibrieren, um weiterhin präzise und zuverlässige pH-Werte zu erhalten.
Skizze zum Stokes-Shift inklusive Achsenbeschriftung (leeres Diagramm gegeben).
Der Stokes-Shift beschreibt die Wellenlängenverschiebung zwischen der Absorption und der Emission von elektromagnetischer Strahlung durch ein Fluorophor. Wenn ein Molekül Licht einer bestimmten Wellenlänge (Anregungslicht) absorbiert, gelangen dessen Valenzelektronen auf höhere Energieniveaus. Bei der Rückkehr in den Grundzustand wird Energie in Form von Fluoreszenzlicht (Emission) freigesetzt. Ein Teil der ursprünglich absorbierten Energie geht dabei durch interne Kollisionen als Wärme verloren. Dies führt dazu, dass die emittierte Strahlung eine längere Wellenlänge und damit geringere Energie aufweist als die absorbierte Strahlung.
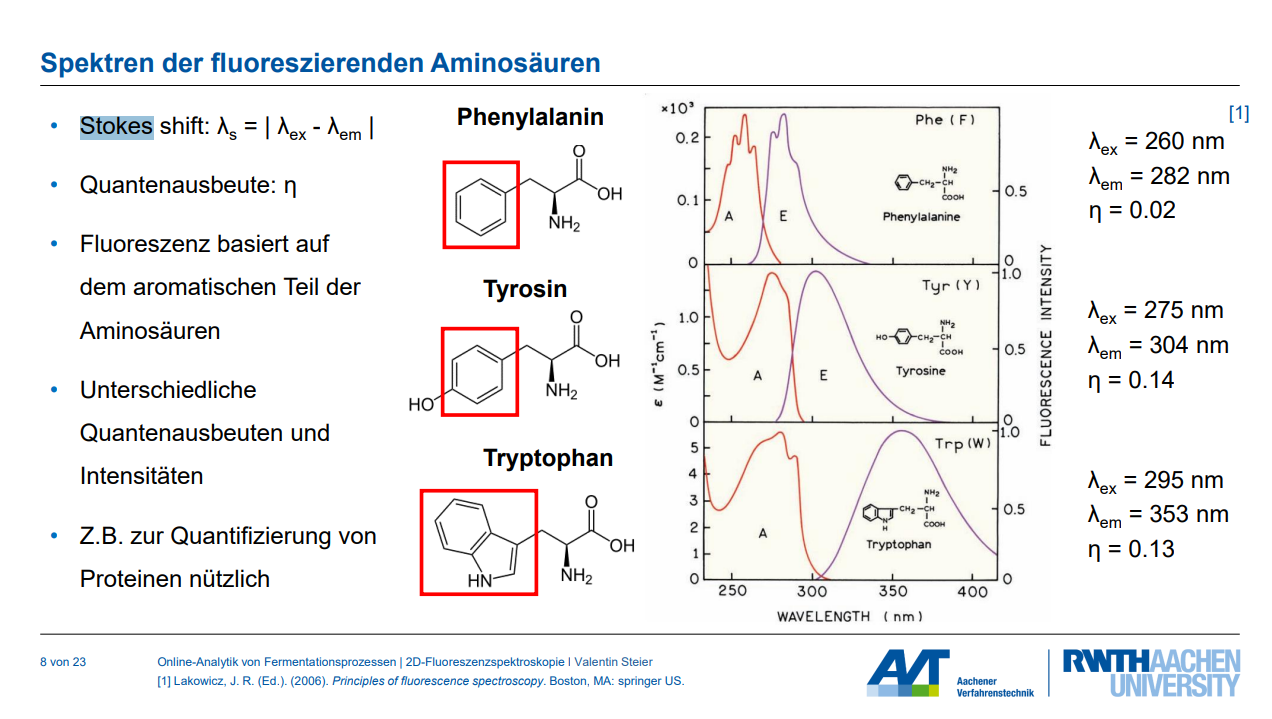
Warum kann die Anregungswellenlänge nicht größer sein als die
Emissionswellenlänge?
Die Anregungswellenlänge kann nicht größer sein als die Emissionswellenlänge aufgrund eines physikalischen Phänomens, das als Stokes-Shift bekannt ist.
Hier sind die Gründe dafür, basierend auf den vorliegenden Quellen und unserer vorherigen Konversation:
• Absorption von Energie: Wenn ein Fluorophor Licht absorbiert (Anregungslicht), werden seine Valenzelektronen auf höhere Energieniveaus angehoben. Dieses Anregungslicht hat eine bestimmte Wellenlänge (Anregungswellenlänge, λex) und somit eine entsprechende Energie.
• Energieverlust durch interne Kollisionen: Bevor das Molekül Licht emittiert, durchläuft es interne Prozesse, bei denen ein Teil der ursprünglich absorbierten Energie als Wärme verloren geht [185, vorherige Konversation]. Dies geschieht durch Übergänge von höheren zu niedrigeren Energieniveaus innerhalb des Anregungszustands mittels interner Kollisionen.
• Geringere Energie der Emission: Da während dieser nicht-strahlenden Desaktivierung Energie verloren geht, ist die Energie des emittierten Fluoreszenzlichts immer geringer als die Energie des absorbierten Lichts [vorherige Konversation].
• Wellenlängenverschiebung: Energie und Wellenlänge sind umgekehrt proportional. Das bedeutet, dass eine niedrigere Energie einer längeren Wellenlänge entspricht. Folglich hat das emittierte Licht (Emissionswellenlänge, λem) eine längere Wellenlänge als das absorbierte Anregungslicht [vorherige Konversation].
Der Stokes-Shift (λs = |λex - λem|) beschreibt genau diese Wellenlängenverschiebung zwischen der Absorption und der Emission, die für jedes Fluorophor charakteristisch ist. Die emittierte Wellenlänge ist also immer länger als die Anregungswellenlänge, weil das Molekül einen Teil der Energie in nicht-strahlenden Prozessen (z.B. als Wärme oder, wie im Fall von Fluoreszenz-Quenching, durch Energieübertragung auf Sauerstoff) dissipiert, bevor es fluoresziert.
Beschreiben sie das Messprinzip der Ratiometrie bei pH-Messung mit
Fluoreszenzfarbstoff und nennen sie 2 Vorteile
Das Messprinzip der Ratiometrie bei der pH-Messung mit Fluoreszenzfarbstoffen basiert auf der Bestimmung des Verhältnisses aus mehreren Fluoreszenzintensitäten.
Dabei wird ein pH-sensitiver Fluoreszenzfarbstoff verwendet, wie zum Beispiel 8-Hydroxy-1,3,6-pyrentrisulfonsäuretrinatriumsalz (HPTS oder Pyranin). Das Prinzip nutzt aus, dass die Fluoreszenzintensität des Farbstoffs von seiner Protonierung und damit vom pH-Wert abhängt. Typischerweise wird das Verhältnis der Emissionsintensitäten bei einer bestimmten Emissionswellenlänge (z.B. 510 nm) bei Anregung mit zwei verschiedenen Anregungswellenlängen (z.B. 410 nm und 460 nm für HPTS) gemessen. Dieses Intensitätsverhältnis korreliert dann mit dem pH-Wert der Probe.
Die ratiometrische pH-Messung bietet folgende Vorteile:
• Geringere Empfindlichkeit gegenüber Störgrößen: Im Vergleich zu Messungen, die nur auf der Intensität basieren, ist die ratiometrische Methode unempfindlicher gegenüber Drifts der Lichtquelle, optischer Justierung, des Photosensors, der Verstärkung sowie der Trübung des Mediums und des Ausbleichens des Farbstoffs. Da ein Verhältnis gebildet wird, werden Intensitätsschwankungen, die alle Wellenlängen gleichermaßen betreffen, weitgehend kompensiert.
• Hohe Präzision: Durch die Nutzung eines Verhältnisses können präzisere und stabilere pH-Werte über einen längeren Zeitraum erzielt werden, da individuelle Schwankungen der Signalintensität minimiert werden.
4) Skizzieren sie Fluoreszenz-Quenching (es war das Schema nur mit 4 leeren Kugeln +
Pfeilen gegeben).
Der Fluoreszenz-Quenching-Effekt beschreibt die Abnahme der Emissionsintensität eines Fluorophors (eines fluoreszierenden Moleküls) in Anwesenheit einer quenchierenden Substanz, wie zum Beispiel Sauerstoff. Ein Teil der ursprünglich vom Fluorophor absorbierten Energie wird dabei auf den Quencher (Sauerstoff) übertragen und geht dadurch als Fluoreszenzsignal verloren. Dieser Effekt ist proportional zum Sauerstoffpartialdruck und wird durch die Stern-Volmer-Gleichung beschrieben.
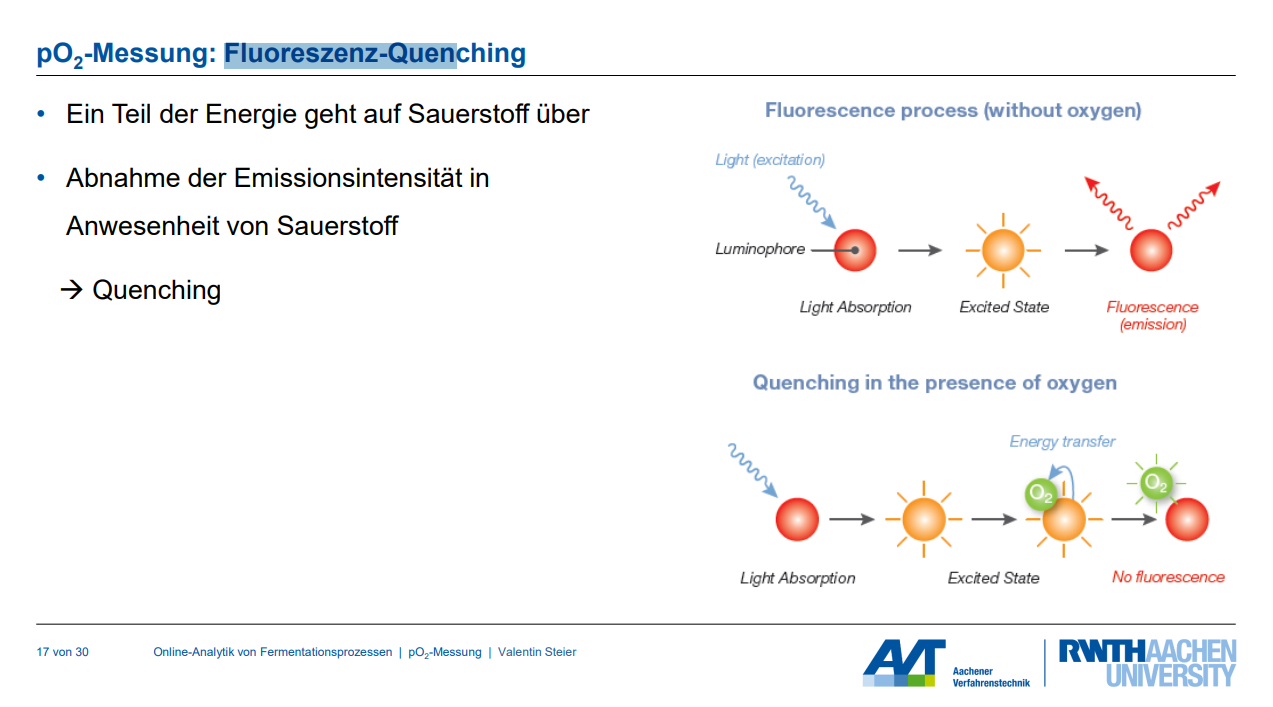
Warum können manche Aminosäuren fluoreszieren. Nenne außerdem ein Beispiel
Manche Aminosäuren können fluoreszieren, weil ihre Fluoreszenz auf dem aromatischen Teil der Aminosäuren basiert. Dies bedeutet, dass die Struktur dieser Aminosäuren ungesättigte funktionelle Gruppen enthält, die ausreichen, um durch Absorption von UV- und sichtbarer Strahlung angeregt zu werden und anschließend Fluoreszenz zu emittieren.
Ein Beispiel für eine Aminosäure, die fluoreszieren kann, ist Tryptophan. Tryptophan hat eine charakteristische Anregungswellenlänge (λex) von 295 nm und eine Emissionswellenlänge (λem) von 353 nm. Die Quantenausbeute (η) von Tryptophan beträgt 0,13.
Weitere fluoreszierende Aminosäuren, die in den Quellen genannt werden, sind Phenylalanin und Tyrosin.
Sie messen die Fluoreszenz von einem Cofaktor und einem Protein. Wo in diesem
Diagramm (war größtenteils leer) würden sie die Absorptionen erwarten. Zusätzlich
erklären sie, was die schraffierte Fläche beschreibt (der scattered light Bereich war
gemeint)
Beschreibung der schraffierten Fläche (Scattered Light Bereich):
Die schraffierte Fläche in einem Fluoreszenzdiagramm, die als "scattered light" oder "Streulichtbereich" bezeichnet wird, beschreibt das Signal, das nicht von der Fluoreszenz des Moleküls herrührt, sondern von Licht, das im Probenmedium gestreut oder rückgestreut wird.
Dies geschieht durch die Wechselwirkung des Anregungslichts mit Partikeln im Medium, die das Licht in verschiedene Richtungen ablenken, anstatt es zu absorbieren und wieder zu emittieren.
Wichtige Merkmale und Implikationen des Streulichts:
• Ursprung des Signals: Gestreutes Licht wird von allen Komponenten verursacht, die Licht streuen können. Dazu gehören insbesondere Zellen (sowohl lebende als auch tote), Medienkomponenten, feste Partikel (z.B. aus komplexen Medien wie Fischmehl) und Gasblasen. Die Größe und Form der Partikel sowie der Messwinkel beeinflussen die Intensität der Streuung.
• Mangelnde Selektivität: Das Streulichtsignal ist nicht selektiv für bestimmte Fluorophore. Es kann daher die eigentlichen Fluoreszenzsignale überlagern und die Interpretation der Messdaten erschweren, da es zu fehlerhaften oder weniger genauen Messungen führen kann.
• Anwendung als Biomasseparameter: Trotz seiner Eigenschaft als Störgröße in der Fluoreszenzmessung wird das Streulichtsignal (insbesondere die Rückstreuung, "Backscatter") häufig und erfolgreich zur Online-Messung der Biomassekonzentration eingesetzt. Dies liegt daran, dass die Intensität des Streulichts proportional zur Zellkonzentration ist.
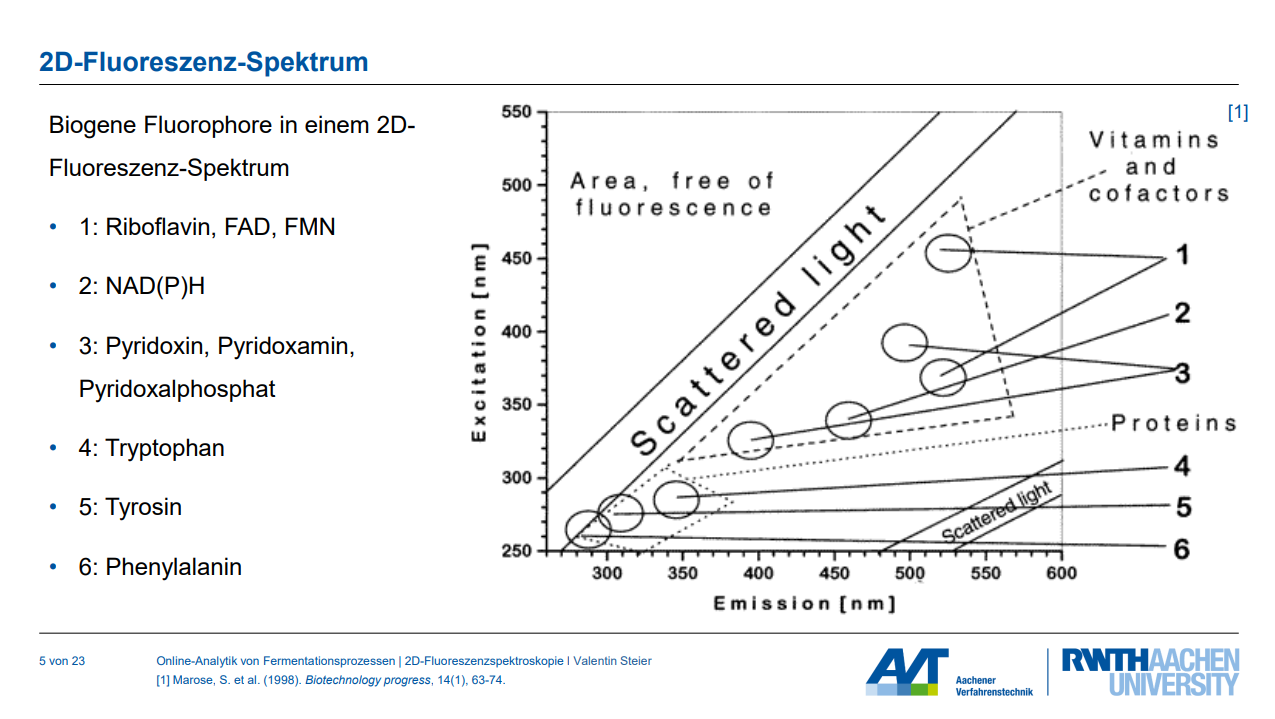
Nennen sie 2 nicht direkt „biologische“ Anwendungen für die Online-Mikroskopie.
Zwei nicht direkt "biologische" Anwendungen für die Online-Mikroskopie sind:
• Mischen und Rühren, insbesondere zur Überwachung von Emulsionen und Dispersionen.
• Kristallisation, zum Beispiel bei der Kühlkristallisation.
Weitere nicht-biologische Anwendungsbeispiele umfassen das Granulieren, Mahlen, die Erkennung von Fremdkörpern, Polymerisation (gewollt oder ungewollt), sowie die Analyse von Schäumen (z.B. Polyurethanen) und die Farbdifferenzierung
2 Auswertungsmethoden der fluoreszenzbasierten Analyse nennen.
. Ratiometrische Messung
◦ Prinzip: Bei dieser Methode wird das Verhältnis aus mehreren Fluoreszenzintensitäten bestimmt. Anstatt nur eine Intensität zu messen, werden typischerweise zwei Fluoreszenzintensitäten bei unterschiedlichen Anregungswellenlängen (aber gleicher Emissionswellenlänge) oder umgekehrt gemessen und ihr Verhältnis gebildet.
◦ Beispiel: Bei der pH-Messung mit dem Farbstoff HPTS (8-Hydroxy-1,3,6-pyrentrisulfonsäuretrinatriumsalz) wird beispielsweise das Intensitätsverhältnis von 410 nm Anregung/510 nm Emission zu 460 nm Anregung/510 nm Emission verwendet.
◦ Vorteile: Diese Methode ist unempfindlicher gegenüber Störgrößen wie Drift der Lichtquelle, Probleme bei der optischen Justierung, Schwankungen des Photosensors und der Verstärkung. Sie ist auch weniger anfällig für Trübung des Mediums und das Ausbleichen (Bleaching) des Farbstoffes.
2. Messung der Abklingzeit (Pulsanregung) oder des Phasenwinkels (Phasenaufgelöste Bestimmung)
◦ Prinzip: Diese Methoden basieren auf dem Fluoreszenz-Quenching, bei dem die Abnahme der Emissionsintensität eines Fluorophors in Anwesenheit einer quenchierenden Substanz (z.B. Sauerstoff) genutzt wird. Die Auswertung erfolgt hier nicht über die absolute Intensität, sondern über zeitabhängige Parameter:
▪ Abklingzeit: Bei der Pulsanregung wird die Lumineszenzabklingzeit (τ) gemessen, die die Dauer beschreibt, bis die Intensität auf 1/e ihres Anfangswertes abgefallen ist. Diese Abklingzeit ändert sich in Abhängigkeit von der Konzentration des Quenchers.
▪ Phasenwinkelverschiebung: Eine weitere phasenaufgelöste Bestimmungsmethode misst die Phasenwinkelverschiebung (Φ) zwischen dem Anregungslicht und dem emittierten Lumineszenzlicht. Mit steigender Quencherkonzentration wird diese Phasenwinkelverschiebung kleiner.
◦ Vorteile: Diese Verfahren sind unabhängig von der Lichtintensität und der Detektorsensitivität. Sie sind besonders sensitiv bei niedrigen Partialdrücken des Quenchers.
Für E. coli und eine Hefe den Zusammenhang zwischen Kapazität und Zellzahl
beziehungsweise Kapazität und Biomassen in 2 Diagramme einzeichnen (nur die
Achsenbeschriftung war gegeben). Warum gibt es einen Unterschied?
Unterschied E. coli und Hefe:
◦ E. coli zeigt eine höhere Kapazität pro Biomassekonzentration im Vergleich zu Hefe. Dies ist das scheinbar widersprüchliche Ergebnis im Vergleich zur Zellzahlbetrachtung, das sich jedoch logisch erklären lässt:
▪ Um die gleiche Biomasse (Masse) zu erreichen, benötigt man eine viel höhere Anzahl ($N$) kleinerer E. coli-Zellen als größerer Hefezellen.
▪ Obwohl die einzelnen E. coli-Zellen einen kleineren Radius $(r)$ haben, führt die erheblich höhere Anzahl an Zellen ($N$) pro Masseeinheit dazu, dass die gesamte Membranfläche und somit die gemessene Gesamtkapazität für E. coli höher ist als für Hefe bei gleicher Biomassekonzentration. Die Kapazität wird maßgeblich von der Anzahl der vorhandenen Zellen und deren Membranen beeinflusst.
(Stellen Sie sich wieder zwei Geraden durch den Ursprung vor. Diesmal hätte die Gerade für E. coli eine steilere Steigung als die für Hefe.)
Warum gibt es einen Unterschied?
Der Hauptgrund für den Unterschied im Zusammenhang zwischen Kapazität und Zellzahl bzw. Kapazität und Biomasse liegt in der Größe der Zellen und der unterschiedlichen Abhängigkeit der Kapazität von Zellzahl versus Zellmasse.
• Zellgröße: Hefezellen sind deutlich größer als E. coli-Zellen.
• Kapazität pro Zelle (abhängig von Zellradius): Die Formel $\Delta C \sim N \cdot r^4 \cdot C_m$ zeigt, dass die Kapazität stark vom Zellradius ($r^4$) abhängt. Daher trägt jede einzelne größere Hefezelle proportional mehr zur Kapazität bei als eine einzelne E. coli-Zelle. Dies erklärt die höhere Kapazität der Hefe bei gleicher Zellzahl.
• Kapazität pro Biomasse (abhängig von Zellzahl und Zellgröße): Wenn man die gleiche Masse an Biomasse betrachtet, sind aufgrund der kleineren Einzelzellgröße viel mehr E. coli-Zellen vorhanden als Hefezellen. Die Kapazitätsmessung reagiert auf die Gesamtheit der isolierenden Membranflächen. Obwohl jede einzelne E. coli-Zelle eine geringere Kapazität aufweist, überwiegt die deutlich höhere Anzahl an Zellen bei gleicher Biomassemasse den Effekt des kleineren Einzelzellradius. Dies führt dazu, dass die Gesamt-Kapazität bei E. coli pro Biomassemasse höher ist als bei Hefe.
Zusammenfassend lässt sich sagen, dass die Zellgröße der bestimmende Faktor für die unterschiedlichen Korrelationen zwischen Kapazität und Zellzahl bzw. Kapazität und Biomassemasse bei E. coli und Hefe ist.
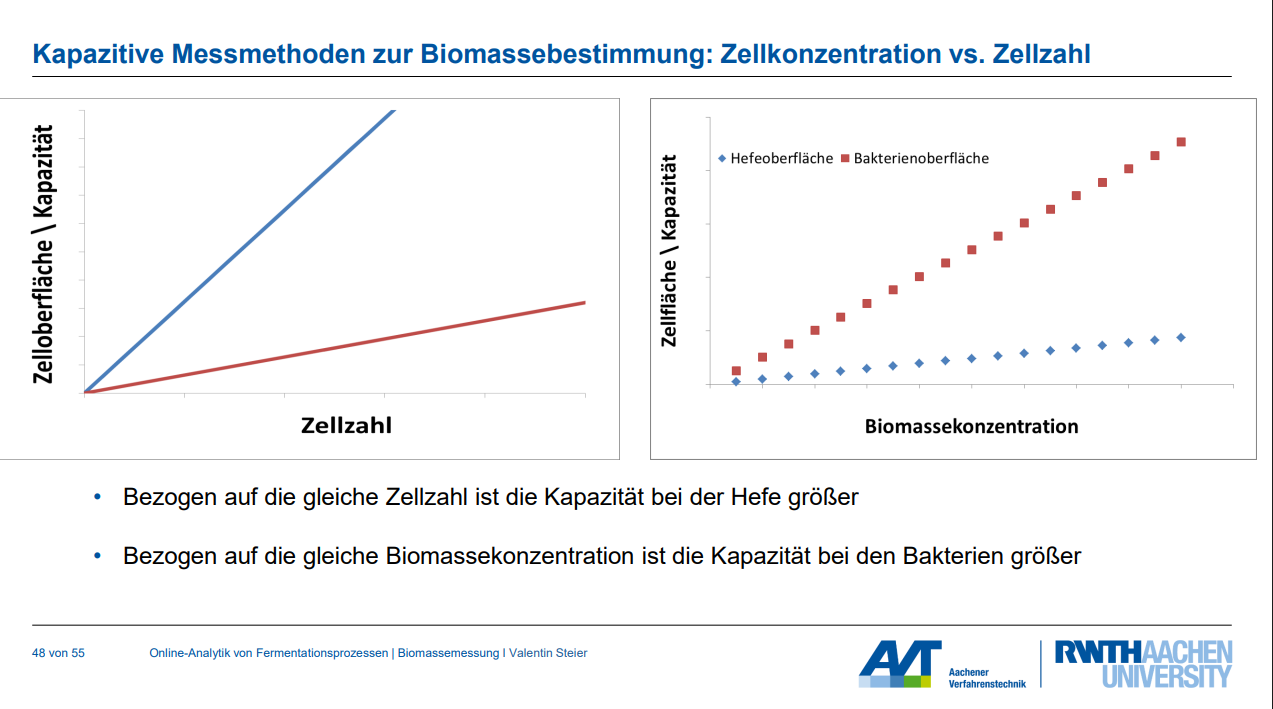
Nenne 2 Vorteile einer kapazitiven Biomassebestimmung gegenüber einer optischen
Methode.
Zwei wesentliche Vorteile einer kapazitiven Biomassebestimmung gegenüber einer optischen Methode sind:
1. Messung ausschließlich vitaler Biomasse: Die kapazitive Messung erfasst ausschließlich vitale (lebende) Biomasse. Dies ist ein entscheidender Vorteil, da optische Methoden wie die optische Dichte (OD) die Gesamtzellzahl messen, ohne zwischen lebenden und toten Zellen zu unterscheiden. Dadurch liefert die kapazitive Methode ein spezifischeres Signal für die metabolisch aktive Biomasse.
2. Unempfindlichkeit gegenüber festen Partikeln im Medium: Feste Partikel wie Medienbestandteile (z.B. Fischmehl) haben meistens keinen Einfluss auf die kapazitive Messung. Optische Methoden, insbesondere die Streulichtmessung, werden hingegen stark von allen Komponenten beeinflusst, die Lichtstreuung verursachen, einschließlich toter Zellen, Medienkomponenten, Feststoffpartikel und Gasblasen. Dies kann zu einer mangelnden Selektivität des Messsignals und somit zu fehlerhaften Biomasseschätzungen führen.
3) Nennen sie 2 optische Methoden für die Bestimmung der Biomassekonzentration.
Warum ist die eine besser als die andere?
1. Durchlichtmessung (Turbidimetrie)
• Messprinzip: Die Durchlichtmessung basiert auf dem Lambert-Beer-Gesetz, das die Absorption von Strahlung durch eine Substanz beschreibt. Ein Photodetektor misst die Intensität des Lichts, das eine Probe durchdringt. Bei zunehmender Biomasse nimmt das am Detektor ankommende Lichtsignal ab.
• Nachteile:
◦ Schnelle Sättigung: Die optische Dichte (OD) Sättigung wird bereits bei geringen Biomassekonzentrationen erreicht. Dies bedeutet, dass die Messung bei höheren Zelldichten keine genaue Korrelation mehr zur tatsächlichen Biomasse aufweist. Dies ist ein erheblicher Nachteil für viele Fermentationsprozesse, bei denen hohe Zelldichten erreicht werden.
◦ Verdünnung nötig: Offline muss die Probe klassischerweise verdünnt werden, um in den linearen Messbereich zu gelangen.
◦ Beeinflussung durch Partikel: Wie die Streulichtmessung misst auch die Durchlichtmessung die Gesamtzellzahl und unterscheidet nicht zwischen lebenden und toten Zellen. Zudem können auch andere Partikel im Medium das Signal beeinflussen.
2. Streulichtmessung (Nephelometrie)
• Messprinzip: Die Streulichtmessung erfasst das Licht, das von den Partikeln in der Probe gestreut wird. Die Streuung hängt von der Größe und Form der Partikel ab. Bei zunehmender Biomasse wird mehr Licht gestreut und trifft auf den Photodetektor. Diese Methode kann in verschiedenen Anordnungen erfolgen, z.B. bei 0°, 90° (Sideward Scatter) oder 180° (Backscatter).
• Vorteile gegenüber der Durchlichtmessung:
◦ Geringere Sättigung: Die Sättigung wird bei der Streulichtmessung nicht so schnell erreicht wie bei der Durchlichtmessung. Dies ermöglicht eine lineare Messung bis zu sehr hohen Biomassekonzentrationen, wie beispielsweise in Mikrotiterplatten (MTPs) beobachtet. Dies ist entscheidend für die Online-Überwachung dichter Kulturen in Fermentationsprozessen.
◦ Unabhängigkeit von Füllvolumen und Meniskus: In MTPs kann die Messung des Streulichts unabhängig vom Füllvolumen und dem Flüssigkeitsmeniskus an der Oberfläche erfolgen.
◦ Keine Unterbrechung der Sauerstoffzufuhr: In einigen Systemen (z.B. MTPs) ist die Messung ohne Unterbrechung des Schüttelns und somit der Sauerstoffzufuhr möglich, was den Prozess weniger beeinträchtigt.
• Nachteile:
◦ Mangelnde Selektivität: Die größte Herausforderung der Streulichtmessung ist ihre mangelnde Selektivität. Sie misst alle Komponenten, die Lichtstreuung verursachen, einschließlich lebender und toter Zellen, Medienkomponenten, fester Partikel und Gasblasen. Dies kann zu Fehlern führen, insbesondere in komplexen Medien, die feste Bestandteile (wie Fischmehl) enthalten, deren Konzentration sich während der Fermentation ändern kann. Auch die Morphologie der Zellen kann das Signal beeinflussen.
Fazit: Warum ist die Streulichtmessung oft besser?
Obwohl die Streulichtmessung unter Selektivitätsproblemen leidet, ist sie für die Online-Bestimmung der Biomassekonzentration in Fermentationsprozessen oft vorteilhafter, weil sie im Gegensatz zur Durchlichtmessung nicht so schnell in die Sättigung geht und somit lineare Messungen über einen viel größeren Bereich an Biomassekonzentrationen ermöglicht. Dies ist besonders wichtig bei Kulturen, die hohe Zelldichten erreichen. Die Fähigkeit, den Prozess kontinuierlich und ohne Verdünnung zu überwachen, überwiegt in vielen Anwendungen die Nachteile der mangelnden Selektivität, insbesondere wenn die Zusammensetzung des Mediums relativ stabil ist oder die Störeinflüsse modelliert werden können.
Was ist das Problem mit Chip-Kalorimetrie bei einer Hochzelldichtefermentation?
Das Hauptproblem der Chip-Kalorimetrie bei einer Hochzelldichtefermentation ist die mögliche Sauerstofflimitierung in der Probenkammer des Chip-Kalorimeters, die durch den Bypass zugeführt wird.
Eine Chip-Kalorimetermessung erfolgt, indem eine Probe aus dem Fermenter in eine Messkammer gepumpt wird. Während dies den Vorteil hat, dass Störgrößen im Reaktor (wie Rührerdrehzahl und Begasung) keinen Einfluss auf die Messung haben, kann der Bypass selbst negative Effekte verursachen, insbesondere die Sauerstofflimitierung.
Bei Hochzelldichtefermentationen ist die metabolische Aktivität der Zellen und somit ihr Sauerstoffbedarf sehr hoch, was auch zu einer hohen Wärmeproduktion führt. Das Beispiel einer E. coli K12 Fermentation zeigt, dass die Probenkammer des Chip-Kalorimeters bei einer volumenspezifischen Wärme von ca. 3,7 kW/m³ sauerstofflimitiert wurde. Dies bedeutet, dass die Zellen in der Messkammer nicht mehr unter den optimalen Bedingungen des Hauptreaktors wachsen oder produzieren können, da der Sauerstoff dort schnell verbraucht wird. Infolgedessen würde die gemessene Wärmeproduktion im Chip-Kalorimeter nicht mehr die tatsächliche metabolische Aktivität der Hochzelldichtekultur widerspiegeln, sondern die Aktivität unter limitierten Bedingungen.
Zusammenfassend kann die hohe metabolische Aktivität von Hochzelldichtekulturen zu einem Sauerstoffmangel in der Bypass-Messkammer des Chip-Kalorimeters führen, was die Genauigkeit der Messung der realen Wärmeproduktion und damit der Stoffwechselaktivität beeinträchtigt.
Ein Chip-Kalorimeter soll mit einem Bypass verwendet werden. Nenne 2
Möglichkeiten, wie man eine Limitierung vom Sauerstoff vermeiden kann.
1. Minimierung der Verweilzeit der Probe im Bypass: Eine hohe metabolische Aktivität bei Hochzelldichtefermentationen führt zu einem sehr schnellen Sauerstoffverbrauch. In einem Bypass kann eine Sauerstofflimitierung bereits nach wenigen Sekunden eintreten, wie im Beispiel einer E. coli-Fermentation, wo dies nach circa 3 Sekunden im Bypass festgestellt wurde. Indem die Flussrate der Probe durch den Bypass und die Probenkammer des Chip-Kalorimeters stark erhöht wird, wird die Zeit, in der die Zellen Sauerstoff verbrauchen können, minimiert. Dies hilft, die Sauerstoffkonzentration in der Probe bis zur Messung annähernd auf dem Niveau des Hauptreaktors zu halten.
2. Verbesserung der Durchmischung innerhalb des Bypass-Systems: Eines der Hauptprobleme von Probenschleifen und Bypässen ist eine schlechte Durchmischung, die zu Sauerstofflimitierung und damit zu veränderten Messergebnissen führen kann. Wenn die Geometrie des Bypass-Systems oder der Probenkammer es zulässt, könnte eine optimierte Durchmischung (analog zur Anpassung von Kulturbedingungen wie Füllvolumen oder Schütteldurchmesser in Schüttelkolben zur Erhöhung der maximalen Sauerstofftransferkapazität) dazu beitragen, den Sauerstoffeintrag in die Flüssigkeit der Probe zu verbessern oder die Sauerstoffverteilung zu homogenisieren. Obwohl die Quellen keine spezifischen Bauweisen für einen aktiv begasten Kalorimeter-Bypass beschreiben, ist die Verbesserung der Sauerstoffzufuhr oder des Transfers ein allgemeines Prinzip zur Vermeidung von Limitierungen.
Wie heißt der Effekt, den man sich in Chip-Kalorimetern zu Nutze macht.
Der Effekt, der in Chip-Kalorimetern genutzt wird, ist der Seebeck-Effekt.
Der Seebeck-Effekt beschreibt, dass in einem Stromkreis, der aus zwei verschiedenen Leitern besteht, eine elektrische Spannung entsteht, wenn eine Temperaturdifferenz zwischen den Kontaktstellen dieser Leiter vorliegt. Im Chip-Kalorimeter führt die von Mikroorganismen erzeugte biologische Wärme zu einer messbaren Spannung, die diesen Effekt nutzt.
4) Was besagt die „Rule of Thornton”? Inklusive Angabe des Proportionalitätsfaktors.
Die „Rule of Thornton” (auch bekannt als oxikalorisches Äquivalent) besagt, dass für jedes übertragene Mol Elektronen eine Wärmemenge von (-)115 kJ freigesetzt wird.
Dieser Proportionalitätsfaktor ermöglicht die Abschätzung der Wärmefreisetzung bei der oxidativen Umsetzung von Substraten. Zum Beispiel kann die freigesetzte Wärme bei der Oxidation von Glucose berechnet werden, indem der Reduktionsgrad (Anzahl der bei einer Oxidation entfernbaren Elektronen) mit diesem Wert multipliziert wird. Das oxikalorische Äquivalent erlaubt somit die Bestimmung der metabolischen Wärme aus der Abgasbilanz, basierend auf dem verbrauchten Sauerstoff. Es berücksichtigt dabei ausschließlich aerobe Reaktionen.
Welche 2 Prinzipien bei der Reaktorkalorimetrie kennen Sie? Ordnen sie die gegebenen Formeln diesen zu und benennen sie die Parameter. Skizzieren Sie außerdem die Methodik.
Es gibt zwei Hauptprinzipien für die Reaktorkalorimetrie: die Bilanzierung über die Wärmekapazität des Kühlwassers und die Bilanzierung mittels Wärmedurchgang.
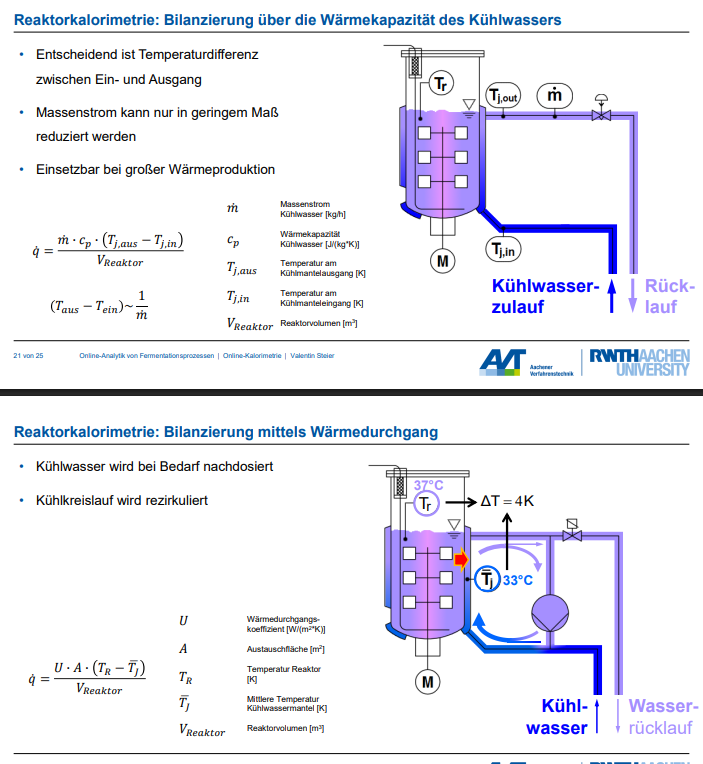
6) Nennen sie 4 Senken oder Quellen für Wärme im Reaktor
Im Reaktor gibt es verschiedene Quellen und Senken für Wärme, die bei der Reaktorkalorimetrie berücksichtigt werden müssen. Die wichtigsten davon sind:
1. Biologische Wärmeleistung (Qbio): Dies ist die von den Mikroorganismen während des Fermentationsprozesses erzeugte Wärme, die oft die primär gewünschte Messgröße darstellt.
2. Leistungseintrag durch den Rührer (P): Die mechanische Energie, die durch das Rühren in das System eingebracht wird, wird in Wärme umgewandelt und trägt zur Gesamtwärmebilanz bei.
3. Evaporation (QEvap): Die Verdampfung von Wasser oder anderen flüchtigen Komponenten aus dem Kulturmedium führt zu einem Wärmeentzug aus dem System, da hierfür Energie (Verdampfungswärme) benötigt wird.
4. Wärmeverlust an die Umgebung (QVerlust): Wärme geht durch Konvektion und Strahlung an die Umgebung verloren, was eine Senke in der Wärmebilanz darstellt.
Weitere Wärmequellen oder -senken können auch Lösungsenthalpien sein, die durch die Zugabe von Substanzen wie pH-Regulatoren oder Feeds entstehen.
2) Nenne 4 Möglichkeiten, den Sauerstoffeintrag in einem Schüttelkolben zu erhöhen.
Um den Sauerstoffeintrag (Sauerstofftransferrate, OTR) in einem Schüttelkolben zu erhöhen, gibt es verschiedene Möglichkeiten, die auf der Beeinflussung der Sauerstofftransferkapazität (OTRmax) basieren:
Reduzierung des Füllvolumens (V_L): Eine höhere maximale Sauerstofftransferkapazität (OTRmax) wird erreicht, wenn das Flüssigvolumen im Schüttelkolben geringer ist. Je höher das Füllvolumen, desto niedriger ist die OTRmax.
Erhöhung der Schüttelgeschwindigkeit (n): Die Gastransferrate wird durch die gewählten Kulturbedingungen, wie die Schüttelfrequenz, bestimmt. Eine höhere Schüttelgeschwindigkeit führt zu einer besseren Durchmischung und damit zu einem erhöhten Sauerstofftransfer.
Erhöhung des Schütteldurchmessers (d0): Der Schütteldurchmesser ist ein Parameter, der die maximale Sauerstofftransferkapazität beeinflusst. Ein größerer Schütteldurchmesser verbessert in der Regel den Gasaustausch.
Verwendung von Kultivierungsgefäßen mit verbesserter Geometrie (z.B. FlowerPlates oder Kolben mit Schikanen): Spezielle Plattentypen wie "FlowerPlates" wurden entwickelt, um höhere Transferraten zu ermöglichen, ähnlich wie Schüttelkolben mit Schikanen. Solche Modifikationen des Gefäßes können die Sauerstofflöslichkeit und den Transfer deutlich steigern. Das Einbringen von Elektroden in Schüttelkolben kann ebenfalls zu einem "ähnlichen Verhalten wie Schikanen" führen und den Sauerstofftransfer beeinträchtigen, was die Wirkung von Geometrieänderungen auf den Transfer verdeutlicht.
Was ist das Problem bei der Verwendung von Spots in Schüttelkolben?
Das Hauptproblem bei der Verwendung von Sensorspots (Optoden) in Schüttelkolben für die Online-Analytik, insbesondere zur Messung von pH-Wert und pO2, liegt im mangelnden permanenten Kontakt des Sensors mit der Flüssigkeitsphase.
Im Detail ergeben sich folgende Schwierigkeiten:
• Nicht dauerhafte Bedeckung der Spots: Es gibt keine Stelle im Schüttelkolben, die dauerhaft mit Flüssigkeit bedeckt ist. Die am Boden angebrachten Sensorspots sind daher nicht kontinuierlich von der Kulturflüssigkeit umspült. Dies ist nur unter sehr spezifischen Bedingungen, wie extrem hohen Füllvolumina oder in Zellkulturen, teilweise der Fall.
• Fehlerhafte Messungen bei Sauerstofflimitierung: Wenn die Kultur sauerstofflimitiert ist, wird der eingetragene Sauerstoff sofort nach Eintritt in die Flüssigkeit verbraucht. In solchen Fällen ist der gelöste Sauerstoff (pO2) in der Flüssigkeit nahe Null. Wenn der Sensorspot nicht ständig in Kontakt mit der Flüssigkeit ist, kann er die tatsächlichen Verhältnisse nicht korrekt abbilden, was zu fehlerhaften Messergebnissen führt.
Das grundsätzliche Messprinzip dieser Spots basiert auf einer optischen Messung über Optoden oder Farbstoffe, die über Lichtwellenleiter, die außen am Kolben oder im Kolben positioniert sind, ausgelesen werden. Dazu werden Sensorspots zum Einkleben verwendet oder Kolben mit bereits enthaltenen Sensorspots. Trotz dieser technologischen Ansätze bleibt der inkonsistente Kontakt mit der Flüssigkeit eine wesentliche Einschränkung.
Nenne 2 Vorteile eines Laborroboters bei der Kultivierung in MTP.
Laborroboter bieten bei der Kultivierung in Mikrotiterplatten (MTPs) mehrere Vorteile:
Erhöhte Reproduzierbarkeit und Reduzierung von Handling-Fehlern: Durch den Einsatz von Pipettierrobotern kann die Inokulationsdichte und das Handling von Kulturen standardisiert werden. Manuelle Abweichungen im Handling, die sonst zu unterschiedlichen Wachstumskinetiken und Lag-Phasen führen können, werden minimiert. Dies führt zu einem sehr reproduzierbaren Wachstum in der Hauptkultur.
Ermöglichung und Optimierung von Hochdurchsatz-Screening-Ansätzen: Mikrotiterplatten sind generell gut für das Screening von Stammbibliotheken geeignet, da sie kleine Volumina und somit geringere Medienkosten sowie einen höheren Durchsatz ermöglichen. Laborroboter, wie Pipettierroboter oder Replikator-Systeme, sind unerlässlich für die effiziente Durchführung solcher Hochdurchsatz-Experimente. Sie ermöglichen die präzise Vorbereitung von Kryokulturen gleicher Biomasse und das Überimpfen nach definierten Kriterien wie Biomasse oder Zeit. Dies kombiniert den hohen Durchsatz der MTPs mit einer hohen Informationsdichte durch online-Messungen.
Was sind Nachteile/Herausforderungen bei der Verwendung von OXNANO-Partikeln,
vor allem im Vergleich mit DO-Sensorpillen
Bei der Verwendung von OXNANO-Partikeln in Schüttelkolben zur Online-Messung des gelösten Sauerstoffs (DO) gibt es mehrere Nachteile und Herausforderungen, insbesondere im Vergleich zu DO-Sensorpillen.
Nachteile und Herausforderungen bei der Verwendung von OXNANO-Partikeln:
Probleme bei der Erkennung der Flüssigkeitssichel: Eine der Hauptschwierigkeiten bei OXNANO-Partikeln ist die zuverlässige Erkennung der Flüssigkeitssichel für die DOT-Messung. Dies gilt besonders bei Kultivierungen, bei denen sich die Viskosität des Mediums ändert. Das bedeutet, dass eine präzise Messung des gelösten Sauerstoffs erschwert sein kann, wenn sich die optischen Bedingungen der Flüssigkeit ändern.
Hohe Kosten: Die Nanopartikel sind vergleichsweise teuer, mit einem Preis von 50 € pro Milligramm.
Kalibrierungsaufwand: OXNANO-Partikel erfordern eine Kalibrierung vor jeder Nutzung.
Notwendigkeit der Vorbehandlung: Vor der Anwendung müssen die Partikel durch Ultraschall dispergiert werden.
Potenzieller Einschluss in Zellen: Es besteht die Möglichkeit, dass die Nanopartikel in Zellen eingeschlossen werden, was die Messgenauigkeit beeinträchtigen könnte.
Vergleich mit DO-Sensorpillen:
Im Gegensatz dazu bieten DO-Sensorpillen einige deutliche Vorteile:
Konstanter Flüssigkeitskontakt: Die Sensorpille bewegt sich im Schüttelkolben mit der Flüssigkeit mit und gewährleistet so einen ständigen Kontakt zur Flüssigkeit. Dies ist ein entscheidender Vorteil gegenüber Sensorspots, die am Boden befestigt sind und nicht immer vollständig von Flüssigkeit bedeckt sind, was zu fehlerhaften Messergebnissen führen kann, besonders bei sauerstofflimitierten Kulturen, wo der Sauerstoff sofort verbraucht wird.
Einfache Handhabung und Einrichtung: DO-Sensorpillen zeichnen sich durch ihre einfache Handhabung und schnelle Einrichtung aus.
Werkskalibrierung: Die Kalibrierung der DO-Sensorpillen erfolgt bereits im Werk, was den Vorbereitungsaufwand für den Anwender reduziert.
Zusammenfassend lässt sich sagen, dass DO-Sensorpillen im Vergleich zu OXNANO-Partikeln eine robustere und anwenderfreundlichere Lösung für die gelöste Sauerstoffmessung in Schüttelkolben darstellen, da sie einen konsistenten Kontakt zur Kulturflüssigkeit gewährleisten und weniger aufwendige Vorbereitungs- und Kalibrierungsschritte erfordern.
Nenne 3 Probleme bei der klassischen Biomassemessung mit Durchlicht in MTP.
Bei der klassischen Biomassemessung mit Durchlicht in Mikrotiterplatten (MTPs) treten mehrere Probleme auf:
1. Schnelle Sättigung des Messsignals: Die Durchlichtmessung sättigt sehr schnell, was bedeutet, dass sie nur bei geringen Biomassekonzentrationen sinnvoll ist und der Messbereich eingeschränkt ist. Bei höheren Zellkonzentrationen korreliert das Signal nicht mehr linear mit der Biomasse.
2. Beeinträchtigung durch Meniskus und Sterilabdeckung: Der Meniskus (Krümmung der Flüssigkeitsoberfläche) im Well beeinträchtigt die Messung. Zusätzlich können Hindernisse durch die Sterilabdeckung die Durchlichtmessung beeinflussen.
3. Unterbrechung der Sauerstoffzufuhr: Abhängig vom Messgerät muss das Schütteln für die Messung unterbrochen werden, was zu einer Unterbrechung der Sauerstoffzufuhr zur Kultur führt. Dies kann die Kulturbedingungen und somit das Zellwachstum beeinträchtigen.
4) Welchen Parameter kann man mit Spots in MTP noch bestimmen außer pH?
Neben dem pH-Wert kann mit Sensorspots (Optoden) in Mikrotiterplatten (MTPs) auch der gelöste Sauerstoff (pO2) bestimmt werden.
Das Messprinzip für gelösten Sauerstoff basiert auf dem Lumineszenz-Quenching. Dabei wird ein Indikator mit rotem Licht angeregt (610 – 630 nm), und die Intensität seiner Lumineszenz im NIR-Bereich (760 – 790 nm) nimmt mit zunehmendem Sauerstoffgehalt ab. Ein Detektor misst die Phasenverschiebung zwischen der angeregten und der emittierten Lumineszenz, wodurch der Sauerstoffpartialdruck quantifiziert werden kann.
Ähnlich wie bei pH-Spots sind diese pO2-Sensorspots am Boden der Wells immobilisiert. Es ist wichtig zu beachten, dass die Fluoreszenzmessung durch Autofluoreszenz von Medienkomponenten beeinträchtigt werden kann, beispielsweise durch unterschiedliche Hefeextrakt-Konzentrationen. Plateau-Verläufe im pO2-Signal nach einer Abnahme sind zudem ein starker Hinweis auf eine Sauerstofflimitierung der Kultur.
Wie unterscheidet sich eine Clark-Elektrode von einer pH-Elektrode?
Eine Clark-Elektrode und eine pH-Elektrode unterscheiden sich grundlegend in ihrem Messprinzip, dem gemessenen Parameter und ihrem Aufbau:
Gemessener Parameter:
Die Clark-Elektrode misst den Sauerstoffpartialdruck (pO2) in der Messlösung. Sie misst nicht die Sauerstoffkonzentration, sondern den Partialdruck.
Die pH-Elektrode misst den pH-Wert der Lösung, der die Wasserstoffionen-Aktivität widerspiegelt.
Messprinzip:
Die Clark-Elektrode arbeitet amperometrisch. Eine externe Polarisationsspannung wird angelegt, um Sauerstoff an einer Platin-Kathode zu reduzieren und Silber an einer Anode zu oxidieren. Der resultierende Stromfluss ist proportional zum Sauerstoffpartialdruck.
Die pH-Elektrode arbeitet potentiometrisch. Sie misst eine Potentialdifferenz zwischen einer Messelektrode (typischerweise einer pH-sensitiven Glasmembran) und einer Bezugselektrode. Idealerweise fließt dabei kein Strom, was durch ein hochohmiges Voltmeter erreicht wird.
Aufbau und Elektroden:
Die Clark-Elektrode besteht aus zwei Elektroden: einer Platin-Kathode (an der Sauerstoff reduziert wird) und einer Silber-Anode (an der Silber oxidiert wird). Diese Elektroden sind durch eine dünne, gaspermeable Membran (z.B. aus PTFE) vom Messgut getrennt, die selektiv für Sauerstoff ist und unerwünschte Reaktionen an den Elektroden verhindert.
Die pH-Elektrode (speziell die Glaselektrode) besteht aus einer pH-sensitiven Glasmembran und einer Bezugselektrode (häufig Ag/AgCl). Die Glasmembran bildet bei Kontakt mit wässrigen Lösungen eine Gelschicht, an der der Ionenaustausch stattfindet. Es gibt auch Metall/Metalloxid-Elektroden, die Metalloxide wie Iridiumoxid verwenden und robuster sein können als Glaselektroden.
Spezifische Eigenschaften:
Clark-Elektrode:
Misst Sauerstoffverbrauch und erfordert kontinuierliche Sauerstoffnachlieferung.
Die Messung ist von der Strömung und Viskosität der Messlösung abhängig.
Erfordert eine Polarisationszeit vor genauen Messungen (kann Stunden bis zu einem Tag dauern).
Die Anode (Silber) kann sich durch Abscheidung von Silberchlorid (AgCl) abnutzen, was regelmäßige Reinigung erfordert.
pH-Elektrode:
Das Potential bildet sich nicht direkt an der Elektrode aus, sondern an den Phasengrenzen der Glasmembran.
Kann durch Alkalifehler (bei hohem pH-Wert) und Säurefehler (bei sehr niedrigem pH-Wert) beeinflusst werden.
Ist temperaturabhängig.
Muss regelmäßig kalibriert werden, da unerwünschte Potentialdifferenzen entstehen können.
Zusammenfassend lässt sich sagen, dass die Clark-Elektrode ein dynamisches, auf Strommessung basierendes System für Gase ist, während die pH-Elektrode ein statisches, auf Potentialmessung basierendes System für Ionen ist.
Vergleich Redox- und Clark-Elektrode. Nenne einen Vorteil und einen Nachteil der
Redox-Elektrode.
Clark-Elektrode (O₂-Elektrode)
Misst den Sauerstoffpartialdruck direkt, spezifisch für O₂.
Aufbau: Kathode (meist Pt) + Anode (Ag/AgCl) hinter einer O₂-durchlässigen Membran.
O₂ wird an der Kathode reduziert, Stromfluss ∝ O₂-Konzentration.
👉 Typische Anwendung: Online-O₂-Messung im Fermenter (pO₂-Regelung).
Redox-Elektrode
Misst das Redoxpotential (Eh) des Mediums, d. h. das Gleichgewicht aller oxidierenden und reduzierenden Substanzen.
Aufbau: Redox-Elektrode (z. B. Platinelektrode) + Bezugselektrode (Ag/AgCl).
Liefert nur ein Summensignal (kein spezifischer Stoff).
👉 Typische Anwendung: z. B. Überwachung anaerober Bedingungen oder in Abwasser-/Klärtechnik.
Vorteil der Redox-Elektrode
Liefert eine Gesamtinformation über den Redox-Zustand der Kultur → kann anzeigen, ob Bedingungen oxidativ oder reduzierend sind.
Robuster und einfacher im Aufbau (keine Membran, keine Elektrolytfüllung wie bei Clark-Elektrode).
Nachteil der Redox-Elektrode
Nicht spezifisch: Signal wird von vielen Komponenten beeinflusst (O₂, CO₂, Metabolite, pH, Mediumsbestandteile).
Daher keine direkte Aussage über die O₂-Konzentration möglich, sondern nur ein „globales“ Bild des Redoxmilieus.
Warum muss man eine Clark-Elektrode polarisieren?
weck der Polarisierung
Sicherstellen der richtigen Reaktion:
Nur wenn die Kathode auf das passende Potential gebracht wird, läuft die Sauerstoffreduktion ab.
Ohne Polarisierung könnten Nebenreaktionen dominieren.
Linearer Zusammenhang O₂ ↔ Stromfluss:
Durch das konstante Potential ist die Kathode im diffusionskontrollierten Bereich.
Der gemessene Strom ist dann direkt proportional zur O₂-Konzentration.
Unterdrückung anderer Einflüsse:
Polarisierung stellt sicher, dass die Elektrode auf O₂ reagiert und nicht auf andere redoxaktive Stoffe.
Plateaubereich = diffusionskontrolliert − Spannung zu niedrig: keine vollständige Umsetzung von O2 − Spannung zu hoch: unerwünschte Nebenreaktionen
Was sind 2 Methoden der Auswertung von O2-Fluorezenzdaten?
Diagramme zeichnen zur Kalibrierung der Clark-Elektrode (es waren leere Diagramme
gegeben, die wollten das hier sehen)
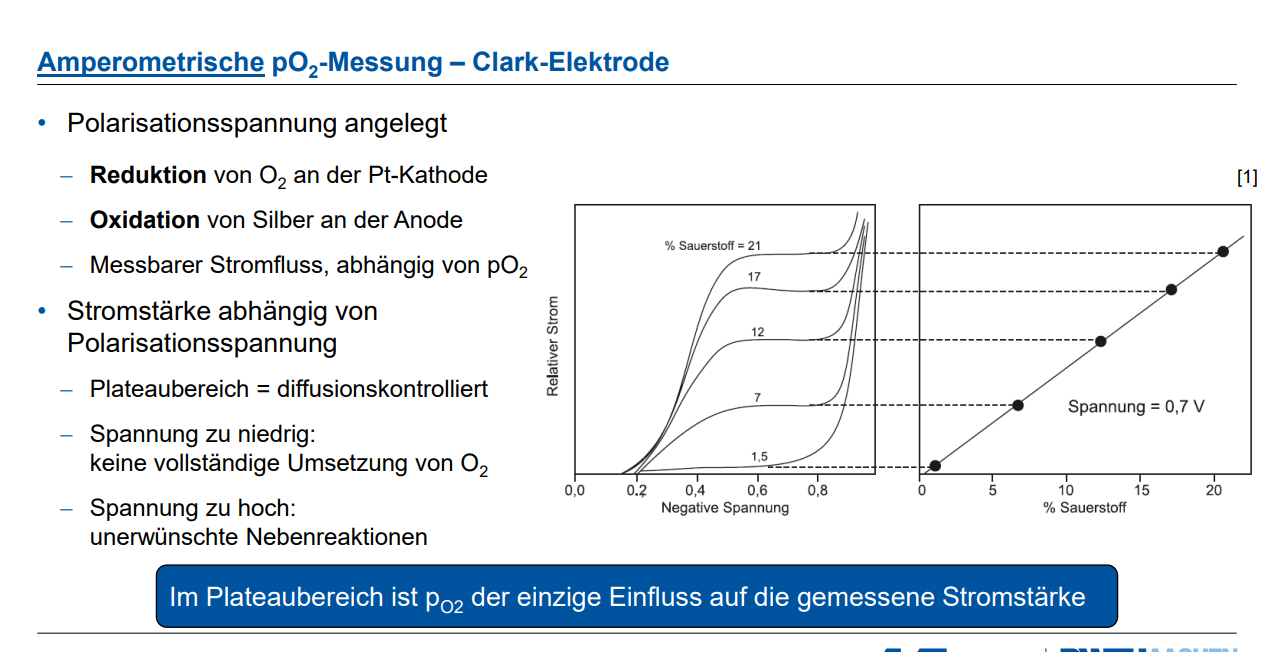
Nenne 2 Eigenschaften der Membran eines Sauerstoffsensors.
gaspermeabel
selektiv für sauerstoff
Zeichne folgende Verläufe der OTR (inklusive Achsenbeschriftung): unlimitiert,
Produktlimitierung, Sauerstofflimitierung, starke Induktion (leere Diagramme
gegeben).
Was wird bei der i) visuellen und ii) photometrischen pH-Messung ausgewertet?
Bei der pH-Wert-Messung werden folgende Aspekte ausgewertet:
i) Bei der visuellen pH-Messung wird eine einfache Farbumschlagsmethode (mittels eines Indikators) ausgewertet.
ii) Bei der photometrischen pH-Messung wird die Änderung des Wellenlängenspektrums durch den pH-Wert ausgewertet, typischerweise unter Verwendung eines Spektralphotometers.
Sie haben einen biologischen Prozess, in dem Schwefelwasserstoff (H2S) entsteht. Welches
Problem kann bei der pH-Messung auftreten? Wie kann dies verhindert werden?
Wenn in einem biologischen Prozess Schwefelwasserstoff (H2S) entsteht, kann dies bei der potentiometrischen pH-Messung zu Problemen führen.
Das Problem bei der pH-Messung:
Das Hauptproblem betrifft das Diaphragma der Bezugselektrode.
Die am häufigsten verwendete Art des Diaphragmas ist ein poröses Keramikdiaphragma, das einen direkten Kontakt zwischen dem Elektrolyten der Elektrode (z.B. KCl) und der Messlösung herstellt.
Schwefelwasserstoff (H2S) in der Messlösung kann mit Bestandteilen des Innenelektrolyten, insbesondere mit Silber (Ag) aus der Ag/AgCl-Referenzelektrode, zu schwer löslichen Niederschlägen reagieren, wie zum Beispiel Silbersulfid (Ag2S).
Diese Niederschläge können das Diaphragma verstopfen ("das Diaphragma verstopfen können").
Ein verstopftes Diaphragma stört das konstante Potential der Bezugselektrode, welche für eine genaue pH-Messung unerlässlich ist. Das gemessene Potential würde somit nicht mehr zuverlässig den pH-Wert widerspiegeln.
Wie das Problem verhindert werden kann:
Es gibt verschiedene Ansätze, um dieses Problem zu verhindern oder zu beheben:
Reinigung des Diaphragmas: Niederschläge, die sich gebildet haben, können durch mehrstündiges Einlegen in eine Thioharnstoff-Lösung entfernt werden.
Alternative Diaphragmen: Der Einsatz anderer Diaphragmentypen wie Schraubschliff-Diaphragmen oder Ringspalt-Diaphragmen kann die Bildung von Ablagerungen reduzieren.
Verwendung von Metall/Metalloxid-Elektroden: Eine effektive Methode ist der Einsatz von pH-Elektroden auf Basis von Metalloxiden, wie beispielsweise Iridiumoxid-Elektroden. Diese Elektroden sind "nicht störanfällig gegen die meisten Ionen (wie Cu2+, Li+, Na+, K+), O2, CO2, NH3 und H2S". Iridiumoxid ist das am häufigsten verwendete Material für solche Elektroden, da es eine schnelle Ansprechzeit hat und gegenüber vielen Substanzen, einschließlich H2S, stabil ist.
Nennen Sie 3 Vorteile der Metall/Metalloxid-Elektrode gegenüber der Einstabsmesskette für pH-Messung.
Die Metall/Metalloxid-Elektrode bietet gegenüber der klassischen Glaselektrode (Einstab-Messkette) mehrere Vorteile für die pH-Messung:
Robustheit und Bruchfestigkeit: Metall/Metalloxid-Elektroden, wie die pilzförmige Antimonelektrode, sind im Gegensatz zur zerbrechlichen Glaselektrode nicht zerbrechlich. Dies ist ein wesentlicher Vorteil, insbesondere bei Anwendungen, die eine hohe mechanische Stabilität erfordern, wie zum Beispiel Magensonden. Sie sind zudem weitgehend korrosionsbeständig auch in aggressiven Flüssigkeiten, was bei Glaselektroden nicht der Fall ist.
Stabilität in verschiedenen Umgebungen: Diese Elektroden sind in wässriger Lösung über einen weiten Temperatur- und Druckbereich stabil.
Geringe Störanfälligkeit gegenüber bestimmten Ionen und Gasen: Iridiumoxid-Elektroden, die am häufigsten verwendeten Metall/Metalloxid-Elektroden, sind nicht störanfällig gegen die meisten Ionen (wie Cu2+, Li+, Na+, K+), O2, CO2, NH3 und H2S. Dies ist besonders relevant in biologischen Prozessen, wo Schwefelwasserstoff (H2S) entstehen kann, da H2S bei herkömmlichen Elektroden das Diaphragma verstopfen und die Messung stören könnte, wie in unserer vorherigen Konversation besprochen.
Schnelle Ansprechzeit und Lagerung: Iridiumoxid-Elektroden zeichnen sich durch eine schnelle Ansprechzeit aus und können ggf. trocken lagerbar sein.
Miniaturisierbarkeit: Metall/Metalloxid-Elektroden sind miniaturisierbar, auch wenn ihr Herstellungsverfahren (Galvanisierung) teuer ist.
Nennen Sie zwei Funktionen der Membran einer Clark-Elektrode
Die Membran einer Clark-Elektrode erfüllt zwei wesentliche Funktionen:
Trennung des Elektrodenraums vom Messgut: Die Membran dient dazu, den internen Elektrodenraum, der den Elektrolyten und die Elektroden (Platin-Kathode und Silber-Anode) enthält, vom äußeren Messmedium zu trennen.
Selektive Gaspermeabilität für Sauerstoff: Sie ist gaspermeabel und gleichzeitig selektiv für Sauerstoff. Dies bedeutet, dass sie den Durchtritt von Sauerstoffmolekülen in den Elektrodenraum ermöglicht, während sie andere Substanzen zurückhält, um unerwünschte Reaktionen an den Elektroden zu verhindern und sicherzustellen, dass nur der Sauerstoffpartialdruck gemessen wird.
Zusätzlich sorgt die Membran dafür, dass die Dicke der diffusionslimitierenden Schichten konstant gehalten wird, was für eine genaue und reproduzierbare Sauerstoffmessung entscheidend ist.
Nennen Sie einen Vor- und einen Nachteil der Redox-Elektrode gegenüber der Clark-Elektrode
Gerne, hier ist ein Vorteil und ein Nachteil der Redox-Elektrode im Vergleich zur Clark-Elektrode:
Vorteil: Die Redox-Elektrode bietet eine höhere Empfindlichkeit im mikroaerophilen Bereich. Sie kann bei sehr niedrigen Gelöstsauerstoffmengen noch Unterschiede auflösen, die die Clark-Elektrode oder Fluoreszenzsonden nicht mehr erfassen können. Dies ist besonders nützlich, wenn Prozesse unter Sauerstofflimitierung oder sehr geringen Sauerstoffkonzentrationen untersucht oder geregelt werden sollen, wo herkömmliche pO2-Messungen (wie die der Clark-Elektrode) ihre Messgrenze erreichen.
Nachteil: Das Redoxpotential ist ein Summenparameter. Es hängt von der Summe aller Redox-Paare in der Lösung ab und wird von verschiedenen Haupt-Einflussgrößen wie Sauerstoff, pH-Wert sowie unbekannten oxidierten und reduzierten Metaboliten beeinflusst. Dies macht das gemessene Signal schwer interpretierbar, da es nicht spezifisch für eine einzelne Komponente ist, im Gegensatz zur Clark-Elektrode, die spezifisch den Sauerstoffpartialdruck misst.
Beschriften Sie die Punkte 1-5 der folgenden Abbildung:
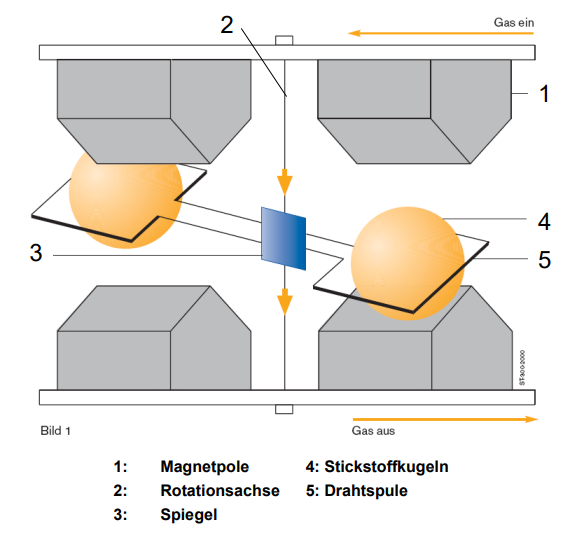
Nennen Sie die drei Hauptkomponenten der MS und beschreiben Sie kurz deren Funktion.
Die drei Hauptkomponenten eines Massenspektrometers (MS) und deren Funktionen sind:
Ionenquelle: In der Ionenquelle wird die Probe in einen Strahl geladener Ionen umgewandelt. Ein häufiges Verfahren ist die Elektronenstoßionisation (EI), bei der die Analyten mit Elektronen beschossen werden, um sie zu ionisieren oder zu fragmentieren. Hierfür muss die Probe unzersetzt im gasförmigen Zustand vorliegen. Die Ionen werden dann aus der Ionisationsregion entfernt, beschleunigt und fokussiert, um einen möglichst hohen Ionenstrom zum Analysator zu gewährleisten.
Massenanalysator: Der Massenanalysator ist dafür zuständig, die erzeugten Ionen nach ihrem Masse-zu-Ladung-Verhältnis (m/z) aufzutrennen. Es gibt verschiedene Typen von Massenanalysatoren, darunter Sektorfeldmethoden und Quadrupolsysteme. Ein Quadrupol besteht aus vier Metallstäben, an die Gleich- und Wechselspannungen angelegt werden. Ionen mit einem bestimmten m/z-Verhältnis können eine stabile Trajektorie durch den Quadrupol fliegen und den Detektor erreichen, während andere Ionen mit den Stäben kollidieren und neutralisiert werden.
Detektor: Am Detektor wird die Intensität der Ionen registriert, um das Massenspektrum zu erstellen, das die relativen Mengen der gebildeten Ionen zeigt. Gängige Detektortypen sind der Faraday-Cup und der Sekundärelektronenvervielfacher (SEV). Der Faraday-Cup misst den Spannungsabfall, der durch die Neutralisierung positiver Ionen auf einer Kollektorelektrode entsteht. Der SEV hingegen verstärkt kleinste Elektronen- oder Ionenströme durch Sekundärelektronenemission, indem auftreffende Ionen Elektronen freisetzen, die dann exponentiell verstärkt werden.
Nennen Sie je einen Vor- und einen Nachteil des Sekundärelektronenvervielfachers gegenüber
dem Faraday-Cup.
Gerne, hier ist ein Vor- und ein Nachteil des Sekundärelektronenvervielfachers (SEV) im Vergleich zum Faraday-Cup:
Vorteil des SEV: Der Sekundärelektronenvervielfacher ist schneller und empfindlicher als der Faraday-Cup. Er ermöglicht Messungen im ppb (parts per billion) Bereich (10⁻⁹).
Nachteil des SEV: Der SEV ist weniger stabil und robust als der Faraday-Cup. Er ist ungeeignet bei höherem Druck und höheren Konzentrationen und muss zudem gegen den Faraday-Cup kalibriert werden, wobei auch Anpassungen für Änderungen der Verstärkung nötig sind.
Beschreiben Sie das Funktionsprinzip eines Nafionschlauches.
Ein Nafionschlauch ist ein synthetisches Polymer aus der Klasse der Ionomere, das für die Messgaskonditionierung, insbesondere die Entfernung von Wasserdampf, eingesetzt wird.
Sein Funktionsprinzip basiert auf folgenden Eigenschaften:
Zusammensetzung und Struktur: Nafion kombiniert die physikalischen und chemischen Eigenschaften von Teflon mit ionischen Charakteristiken, die durch die Addition von Sulfonsäuregruppen zur Polymermatrix entstehen.
Selektive Permeabilität für Wasser: Die Sulfonsäuregruppen ermöglichen es dem Material, sehr effizient Wasser zu absorbieren. Die Verbindungen zwischen diesen Sulfongruppen führen zu einem schnellen Transfer von Wasser durch das Nafion. Die Permeabilität ist für Wasser besonders hoch und deutlich höher als für andere Gase wie CO2, O2 oder N2.
Funktion in der Messgaskonditionierung: Der Nafionschlauch wird verwendet, um überschüssigen Wasserdampf aus dem Abgasstrom zu entfernen und so Kondensation im Messgerät zu verhindern. Dadurch wird vermieden, dass durch Wasserdampf bedingte fehlerhafte Daten oder Hintergrundrauschen bei der Gasanalyse entstehen. Dies ist wichtig, da Wasserdampf die Sauerstoffkonzentration im Gasvolumen beeinflussen und einen Sauerstoffverbrauch vortäuschen kann, wo keiner vorhanden ist.
Wie verhält sich die Leitfähigkeit einer Frings-Sonde, wenn Ethanol anwesend ist? Wie verhält sie sich, wenn zusätzlich Methanol anwesend ist?
Die Frings-Sonde, die einen Halbleiter-Gassensor (typischerweise aus Zinnoxid, SnO2) verwendet, misst die Konzentration von reduzierenden Gasen wie Ethanol und Methanol über eine Änderung ihres Sensorwiderstandes.
Wenn Ethanol anwesend ist:
Ethanolmoleküle adsorbieren an der Oberfläche des Zinnoxids und reagieren mit dort adsorbierten Sauerstoff-Ionen.
Diese Reaktion, beispielsweise C₂H₅OH + 6 O⁻ → 2 CO₂ + 3 H₂O + 6 e⁻, führt zur Freisetzung von Elektronen in das Leitungsband des Halbleiters.
Die Folge ist ein Anstieg der elektrischen Leitfähigkeit des Sensors, da mehr freie Ladungsträger zur Verfügung stehen. Entsprechend sinkt der Widerstand des Sensors.
Wenn zusätzlich Methanol anwesend ist:
Methanol wird ebenfalls als reduzierendes Gas von der Frings-Sonde erfasst.
Analog zum Ethanol würde auch die Anwesenheit von Methanol zu einer Freisetzung von Elektronen in das Leitungsband des Halbleiters führen.
Somit würde auch Methanol eine Erhöhung der Leitfähigkeit (bzw. eine Verringerung des Widerstandes) bewirken.
Das Prinzip besagt, dass bei reduzierenden Gasen die Leitfähigkeit des Sensors steigt und der Widerstand sinkt. Daher würden sowohl Ethanol als auch Methanol, als reduzierende Analyten, in dieselbe Richtung auf die Leitfähigkeit des Sensors wirken.
Nennen und erklären Sie den Vorteil einer 4-Pol-Elektrode gegenüber einer 2-Pol-Elektrode
zur Leitfähigkeitsmessung.
Der Vorteil einer 4-Pol-Elektrode gegenüber einer 2-Pol-Elektrode bei der Leitfähigkeitsmessung liegt in der Reduzierung der Elektrodenpolarisation.
Erklärung:
Bei kapazitiven Messmethoden zur Biomassebestimmung, die auch die Leitfähigkeit des Mediums berücksichtigen, besteht die Sonde aus vier Metallelektroden.
Funktionsweise der 4-Pol-Elektrode: Die beiden äußeren Elektroden erzeugen das elektrische Feld, während die beiden inneren Elektroden die Ladungstrennung messen.
Problem der Elektrodenpolarisation bei 2-Pol-Elektroden (impliziert): Die Elektrodenpolarisation trägt zur gemessenen Kapazität bei und steigt mit zunehmender Ionenkonzentration. Sie ist zudem empfindlich gegenüber dem Zustand der Elektrodenoberfläche; wenn die Elektrode verschmutzt ist, wird der Polarisationseffekt größer.
Vorteil der 4-Pol-Elektrode: Durch die Trennung von Stromzuführung (äußere Elektroden) und Spannungsmessung (innere Elektroden) wird die Elektrodenpolarisation erheblich reduziert. Eine falsche Wahl der Messfrequenz (f-low) kann dazu führen, dass die Kapazitätsänderung durch die Leitfähigkeit und nicht durch die Biomasse verursacht wird, oder dass die gemessene Kapazität durch steigende Elektrodenpolarisation überschätzt wird. Die 4-Pol-Anordnung hilft, diese Probleme zu vermeiden und präzisere Messwerte zu liefern.
Zusammenfassend ermöglicht die 4-Pol-Elektrode eine genauere und stabilere Messung der Leitfähigkeit, indem sie störende Einflüsse der Elektrodenpolarisation minimiert, die besonders bei hohen Ionenkonzentrationen oder Verschmutzungen auftreten können.
Nennen Sie drei Cofaktoren und drei Aminosäuren, die man über Fluoreszenz nachweisen
kann.
Basierend auf den vorliegenden Quellen und unserer Konversation können die folgenden Cofaktoren und Aminosäuren über Fluoreszenz nachgewiesen werden:
Drei Cofaktoren/Vitamine, die über Fluoreszenz nachgewiesen werden können:
Riboflavin, FAD, FMN: Diese sind wichtige Vitamine und Cofaktoren im Stoffwechsel.
NAD(P)H: NADH ist eine zentrale Schnittstelle zwischen Katabolismus und Anabolismus, wobei nur die reduzierte Form (NADH) fluoresziert.
Pyridoxin, Pyridoxamin, Pyridoxalphosphat: Diese fungieren ebenfalls als Vitamine und Cofaktoren.
Drei Aminosäuren, die über Fluoreszenz nachgewiesen werden können: Die Fluoreszenz aromatischer Aminosäuren wird zur Quantifizierung von Proteinen genutzt.
Tryptophan: Fluoresziert bei einer Anregungswellenlänge (λex) von 295 nm und einer Emissionswellenlänge (λem) von 353 nm.
Tyrosin: Fluoresziert bei einer Anregungswellenlänge (λex) von 275 nm und einer Emissionswellenlänge (λem) von 304 nm.
Phenylalanin: Fluoresziert bei einer Anregungswellenlänge (λex) von 260 nm und einer Emissionswellenlänge (λem) von 282 nm.
Die Fluoreszenz dieser Aminosäuren basiert auf ihrem aromatischen Teil.
Erklären Sie, wie mittels phasenaufgelöster Bestimmung Sauerstoff beim
Fluoreszenzquenching gemessen wird.
Bei der phasenaufgelösten Bestimmung von Sauerstoff mittels Fluoreszenz-Quenching wird die Phasenverschiebung zwischen dem angeregten und dem emittierten Lumineszenzlicht gemessen.
Hier ist eine Erklärung des Prinzips:
Messprinzip: Die Methode basiert auf dem Phänomen des Lumineszenz-Quenchings, bei dem Sauerstoff einen Teil der Energie eines Fluoreszenzfarbstoffs absorbiert, was zu einer Abnahme der Emissionsintensität des Farbstoffs führt.
Anregung und Emission: Ein Indikatorfarbstoff (z.B. ein Rutheniumkomplex) wird mit einem Lichtpuls oder einer modulierten Lichtquelle (z.B. rotem Licht im Bereich von 610–630 nm) angeregt. Dieser angeregte Farbstoff emittiert dann Lumineszenzlicht (z.B. im NIR-Bereich von 760–790 nm).
Einfluss von Sauerstoff (Quenching): In Anwesenheit von Sauerstoff wird die Lumineszenzabklingzeit (τ) des Farbstoffs verkürzt.
Phasenwinkelverschiebung: Statt die Intensität der Lumineszenz zu messen, die auch von Störfaktoren wie der Lichtquelle oder der Detektorempfindlichkeit beeinflusst werden kann, wird bei der phasenaufgelösten Bestimmung die Phasenverschiebung (Φ) zwischen dem Anregungslicht und dem emittierten Lumineszenzlicht ausgewertet. Diese Messung ist unabhängig von der Lichtintensität und der Detektorsensitivität, was sie robuster macht.
Messwert und Sauerstoffkonzentration: Die Lumineszenzlebenszeit (Λ) ist höher, wenn kein Sauerstoff vorhanden ist. Mit steigender Sauerstoffmenge wird die Phasenwinkelverschiebung kleiner. Zum Beispiel wurde eine Phasenwinkelverschiebung von 63,9° ohne Sauerstoff und 38,1° bei steigender Sauerstoffmenge beobachtet. Ein Detektor misst diese Phasenverschiebung.
Referenz: Für die Sauerstoffmessung mittels Phasenwinkel ist eine Referenz erforderlich.
Zusammenfassend erlaubt die phasenaufgelöste Bestimmung eine präzise und zuverlässige Sauerstoffmessung, indem sie die Auswirkungen von Sauerstoff auf die Fluoreszenzabklingzeit des Sensors in eine messbare Phasenverschiebung umwandelt.
Nennen Sie zwei Vorteile der NIR- gegenüber der MIR-Messung.
Basierend auf den vorliegenden Quellen lassen sich zwei Vorteile der Nahinfrarot- (NIR) gegenüber der Mittelinfrarot-Messung (MIR) ableiten:
Geringere Anfälligkeit für Störungen durch Wasserdampf und andere IR-aktive Gase: Bei der MIR-Messung von Kohlenstoffdioxid kann die IR-Absorption von Wasserdampf störende Einflüsse haben. Ebenso können andere IR-aktive Komponenten wie Methan (CH4) oder Distickstoffoxid (N2O), die ebenfalls im Infrarotbereich absorbieren, die Messung stören. Aus diesem Grund ist es bei der Abgasanalyse mittels MIR-Methoden oft notwendig, das Gas zu trocknen und eine Messgaskonditionierung vorzunehmen, um Kondensation im Gerät und fehlerhafte Daten zu verhindern. Für die in den Quellen beschriebenen Anwendungen der NIR-Messung (z.B. Sauerstoff- oder pH-Messung mittels Fluoreszenz oder Biomassemessung mittels Streulicht) wird eine solche aufwendige Messgaskonditionierung zur Vermeidung von Wasserdampfinterferenzen nicht explizit erwähnt, was auf eine geringere Anfälligkeit in diesen spezifischen Anwendungen hindeutet.
Minimierung von Interferenzen durch Medienfarbe bei der Biomassemessung: Im Kontext der Online-Biomassemessung mittels Durchlicht wird der Nah-Infrarot-Bereich (NIR) zwischen 840 und 910 nm verwendet, um Interferenzen durch die Farbe des Mediums zu minimieren. Dies ist ein Vorteil, da sichtbares Licht von farbigen Medienkomponenten stark absorbiert werden kann, was die Messung der optischen Dichte beeinträchtigen würde. Im NIR-Bereich ist die Absorption vieler Medienfarbstoffe und -komponenten geringer, was präzisere Messungen in komplexen biologischen Medien ermöglicht. Die Quellen erwähnen diesen Aspekt nicht explizit für MIR-Messungen, aber MIR wird primär für die Analyse spezifischer molekularer Absorptionsbanden eingesetzt, die in Medien durch andere IR-aktive Substanzen beeinträchtigt werden können.
Nennen Sie die zwei Grundprinzipien der Online-Mikroskopie.
Die Online-Mikroskopie basiert auf zwei fortgeschrittenen Grundprinzipien:
Prinzip des Probeneinschlusses
Prinzip der Schärfentiefe
Hier sind die Erklärungen zu beiden Prinzipien:
1. Prinzip des Probeneinschlusses
Messprinzip: Bei diesem Prinzip wird das zu mikroskopierende Volumen mechanisch eingeschlossen und beruhigt. Dies ermöglicht die Aufnahme von scharfen Bildern und gewährleistet ein definiertes Probenvolumen.
Aufbau und Funktion: Ein Prototyp eines Inline-Mikroskops mit mechanischem Probeneinschluss besteht aus einem äußeren Tubus, der das Probenahme- und Beleuchtungssystem enthält, und einem inneren Tubus mit einer Linse (die nicht hitzestabil ist und zum Autoklavieren entfernt werden kann). Das Medium fließt normalerweise frei durch eine Lücke zwischen dem Objektträger und dem Deckglas. Für die Probenahme wird diese Lücke geschlossen, indem das Beleuchtungssystem zum Deckglas bewegt wird und ein Silikon-Elastomer den Raum abdichtet. Die Probe verweilt für die Dauer der Mikroskopie (ca. 2 Sekunden) in diesem abgeschlossenen Raum.
Vorteile: Es liefert klare Bilder einer "fixierten" Probe, ähnlich der Betrachtung unter einem "normalen" Mikroskop.
2. Prinzip der Schärfentiefe
Messprinzip: Dieses Prinzip nutzt eine sehr kurze Blitzbeleuchtung, um eine Abfolge von Standbildern zu erzeugen und Bewegungsunschärfen zu vermeiden. Ein entscheidendes Merkmal ist die unterschiedlich starke Abbildungsunschärfe, die je nach Abstand des Objekts zum Objektiv auftritt. Eine unscharfe Zelle wirkt beispielsweise größer und verschwommener und hat tendenziell einen geringeren Kontrast als eine scharfe Zelle.
Auswertung: Die Unschärfe eines gegebenen Partikels ist eine Funktion seines Abstandes von der Position scharfer Bildfokussierung. Durch automatische Abgrenzung eines festen Suspensionsbereichs bei festgelegter maximaler Unschärfe und die virtuelle Festlegung des Probenvolumens durch die Bildverarbeitung sind quantitative Messungen ohne mechanische Abgrenzung möglich.
Aufbau und Funktion: Die Fermentationsbrühe fließt kontinuierlich durch einen kleinen Spalt zwischen Belichtungsleiter und Quarzglas. Die Umsetzung kann als Inline- oder Online-Variante (im Bypass) erfolgen. Der Abstand zur Probe kann je nach Ausführung variiert werden. Eine qualitativ gute Beleuchtung ist für scharfe Bilder entscheidend und muss je nach Anwendung angepasst werden (Reflexion, Transmission, Transflexion).
Vorteile: Dieses Prinzip ermöglicht die Analyse dynamischer Proben und eine Echtzeitanalyse mit geringerem Einfluss auf die Kultur im Vergleich zum Probeneinschluss.
Nennen Sie zwei chemisch-physikalische Größen, die die Anregungsenergie für Infrarot-
Messungen bestimmen.
Zwei chemisch-physikalische Größen, die die Anregungsenergie für Infrarot-Messungen bestimmen, sind:
Die Änderung des Dipolmoments des Moleküls: Moleküle sind nur dann infrarot-aktiv und können Infrarot-Strahlung absorbieren, wenn die Absorption dieser Strahlung eine Änderung ihres Dipolmoments bewirkt. Dies ist eine grundlegende Voraussetzung dafür, dass ein Molekül überhaupt Energie im Infrarotbereich aufnehmen kann.
Die Wellenlänge oder Wellenzahl der Infrarotstrahlung: Die Wellenlänge oder ihr reziproker Wert, die Wellenzahl, charakterisiert die Infrarot-Strahlung. Jedes Molekül besitzt einen einzigartigen „Fingerprint“ im Infrarotbereich, da es nur bei bestimmten Wellenlängen Energie absorbiert, die seinen spezifischen Schwingungsfrequenzen entsprechen. Die Anregungsenergie ist direkt von der Frequenz (und damit indirekt von der Wellenlänge/Wellenzahl) der einfallenden Strahlung abhängig.
Rechenaufgabe: Wie lang darf ein Bypass für ein Chipkalorimeter sein, damit keine Sauerstofflimitation auftritt? Gegeben waren pO2, OTRmax, yO2, in, vBypass, pabs, LO2.
L_bypass_max = vBypass × t_limit × 3600 [m]
![<p><strong>L_bypass_max = vBypass × t_limit × 3600</strong><span> [m]</span></p>](https://knowt-user-attachments.s3.amazonaws.com/36707900-e2db-491a-9d6a-459491a34689.png)
Was kann modifiziert werden, um eine Sauerstofflimitation im Bypass zu verhindern?
Um eine Sauerstofflimitierung in einem Bypass zu verhindern, können verschiedene chemisch-physikalische Größen und operationelle Parameter modifiziert werden, die die Sauerstoffkonzentration im Medium oder die Verweilzeit der Probe im Bypass beeinflussen.
Die Berechnung der maximal zulässigen Bypasslänge, bevor eine Sauerstofflimitierung auftritt, basiert auf der Formel: L_bypass_max = vBypass × t_limit wobei t_limit = cO2 / OTRmax und cO2 = LO2 × pabs × yO2,in × (pO2 / 100).
Basierend auf dieser Formel und den Problemen von Transportlimitierungen in Bypässen, können folgende Modifikationen vorgenommen werden:
Erhöhung der Strömungsgeschwindigkeit (vBypass) im Bypass: Indem die Probe schneller durch den Bypass geleitet wird, verringert sich die Verweilzeit im Bypass. Eine kürzere Verweilzeit bedeutet, dass der Sauerstoff nicht so schnell durch die Zellatmung verbraucht werden kann, bevor die Messung erfolgt.
Minimierung der Länge des Bypass (L_bypass_actual): Eine Reduzierung der physikalischen Länge des Bypass-Schlauches oder der Messkammer verringert ebenfalls die Zeit, in der die Probe außerhalb des Hauptreaktors Sauerstoff verbraucht, und somit das Risiko einer Sauerstofflimitierung.
Erhöhung der anfänglichen Sauerstoffkonzentration im Medium (cO2) der entnommenen Probe: Die Sauerstoffkonzentration im Medium kann durch verschiedene Faktoren beeinflusst werden, die im Hauptreaktor eingestellt werden:
Erhöhung des Sauerstoffpartialdrucks (pO2) im Hauptreaktor: Wenn die Fermentation in einem Zustand höherer Sauerstoffsättigung (gemessen durch die pO2-Elektrode) betrieben wird, enthält die entnommene Probe mehr gelösten Sauerstoff, was die Zeit bis zur Limitierung verlängert.
Erhöhung des Molenbruchs des Sauerstoffs in der Zuluft (yO2,in): Durch die Begasung des Hauptreaktors mit sauerstoffangereicherter Luft oder reinem Sauerstoff kann die Sättigungskonzentration von Sauerstoff im Medium erhöht werden.
Erhöhung des absoluten Drucks (pabs) im System: Ein höherer Systemdruck kann die Löslichkeit von Gasen im Medium erhöhen und somit die Sauerstoffkonzentration steigern.
Reduzierung der maximalen Sauerstoffverbrauchsrate (OTRmax) der Kultur: Eine geringere OTRmax bedeutet, dass die Kultur den vorhandenen Sauerstoff langsamer verbraucht. Dies ist jedoch in der Regel keine wünschenswerte Strategie, da die OTRmax eine wesentliche metabolische Eigenschaft der Kultur und des Fermentationsprozesses darstellt und eine Reduzierung oft mit einer unerwünschten Beeinträchtigung des Prozesses einhergeht.
Berechnen Sie mit Hilfe der Rule of Thornton die freigesetzte Wärme der folgenden Reaktion: C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Um die freigesetzte Wärme der Reaktion C6H12O6 + 6 O2 → 6 CO2 + 6 H2O mit Hilfe von Thornton's Rule (der oxikalorischen Äquivalenz) zu berechnen, gehen wir wie folgt vor:
Bestimmung der Anzahl übertragener Elektronen: Nach Thornton's Rule werden für die oxidative Umsetzung von Substraten Elektronen freigesetzt. Die Quelle gibt an, dass jedes Kohlenstoffatom in einer organischen Substanz, das oxidiert wird (z.B. zu CO2), einen Reduktionsgrad von 4 aufweist, d.h. 4 Elektronen entfernt werden können. In Glucose (C6H12O6) sind 6 Kohlenstoffatome enthalten. Die Gesamtzahl der übertragbaren Elektronen aus einem Mol Glucose beträgt somit: 6 Kohlenstoffatome × 4 Elektronen/Kohlenstoffatom = 24 Elektronen.
Berechnung der freigesetzten Wärme: Thornton's Rule besagt, dass für jedes übertragene Mol Elektronen (-)115 kJ an Wärme freigesetzt werden. Da 24 Mol Elektronen bei der vollständigen Oxidation von einem Mol Glucose übertragen werden, ist die freigesetzte Wärme für die gesamte Reaktion: 24 Mol Elektronen × (-115 kJ/Mol Elektron) = -2760 kJ.
Die freigesetzte Wärme für die Reaktion C6H12O6 + 6 O2 → 6 CO2 + 6 H2O beträgt demnach -2760 kJ. Dies entspricht auch dem Wert, wenn man die Angabe in der Quelle von -460 kJ/mol O2 mit den 6 Mol O2 der Reaktion multipliziert (6 × -460 kJ = -2760 kJ).
Was ist der Seebeck-Effekt und wie wird er für die Chip-Kalorimetrie genutzt?
Der Seebeck-Effekt ist ein thermoelktrisches Phänomen. Er beschreibt, dass in einem Stromkreis, der aus zwei verschiedenen Leitern besteht, eine elektrische Spannung entsteht, wenn zwischen den Kontaktstellen eine Temperaturdifferenz vorliegt.
Im Kontext der Chip-Kalorimetrie wird der Seebeck-Effekt genutzt, um die von Mikroorganismen erzeugte biologische Wärme zu messen.
Das Funktionsprinzip im Chip-Kalorimeter ist wie folgt:
Eine Probe aus dem Fermenter wird in eine Messkammer gepumpt, wodurch Störgrößen aus dem Reaktor (wie Rührerdrehzahl oder Begasung) keinen Einfluss auf die Messung haben.
Die von den Mikroorganismen erzeugte biologische Wärme in der Messkammer führt zu einer messbaren Spannung über den Seebeck-Effekt.
Diese Spannung ist direkt abhängig vom Temperaturunterschied, der durch die Stoffwechselaktivität der Organismen entsteht.
Wieso ist es vorteilhaft, einen Pipettierroboter zu nutzen, wenn man in Mikrotiterplatten
kultiviert? Nennen Sie zwei Gründe.
Die Nutzung eines Pipettierroboters bei der Kultivierung in Mikrotiterplatten (MTPs) bietet mehrere Vorteile, die zur Optimierung von Screening-Ansätzen beitragen. Hier sind zwei Gründe:
Erhöhte Reproduzierbarkeit und Vergleichbarkeit der Wachstumskinetiken: Pipettierroboter ermöglichen eine hochpräzise und konsistente Animpfung der Wells in Mikrotiterplatten. Dies führt zu einer deutlich vergleichbareren Wachstumskinetik zwischen den Replikatoren und reduziert Unterschiede, die andernfalls durch manuelles Abweichen im Handling entstehen könnten. Ein sehr reproduzierbares Wachstum ist für aussagekräftige Experimente essenziell.
Ermöglichung fortschrittlicher Inokulationsstrategien: Pipettierroboter sind unerlässlich für die Implementierung komplexer Vorkulturstrategien, wie die Inokulation nach einer bestimmten Zeit oder, noch präziser, nach Erreichen eines spezifischen Biomasse-Schwellenwerts (z.B. basierend auf Streulichtmessungen). Dies stellt sicher, dass die Organismen in einer möglichst gleichen Wachstumsphase in die Hauptkultur überimpft werden, was zu einem ebenfalls sehr reproduzierbaren Wachstum in der Hauptkultur führt und die Prozesskontrolle verbessert.
Warum ist es problematisch Elektroden im Schüttelkolben zu nutzen?
Die Nutzung von konventionellen (Fermenter-)Elektroden in Schüttelkolben ist problematisch und wird als keine gute Idee angesehen. Dies liegt an mehreren kritischen Auswirkungen auf die Kultivierungsbedingungen und die Messgenauigkeit:
Beeinflussung der Flüssigkeitsbewegung und des Gastransfers: Elektroden im Schüttelkolben beeinflussen die Flüssigkeitsbewegung im Kolben stark. Dies kann zu einem definierten Plateau im Sauerstofftransfer führen, welches die Berechnung des Sauerstofftransfers unmöglich macht. Das Verhalten ist ähnlich wie bei Schikanen.
Verlust der definierten Bedingungen: Der große Vorteil von Schüttelkolben sind ihre sehr genau definierten Bedingungen. Durch das Einbringen einer Elektrode wird dieser Vorteil hinfällig, da die Bedingungen nicht mehr exakt reproduzierbar oder kontrollierbar sind.
Volumen und permanenter Kontakt: Der Kolben kann potenziell sehr voll werden. Zudem sind die Elektroden nicht dauerhaft in der Flüssigkeit bedeckt, was die Zuverlässigkeit der Messungen beeinträchtigt.
Problem mit nassen Stopfen: Ein zusätzliches Problem ist, dass spritzende Kulturbrühe den Wattestopfen nass machen kann, was wiederum zu keinem Gastransfer führt.
In Mikrotiterplatten kann keine Clark-Elektrode verwendet werden. Welche Methode kann
man stattdessen nutzen, um den Gelöstsauerstoff zu messen?
Stattdessen werden in Mikrotiterplatten optische Messmethoden mittels Optoden genutzt, um den Gelöstsauerstoff zu messen.
Das Prinzip basiert auf dem Fluoreszenz-Quenching:
• Sensorspots/Optoden: Kleine Sensorspots mit immobilisiertem Fluoreszenzfarbstoff werden in den Boden der Wells der Mikrotiterplatte integriert. Diese Sensoren werden oft bereits im Werk kalibriert.
• Messprinzip: Der Fluoreszenzfarbstoff wird mit Licht einer bestimmten Wellenlänge (z.B. 520 nm) angeregt. Die anschließende Emission des Lichts (z.B. bei 600 nm) ist sauerstoffabhängig. Bei zunehmendem Sauerstoffgehalt nimmt die Lumineszenz ab (Quenching).
• Detektion: Ein Detektor misst die Phasenverschiebung zwischen dem angeregten und dem emittierten Lumineszenzsignal, oder die Abklingzeit des Lumineszenzsignals.
• Vorteile der optischen Messung in MTPs:
◦ Sie ist nicht-invasiv im Sinne, dass keine Elektrode direkt in die Flüssigkeit taucht und die Bewegung stört.
◦ Die Messung erfolgt durch den transparenten Boden des Wells, was die Beeinträchtigung der Kultivierung minimiert.
◦ Das Prinzip des Fluoreszenz-Quenchings kann auch mit Nanopartikeln im Kulturmedium oder einer Sensorpille, die sich mit der Flüssigkeit bewegt, umgesetzt werden, um ständigen Flüssigkeitskontakt zu gewährleisten.
◦ Plateaus in der pO2-Signalabnahme sind ein starkes Indiz für Sauerstofflimitierung.
• Herausforderungen: Die Fluoreszenzmessung kann durch Autofluoreszenz von Medienkomponenten (z.B. Hefeextrakt) beeinträchtigt werden. Ein Verständnis der Signalverläufe ist daher entscheidend für die korrekte Interpretation.
Alkali- und Säurefehler in eigenen Worten beschreiben.
Gerne erkläre ich die Alkali- und Säurefehler bei der pH-Wert-Messung in eigenen Worten, basierend auf den vorliegenden Quellen.
Die pH-Wert-Messung mit einer Glaselektrode beruht auf der Bildung eines Potentials an der pH-sensitiven Glasmembran, welches durch den Ionenaustausch von Wasserstoffionen beeinflusst wird. Unter bestimmten extremen Bedingungen kann dieses Messprinzip jedoch gestört werden, was zu den sogenannten Alkali- und Säurefehlern führt.
Alkalifehler:
Dieser Fehler tritt in stark alkalischen Lösungen auf, das heißt bei einem pH-Wert über 12.
In solch hohen pH-Bereichen ist die Konzentration der Wasserstoffionen (Protonen) extrem gering. Die Natriumionen (und andere einwertige Kationen) in der Lösung beginnen dann, anstelle der Wasserstoffionen, zur Potentialdifferenz an der Glasmembran beizutragen.
Das führt dazu, dass der gemessene pH-Wert niedriger ausfällt als der tatsächliche pH-Wert der Lösung. Die Stärke dieses Fehlers hängt dabei sowohl vom spezifischen Kation als auch von der Zusammensetzung der Glasmembran ab.
Säurefehler:
Der Säurefehler tritt in sehr sauren Lösungen auf, genauer gesagt bei einem pH-Wert unter 0,5.
Hier ist die Konzentration der Wasserstoffionen extrem hoch. Diese sehr hohe Protonenkonzentration behindert die Bewegung an der Glasmembran.
Die Folge ist, dass der gemessene pH-Wert höher angezeigt wird als er tatsächlich ist.
Unterschied Aufbau Redox-Elektrode und pH-Elektrode.
Die Redox-Elektrode und die pH-Elektrode weisen sowohl Gemeinsamkeiten im Messprinzip als auch wesentliche Unterschiede in ihrem Aufbau auf, insbesondere im Hinblick auf das sensorische Element.
Gemeinsamkeiten im Aufbau und Messprinzip:
Potentiometrische Messung: Beide Elektrodentypen basieren auf einer potentiometrischen Messmethode, bei der eine elektrische Potentialdifferenz bestimmt wird, die sich aus einer chemischen Reaktion ergibt. Dabei fließt kein realer Strom durch das Messsystem, da ein hochohmiges Voltmeter verwendet wird, um den Stromfluss zu verhindern. Die Messung erfolgt direkt als Spannung in Millivolt (mV).
Mess- und Bezugselektrode: Für beide Messungen sind eine Mess- und eine Bezugselektrode notwendig, um die Potentialdifferenz messen zu können.
Ag/AgCl-Referenzelektrode: Häufig wird bei beiden Elektrodentypen eine Ag/AgCl-Elektrode als Bezugselektrode verwendet, die ein konstantes, pH-unabhängiges Potential bereitstellt. Diese Bezugselektrode enthält üblicherweise eine KCl-Salzlösung als Innenelektrolyt, der über ein Diaphragma (poröser Stopfen) mit der Messlösung in Kontakt steht.
Hauptunterschied im Aufbau:
Der entscheidende Unterschied liegt im Material der Messelektrode und deren Interaktion mit der Messlösung:
pH-Elektrode:
Die Messelektrode einer pH-Elektrode, typischerweise eine Einstab-Messkette, verfügt über eine pH-sensitive Glasmembran.
Diese dünne Glasmembran bildet bei Kontakt mit wässrigen Lösungen eine Gelschicht. An dieser Gelschicht findet ein Ionenaustausch zwischen den Alkali-Ionen der Glasoberfläche und den Wasserstoff-Ionen (H+) der Lösung statt.
Dieser Ionenaustausch erzeugt ein sogenanntes Galvanipotential, das proportional zum pH-Wert der Probenflüssigkeit ist. Im Inneren der Messelektrode befindet sich ein Puffer (meist pH 7) und KCl, die ein konstantes Referenzpotential auf der Innenseite der Glasmembran gewährleisten.
Metalloxid-Elektroden sind eine Alternative zur Glaselektrode, haben aber ebenfalls eine pH-empfindliche Oberfläche und einen eingeschränkten pH-Bereich.
Redox-Elektrode:
Die Messelektrode einer Redox-Elektrode verwendet inerte Edelmetalle wie Platin (Pt) oder Gold (Au) anstelle einer pH-sensitiven Glasmembran.
Diese Edelmetalle interagieren nicht direkt chemisch mit der Lösung, sondern dienen als Sammelpunkt für Elektronen und messen das Gesamt-Redoxpotential der Lösung, welches von der Summe aller oxidierten und reduzierten Substanzen abhängt.
Das gemessene Redoxpotential ist ein Summenparameter, dessen Haupteinflussgrößen Sauerstoff, pH-Wert und andere oxidierte oder reduzierte Metabolite sind. Der Einfluss von Sauerstoff überwiegt dabei in aeroben Fermentationen.
Zusammenfassend lässt sich sagen, dass die pH-Elektrode spezifisch auf die Wasserstoffionenaktivität über eine Glasmembran reagiert, während die Redox-Elektrode die allgemeine Elektronenverfügbarkeit (Oxidations- oder Reduktionszustand) der Lösung mittels eines inerten Edelmetalls misst.
Warum ist die Gelöstsauerstoff-Konzentration die Haupteinflussgröße bei der Redox-
Messung?
Die Gelöstsauerstoff-Konzentration ist die Haupteinflussgröße bei der Redox-Messung, insbesondere in aeroben Fermentationen, da der Einfluss von Sauerstoff in der Regel überwiegt.
Um dies genauer zu erklären, hier die relevanten Punkte:
Redoxpotential als Summenparameter: Das gemessene Redoxpotential ist ein Summenparameter. Das bedeutet, es hängt von der Summe aller Redox-Paare in der Lösung ab und spiegelt die gesamte Verfügbarkeit von Elektronen wider.
Haupteinflussgrößen: Die wichtigsten Einflussgrößen auf das Redoxpotential sind Sauerstoff, der pH-Wert sowie andere oxidierte und reduzierte Metabolite (die oft unbekannt sind).
Dominanz von Sauerstoff: In Fermentationen, die unter aeroben Bedingungen ablaufen (also mit Sauerstoffzufuhr), überwiegt der Einfluss von Sauerstoff in der Regel auf das Redoxpotential. Dies liegt daran, dass Sauerstoff ein starkes Oxidationsmittel ist und seine Konzentration im Medium einen erheblichen Einfluss auf das Verhältnis von oxidierten zu reduzierten Komponenten hat.
Im Gespräch zuvor wurde bereits erläutert, dass die Redox-Elektrode, die inerte Edelmetalle wie Platin oder Gold verwendet, das Gesamt-Redoxpotential der Lösung misst, welches von der Summe aller oxidierten und reduzierten Substanzen abhängt. Der genannte Einfluss von Sauerstoff, der in aeroben Fermentationen überwiegt, ist dabei ein Schlüsselaspekt.
Clark-Elektrode beschriften.
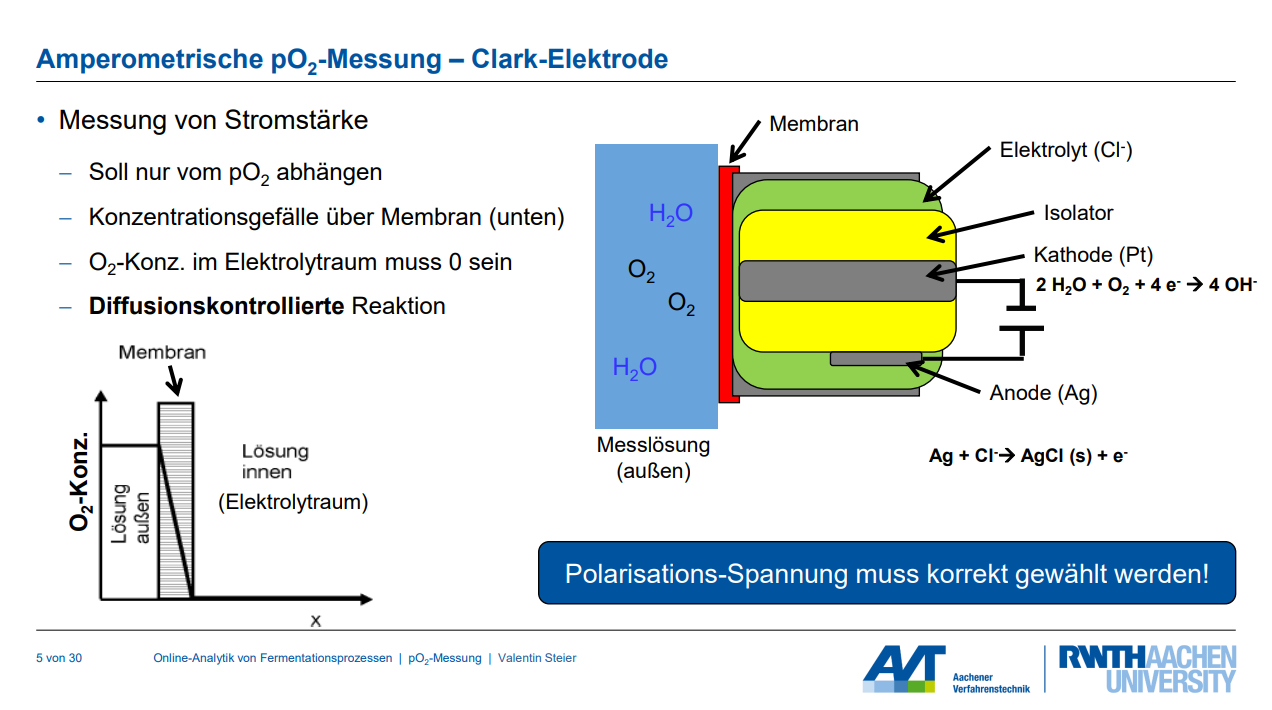
Messprinzip Clark Elektrode beschreiben
Die Clark-Elektrode ist das bekannteste Beispiel für die amperometrische Messung des Sauerstoffpartialdrucks (pO2). Sie wurde von Leland C. Clark im Jahr 1956 beschrieben.
Das Messprinzip lässt sich wie folgt zusammenfassen:
Angelegte Polarisationsspannung: Eine Spannung wird von außen an die Elektrode angelegt.
Zwei Elektroden: Die Clark-Elektrode besteht aus zwei Hauptkomponenten:
Einer Platin-Kathode (Pt).
Einer Silber-Anode (Ag).
Reaktionen an den Elektroden:
An der Platin-Kathode wird Sauerstoff reduziert, indem Elektronen aufgenommen werden: 2 H2O + O2 + 4 e- → 4 OH-. Dieser Prozess verbraucht Sauerstoff.
An der Silber-Anode wird Silber oxidiert, indem Elektronen abgegeben werden: Ag + Cl- → AgCl (s) + e-.
Messbarer Stromfluss: Durch diese Redoxreaktionen entsteht ein messbarer Stromfluss.
Sauerstoffselektive Membran: Die Elektroden sind durch eine dünne (ca. 20 µm), gaspermeable Membran vom Messgut getrennt. Diese Membran ist selektiv für Sauerstoff, um unerwünschte Reaktionen an den Elektroden zu verhindern.
Diffusionskontrollierte Reaktion: Sauerstoff diffundiert durch diese Membran in den Elektrolytraum der Elektrode. Dort muss die Sauerstoffkonzentration aufgrund der sofortigen Reduktion an der Kathode nahezu Null sein, wodurch die Reaktion diffusionskontrolliert abläuft. Das bedeutet, die Stromstärke ist direkt proportional zum Sauerstoffpartialdruck der Messlösung.
Wahl der Polarisationsspannung: Die angelegte Polarisationsspannung muss korrekt gewählt werden, um im sogenannten Plateaubereich zu arbeiten. In diesem Bereich ist der pO2 der einzige Einflussfaktor auf die gemessene Stromstärke. Eine zu niedrige Spannung würde eine unvollständige Sauerstoffumsetzung verursachen, während eine zu hohe Spannung unerwünschte Nebenreaktionen hervorrufen könnte.
Messung des Partialdrucks: Die Elektrode misst den Sauerstoffpartialdruck (pO2) und nicht die Sauerstoffkonzentration. Die Sauerstofflöslichkeit in der Membran ist unabhängig von der Sauerstofflöslichkeit im Medium, sodass die Zugabe von Salzen, die die Konzentration ändern, den Partialdruck nicht beeinflusst.
Kontinuierlicher Sauerstoffnachschub: Da Sauerstoff an der Kathode verbraucht wird, muss er kontinuierlich aus der Messlösung nachgeliefert werden. Daher ist die Messung auch von der Strömung und Viskosität der Messlösung abhängig.
Kalibrierung und Polarisation: Für genaue Messungen ist eine Polarisation der Membran (Dauer von Stunden bis zu einem Tag) und eine Kalibrierung unter den jeweiligen Fermentationsbedingungen (Rührerdrehzahl, Druck, Temperatur, Medium) erforderlich.
Wie verhält sich ein paramagnetischer und ein diamagnetischer Stoff in einem starken
Magnetfeld?
In einem starken Magnetfeld verhalten sich paramagnetische und diamagnetische Stoffe wie folgt:
Paramagnetische Materialien: Diese Stoffe werden in ein Magnetfeld hereingezogen. Sie richten ihre magnetischen Momente parallel zum äußeren Magnetfeld aus und verstärken dieses dadurch. Ein bekanntes Beispiel hierfür ist Sauerstoff (O2), dessen paramagnetisches Verhalten auf ungepaarten Elektronen in seinen Orbitalen beruht, deren magnetische Felder sich nicht aufheben. Die Magnetisierung eines paramagnetischen Stoffes ist dabei proportional zum angelegten Magnetfeld.
Diamagnetische Materialien: Diese Stoffe zeigen die Tendenz, aus einem Magnetfeld herauszuwandern. Sie richten sich entgegen dem äußeren Magnetfeld aus und schwächen dieses somit. Dieses Verhalten wird durch das magnetische Bahnmoment der Elektronen verursacht.
Nennen Sie zwei Sauerstoff-Analysatoren die auf dem Paramagnetismus beruhen.
Zwei Sauerstoff-Analysatoren, die auf dem Prinzip des Paramagnetismus beruhen, sind der Thermomagnetische Sauerstoff-Analysator und der Magnetomechanische Sauerstoff-Analysator (Pauling-Analysator). Sauerstoff (O2) ist eine paramagnetische Substanz, was bedeutet, dass er in ein Magnetfeld hineingezogen wird, da die magnetischen Felder seiner ungepaarten Elektronen sich nicht aufheben.
Hier ist eine kurze Beschreibung der beiden Analysatoren:
Thermomagnetischer Sauerstoff-Analysator:
Dieser Analysator wird auch als Magnetwind-Analysator bezeichnet.
Er funktioniert, indem Messgas, das Sauerstoff enthält, in eine Ringkammer strömt.
Der Sauerstoff wird in das Magnetfeld eines Messrohrs gezogen.
Ein Teil des Gases im Magnetfeld wird durch eine Heizspule erwärmt. Da die Suszeptibilität (Maß für die Stärke des Paramagnetismus) von Sauerstoff mit steigender Temperatur sinkt, wird die Magnetisierung des erwärmten Sauerstoffs reduziert.
Der erwärmte, weniger magnetische Sauerstoff wird vom nachströmenden kalten Gas verdrängt (dem "Magnetwind"). Die Geschwindigkeit dieser Strömung ist proportional zur Sauerstoffkonzentration.
Die Abkühlung der Heizspule durch den Gasfluss führt zu einer Widerstandsänderung, die mit einer Wheatstone-Brücke erfasst und als Maß für die Sauerstoffkonzentration genutzt wird.
Magnetomechanischer Sauerstoff-Analysator (Pauling-Analysator):
Dieses Prinzip wurde in den 1940er Jahren für militärische Anwendungen entwickelt.
Es basiert ebenfalls auf dem Paramagnetismus von Sauerstoff.
Sauerstoff fließt durch eine Messzelle und wird in ein Magnetfeld zwischen den Polen gezogen.
Dabei werden mit Stickstoff gefüllte Glaskugeln aus dem Magnetfeld gedrängt, was dazu führt, dass sich eine Hantel, an der die Glaskugeln befestigt sind, dreht.
Die Drehung der Hantel ist proportional zum Sauerstoffpartialdruck und wird über einen Spiegel und Fotozellen detektiert. Der Strom, der benötigt wird, um die Hantel in ihre Ausgangslage zurückzudrehen, ist direkt proportional zum Sauerstoffpartialdruck.
Ein dritter Analysator, der ebenfalls auf Paramagnetismus beruht, ist der Magnetoakustische Sauerstoff-Analysator.
Zwei Boxen mit O2, CO2 und N2 gegeben. Zustand A: 4 x O2, 2 N2, 4 CO2. Zustand B:
4 x O2, 3 CO2, 2 N2. Beschreibe die Änderung des Sauerstoffpartialsdruckes, der
Sauerstoffkonzentration und des Gesamtdrucks.
Um die Änderungen des Sauerstoffpartialdrucks, der Sauerstoffkonzentration und des Gesamtdrucks zwischen Zustand A und Zustand B zu beschreiben, gehen wir davon aus, dass die beiden Boxen das gleiche Volumen und die gleiche Temperatur haben. Nach dem idealen Gasgesetz ist der Druck direkt proportional zur Anzahl der Gasmoleküle.
Zustand A:
Anzahl Sauerstoff (O2) = 4
Anzahl Stickstoff (N2) = 2
Anzahl Kohlenstoffdioxid (CO2) = 4
Gesamtzahl der Moleküle (nA) = 4 + 2 + 4 = 10
Zustand B:
Anzahl Sauerstoff (O2) = 4
Anzahl Stickstoff (N2) = 2
Anzahl Kohlenstoffdioxid (CO2) = 3 (gegenüber Zustand A wurde 1 CO2-Molekül entfernt)
Gesamtzahl der Moleküle (nB) = 4 + 2 + 3 = 9
Basierend auf diesen Zahlen können die Änderungen wie folgt beschrieben werden:
Sauerstoffpartialdruck (pO2): Der Sauerstoffpartialdruck ist direkt proportional zur absoluten Anzahl der Sauerstoffmoleküle im System, unter der Annahme eines konstanten Volumens und einer konstanten Temperatur. Da in beiden Zuständen (A und B) die Anzahl der Sauerstoffmoleküle gleich bleibt (4 O2), ändert sich der Sauerstoffpartialdruck nicht. Die Clark-Elektrode misst beispielsweise den Sauerstoffpartialdruck und nicht die Konzentration, wobei die Gaszusammensetzung und damit der Partialdruck bei der Zugabe von Salzen (die die Konzentration ändern) unverändert bleiben würde.
Änderung: Der Sauerstoffpartialdruck bleibt gleich.
Sauerstoffkonzentration: Die Sauerstoffkonzentration (als Gasphase) ist definiert als die Anzahl der Sauerstoffmoleküle pro Volumeneinheit. Da die Anzahl der Sauerstoffmoleküle in beiden Zuständen (4 O2) und das Volumen der Boxen als konstant angenommen werden, bleibt auch die Sauerstoffkonzentration unverändert. Die Quellen unterscheiden zwischen der Sauerstoffkonzentration im Medium und dem Sauerstoffpartialdruck, wobei letzterer von der Gasphasenzusammensetzung abhängt.
Änderung: Die Sauerstoffkonzentration bleibt gleich.
Gesamtdruck: Der Gesamtdruck einer Gasmischung ist proportional zur Gesamtzahl der Moleküle. In Zustand A gibt es 10 Moleküle, während in Zustand B 9 Moleküle vorhanden sind. Da die Gesamtzahl der Moleküle von Zustand A zu Zustand B abnimmt (von 10 auf 9), nimmt auch der Gesamtdruck ab.
Änderung: Der Gesamtdruck nimmt ab.
2 Messprinzipien bei der Fluoreszenz-Analyse nennen.
Bei der Fluoreszenz-Analyse werden verschiedene Messprinzipien angewendet. Zwei davon sind:
Fluoreszenz-Quenching (Löschen der Fluoreszenz): Dieses Prinzip wird hauptsächlich zur Messung des Sauerstoffpartialdrucks (pO2) genutzt. Dabei wird ein Indikator mit Licht angeregt, und die Intensität seiner Lumineszenz nimmt mit zunehmendem Sauerstoffgehalt ab. Sauerstoff absorbiert einen Teil der Energie des angeregten Fluorophors, wodurch dessen Emission gemindert wird – dies wird als Quenching bezeichnet. Der Zusammenhang zwischen Fluoreszenzintensität und Sauerstoffpartialdruck wird durch die Stern-Volmer-Gleichung beschrieben. Die Messung kann über die Abklingzeit der Lumineszenz nach Pulsanregung oder über die Phasenwinkelverschiebung zwischen Anregungs- und Emissionslicht erfolgen. Dies ist ein selektiver Prozess, da der Sauerstoff direkt mit dem Fluorophor interagiert, um das Signal zu beeinflussen.
Ratiometrische Messung (pH-Messung mittels Fluoreszenzfarbstoff): Dieses Prinzip wird bei der pH-Wert-Messung unter Verwendung von Fluoreszenzfarbstoffen angewendet. Es basiert auf der Bestimmung des Verhältnisses aus mehreren Fluoreszenzintensitäten. Der Vorteil dieser Methode ist ihre Unempfindlichkeit gegenüber Störfaktoren wie der Drift der Lichtquelle, optischer Justierung, Photosensor- oder Verstärkerproblemen sowie der Trübung des Mediums oder dem Ausbleichen des Farbstoffs. Im Gegensatz zur reinen Intensitätsmessung, die anfälliger für solche Störungen ist, verbessert die ratiometrische Messung die Zuverlässigkeit, indem sie interne Referenzen nutzt.
Die Rührzahl wird schlagartig erhöht. Zeichne den Verlauf des yO2, Abgas und des pO2 quantitativ ein
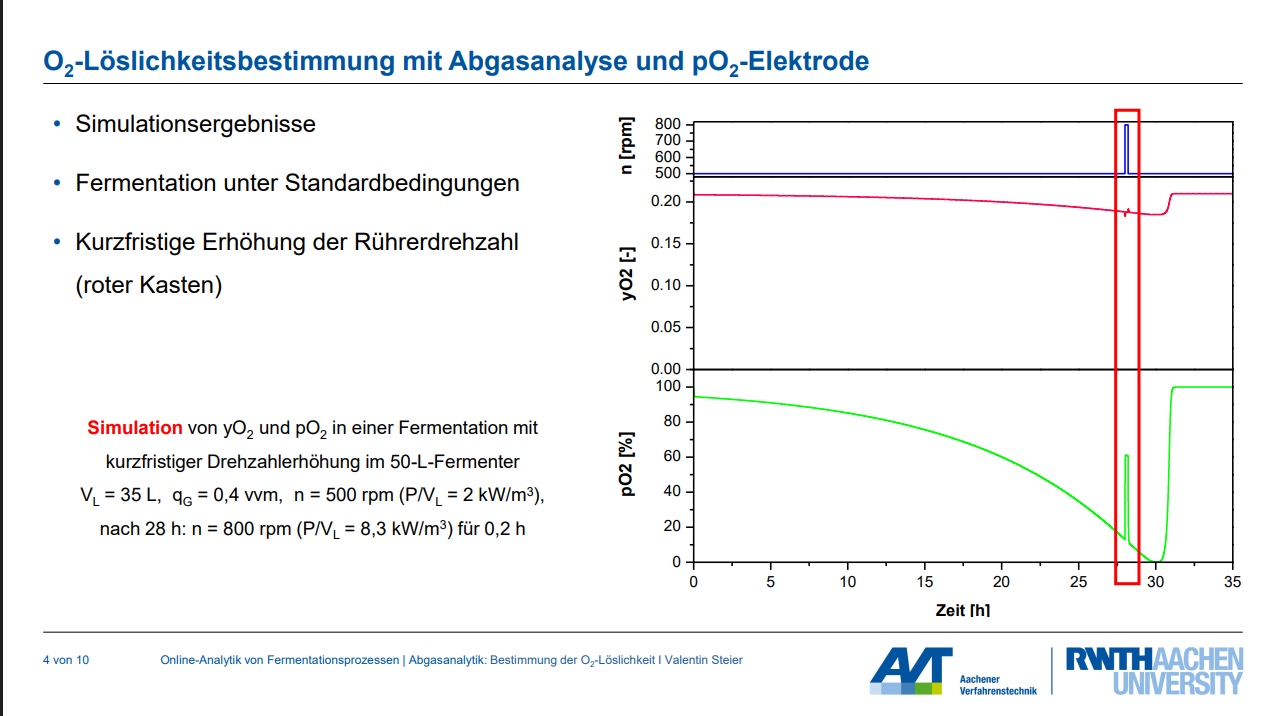
Was kann man bestimmen, wenn man bei Leitfähigkeitsmessung Wechselspannung
zusätzlich bestimmt? Warum nutzt man generell Wechselspannung?
Wenn bei der Leitfähigkeitsmessung zusätzlich Wechselspannung herangezogen wird, insbesondere im Kontext der Biomassemessung mittels Kapazitätsmessung, können mehrere wichtige Parameter bestimmt werden:
Was man bestimmen kann, wenn zusätzlich Wechselspannung bestimmt wird:
Vitale Biomasse (Zellzahl/Zellkonzentration): Die Kapazitätsmessung ist eine Methode, die ausschließlich vitale Biomasse erfasst. Zellen wirken in einem elektrischen Feld als Dipole und werden polarisiert, wodurch sie als zusätzliche Kondensatoren fungieren. Bei gleicher Spannung steigt die Gesamtkapazität mit zunehmender Zellzahl. Die Abhängigkeit der Kapazitätsänderung (ΔC) von der Zellkonzentration (N), dem Zellradius (r) und der Kapazität pro Einheits-Membranfläche (Cm) (ΔC ~ N r^4 Cm) erlaubt eine Quantifizierung der Biomasse, wenn die Zellgröße während der Fermentation konstant bleibt oder bei der Kalibrierung berücksichtigt wird.
Dielektrische Leitfähigkeit (Permittivität): Die gemessene Kapazität kann als dielektrische Leitfähigkeit oder Permittivität dargestellt werden, was unabhängig von der Elektrode und ihrem Abstand ist.
Hintergrundleitfähigkeit des Mediums: Die Kapazitätssonde ist in der Lage, auch die Leitfähigkeit der Messlösung zu bestimmen. Dies ist relevant, da die Leitfähigkeit des Mediums den Verlauf der Kapazitäts-Frequenz-Kurve beeinflusst.
Zellzustand und Vitalität: Ein starker Rückgang der Kapazität bei gleichzeitigem langsamem Anstieg der Biomasse kann auf Zelllyse hinweisen, da intrazelluläre Metabolite freigesetzt werden und die Leitfähigkeit des Mediums steigt. Dies gibt Aufschluss über die Integrität und den physiologischen Zustand der Zellen.
Einfluss von festen Partikeln: Feste Partikel wie Medienbestandteile haben meistens keinen Einfluss auf die Kapazitätsmessung, was ein Vorteil gegenüber optischen Methoden ist.
Warum man generell Wechselspannung nutzt:
Die Verwendung von Wechselspannung (AC) ist bei der Kapazitätsmessung entscheidend und bietet Vorteile:
Kapazitätsbildung bei spezifischen Frequenzen: Die Kapazität der Zellen bildet sich bei niedrigen Wechselstromfrequenzen aus, typischerweise im Bereich von 0,2 bis 10 MHz. Nur bei diesen Frequenzen können die Zellmembranen als Kondensatoren wirken und das Messsignal erzeugen.
Polarisation der Zellmembranen: Zellen besitzen isolierende Zellmembranen (Lipiddoppelschichten), die sich in einem elektrischen Feld als Kondensatoren verhalten. Die Wechselspannung bewirkt eine Polarisation dieser Zellmembranen, die direkt mit der Menge der vitalen Biomasse korreliert werden kann.
Vermeidung von Elektrodenpolarisation: Generell wird Wechselspannung in der Elektrochemie eingesetzt, um die Polarisation der Elektroden zu reduzieren. Bei der Kapazitätsmessung werden typischerweise vier Elektroden verwendet, um diesen Effekt weiter zu minimieren. Dies ist wichtig, da die Elektrodenpolarisation die gemessene Kapazität beeinflussen und zu fehlerhaften Messwerten führen kann. Gleichstrom würde zu einer Anhäufung von Ionen an den Elektroden führen, was die Messung über die Zeit verfälschen würde.
Eliminierung von Störsignalen (β-Dispersion): Durch die Messung bei verschiedenen Frequenzen kann die sogenannte β-Dispersion ausgewertet werden. Hierbei nimmt die Kapazität mit steigender Frequenz ab, da weniger Ionen die Zellmembran erreichen, um eine Polarisation zu bewirken. Dies ermöglicht die Unterscheidung des Signals von lebenden Zellen von der Hintergrundkapazität des Mediums.
Selektivität für vitale Biomasse: Die frequenzabhängigen dielektrischen Eigenschaften der vitalen Zellmembranen ermöglichen es, das Signal spezifisch auf lebende Zellen zu beschränken, da tote Zellen diese Eigenschaften nicht mehr in gleicher Weise aufweisen.
Nennen Sie zwei Methoden, um Wasser aus dem Abgas zu entfernen.
Um Wasser aus dem Abgas zu entfernen und somit genaue Online-Analysen zu ermöglichen sowie Geräteschäden zu vermeiden, können die Quellen zwei Hauptmethoden im Rahmen der Messgaskonditionierung nennen:
Genie Membranfilter:
Diese Filter dienen dazu, flüssiges Wasser und Schaum aus dem Abgas zu entfernen.
Das Prinzip basiert darauf, dass die Oberflächenspannung von Flüssigkeiten größer ist als die von Gasen. Eine hydrophobe Membran im Filter lässt Flüssigkeit nicht passieren.
Selbst kleinste Aerosoltropfen werden effektiv vom Gasstrom getrennt.
Ein großer Vorteil ist, dass die Gaszusammensetzung unverändert bleibt, da das gesamte Gas bzw. der Dampf die Membran passiert.
Der Separator muss so installiert sein, dass Wasser abfließen kann.
Nafion-Schläuche:
Nafion-Schläuche werden eingesetzt, um überschüssigen Wasserdampf zu entfernen, um so Kondensation in den Analysegeräten zu verhindern.
Nafion ist ein synthetisches Polymer mit ionischen Eigenschaften, das die physikalischen und chemischen Eigenschaften von Teflon mit ionischen Charakteristiken kombiniert.
Es besitzt die Eigenschaft, sehr selektiv und permeabel für Wasser zu sein. Die Sulfongruppen des Polymers absorbieren Wasser effizient und ermöglichen einen schnellen Transfer des Wassers durch das Nafion-Material.
Die Permeabilität von Nafion ist für Wasser im Vergleich zu anderen Gasen wie CO2, O2 oder N2 logarithmisch sehr hoch.
Zusätzlich zu diesen spezifischen Methoden wird allgemein die Abgaskühlung als eine Maßnahme genannt, um Störfaktoren wie den Wasserdampfpartialdruck zu vermeiden oder zu kompensieren.
Die Entfernung von Wasserdampf ist wichtig, da dessen Präsenz die Messung beeinflussen und zu fehlerhaften Daten führen kann, beispielsweise indem ein Sauerstoffverbrauch gemessen wird, wo keiner ist.
Aufbau Durchlicht Photometer malen.
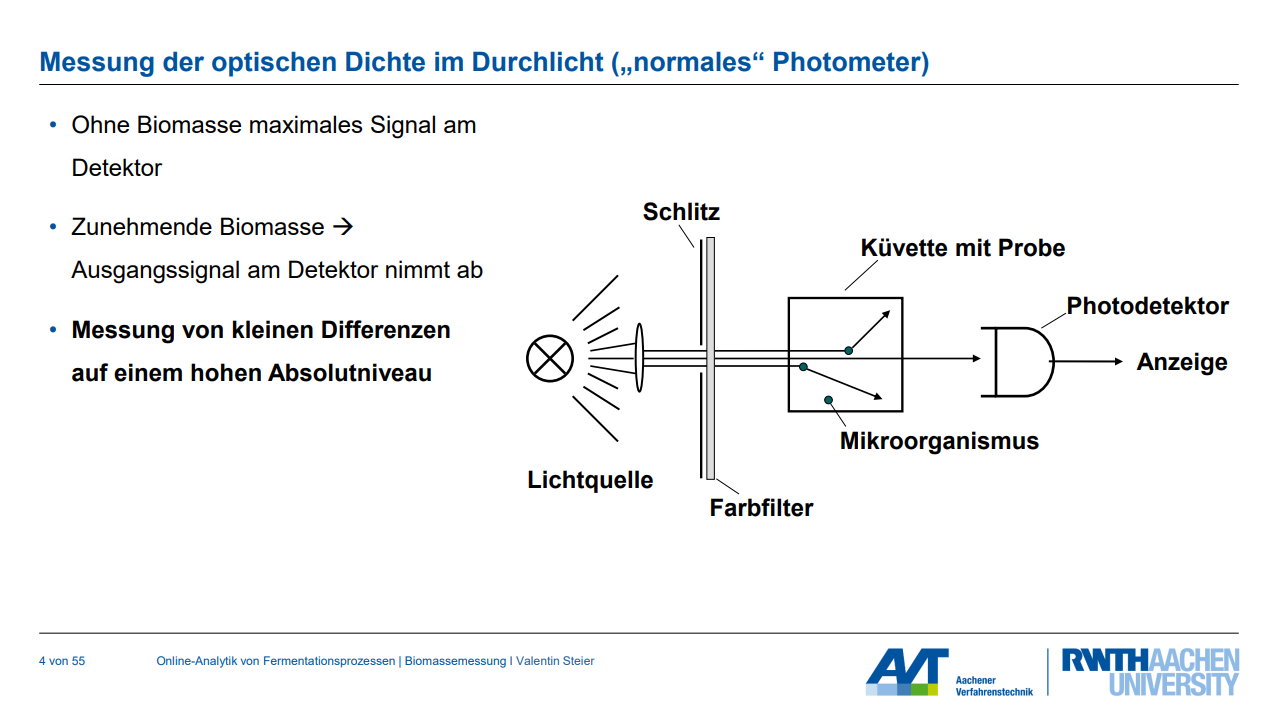
Detektor für Nephelometer einzeichnen.
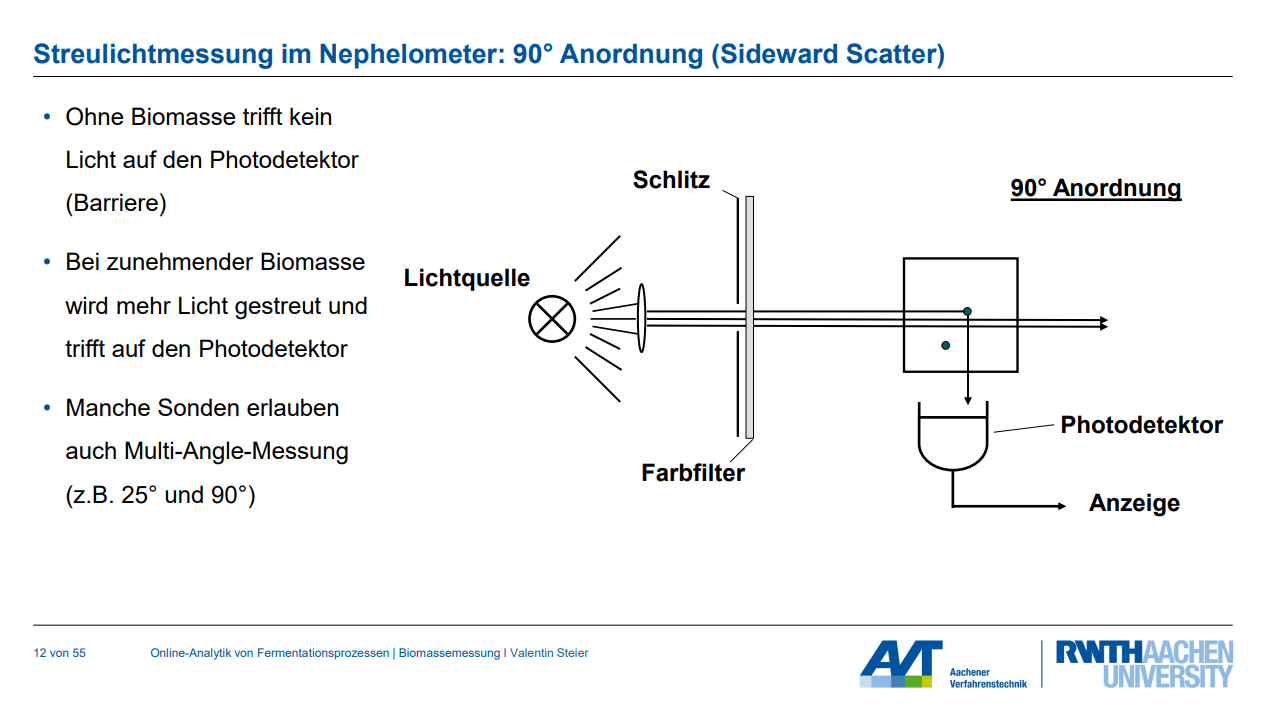
Was hat bei der Streulicht-Messung noch einen Einfluss auf das Messsignal?
Bei der Streulichtmessung, wie sie beispielsweise in der Nephelometrie zur Biomassebestimmung eingesetzt wird, haben verschiedene Faktoren einen Einfluss auf das Messsignal, der über die reine Zellkonzentration hinausgeht. Dies kann die Spezifität und Genauigkeit der Messung erheblich beeinflussen:
Partikelgröße und -form: Die Streuung des Lichts hängt von der Größe und Form der Partikel ab. Da Mikroorganismen unterschiedliche Größen und Formen aufweisen können und sich diese während einer Fermentation ändern können, wirkt sich dies direkt auf das Streulichtsignal aus.
Alle lichtstreuenden Komponenten: Das Messsignal erfasst nicht nur die gewünschte Biomasse, sondern alle Komponenten, die Lichtstreuung verursachen. Dazu gehören:
Zellen (tot und lebendig!): Es wird kein Unterschied zwischen lebenden und toten Zellen gemacht.
Medienkomponenten: Bestandteile des Kulturmediums können Licht streuen.
Feststoffpartikel: Insbesondere industriell eingesetzte Komplexmedien beinhalten häufig feste Partikel, wie zum Beispiel Fischmehl, Erdnussöl, Maisstärke, Baumwollsaatmehl oder Sojabohnenmehl. Die Konzentration oder Zusammensetzung dieser Partikel kann sich im Laufe der Fermentation ändern und somit das Messsignal beeinflussen.
Gasblasen: Auch Gasblasen im Medium können das Lichtstreusignal verfälschen.
Morphologie der Zellen: Die Morphologie der Zellen kann das Messsignal ebenfalls beeinflussen. Wenn sich die Zellmorphologie, beispielsweise durch intrazelluläre Produktakkumulation oder Aggregatbildung, ändert, wird dies im Streulichtsignal sichtbar.
Konzentration/Medienzusammensetzung: Eine Änderung der Konzentration oder Zusammensetzung der Medienbestandteile während der Fermentation kann das Streulichtsignal stark und unterschiedlich beeinflussen.
Sättigung des Signals: Obwohl die Streulichtmessung in der Regel linear bis zu sehr hohen Biomassekonzentrationen sein kann, ist es wichtig zu beachten, dass bei extremer Dichte oder ungünstigen Bedingungen auch hier eine Sättigung eintreten kann, wenn auch nicht so schnell wie bei der Durchlichtmessung.
Gerätespezifische Einstellungen: Generell haben die Geräte spezifische Messeinstellungen und Auswertungen, wie zum Beispiel die Wellenlänge oder die optische Pfadlänge. Skalen werden häufig mit "arbitrary units" (a.u.) annotiert, was den Vergleich zwischen unterschiedlichen Messgeräten und -methoden erschwert.
Aufgrund dieser vielfältigen Einflussfaktoren ist die mangelnde Selektivität eine der größten Herausforderungen bei der Streulichtmessung. Dies bedeutet, dass das gemessene Signal nicht immer eindeutig der Biomasse zugeordnet werden kann und eine sorgfältige Kalibrierung unter den spezifischen Fermentationsbedingungen sowie ein fundiertes Prozessverständnis erforderlich sind.
Warum ist bei den MTPs die Durlichtmessung schlecht? Nenne 4 Nachteile.
Die Durchlichtmessung (Absorbanz-Messung) in Mikrotiterplatten (MTPs) ist aufgrund mehrerer Nachteile nur eingeschränkt einsetzbar, insbesondere bei höheren Biomassekonzentrationen. Hier sind vier wesentliche Nachteile, die in den Quellen genannt werden:
Sehr schnelle Sättigung des Signals: Die Durchlichtmessung ist nur in einem kleinen Bereich annähernd linear und erreicht bereits bei geringen Biomassekonzentrationen eine Sättigung. Dies bedeutet, dass das Signal auch bei weiter steigender Biomasse kaum noch zunimmt, wodurch keine genaue Korrelation mit der tatsächlichen Biomasse mehr möglich ist. Die Messung ist daher nur sinnvoll bei geringen Biomassekonzentrationen.
Beeinträchtigung durch Meniskus und Sterilabdeckung: Der Meniskus (die Krümmung der Flüssigkeitsoberfläche) und die Sterilabdeckung der Wells können die Messung erheblich beeinflussen und als Hindernisse wirken.
Unterbrechung des Schüttelns und somit der Sauerstoffzufuhr: Je nach Messgerät und Durchführung muss das Schütteln für die Messung unterbrochen werden. Dies führt zu einer unterbrochenen Sauerstoffzufuhr, was die Kulturbedingungen stark beeinträchtigen und somit die Messergebnisse verfälschen kann.
Einfluss durch Verdunstung: Die Messung wird durch Verdunstung beeinflusst, was zu Volumenänderungen in den kleinen Wells der MTPs führen kann. Dies ist besonders problematisch, da MTPs ohnehin nur sehr kleine Volumina (maximal 200 µL) ermöglichen.
Reaktorkalorimetrie: Gleichung für U. δ/λ erklären. Welche Einheit hat U? Wofür
steht δ?
Im Kontext der Reaktorkalorimetrie, bei der die Bilanzierung mittels Wärmedurchgang erfolgt, wird die volumenspezifische Wärmeleistung ($\dot{q}$) durch die Gleichung $\dot{q} = \frac{U \cdot A \cdot (T_R - \bar{T}J)}{V{Reaktor}}$ berechnet. Hierbei ist $U$ der Wärmedurchgangskoeffizient.
Die Gleichung zur Bestimmung des Wärmedurchgangskoeffizienten $U$ ist wie folgt gegeben: $\frac{1}{U} = \frac{1}{\alpha_i} + \frac{\delta}{\lambda_i} + \frac{1}{\alpha_a}$
Hier sind die Erklärungen der einzelnen Terme und deren Einheiten:
U (Wärmedurchgangskoeffizient):
Der Wärmedurchgangskoeffizient $U$ beschreibt die Effizienz der Wärmeübertragung durch eine Trennwand zwischen zwei Fluiden.
Einheit von U: $W/(m^2 \cdot K)$.
$U$ kann berechnet werden (besonders bei gut bekannten Systemen) oder messtechnisch bestimmt werden, wobei Letzteres zusätzlichen apparativen Aufwand erfordert.
$\delta$ (Wärmeleitung Innenwand):
$\delta$ steht für die Dicke der Wand durch die die Wärme geleitet wird, in diesem Fall die Innenwand des Reaktors.
Einheit von $\delta$: Meter ($m$) (impliziert durch die Einheit von $\lambda_i$).
$\lambda_i$ (Wärmeleitfähigkeit Innenwand):
$\lambda_i$ ist die Wärmeleitfähigkeit der Innenwand des Reaktors. Sie beschreibt, wie gut das Material Wärme leitet. Die Quelle bezeichnet $\lambda_i$ als "Wärmeleitung Innenwand" und gibt die Einheit als $(m^2 \cdot K)/W$ an. Diese Einheit ist jedoch die Einheit des spezifischen Wärmewiderstands. Die übliche Einheit für die Wärmeleitfähigkeit ist $W/(m \cdot K)$. Es ist anzunehmen, dass $\lambda_i$ hier die Wärmeleitfähigkeit der Wand darstellt.
$\alpha_i$ (Wärmeübergang Medium-Innenwand):
$\alpha_i$ ist der Wärmeübergangskoeffizient zwischen dem Medium (im Reaktorinneren) und der Innenwand.
Einheit von $\alpha_i$: $W/(m^2 \cdot K)$.
$\alpha_a$ (Wärmeübergang Innenwand-Kühlwasser):
$\alpha_a$ ist der Wärmeübergangskoeffizient zwischen der Innenwand und dem Kühlwasser im Kühlmantel.
Einheit von $\alpha_a$: $W/(m^2 \cdot K)$.
Diese Gleichung berücksichtigt also den Wärmewiderstand an den Grenzflächen (Wärmeübergang) und innerhalb der Wand (Wärmeleitung), um den gesamten Wärmedurchgang zu quantifizieren.
Fluoreszenzsignal von NADH bei O2 Limitation einzeichnen.
Im Kontext der Online-Analytik von Fermentationsprozessen ist die Fluoreszenzmessung von NADH ein wichtiges Werkzeug zur Überwachung des metabolischen Zustands von Mikroorganismen.
Erklärung des NADH-Fluoreszenzsignals bei Sauerstofflimitierung:
Grundlagen NADH-Fluoreszenz: NADH (Nicotinamid-Adenin-Dinukleotid in reduzierter Form) ist eine zentrale Schnittstelle zwischen katabolischen und anabolischen Prozessen im Stoffwechsel. Von den beiden Formen NAD+ und NADH fluoresziert nur die reduzierte Form, NADH.
Auswirkungen von Sauerstofflimitierung:
Unter aeroben Bedingungen mit ausreichender Sauerstoffversorgung wird NADH in der Regel rasch in der Atmungskette zu NAD+ reoxidiert. Daher sind die intrazellulären NADH-Konzentrationen (und somit das Fluoreszenzsignal) in dieser Phase tendenziell niedriger. In unlimitierten Kulturen kann die NADH-Fluoreszenz gut mit der Biomasse korrelieren.
Wenn jedoch eine Sauerstofflimitierung eintritt, kann die Atmungskette ihre Funktion nicht mehr ausreichend erfüllen, um das anfallende NADH zu reoxidieren. Dies führt zu einer Akkumulation von NADH innerhalb der Zelle.
Diese Akkumulation von NADH äußert sich in einem deutlichen Anstieg des Fluoreszenzsignals. Die Änderung des NAD+/NADH-Verhältnisses ist somit ein direkter Indikator für den Energie- und Redoxzustand der Zelle.
Oft geht dieser Anstieg des NADH-Signals unter Sauerstofflimitierung mit einer Umstellung des Stoffwechsels einher, beispielsweise auf die Produktion von Overflow-Metaboliten wie Ethanol oder andere Gärungsprodukte.
Einzeichnen des NADH-Fluoreszenzsignals bei O2-Limitierung (basierend auf Beispiel):
Stellen Sie sich zwei parallel verlaufende Kurven über die Zeit vor: eine für den gelösten Sauerstoffpartialdruck (pO2) und eine für die Fluoreszenz (z.B. in mV).
Startbedingungen (ausreichend Sauerstoff):
Die pO2-Kurve würde zunächst auf einem hohen Niveau verlaufen, z.B. bei 60-70% Sauerstoffsättigung.
Die Fluoreszenzkurve würde in dieser Phase auf einem relativ niedrigen, stabilen Basislinienwert liegen, da NADH kontinuierlich reoxidiert wird.
Einsetzen der O2-Limitierung:
Zu einem bestimmten Zeitpunkt (z.B. durch Abschalten der Begasung oder erhöhte metabolische Aktivität der Kultur) fällt die pO2-Kurve rapide ab und erreicht schnell 0 % (oder nahe 0 %).
Gleichzeitig beginnt die Fluoreszenzkurve (NADH-Fluoreszenz) signifikant und steil anzusteigen. Dieser Anstieg spiegelt die Akkumulation von NADH aufgrund der unzureichenden Reoxidation wider.
Zustand unter O2-Limitierung:
Die pO2-Kurve verbleibt auf 0 % (oder sehr niedrig).
Die Fluoreszenzkurve erreicht ein neues, höheres Plateau. Dies deutet darauf hin, dass die Zellen nun primär anaerobe/fermentative Stoffwechselwege nutzen, bei denen NADH akkumuliert und nicht mehr effizient durch Sauerstoff reoxidiert werden kann.
Das Beispiel einer kontinuierlichen Kultur von Candida tropicalis in den Quellen illustriert dies sehr deutlich: Nach dem Ausschalten der Begasung fällt der gelöste Sauerstoffpartialdruck (pO2) auf 0 %, und gleichzeitig steigt die Fluoreszenz des NADH stark an, da C. tropicalis unter diesen Bedingungen Ethanol bildet.
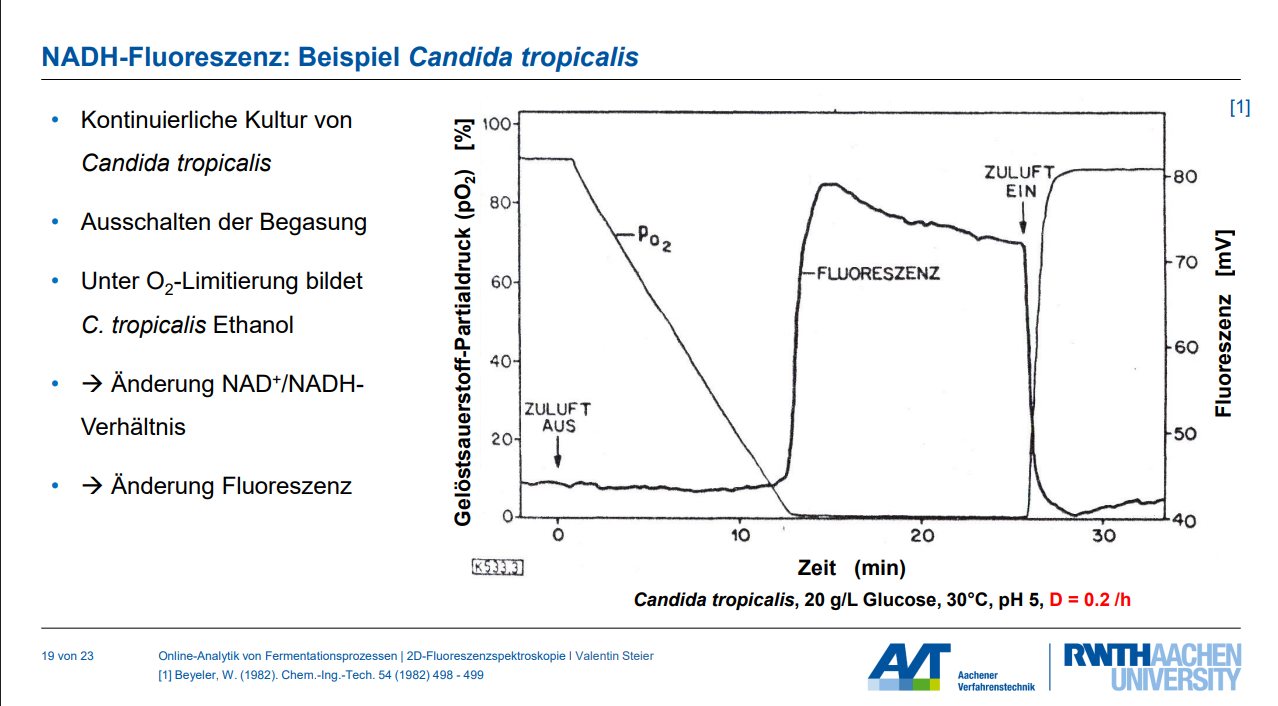
Beschreibe bei der Mikroskopie das Prinzip der Schärfentiefe. Warum muss keine
mechanische Abtrennung des Probenvolumens getroffen werden?
Bei der Online-Mikroskopie existieren zwei fortgeschrittene Varianten von Inline-Mikroskopen, wovon eine das Prinzip der Schärfentiefe nutzt.
Prinzip der Schärfentiefe:
Das Prinzip basiert auf einer sehr kurzen Blitzbeleuchtung, die eine Reihenfolge von Standbildern erzeugt und somit keine Bewegungsunschärfe aufweist.
Ein entscheidendes Merkmal ist die unterschiedlich starke Abbildungs-Unschärfe je nach Abstand des Objekts zum Objektiv. Eine unscharfe Zelle erscheint beispielsweise größer und verschwommener und hat tendenziell einen geringeren Kontrast als eine scharfe Zelle.
Die Unschärfe ist bei einem gegebenen Partikel eine Funktion seines Abstandes von der Position scharfer Bildfokussierung.
Warum keine mechanische Abtrennung des Probenvolumens nötig ist:
Bei der Auswertung wird eine automatische Abgrenzung eines festen Suspensionsbereiches bei festgelegter maximaler Unschärfe vorgenommen.
Für quantitative Messungen wird eine Obergrenze für die Ausprägung der Unschärfe in den registrierten Bildern festgelegt, d.h., es wird definiert, wie scharf eine Zelle sein muss, um gezählt zu werden.
Diese virtuelle Festlegung des Probenvolumens durch die Bildverarbeitung ermöglicht quantitative Messungen ohne mechanische Abgrenzung des Probenvolumens.
Die Fermentationsbrühe fließt bei dieser Ausführung kontinuierlich durch einen kleinen Spalt zwischen Belichtungsleiter und Quarzglas.
Im Vergleich zum Prinzip des Probeneinschlusses, bei dem das mikroskopierte Volumen mechanisch eingeschlossen und beruhigt wird, um scharfe Bilder zu erhalten, bietet das Prinzip der Schärfentiefe eine dynamischere Probenanalyse und hat einen geringeren Einfluss auf die Kultur, was eine Echtzeitanalyse ermöglicht.
Es war der schematische Aufbau eines magneto-akustischen Gasanalysators gegeben. Diese
sollte man beschriften.
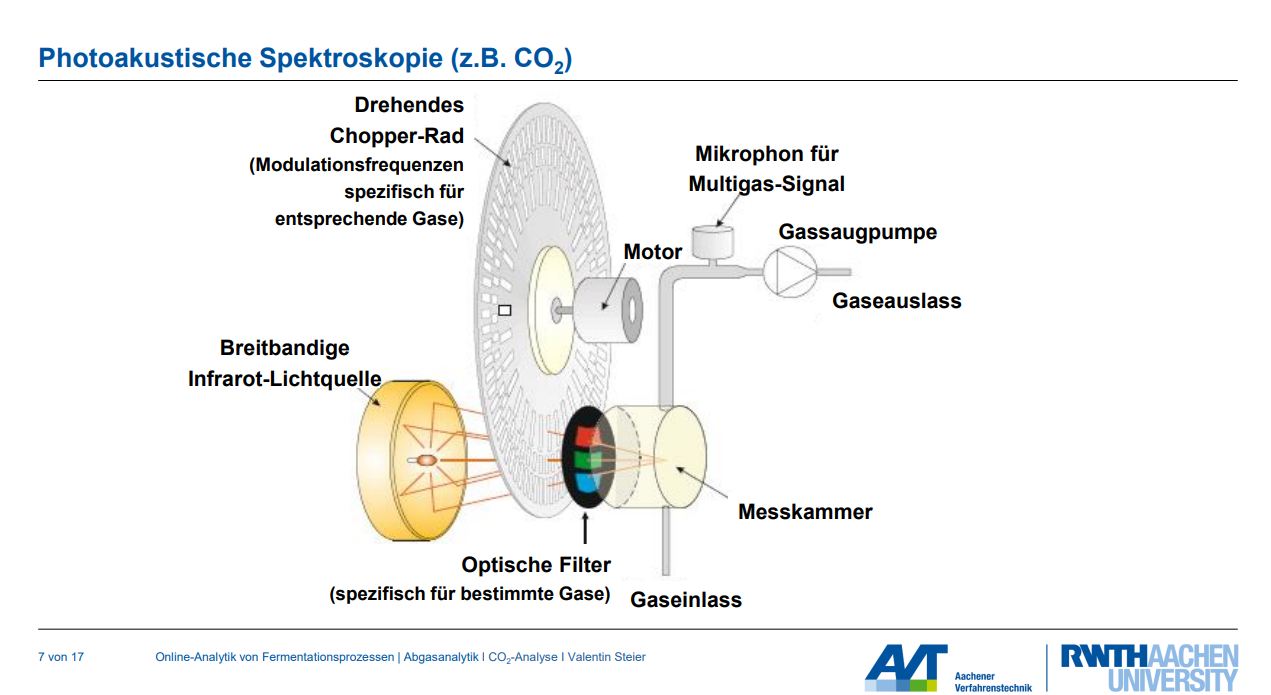
Welche Gase können mit dem magneto-akustischen Gasanalysator gemessen werden?
Der magneto-akustische Gasanalysator ist primär für die Messung von Sauerstoff (O2) konzipiert.
Sein Messprinzip basiert auf dem Paramagnetismus von Sauerstoff:
Sauerstoff in einem alternierenden magnetischen Feld wird expandiert und kontrahiert.
Dies erzeugt eine Druckwelle, deren Intensität proportional zum Sauerstoffpartialdruck ist.
Diese Druckwelle wird über ein Mikrofon gemessen.
Es gibt auch ein kombiniertes magneto- und photoakustisches Gasmesssystem, das eine gleichzeitige Messung von CO2 und O2 im Abgasstrom ermöglicht. In diesem kombinierten System ist die magneto-akustische Komponente für Sauerstoff zuständig, während die photoakustische Komponente für die CO2-Messung genutzt wird.
in welchem Bereich ist die optische pO2-Messung genauer als die Clark-Elektrode?
Basierend auf den vorliegenden Quellen ist die optische pO2-Messung (mittels Optode) genauer als die Clark-Elektrode bei niedrigem Sauerstoffpartialdruck.
Im Detail:
Die Clark-Elektrode ist besonders sensitiv bei hohem Partialdruck.
Die Optode zeichnet sich hingegen durch eine besondere Sensitivität bei niedrigem Partialdruck aus.
Die Fluoreszenz-Quenching-Messung, die die Grundlage der Optode bildet, ist besonders für geringe Sauerstoffpartialdrücke geeignet. Die Auflösung ist hierbei abhängig vom Sauerstoffpartialdruck.
Zusätzliche Informationen zu den beiden Methoden:
Clark-Elektrode: Verfügt über ein geringeres Signalrauschen und muss gereinigt werden, da sich AgCl an der Anode ablagert. Sie misst den Sauerstoffpartialdruck, nicht die Konzentration.
Optode: Hat eine geringere Ansprechzeit und muss nicht polarisiert werden. Ihre Lebensdauer ist jedoch durch Ausbleichen und Ausbluten des Farbstoffs begrenzt. Optoden sind zudem miniaturisierbar.
Aus welchem Material ist die Matrix, durch die die Oxid-Ionen bei der Lambda-Sonde wandern?
Bei der Lambda-Sonde, die zur optischen pO2-Messung eingesetzt wird, wandern die Oxid-Ionen (O2-) durch eine Matrix aus Zirconiumdioxid (ZrO2).
Dieses Material wird als Festkörper-Elektrolyt verwendet, in dem die O2--Ionen beweglich sind. Die Diffusion der Sauerstoffionen durch das Zirconiumdioxid ist temperaturabhängig, weshalb die Sonde bei hohen Betriebstemperaturen (ca. 600 °C) arbeitet. Das Zirconiumdioxid ist häufig mit Fremdionen dotiert, was Gitterdefekte verursacht und die Bewegung der O2--Ionen ermöglicht.