Organisk och allmän kemi
1/34
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
35 Terms
allmän kemi
atomkärna: protoner(positiva), neutroner Utanför:elektroner(negativa)
Pi-bindning/π bindning
dubbelbindning och vid trippelbindning finns det 2 pi bindningar
vilka typer av bindningar finns det?
kovaleta bindningar, jonbindning, Van Der Waals, dipol-dipol och vätebindning
Kovalent bindning
I en kovalen bindning delar man på elektronerna som gör bindningen väldigt stabil (intramolekylär).
jonbindning
Jonbindning är en attraktion mellan positivt och negativt laddade joner (intramolekylär). Då ger molekyler bort elektroner för att göra andra atomer stabilare som t.ex. Na+ och Cl-.
Van Der Waals
Van Der Waals är svaga bindningar som är övergående, tillfällig polarisering i molekylerna. Ju större kolkedjan är desto fler Van Der Waals bindningar finns det och detta gör det mer energikrävande att sära på kolkedjorna vilket i sin tur gör att kokpunkten ökar. Bindningen uppstår på grund av temporära förändringar i elektronmolnet runt en molekyl vilket gör den till en svag dipol (intermolekylär).
vätebindningar
Vätebindningar är intermolekylära bindningar mellan molekyler som är svagare än kovalenta bindningar och jonbindningar.
Dipol-Dipol bindningar
Dipol-Dipol bindningar är permanenta partiella laddningar, bildas mellan atomer med en elektronegativ laddning och elektropositiv laddning och är svagare än vätebindningar
vilka interaktioner finns det?
hydrofoba interaktioner och hydrofila interaktioner
Hydrofoba interaktioner
Hydrofoba molekyler såsom fettmolekyler tvingas samman på grund av repulsion av vatten.
hydrofila interaktioner
Interaktioner som sker mellan molekyler som löser sig bra i vatten.
Arrheius
Syror generar vätejoner(H⁺) i kontakt med vatten, och baserna genererar hydroxidjoner(OH⁻) när de kommer i kontakt med vatten
Buffert
Motstår pH förändring alltså om pH sjunke(syra)r kommer bufferten neutralisera den till det vanliga och om pH ökar(basist) kommer den neutralisera.(en buffert motstår förändringar i pH när små mängder syra eller bas tillsätts9
organisk kemi kolkedjor som du skall kunna
metan, etan ,propan, butan, pentan, hexan, heptan, oktan
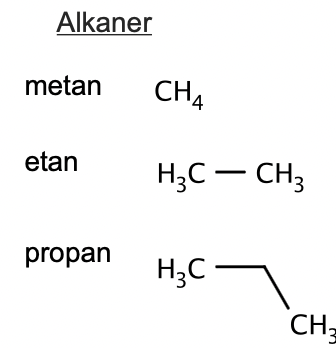
vad känner tecknar alkaner
uppbyggnad av kolkedja såsom Metan, Etan, Propan(suffix:-an)
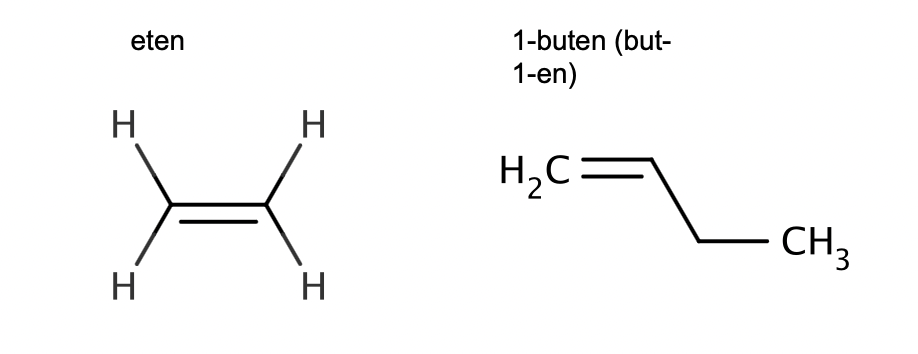
vad känner tecknar alkener
uppbyggnad av kolkedja med dubbelbindning såsom Meten, Eten, Propen(suffix:-en)
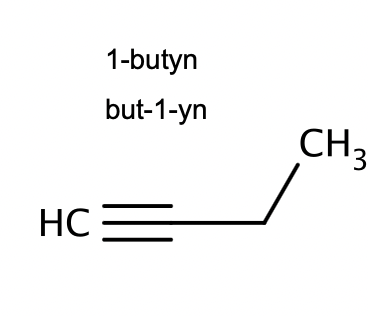
vad känner tecknar alkyner
Uppbyggnad av kolkedja med trippelbindning såsom Metyn, Etyn, Propyn(suffix:-yn)
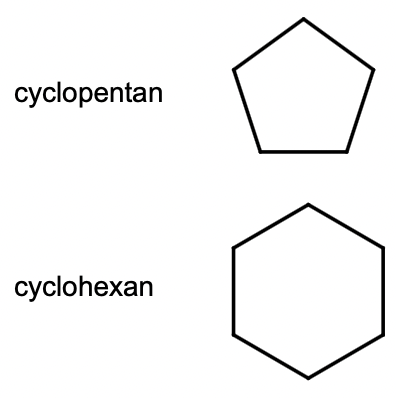
cykloalkaner
prefix: cyclo-
Aromater
Extra stabila kolkedjor
alkoholer
Prefix: hydroxyl-, Suffix: -ol. kännetecknas av en OH

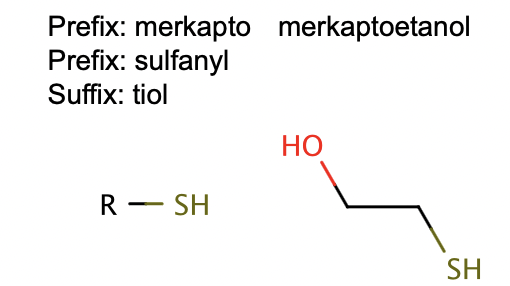
Tioler
prefix: merkapto- eller sulfanyl-, suffix:-tiol
karboxylsyror
suffix:-syra. dubbelbindning till en syra(O) och enkelbindning till en negativ syra (O^-)
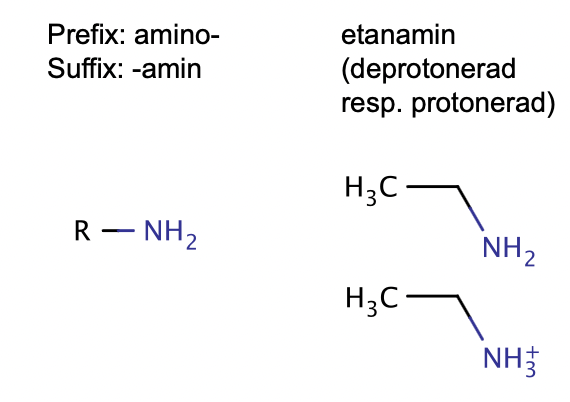
aminer(baser)
Suffix:-amin och prefix:amino-
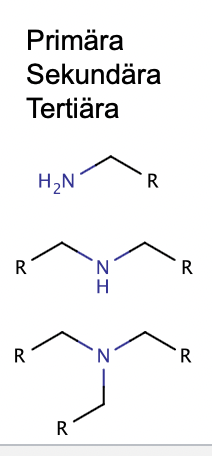
primär, sekundära och tertiära strukturer. hur ser de ut?
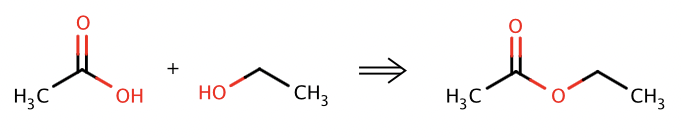
estrar ser ut och vad förenas de med
Ester: Förening mellan karboxylsyra och alkohol
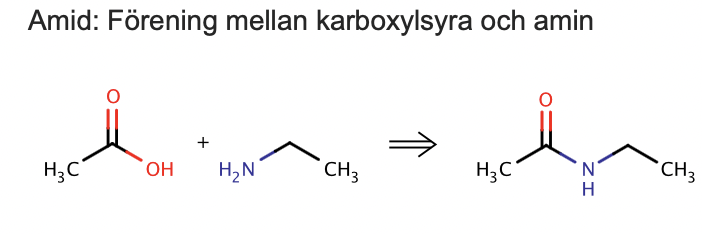
amid ser ut och vad förenas de med
Amid: Förening mellan karboxylsyra och amin
etrar
är kolkedjor som är bundna till enbart en syreatom som t.ex. dietyleter
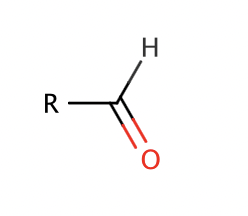
aldehyder struktur
suffix: -al
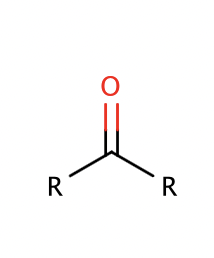
ketoner struktur
Suffix: -on
isomeri
Konstitutionell Isomeri
Samma formel – olika sammanbundna atomer - olika egenskaper
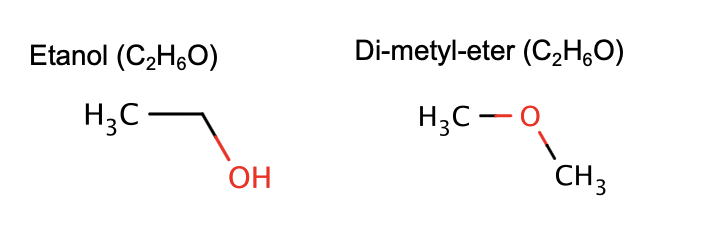
stereoisomeri
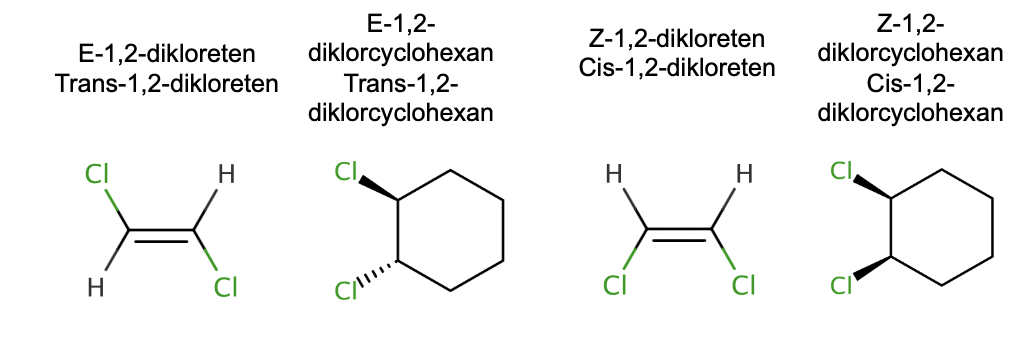
E/Z-Isomeri – samma bindningar – olika organisation i rymden –
olika egenskaper. (skit i bild 2 och 4)
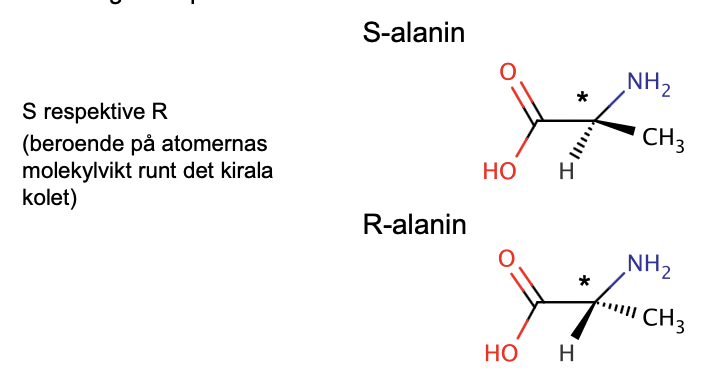
stereoisomeri (spegelbilder)
Kiralitet, samma struktur – spegelbilder (enantiomerer) – samma
kemiska egenskaper
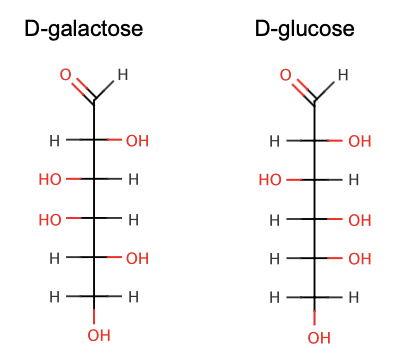
stereoisomeri (icke spegelbilder)
Diastereomerer – Stereoisomerer som ej är spegelbilder – olika kemiska
egenskaper
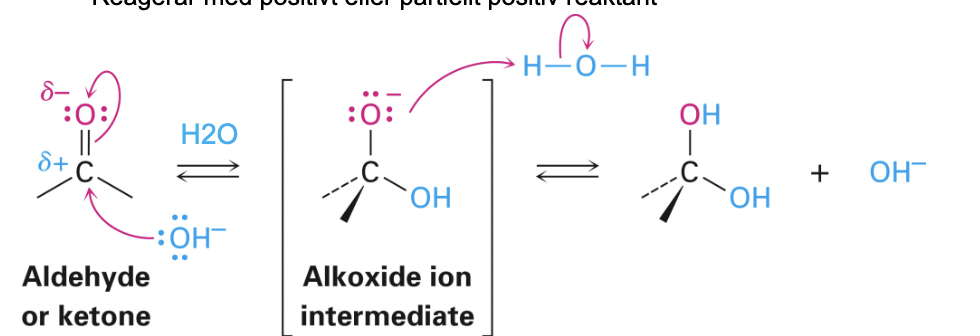
nukleofil attack kunna beskriva och rita (ketoner och aldehyder)
Nukleofil attack
- Vanlig typ av reaktion i organisk och biokemi
- Negativ eller partiellt negativ reaktant = nukleofil (Nu)
- Ex: Negativ jon, dubbelbindning, fria elektronpar
- Reagerar med positivt eller partiellt positiv reaktant