Estructura 3.1: Tabla Periódica
1/17
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
18 Terms
Tabla Periódica
Es una disposición de los elementos, organizados dependiendo de sus características y propiedades. Están ordenadas por el Número Atómico (Z).
Grupos
Columna vertical que agrupa a los elementos químicos por propiedades similares. Estos elementos de un grupo tendrán los mismos electrones de valencia (en su última capa). Hay 18 GRUPOS.
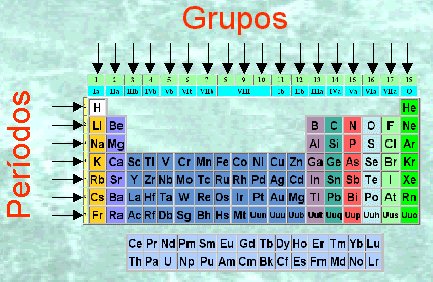
Periodos
Fila horizontal que agrupa a los elementos químicos según el número atómico. Estos elementos tendrán el mismo número de niveles de energía. Hay 7 PERIODOS.
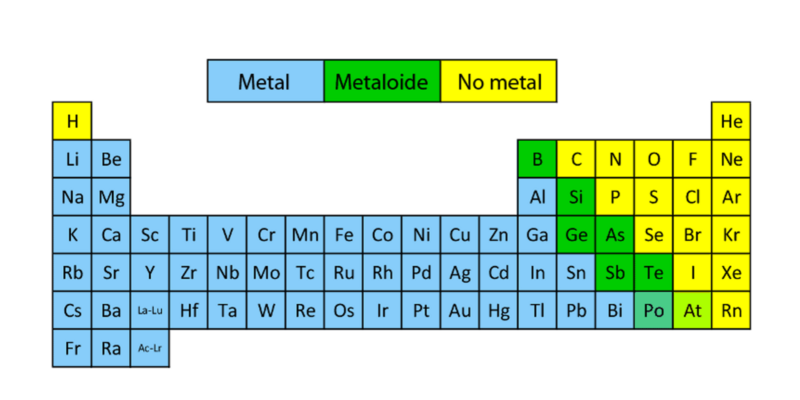
Metales, No metales y Metaloides
La tabla periódica cuenta tanto por metales como no metales y metaloides. Los metales están a la izquierda de la tabla periódica. Los no metales están a la derecha.
Los metaloides los cuales tienen propiedades tanto metálicas como covalentes. como iónicas.
Periodicidad
La tendencia de los elementos a lo largo de un periodo.
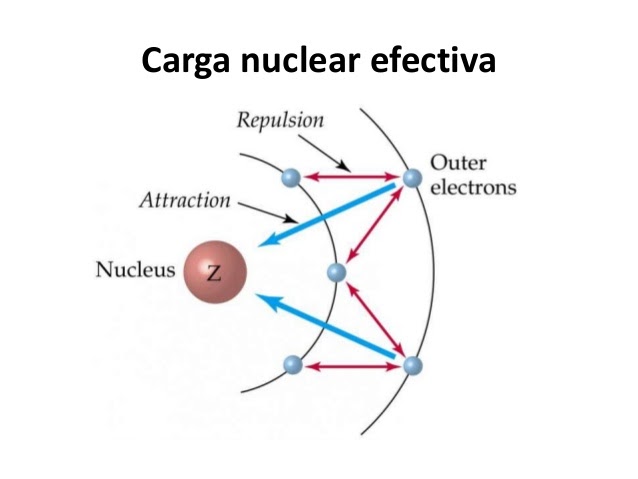
Carga Nuclear Afectiva
La fuerza que experimenta un electrón de valencia (de atracción) al núcleo. Esta se ve perjudicada por el número de electrones internos, debido a que mientras más electrones internos, más reducida esta atracción dado que se reparte.
Esta propiedad influirá en la periodicidad.
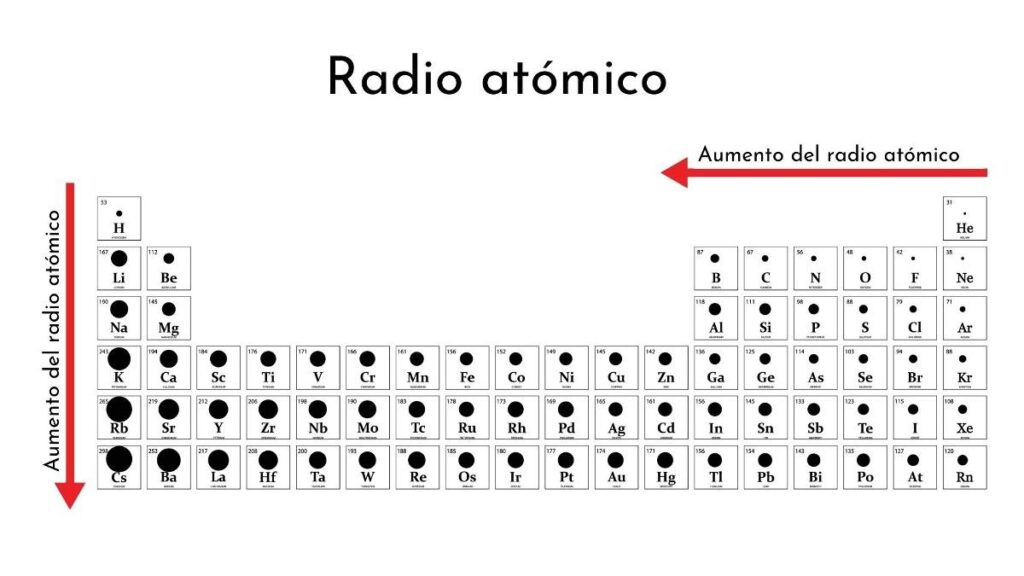
Radio Atómico
Se define como la distancia que hay entre el núcleo de un átomo y la última capa de electrones (los electrones de valencia).
Tendencia:
En un grupo aumenta hacia abajo dado que mientras más niveles de energía, más distancia entre el último nivel y el núcleo.
En un periodo aumenta hacia la izquierda, debido a que disminuye la carga nuclear efectiva → La fuerza que experimenta un electrón de valencia hacia el núcleo.
Radio Iónico
El radio en iones, los cuales pueden ser cationes y aniones.
Tendencia:
En cationes tienen un radio menor que sus elementos sin carga, dado que mientras menos electrones, mayor atracción del resto al núcleo.
Mientras mayor carga positiva, menor el radio iónico.
Bajando en un grupo es igual que el radio atómico.
En aniones, tienen un radio mayor que sus elementos sin carga, dado que mientras más electrones, menor atracción de cada una al núcleo.
Cuanta más carga negativa, mayor el radio iónico.
Bajando por un grupo es igual que el radio atómico.
Especies Isoelectrónicas
Aquellos iones que siendo diferentes elementos tienen la misma configuración electrónica.
Por ejemplo: Mg2+, Na+, Ne, F-, O2-
1s2 2s2 2p6
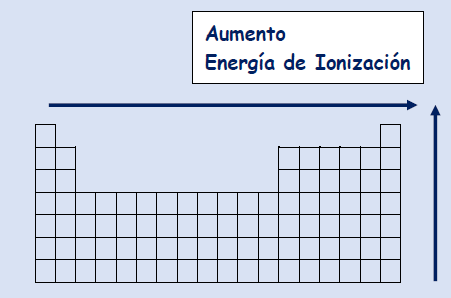
Energía de Ionización
Se define como la energía necesaria para arrancar un electrón de un átomo neutro, en estado fundamental y gaseoso.
X(g) + EI → X+ + e-
Tendencia:
En un grupo, aumenta hacia arriba, debido a que mientras menos niveles de energía, mayor energía necesaria para arrancar un electrón a un átomo.
En un período, aumenta hacia la derecha, debido a que mientras más protones en el núcleo, más atracción a este, por lo que más energía necesaria para arrancarle un electrón.
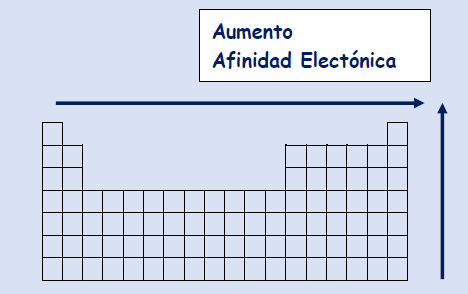
Afinidad Electrónica
Se define como la variación de energía producida cuando se le da un electrón, a un átomo neutro en estado gaseoso y fundamental, formando un ion negativo (anión).
X(g) + e- → X-
Tendencia:
En un grupo, aumenta hacia arriba debido a que mientras menos niveles de energía, más facilidad de atraer electrones a sí mismo al estar más cerca del núcleo.
En un período, aumenta hacia la derecha debido a que mientras mayor número de protones, mayor atracción al núcleo.
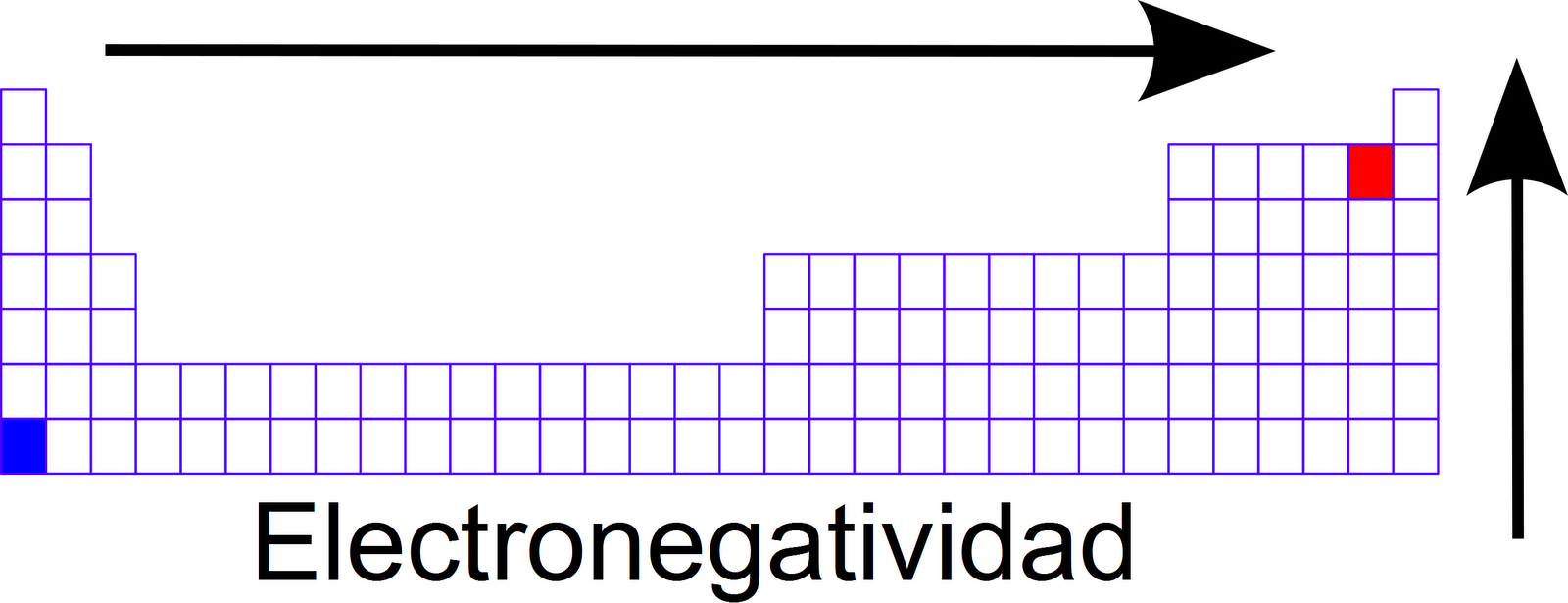
Electronegatividad
Se define como la capacidad o tendencia de un átomo de atraer electrones hacia si mismo que comparte con otro átomo mediante un enlace covalente.
Tendencia:
En un grupo aumenta hacia arriba, debido a que tiene menor radio atómico, por lo que más atracción al núcleo.
En un período aumenta hacia la derecha, ya que mientras más protones, mayor atracción hay al núcleo.
Carácter metálico
Se define como que tan metálico es un elemento.
No metales
MUY Electronegativos.
Alta EI.
Tienden a formar Aniones.
Metales
POCO Electronegativos.
Poca EI
Tienden a formar Cationes.
Estados de Oxidación
Es el número de electrones que se comparten o transfieren al formar un enlace.
Reglas para deducir el número:
El estado de oxidación de cualquier elemento libre es 0 (O2, Cu, F2).
La suma de los estados de oxidación de todos los átomos de un ion poliatómico debe ser la carga del ion.
El estado de oxidación del flúor es -1 SIEMPRE.
Los estados de oxidación del grupo 1 es +1 y del grupo 2 +2, SIEMPRE.
El estado de oxidación del oxígeno es siempre -2 menos cuando está con el flúor (+2) y cuando está en peróxidos (-1).
El estado de oxidación del hidrógeno es +1 cuando se une a no metales, y -1 cuando se une a metales.
Como nombrar oxianiones? Debe incluir el estado de oxidación del que no es oxígeno entre paréntesis y en números romanos.
MnO4- → Mn = 7, por lo que es Manganato (VII).
Ion Nitrito
NO2- (Ion nitrato (III))
Ion Nitrato
NO3- (Ion nitrato (V))
Ion Sulfito
SO3-2 (Ion sulfato (IV))
Ion Sulfato
SO4-2 (Ion sulfato (VI))