chemistry- test
1/45
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
46 Terms
hvordan bindes to ikke-metaller, og hva kalles denne bindingen?
to ikke-metaller bindes ved at de danner en forbindelse der de deler elektronene sine mellom hverandre. atomene i den kovalente bindingen deler altså et eller flere elektronpar, slik at de oppfyller oktettreglen. bindingen heter en kovalent binding, men blir også kalt en elektronparbinding. kovalente bindinger dannes mellom atomer der forskjellen i elektronegativitet er mindre en 2. den kovalente bindingen holder bestemte atomer sammen.
hva er en ionebinding, og hva lages i en ioneforbindelse?
en ionebinding er en binding der det ene atomet tar opp ett eller flere elektroner fra det andre atomet, slik at begge får oppfylt oktettregelen. i Kovalente bindinger, er atomene direkte koblet sammen, fordi de deler på elektronpar, men ionebindinger er ikke satt sammen på lik måte. siden de ikke deler på elektroner, men heller gir bort/tar imot, blir det skapt en positiv ladning med metall atomene, som gir fra seg elektroner, og en negativ ladning med ikke-metall atomene, som tar til seg elektroner. dette fører til at det blir lagd en gitterstruktur. i denne strukturen er de positive og negative ionene omgitt av hverandre, og holdes sammen på grunn av deres polaritet. dette betyr at hver positive ion er omringet av negative ioner og vice versa. altså er ionebindinger bindinger som holdes sammen på grunn av deres sterke elektrostatiske krefter. egenskapene til ioneforbindelser, altså salter, er at de har en elektrisk ledningsevne (fordi ionene kan bevege seg fritt i gitterstrukturen, og er i bevegelse, som er det som skaper elektrisitet), høyt smeltepunkt (på grunn av strukturen), løselighet (salter er ofte løselige i vann, fordi de positive og negative ionene blir omgitt av polare vannmolekyler), ikke ledende i fast form( fordi elektronene ikke kan bevege seg fritt i fast form)
forklar hva et atom er
et atom er den minste grunnleggende enheten til kjemi, og jordas naturlige byggeklosser. alt i verdenen er oppbygd/består av atomer. når atomer kombinerer seg gjennom kjemiske reaksjoner, dannes forbindelser og molekyler, slik som h2o, altså vann. måten atomene er organisert og koblet sammen i molekyler, bestemmer egenskapene til de forskjellige materialene vi ser rundt oss.
forklar hva en nøytron er
nøytroner er en type partikkel som befinner seg i kjernen av et atom, sammen med protonet. nøytroner er nøytralt ladde partikler, som betyr at de ikke har noen elektrisk ladning. nøytroner spiller en viktig rolle i atomet, om å opprettholde stabiliteten til atomkjernen, ved at de legger til en masse i atomet, som hjelper med å stabilisere det, og ved at nøytronene stabiliserer protonene ved å sørge for at de ikke frastøter hverandre. altså fungerer de også som en demper i atomkjernen.
forklar hva en proton er
protoner er en type partikkel som befinner seg i kjernen av et atom, sammen med nøytronet. protoner er positivt ladde partikler, og har motsatt ladning til det negative elektronet. den positive ladningen til protonene, er også den grunnleggende årsaken til at de tiltrekker elektronene i et atom. i tillegg er protonet sentralt for å kunne opprettholde nøytralitet og stabilitet i et atom, siden et atom inneholder like mange elektroner og nøytroner. til slutt, bestemmer antallet protoner i en atomkjerne hvilket kjemisk element atomet tilhører.(protonet bestemmer atomnummeret på periodesystemet, og atomnummeret er en grunnleggende egenskap for hvert kjemisk element, og det som skiller ett element fra et annet.)
forklar hva en elektron er
elektroner er en av de tre grunnleggende partiklene i et atom, sammen med nøytroner og protoner. elektroner er negativt ladede partikler som omringer atomkjernen i det som kalles elektronskall. disse elektronskallene har en begrenset mengde elektroner de har plass til. ofte går det i rekkefølgen 2, og så 8. elektroner er ansvarlige for atomets elektriske egenskaper, og for hvordan atomer samhandler med hverandre, og lager forbindelser og molekyler, fordi de vil oppfylle oktetreglen.
forklar hva en isotop er
en isotop er en betegnelse for en variant av et kjemisk element som har samme antall protoner i kjernen (atomnummer), som andre varianter av elementet, men ulikt antall nøytroner i kjernen. egenskaper til isotoper er at: de har forskjellig masse på grunn av deres forskjellig mengde nøytroner. de er ofte ustabile, slik som i eksempelet med hydrogen, der isotop versjonene av elementet, er veldig ustabile.
forklar bohrs atommodell
Bohrs atommodell, utviklet av den danske fysikeren Niels Bohr i 1913, var en tidlig teoretisk beskrivelse av strukturen til et atom, spesielt hvordan elektronene beveget seg rundt atomkjernen. Denne modellen var en av de første som greide å forklare atomers struktur, og selv om den ble utviklet og forbedret senere, hadde den betydelig innflytelse på vår forståelse av atomer og molekyler.
bohrs modell forklarer/ viser hvordan elektronskall fungerer og at elektroner orbiterer rundt atomkjernen i skall. hvert skall skulle ha et bestemt mengde energinivå, og elektronene kun skal eksistere i disse skallene.
modellen illustrerer atomkjernen, og elektronene som ligger i skall rundt kjernen.
tegn modellen:
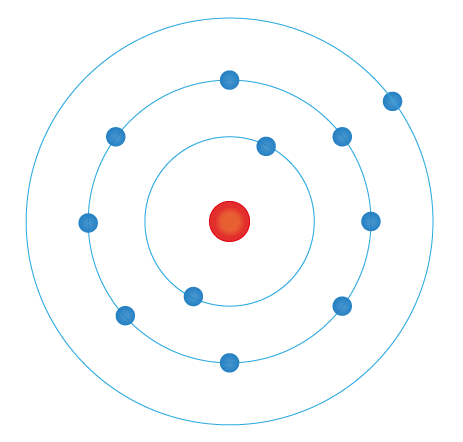
forklar elektronfordeling
elektronfordelig er at hvert skall i atomet, kunn har plass til en viss mengde elektroner, fordi den skal ha et bestemt energinivå i skallet. derfor er det (typisk) plass til 2 elektroner i første skall, og 8 i andre, for å oppnå en tilfreds standard.
forklar grunnstoff
Grunnstoff er et rent stoff hvor alle atomene i stoffet har samme atomnummer. Alle andre rene stoffer er kjemiske forbindelser mellom to eller flere grunnstoffer.
forklar kjemiske forbindelser
en kjemisk forbindelse er et stoff som består av to eller flere grunnstoffer som er bundet sammen med kjemiske bindinger. de tre typene bindinger vi har lært om er kovalente bindinger(elektronparbindinger) ionebindinger (gir eller tar opp elektroner) og metallbindinger( begge er metaller, og begge gir fra)
forklar hvorfor grunnstoffnummer=atomnummer=protontall
atomnummer, grunnstoffnummer og protontall er alle det samme for et bestemt grunnstoff fordi de refererer til den samme grunnleggende egenskapen til et atom, nemlig mengden protoner.
atomnummeret til et grunnstoff, er et heltall som peker på hvor mange protoner det finnes i kjernen på atomene til grunnstoffet. atomnummeret plasserer det også i periodesystemet.
grunnstoffnummeret, er ofte brukt som synonym med atomnummeret, og peker på akkurat det samme.
protontall er en betegnelse på hvor mange protoner det ligger i kjernen av et atom. når vi derfor snakker om protontallet til et atom, er det det samme som å snakke om grunnstoffnummeret eller atomnummeret til grunnstoffet.
forklar periodesytemet
Periodesystemet, også kalt periodetabellen eller det periodiske system, er en tabell som klassifiserer grunnstoffene (eller elementene) i perioder og grupper. Hver periode består av grunnstoffer med det samme antallet elektronskall rundt atomkjernen, mens hver gruppe består av grunnstoffer med samme antall elektroner i ytterste skall.
forklar de 18 gruppene
periodesystemet består av 18 grupper, som grunnstoff er sortert inn i basert på hvor mange elektroner de har i sine ytterste skall.
(fra gruppe 3 til og med gruppe 12, brukes ikke denne regelen. )
gruppe 1- alkalimetallene -(hydrogen, litium, natrium, osv) har 1 elektron i ytterste
gruppe 2 - jordalkalimetallene - (beryllium, magnesium, kalsium, osv) har 2 elektroner i ytterste skall
gruppe 13 (bor, aluminium, osv) har 3 elektroner i ytterste skall
gruppe 14 (karbon, tinn, osv) har 4 elektroner i ytterste skall
gruppe 15 -pniktogene- (nitrogen, fosfor, osv) har 5 elektroner i ytterste skall
gruppe 16- chalkogenene- (oksygen, svovel, osv) har 6 elektroner i ytterste skall
gruppe 17 -halogenene- (fluor, klor, brom) har 7 elektroner i ytterste elektronskall
gruppe 18- edelgassene- (helium, neon, argon, osv,) er oppfylte stoffer
forklar de 7 periodene
de 7 periodene, er horisontale inndelinger av grunnstoffene, basert på hvor mange elektronskall elementet har.
periode 1 (hydrogen, helium), har ett elektronskall
periode 2 har to elektronskall
periode 3 har tre elektronskall
periode 4 har fire
osv
hvor finner vi metaller, ikke-metaller og halvmetaller i periodesystemet?
Metallene står til venstre og utgjør størsteparten av grunnstoffene. Ikke-metallene står helt til høyre, og halv-metallene ligger mellom metaller og ikke-metaller. (hydrogen er også på venstre selv om den er ikke-metall)

forklar hva tilstandsformer er; fast form(s), væskeform(l), gassform(g) og løst i vann(aq)
tilstandsformer er de forskjellige fysiske tilstandene stoffer kan befinne seg i avhengig av trykk og temperatur. de fire vanligste formene er fast form (s), væske form (l), gass form(g), og løst i vann (aq).
fast form: Fast form refererer til tilstanden der partiklene (atomer, molekyler eller ioner) er tett pakket sammen og holder en bestemt form og volum.
Partiklene i faste stoffer er arrangert i et regelmessig mønster, som gir dem en fast struktur.
faste stoffer har en bestemt smelte- og kokepunkt, og de beholder sin form når de ikke utsettes for ytre krefter.
Væskeform er en tilstandsform der partiklene er tett pakket sammen, men de har større bevegelsesfrihet enn i faste stoffer.
Væsker har en bestemt volum, men de tar formen av beholderen de er i.
Partiklene i væsker kan bevege seg rundt hverandre, og væsker har tendens til å flyte og tilpasse seg beholderens form.
Gassform er den tilstanden der partiklene har stor bevegelsesfrihet og er spredt fra hverandre.
Gasser har ingen bestemt form eller volum og fyller den tilgjengelige plassen fullstendig.
Partiklene i gasser beveger seg raskt og kaotisk, og de kolliderer ofte med hverandre og beholderveggene.
løst i vann (aq) "Aq" står for "aqua," som betyr vann. Denne tilstandsformen refererer til stoffer som er oppløst i vann.
Når et stoff er løst i vann, blandes det jevnt med vannmolekylene og danner en homogen blanding.
Den oppløste substansen kan ikke ses som separate partikler og er jevnt fordelt i vannet.
Overganger mellom disse tilstandsformene kan oppstå ved endringer i temperatur og trykk. For eksempel kan is (fast form) smelte til vann (væskeform) når temperaturen øker, og vann kan fordampe til vanndamp (gassform) når det kokes.
forklar åtteregelen/oktettregelen
oktettregelen er en regel som beskriver hvordan atomer strever for å oppnå et fullt skall i deres ytterste elektronskall, for å bli stabile. for å oppnå denne tilstanden vil atomer enten dele på elektroner, gi fra seg elektroner, eller ta til seg elektroner. når dette er gjort, og de har et fullt skall, er atomene veldig tilfredse.
forklar sterke bindinger; ionebindinger(mellom ioner av et metall, og et ikke-metall= et salt) ,
Ionebinding er den kjemiske bindingen mellom to ioner med motsatt ladning. Ionebindinger finnes i salter.
Ionebindinger er sterke bindinger på grunn av de sterke kreftene mellom en positiv ladning (kation) og en negativ ladning (anion). Dette påvirker egenskapene til salter i stor grad. For eksempel har salter høyt smeltepunkt, fordi de sterke ionebindingene delvis må brytes ned i smelteprosessen.
Forklar Kovalente bindinger/elektronparbindinger (mellom ikke-metal og ikke-metall = et molekyl)
Kovalent binding er en binding mellom to atomer i et molekyl som skyldes deling av et eller flere elektronpar mellom de to atomene i molekylet.
I O2-molekylet deler de to atomene to elektronpar O::O, og i N2-molekylet deler de to N-atomene tre elektronpar N:::N.
Deling av ett par kalles en enkeltbinding, deling av to par kalles en dobbeltbinding, og deling av tre elektronpar kalles en trippelbinding.
forklar Metallbindinger (mellom metaller)
Metallbinding er en type kjemisk binding som oppstår mellom metall-atomer i metaller og legeringer. Metallbindinger oppstår mellom atomer med lav elektronegativitet. Bindingen kan beskrives som en elektronsky som ligger mellom positivt ladde metallioner. Den kjemiske bindingen er ikke mellom atomene, men de positive metallatomene tiltrekkes av den negativt ladde skyen.
egenskaper:
En viktig konsekvens er at man kan forskyve metallatomene i forhold til hverandre uten å svekke bindingene, og det betyr at metallet kan deformeres uten å miste sin styrke.
Hva er et ion? Hvordan får vi positive og negative ioner?
et ion er et atom eller en gruppe atomer som har tatt opp eller gitt fra seg et eller flere elektroner. ioner har derfor alltid en elektrisk ladning, enten den er positiv eller negativ. positivt ladet ion(gitt fra seg elektroner), kalles kationer, mens negativt ladet ioner(tatt opp elektroner) kalles anioner.
positive ioner, kationer, oppstår ved at atomene har et overskudd av elektroner, og derfor gir de fra seg. et eksempel på dette er natrium, som har en elektron i ytterste skall, og derfor vil gi det fra seg.
negative ioner, anioner, oppstår ved at atomene har et underskudd av elektroner, og derfor vil ha flere for å oppnå oktettregelen. et eksempel på dette, er fluor, som har 7 elektroner, og derfor trenger kun 1 for å oppnå fullt ytterste skall.
hva er salters egenskaper
salter har vanligvis et høyt smeltepunkt og kokepunkt, fordi ionebindinger er sterke bindinger som det kreves mye energi for å bryte. salter i fast form leder ikke elektrisk strøm, fordi alle elektronene er fastbundet til ionene, og alle ionene er fast bundet til hverandre. det finnes derfor ikke ladninger som kan lede den elektriske strømmen. salter leder godt strøm når de er i flytende form og vannløsning, fordi ionene er frie og kan lede strømmen. faste salter er sprø og ofte gjennomsiktige. dette er på grunn av gitterstrukturen.
oppbygningen til salter
salter har en gitterstruktur fordi hvert negative ion blir omringet av positive ioner, og hvert positivt ion blir omringet av negative ioner. på denne måten dannes det er ionegitter. i ionegitteret ligger ionene på bestemte plasser i forhold til hverandre, bundet sammen av ionebindinger.
oppbygningen til metaller
metallatomene har få elektroner i det ytterste skallet. disse elektronene er så svakt bundet til atomkjernen at de lett kan bevege seg fra et atom til et annet. når atomene blir liggende tett sammen, løsner ytterelektronene helt fra atomene sine, og vandrer fritt omkring metallet. vi kan tenke oss at positivt ladde metallioner som holdes sammen av en negativ elektronsjø. bindingen som oppstår kalles en metallbinding.
hva er enkeltbindinger, dobbeltbindinger, og trippelbindinger.
en enkeltbinding dannes når to atomer deler et par elektroner(to elektroner) mellom seg. dette er den svakeste type bindingen, og atomene kan rotere rundt hverandre
en dobbelbinding dannes når to atomer deler to par elektroner mellom seg.
en trippelbinding dannes når to atomer deler tre par elektroner mellom seg.
strukturformel
tegner hvordan stoffene er koblet med hverandre ved bruk av streker.
elektronprikkmodell
tegner hvordan stoffene er koblet sammen, i tillegg til hvor mange elektroner som blir delt, ved hjelp av prikker.
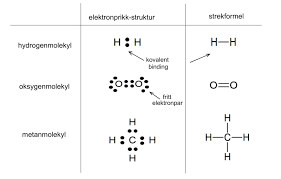
molekylformel
en formel som kun viser hvilke grunnstoff og hvor mange av de det er i bindingen. eks h2o
kulepinnemodell
en modell som fysisk illustrerer atomet med stoffene og bindingene.
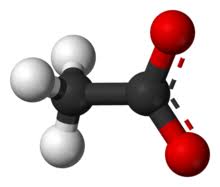
hva er en Polar kovalent binding
En polar kovalent binding er en kjemisk binding der elektroner er fordelt ulikt på de to atomene som deltar i bindingen. Det vil si at det er delvis positiv ladning på ett av atomene, og delvis negativ ladning på det andre, derav navnet polar.
et eksempel på dette er bindingen H2O, der oksygen har en sterkere elektronegativitet en det hydrogen har, og derfor trekker de delte elektronene litt mer mot seg selv, som gjør at oksygenet blir negativt, og hydrogenet blir positivt.
hva er en Dipolbinding
Dette er bindinger mellom molekyler hvor den ene positive delen av et molekyl blir tiltrukket av den negative delen av et annet molekyl.
et eksempel på en dipolbinding er at to vannmolekyler bindes sammen, der det positive hydrogenet, trekkes mot det negativet oksygenet, og vice versa.
hva er en hydrogenbinding
En hydrogenbinding er en svak kjemisk binding mellom et hydrogenatom bundet i et molekyl sammen med et elektronegativt atom, og et annet elektronegativt atom i et annet molekyl.
hva er en midlertidig dipolbinding
En midlertidig dipolbinding, er en type svak kjemisk binding som oppstår i alle molekyler, uavhengig av om de er polare eller ikke-polare. dette er fordi molekylene er i konstant bevegelse, og dersom de feks krasjer inn i hverandre, vil elektronene til molekylene bevege på seg, som gjør at de legger seg nærmere et av atomene en de(t) andre, og at det atomet derfor får en negativ elektronisk ladning, og de(t) andre, får en positiv ladning, altså at molekylet blir polert, midlertidig.
forklar vann som løsningsmiddel
vannmolekylet er et polart molekyl, som gjør at det har både en positiv og en negativ side. dette gjør, at når det blandes med andre molekyler/ioner/bindinger, vil det kunne løse opp disse bindingene, fordi likt løser opp likt, og vannet trekker til seg det positive og negativet i de andre bindingene, som gjør at de løser opp.
forklar Karakteristiske egenskaper til metaller
metaller er gode ledere av både elektrisitet og varme.
de har metallglans.
metaller er formbare.
to eller flere metaller kan smeltes sammen og danne legeringer. legeringer har andre egenskaper enn metallene hver for seg.
de fleste metaller har et høyt smeltepunkt. det forteller oss at metallbindingen er en sterk binding.
metall danner positivt ladde ioner. metallionene inngår sammen med negativt ladde ioner i salter.
forklar legering
det er ofte at vi legger til andre metaller i de rene metallene våre, for å oppnå en spesifikk effekt. når vi legger til disse andre metallene kalles det legeringer. for eksempel er stål en blanding av jern med litt karbon. med 0.1% karbon, er stål mykt, og kan lett trekkes ut til tynne tråder. med 1% karbon blir stålet passe hardt, og kan brukes som konstruksjonsmateriale.
forklar Organiske og uorganiske karbonforbindelser (eksempler)
organiske karbonforbindelser er alle forbindelser som inneholder karbon, utenom et par unntak. uorganiske karbonforbindelser er: oksider med karbon( eks karbondioksid), karbonsyre, og blåsyre. i tillegg er det salter av karbonsyre og blåsyre, og rent karbon, som feks grafitt og diamanter. annet en det er også legeringer med karbon uorganiske forbindelser.
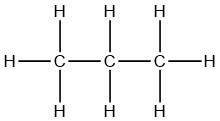
alkaner
alkaner er karbonforbindelser med kun enkeltbindinger.
metan
etan
propan
butan
pentan

alkener
alkener er karbonforbindelser med minst en dobbeltbinding.
eten
propen
buten
penten

alkyner
alkyner er karbonforbindelser med minst en trippeltbinding.
etyn
propyn
butyn
pentyn

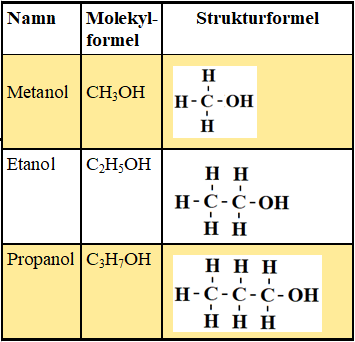
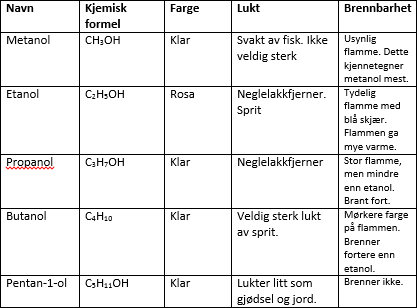
alkoholer
alkoholer er alkaner med en OH gruppe lagt til. alkoholer slutter alltid på ol.
etanol
propanol
butanol
pentanol
forklar karbonets kretsløp
I det raske, eller det biologiske, karbonkretsløpet tar det relativt kort tid for karbonet å fullføre en runde av kretsløpet. Dette foregår ved at planter opp karbon i form av CO2 fra lufta. Gjennom fotosyntesen (vann + co2 + sollys= glukose og oksygen) omdanner plantene CO2 til glukose ved hjelp av vann og sollys. Glukosen lagres i plantene som stivelse og cellulose. Når dyr, som kua, spiser plantene forflytter karbonet seg over i dyra. Karbonet beveger seg videre til lufta, enten fra celleånding(glukose + oksygen= energi, vann og co2) i levende organismer, eller fra nedbryting av døde planter og dyr.
I det biologiske kretsløpet er det balanse mellom mengden karbon som slippes ut i lufta, og mengden som tas opp i vegetasjon i havet og på land.
Karbonet bruker millioner av år på å fullføre en runde i det langsomme karbonkretsløpet. Her omdannes karbonet i døde planter og dyr til fossilt brensel, som kull, gass og olje. Dette skjer når døde planter og dyr brytes ned ved høyt trykk og høy temperatur, med lite tilgang på oksygen. Denne prosessen tar imidlertid millioner av år. Slike reservoarer med karbon under bakken holder store mengder karbon borte fra prosessene som foregår over jordskorpen.
Når vi bruker fossilt brensel, som diesel eller bensin, tilfører vi karbon fra det langsomme kretsløpet til det raske kretsløpet. Vi slipper ut store mengder karbondioksid til atmosfæren i løpet av kort tid, mye mer enn plantene er i stand til å ta opp gjennom fotosyntesen. Det fører til en stadig økende konsentrasjon av CO2 i atmosfæren.
forklar Fotosyntese og celleånding
Fotosyntese er en prosess hvor planter, alger og noen typer bakterier fanger lysenergi og lagrer det som kjemisk energi. Vann og karbondioksid tas opp og omdannes til karbohydrater som brukes og lagres, og oksygengass, hvor noe brukes og noe slippes ut i lufta.
(vann + co2 + sollys= glukose og oksygen)
Celleånding er levende cellers nedbrytning av energirike næringsstoffer som karbohydrater, fett og proteiner. I nedbrytningen frigjøres det energi som brukes i mange av cellens oppgaver, som oppbygging av proteiner, transport over membraner, bevegelse og reproduksjon.
(glukose + oksygen= energi, vann og co2)
forklar drivhuseffekten
Drivhuseffekt er når gasser i atmosfæren fanger opp en del av varmeenergien som jorda sender ut, etter å ha blitt varmet opp av sola. Dette er nødvendig for at det skal være levelig på jorda, men økt drivhuseffekt fører til klimaendringer. Klimagassene CO2, vanndamp og metan fanger opp varmen, og er med på å holde den igjen før den forsvinner ut i verdensrommet
En økt konsentrasjon av klimagasser i atmosfæren fører til at flere av solstrålene fanges opp og avgir varme. Denne mekanismen kalles drivhuseffekten. Varmen blir værende på jorda, og fører til at temperaturen øker slik at vi får klimaendringer.
hva er et molekyl
Et molekyl er en samling av like eller ulike atom som er bundet til hverandre med kjemiske bindinger, kovalente bindinger. Molekyl kan være nøytrale, eller de kan ha et overskudd av positiv eller negativ ladning, og da kaller vi de et ion.