organische chemie hoofdstuk 1
1/58
Earn XP
Description and Tags
Relatie molecuulbouw - reactiviteit
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
59 Terms
wat is de redenen waarom bepaalde organische stoffen reactiveer zijn dan andere
kan verklaard worden door hun driedimensionele structuur
hoe verschillen organische stoffen van elkaar
door het aantal koolstofatomen, het soort
bindingen tussen atomen of een specifieke functionele groep
1. hoe verschillen alkanen, alkenen en alkynen van elkaar
2. waarvoor zorgen deze extra bindingen tussen de koolstofatomen, verklaar dit
1. ze verschillen door het voorkomen van het soort bindingen tussen
de koolstofatomen
alkanen: enkel voddige binding
alkenen: dubbele binding
alkynen: driedubbele binding
2. voor een hogere reactiviteit bij de laatste 2 groepen; Dit kunnen we verklaren m.b.v. het molecuulorbitaalmodel
wat kan je bepalen met de Schrödingervergelijking
men kan de waarschijnlijkheid berekenen om een bepaald elektron aan te treffen in een bepaald punt omheen de atoomkern
definitie orbitaal
Een orbitaal is het trefkansgebied rond een atoomkern waarin een elektron zich met 90% waarschijnlijkheid bevindt.
Waarom kunnen we de beweging van elektronen niet volgen?
Omdat elektronen niet te onderscheiden zijn en hun beweging niet precies te volgen is volgens de kwantummechanica.
wat zijn s-orbitalen
s-orbitalen zijn bolvormig met de kern in het middelpunt. Deze bolsymmetrie betekent dat de trefkans van de s- elektronen op een bepaalde afstand van de kern in alle richtingen even groot is.
Welke vorm heeft een p-orbitaal?
Een p-orbitaal heeft een haltervorm, met het knooppunt in de atoomkern.
Is een p-orbitaal bolsymmetrisch?
Nee, een p-orbitaal is niet bolsymmetrisch.
Hoe oriënteren de drie p-orbitalen zich in de ruimte?
De drie p-orbitalen (px, py en pz) oriënteren zich loodrecht op elkaar langs de x-, y- en z-as.
Is de vorm van een orbitaal afhankelijk van het hoofdenergieniveau (n)?
Nee, de vorm van een orbitaal blijft hetzelfde, ongeacht het energieniveau. Alleen het volume verandert.
Wat gebeurt er met het volume van een orbitaal als het energieniveau (n) stijgt?
Het volume van een orbitaal wordt groter naarmate het hoofdenergieniveau (n) stijgt.
Welk orbitaal is groter: een 1s- of een 2s-orbitaal?
Een 2s-orbitaal is groter dan een 1s-orbitaal.
Welk orbitaal is groter: een 2p- of een 3p-orbitaal?
Een 3p-orbitaal is groter dan een 2p-orbitaal.
definite van het sterisch getal van een atoom in een verbinding
SG = #bindingspartners + #eigen doubletten
Wat is hybridisatie in de chemie?
Hybridisatie is een model dat gebruikt wordt om het vormen van chemische bindingen te verklaren door het combineren van energetisch ongelijke atoomorbitalen tot nieuwe, gelijkwaardige hybrideorbitalen.
Wanneer treedt hybridisatie op?
Hybridisatie treedt op wanneer een atoom in een chemische verbinding voorkomt en bindingen vormt.
Wat gebeurt er met de oorspronkelijke orbitalen tijdens hybridisatie?
Tijdens hybridisatie worden de oorspronkelijke (vaak ongelijke) s- en p-orbitalen gelijkwaardig gemaakt in energie, vorm en ruimtelijke oriëntatie en samengevoegd tot hybrideorbitalen.
Wat is het voordeel van hybridisatie bij het vormen van bindingen?
Hybridisatie zorgt voor betere ruimtelijke ordening van de orbitalen, waardoor er meer en stabielere covalente bindingen kunnen gevormd worden.
Waarom is hybridisatie belangrijk voor de ruimtelijke structuur van moleculen?
Omdat hybridisatie ons toelaat om de geometrie (ruimtelijke schikking) van een molecule te verklaren, gebaseerd op de oriëntatie van de hybrideorbitalen.
Welke drie types hybrideorbitalen zijn er ?
De drie hybrideorbitaal types zijn:
sp³-hybrideorbitalen
sp²-hybrideorbitalen
sp-hybrideorbitalen
Wat bepaalt het type hybrideorbitaal dat gevormd wordt bij een binding?
Het sterisch getal (SG) van het betrokken atoom.
Wat gebeurt er bij SG = 2 met de orbitalen?
Er treedt sp-hybridisatie op: het s- en het px-orbitaal vormen 2 sp-orbitalen, met py en pz als overblijvende orbitalen.
Wat is de hoek tussen de orbitalen bij SG = 3?
120°, typisch voor sp²-hybridisatie.
Hoeveel hybride-orbitalen worden gevormd bij SG = 4?
Vier sp³-hybrideorbitalen, gevormd uit s + px + py + pz.
Wat is het SG van zuurstof in een watermolecule?
SG = 4, want O heeft 2 bindingspartners en 2 vrije elektronenparen.
Wat is de geometrie van H₂O volgens hybridisatietheorie?
Geknikte structuur met bindingshoek van 109° tussen de twee bindingen, door sp³-hybridisatie van het O-atoom.
Wat is het SG van koolstof in CH₄?
SG = 4 → leidt tot sp³-hybridisatie.
Welke orbitalen versmelten bij sp³-hybridisatie?
Eén s- en drie p-orbitalen (px, py, pz).
Welke vorm heeft een sp³-orbitaal?
De vorm van een halter met een grote lus en een kleine lus, met een gemeenschappelijke symmetrieas.
Wat is de onderlinge bindingshoek tussen sp³-orbitalen?
109°
geef me de link tussen het sterisch getal en het type hybridisatieatoomorbitaal

hoe het sterisch getal van een atoom bepalen
geef volgende voorbeelden: methaan (CH4), water (H2O), koolstofdioxide (CO2), ammoniak (NH3)
SG = #bindingspartners + #vrije elktronenepartners (eigen doubletten)
→ bindingspartners: Elke binding met een ander atoom telt als één bindingspartner, ongeacht of het een enkel-, dubbel- of drievoudige binding is.
→ vrije elektroneneparen: Niet-bindende elektronenparen op het atoom zelf (zoals bij zuurstof of stikstof) tellen mee bij het SG.
voorbeelden:
methaan: Koolstof is gebonden aan 4 H-atomen, geen vrije paren
→ SG = 4 + 0 = 4water: Zuurstof heeft 2 bindingen (met H) + 2 vrije elektronenparen
→ SG = 2 + 2 = 4
koolstofdioxide: Koolstof heeft 2 dubbele bindingen (met 2 O-atomen), maar dat zijn 2 bindingspartners
→ SG = 2 + 0 = 2
ammoniak: Stikstof heeft 3 bindingen met H + 1 vrij paar
→ SG = 3 + 1 = 4
wat is het verschil tussen een hybrideorbitaal en een molecuulorbitaal
hybrideorbitaal: Een hybrideorbitaal is een nieuw orbitaal dat ontstaat door het combineren van s- en p-orbitalen van hetzelfde atoom. Deze orbitalen worden gelijkwaardig in energie, vorm en richting, en dienen om bindingen met andere atomen te vormen.
molecuulorbitaal: Een molecuulorbitaal is een orbitaal dat ontstaat door de overlapping van twee atoomorbitalen (meestal van twee verschillende atomen), waarbij een chemische binding gevormd wordt. Dit orbitaal behoort tot het hele molecule en verspreidt zich over beide atoomkernen.

geef visueel het verschil tussen hybrideorbitaal en molecuulorbitaal weer in een tekening voor methaan
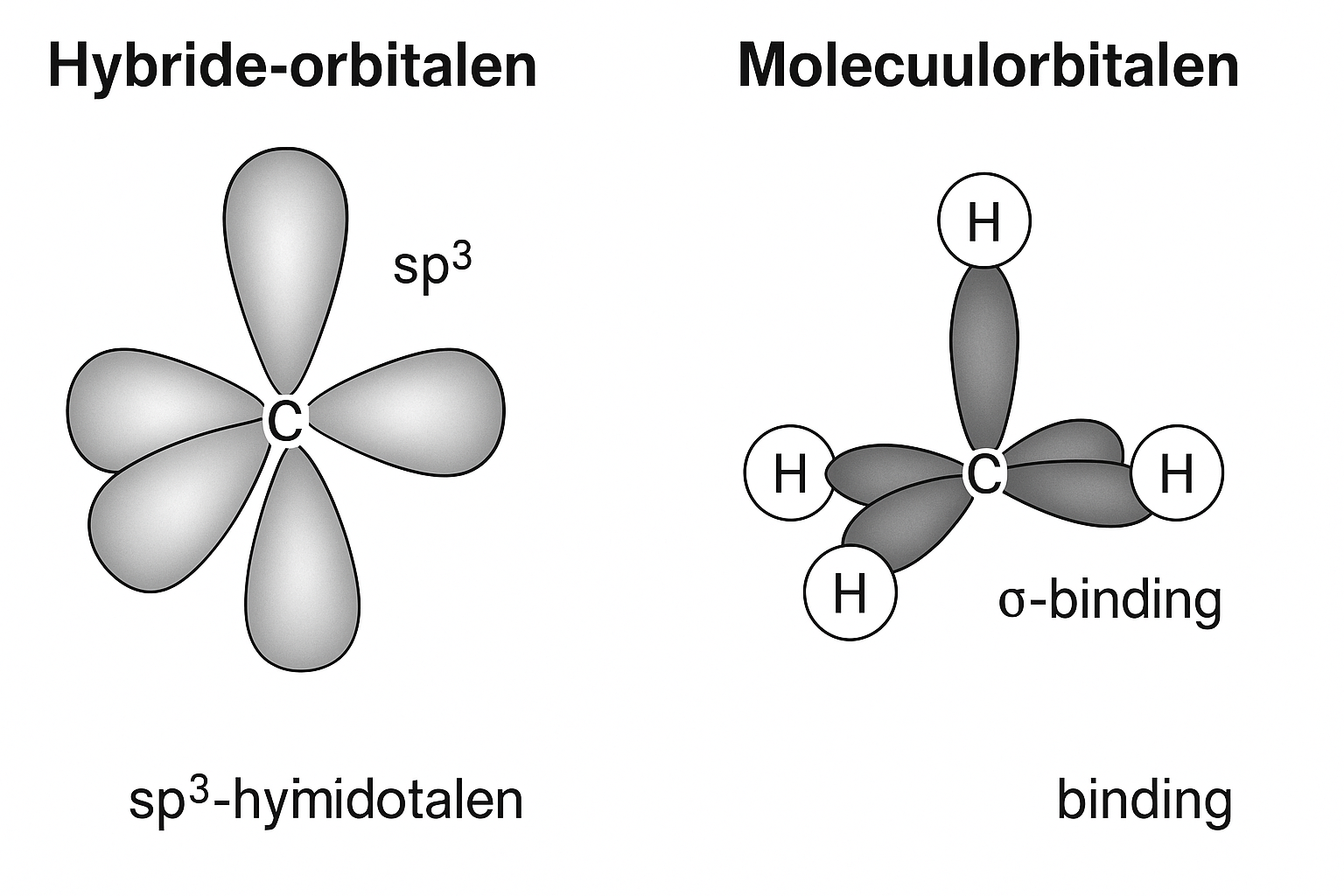
wat is de lewisformule/lewisstructuur
De Lewisformule (of Lewisstructuur) is een schematische voorstelling van een molecule waarbij je de valentie-elektronen van de atomen expliciet weergeeft, met nadruk op:
Bindingen tussen atomen (als streepjes of elektronenparen)
Vrije elektronenparen (doubletten)
Octetregel (voor niet-metaalatomen)
De Lewisformule is een 2D-tekening van een molecule waarin je:
alle valentie-elektronen aanduidt,
laat zien welke atomen gebonden zijn, en
welke elektronenparen niet deelnemen aan bindingen.
waarom is de lewisformule/lewistructuur belangrijk
Je ziet hoeveel bindingen elk atoom vormt
Je controleert of de octetregel gerespecteerd is
het is de basis voor volgende zaken te bepalen:
sterisch getal
hybridisatie
geometrie van het molecule
stappenplan van de lewisformule/lewisstructuur
tel het aantal valentie-elektronen
Kijk per atoom hoeveel valentie-elektronen het bijdraagt.
Voeg ze samen voor het hele molecule.
❗ Let op bij ionen:
Negatieve lading → tel elektronen bij
Positieve lading → trek elektronen af
zet de atomen in de juiste volgorde
Zet het minst elektronegatieve atoom in het midden
(meestal C, N, S – nooit H)Verbind alle atomen met één enkele binding (= 1 streepje → 2 elektronen)
vul eerst de octetten van de buitenste atomen aan
Vul de 8 elektronen (of 2 voor H) aan rond elk buitenste atoom
Gebruik daarvoor niet-gebonden elektronenparen (stippen of dubbele puntjes)
kijk wat er nog over is en vul het centrale atoom aan
Geef het centrale atoom ook een volledig octet als dat nog niet het geval is
maak dubbele of drievoudige bindingen indien nodig
Als het totaal aantal elektronen niet klopt, of het centrale atoom heeft geen octet, maak dan dubbele of drievoudige bindingen
Verplaats dan een vrij elektronenpaar van een buur naar het centrum
geef aan de hand van de stappenplan de lewisformule/lewisstructuur weer van koolstofdioxide (CO2)
valentie-elektronen
C = 4, O = 6 × 2 → totaal = 16 e⁻
Zet C in het midden, 2 O's eraan:
O — C — O
maak octetten:
Merk je: 2 e⁻ per binding → 4 gebruikt → nog 12 over
Zet 6 rond elke O (3 paren)
: O — C — O :
C heeft nog geen octet → maak dubbele bindingen:
O = C = O
(O’s krijgen dan elk 2 vrije paren, C heeft 4 bindingen = 8 e⁻)
geef aan de hand van de stappenplan de lewisformule/lewisstructuur weer van methaan (CH4)
tel valentie-elektronen
C = 4 valentie-elektronen
H = 1 × 4 = 4
→ Totaal: 8 elektronen
zet de atomen correct
C in het midden, 4 H’s eromheen:
H
|
H — C — H
|
H
vul buitenste atomen aan (H)
Elk H heeft 1 binding = 2 e⁻ → ze zijn allemaal voldaan
vul centrale atoom aan (C)
C heeft 4 bindingen → 4 × 2 = 8 e⁻ → octet vervuld
resultaat: Geen vrije elektronen meer over, alle atomen correct gebonden
geef aan de hand van de stappenplan de lewisformule/lewisstructuur weer van water (H2O)
tel valentie-elektronen:
O = 6 valentie-elektronen
H = 1 × 2 = 2
→ Totaal: 8 elektronen
zet de atomen correct:
O in het midden, H’s ernaast:
H — O — H
vul buitenste atomen aan (H)
H mag maximaal 2 e⁻, dus elk H heeft al genoeg met 1 binding (= 2 e⁻ per binding)
vul centrale atoom aan (O)
Elke binding telt als 2 elektronen → O heeft 2 bindingen = 4 e⁻
We hebben nog 4 elektronen over → dat zijn 2 vrije elektronenparen op O
..
H — O — H
°°
resultaat: O heeft 2 bindingen + 2 vrije paren = 8 e⁻ → octet vervuld
hoe ontstaat de sigma binding
De sigma-binding ontstaat bij het overlappen van twee atoomorbitalen die in elkaars
verlengde liggen.
door wat wordt een sigma binding gekenmerkt
Een sigma-binding wordt gekenmerkt door een grote rotatiemogelijkheid.
Waar bevindt zich de grootste elektronendichtheid in een σ-molecuulorbitaal?
De grootste elektronendichtheid bevindt zich tussen de kernen van de gebonden atomen, in het gebied waar de molecuulorbitalen overlappen.
Wat is het gevolg van de hoge elektronendichtheid tussen de atoomkernen in een σ-binding?
Een σ-binding is daardoor stevig en heeft een lage reactiviteit.
Welk soort orbitalen overlappen om een σ-molecuulorbitaal te vormen in de besproken voorbeelden?
Specifieke hybrideorbitalen, zoals sp³-, sp²- of sp-orbitalen, overlappen om een σ-molecuulorbitaal te vormen.
Wat is een pi (π)-binding?
Een π-binding is een normale covalente binding die ontstaat door zijdelingse overlapping van twee halfgevulde p-orbitalen die niet aan hybridisatie deelnemen. Ze komt altijd samen met een σ-binding voor in een meervoudige binding.
Wanneer komt een π-binding voor in een molecule?
Een π-binding komt voor in combinatie met een σ-binding, bijvoorbeeld in een dubbele binding, zoals bij ethene (CH₂=CH₂).
Welke orbitalen overlappen om een π-binding te vormen?
Twee niet-gehybridiseerde p-orbitalen overlappen zijdelings (boven en onder het vlak van de σ-binding).
Waarom kunnen die p-orbitalen niet deelnemen aan hybridisatie?
Ze blijven buiten de hybridisatie zodat ze beschikbaar zijn voor zijdelingse overlapping om een π-binding te vormen.
In welke richting overlappen de p-orbitalen voor een π-binding?
Ze overlappen zijdelings, zowel boven als onder het vlak van de σ-binding.
Wat is het sterisch getal (SG) van een C-atoom in CH₂=CH₂?
SG = 3 → dit leidt tot sp²-hybridisatie.
Welke orbitalen vormen de σ-binding in etheen?
De sp²-gehybridiseerde orbitalen van elk koolstofatoom overlappen om een σ-binding te vormen.
Wat is de bindingshoek tussen de σ-bindingen bij sp²-hybridisatie?
De bindingshoeken zijn ongeveer 120°.
Welke rol speelt het resterende p-orbitaal in de π-binding?
Het blijft vrij en halfgevuld, en zorgt voor zijdelingse overlapping met een ander p-orbitaal → dit vormt de π-binding.
Waarom is een π-binding reactiever dan een σ-binding?
Omdat de π-orbitalen excentrisch liggen, dus minder tussen de atoomkernen, waardoor ze beter bereikbaar zijn voor reactieve deeltjes.
Wat is het effect van de ligging van de π-orbitalen op de reactiviteit?
Doordat de π-orbitalen boven en onder het bindingsvlak liggen en niet centraal tussen de kernen, zijn ze meer blootgesteld en dus reactiever.
Zijn alkenen of alkanen reactiever? Waarom?
Alkenen zijn reactiever dan alkanen, omdat alkenen een π-binding bevatten die gemakkelijker reageert dan de σ-bindingvan alkanen.
Waarom is er bij een π-binding geen vrije rotatie mogelijk tussen de atomen?
Omdat de π-binding bestaat uit zijdelingse overlapping boven en onder het vlak, zou rotatie de overlapping verbreken → rotatie is dus niet vrij mogelijk.