Analytische chemie
4.4(5)
4.4(5)
Card Sorting
1/29
Earn XP
Description and Tags
Study Analytics
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
30 Terms
1
New cards
Geef de verschillende stappen van het chemisch-analytisch proces weer. Beschrijf voor elke processtap kort de te volgen aanpak en/of voornaamste aandachtspunten, toegepast op een gegeven voorbeeld.
1. Probleemstelling: klant legt het probleem voor
2. Specificatie van het probleem: onderzoeker inspecteert het getroffen gebied en welke symptomen hier optreden
3. Selectie van de procedure: op basis van (2) wordt er een analyseplan opgesteld.
1. bemonsteringsplan
2. bemonsteringstechnieken
3. monsterbewaring en voorbereiding
4. analysetechniek
4. Bemonsternig: OPM dit monster moet representatief zijn
5. Monstervoorbereiding: drogen, homogeniseren, verkleinen, …
6. Meting: bepaling van de hoeveelheid aanwezige analiet
7. Evaluatie van de gegevens: terugkoppeling naar het probleem om de betrouwbaarheid van de gegevens na te gaan
8. Conclusies
9. Rapportering naar de client
2
New cards
Aan welke eigenschappen moet een goed monster voldoen? Leg kort uit.
1. Representatief: het weerspiegeld goed wat men wilt te weten komen
2. Homogeen: door goed te mengen, mixen, drogen, vermalen, … vermijden dat sub-stalen verschillende resultaten opleveren
3
New cards
Hoe kun je systematische fouten vermijden?
Door een blanco-bepaling te doen. Hierbij wordt heel het analyseproces doorlopen zonder monster. Op basis van dit verkregen signaal kunnen eventuele fouten bij de eigenlijke analyse vermeden worden
4
New cards
Wat is het verschil tussen accuraatheid en precisie en hoe kun je accuraatheid en precisie \n garanderen?
Accuraatheid = de mate waarin het gemiddelde van alle metingen overeenkomt met de werkelijke waarde/ de waarde die je zou moeten uitkomen
\
Precisie = de mate waarin resultaten bij vele herhalingen overeenkomen
\
fouten vermijden → nauwkeurig werken
1. juiste glaswerk
2. goede gecontroleerde apparatuur
3. gecontroleerde omstandigheden
\
Precisie = de mate waarin resultaten bij vele herhalingen overeenkomen
\
fouten vermijden → nauwkeurig werken
1. juiste glaswerk
2. goede gecontroleerde apparatuur
3. gecontroleerde omstandigheden
5
New cards
Hoe kun je de kwaliteit van het analyseresultaat garanderen (opties voor kwaliteitscontrole)?
1. vergelijken met andere methodes die dezelfde parameter kan bepalen
2. vergelijking met resultaten van andere laboratoria
3. gebruik van gecertificeerde standaardmaterialen. De concentraties zijn hier zeer exact gekend dus je kan na de analyse vergelijken met wat je volgens het certificaat zou moeten uitkomen
6
New cards
Welke factoren moeten in rekening gebracht worden bij omrekening van een concentratie van analiet gemeten in het finale extract naar de oorspronkelijke concentratie in het vaste monster waaruit het analiet geëxtraheerd werd?
7
New cards
Voor welke monstervoorbereiding kan je opteren als je het seleniumgehalte in brood wil \n analyseren, wetende dat je analysetoestel enkel vloeistoffen analyseert?
Digestie
* geschikt voor elementaire analyse
* natte digestie door sterke zuren/base
* droge digestie door verbranding
* geschikt voor elementaire analyse
* natte digestie door sterke zuren/base
* droge digestie door verbranding
8
New cards
Wat kan het doel zijn van monstervoorbereidingsstap en waarvoor moet je opletten tijdens \n de monstervoorbereiding?
Doel: het analiet extraheren naar een vloeistof en eventueel de vaste matrix afbreken, zonder het analiet af te breken tijdens de extractie/ digestie
9
New cards
Wat is het verschil tussen een destructie/digestie en een extractie? Waartoe dienen beiden? \n Waarom gaan we dikwijls een extractie toepassen, en geen digestie?
destructie/ digestie = een methode om de vaste matrix van het monster af te breken. Het is geschikt voor elementaire analyses. Je kan een natte digestie doen waarbij er sterkte zuren en basen worden gebruikt voor de afbraak. In het gebruikte recipiënt, bv destructiebom of microgolfoven, heersen hoge temperaturen en drukken die ook de afbraak van de matrix bevorderen.
\
of een droge digestie, door verassing van het monster
\
Extractie = een methode om het analiet uit de niet volledig afgebroken matrix te extraheren. Het is geschikt voor de analyse van moleculen. Er moet hiervoor een geschikt solvent gekozen.
\
Omdat er meestal de concentratie van een molecule wordt onderzocht.
\
of een droge digestie, door verassing van het monster
\
Extractie = een methode om het analiet uit de niet volledig afgebroken matrix te extraheren. Het is geschikt voor de analyse van moleculen. Er moet hiervoor een geschikt solvent gekozen.
\
Omdat er meestal de concentratie van een molecule wordt onderzocht.
10
New cards
Representatieve monstername: verschil tussen een tijds- en debietsproportioneel monster \n en een schepmonster dient gekend te zijn.
Tijdsproportioneel monster
= op een vast tijdstip bemonstering doen en deze monsters uiteindelijk met elkaar mengen.
\
Debietproportioneel monster
= een bemonsteringsmethode waarbij een verhoogd debiet, de bemonsteringsfrequentie toeneemt. De verschillende monsters worden met elkaar gemengd om het eigenlijke staal te verkrijgen.
\
Schepmonster = op een vast tijdstip een vaste hoeveelheid afvalwater bemonsteren
= op een vast tijdstip bemonstering doen en deze monsters uiteindelijk met elkaar mengen.
\
Debietproportioneel monster
= een bemonsteringsmethode waarbij een verhoogd debiet, de bemonsteringsfrequentie toeneemt. De verschillende monsters worden met elkaar gemengd om het eigenlijke staal te verkrijgen.
\
Schepmonster = op een vast tijdstip een vaste hoeveelheid afvalwater bemonsteren
11
New cards
Principe van potentiometrie kunnen uitleggen
Technieken die gebaseerd zijn op het meten van de potentiaal van elektrochemische cellen zonder toevoeging van significante stroom. Obv de verandering in dit potentiaal bij de toevoeging van het titrans kunnen concentraties van het analiet bepaald worden
12
New cards
Werking en gewenste eigenschappen van indicator- en referentie-elektrode
Indicator-elektrode
= Een elektrode die ondergedompeld is in de analietoplossing en een potentiaal ontwikkeld afhankelijk van de activiteit van het analiet in de te bestuderen oplossing. Ze antwoorden bij voorkeur snel en reproduceerbaar en zijn ook liefst selectief
Referentie-elektrode
= Een halfcel met een exact gekende elektrodepotentiaal die onafhankelijk is van de concentratie van het analiet of andere ionen in de oplossing. Ze zijn bij voorkeur robuust, gemakkelijk te gebruiken, hebben een constante potentiaal bij kleine stromen en zijn ongevoelig voor de samenstelling van de analiet oplossing
= Een elektrode die ondergedompeld is in de analietoplossing en een potentiaal ontwikkeld afhankelijk van de activiteit van het analiet in de te bestuderen oplossing. Ze antwoorden bij voorkeur snel en reproduceerbaar en zijn ook liefst selectief
Referentie-elektrode
= Een halfcel met een exact gekende elektrodepotentiaal die onafhankelijk is van de concentratie van het analiet of andere ionen in de oplossing. Ze zijn bij voorkeur robuust, gemakkelijk te gebruiken, hebben een constante potentiaal bij kleine stromen en zijn ongevoelig voor de samenstelling van de analiet oplossing
13
New cards
Types referentie-elektrodes (werking kunnen uitleggen) + factoren die hun potentiaal \n bepalen kunnen uitleggen
Kalomelreferentie elektroden
De potentiaal reageert op de \[Cl-\] die aanwezig is, waarbij de concentratie bepaald wordt door de oplosbaarheid van KCl ifv de temperatuur → geen T variaties tijdens meting.
\
Zilver/ zilver-referentie-elektrode
Zoals bij de kalomelreferentie-elektrode wordt de gemeten potentiaal bepaald door de aanwezige \[Cl-\], ifv de oplosbaarheid en dus ook de temperatuur → geen temperatuursvariaties tijdens de meting.
De potentiaal reageert op de \[Cl-\] die aanwezig is, waarbij de concentratie bepaald wordt door de oplosbaarheid van KCl ifv de temperatuur → geen T variaties tijdens meting.
\
Zilver/ zilver-referentie-elektrode
Zoals bij de kalomelreferentie-elektrode wordt de gemeten potentiaal bepaald door de aanwezige \[Cl-\], ifv de oplosbaarheid en dus ook de temperatuur → geen temperatuursvariaties tijdens de meting.
14
New cards
Liquid junction (grensvlak)-potentialen + werking zoutbrug kunnen uitleggen
grensvlakpotentiaal/ liquid junction
= een verschil in potentiaal als gevolg van een verschil in mobiliteit van het kation VS het anion doorheen een poreus diafragma
\
dubble junctions
= het gevolg van het gebruik van 2 zoutbruggen zodat een correctie voor het lekken van het elektroliet uit de referentie-elektrode wordt doorgevoerd.
\
zoutbrug
= verhinderd dat de componenten uit de analietoplossing zich mengen met deze van de referentie-elektrode
= een verschil in potentiaal als gevolg van een verschil in mobiliteit van het kation VS het anion doorheen een poreus diafragma
\
dubble junctions
= het gevolg van het gebruik van 2 zoutbruggen zodat een correctie voor het lekken van het elektroliet uit de referentie-elektrode wordt doorgevoerd.
\
zoutbrug
= verhinderd dat de componenten uit de analietoplossing zich mengen met deze van de referentie-elektrode
15
New cards
Types indicatorelektroden + hun werking kunnen uitleggen
Metallische indicatorelektroden
* 1ste orde
* een zuivere metaalelektrode die in direct evenwicht is met zijn kation in oplossing. Ze zijn niet heel selectief, oxideren gemakkelijk, gaan in zuur milieu terug in oplossing en hebben bij hardere metalen geen reproduceerbaar potentiaal
* 2de orde
* een metallische indicatorelektrode die reageert op activiteiten van ionen die weinig oplosbare neerslagen of stabiele complexen vormen met hun eigen kationen
* inerte elektrode
* een inerte elektrode die zelf niet mee doet aan de reactie
Membraanelektroden
* glasmembraanelektroden
* een elektrode opgebouwd uit een dun, pH gevoelig glasmembraan met een Ag-draad omgeven door een buis met een kleine hoeveelheid verdund HCl en verzadigd met AgCl. Ze hebben zeer goede specificiteit tot een pH van 9. OPM het glasmembraan moet gehydrateerd blijven en ze moet dagelijks gekalibreerd worden door het ontstaan van het asymmetrie-potentiaal
* Vloeistofmembraanelektroden
* Een elektrode waarbij een vloeibare ionenwisselaar selectief de analietionen bindt, met ontwikkeling van een potentiaal. Het bestaat uit een geleidend membraan dat selectief calciumionen bindt, een interne oplossing die een vaste concentratie aan CaCl2 bevat en een zilverelektrode gecoat met AgCl als interne referentie heeft
* Kristalijnen membraanelektroden
* Membraanelektroden met kationische sites zodat ze een selectiviteit hebben tov anionen. Het membraan is vast
Gasprobes
* Bestaan uit een buisje dat een referentie elektrode, ionselectieve-elektrode en een elektrolytoplossing bevat met aan het uiteinde een dun gaspermeabelmembraan dat dienst doet als barrière tussen de interne oplossing en de analietoplossing. Water en ionen kunnen de poriën niet binnendringen
* 1ste orde
* een zuivere metaalelektrode die in direct evenwicht is met zijn kation in oplossing. Ze zijn niet heel selectief, oxideren gemakkelijk, gaan in zuur milieu terug in oplossing en hebben bij hardere metalen geen reproduceerbaar potentiaal
* 2de orde
* een metallische indicatorelektrode die reageert op activiteiten van ionen die weinig oplosbare neerslagen of stabiele complexen vormen met hun eigen kationen
* inerte elektrode
* een inerte elektrode die zelf niet mee doet aan de reactie
Membraanelektroden
* glasmembraanelektroden
* een elektrode opgebouwd uit een dun, pH gevoelig glasmembraan met een Ag-draad omgeven door een buis met een kleine hoeveelheid verdund HCl en verzadigd met AgCl. Ze hebben zeer goede specificiteit tot een pH van 9. OPM het glasmembraan moet gehydrateerd blijven en ze moet dagelijks gekalibreerd worden door het ontstaan van het asymmetrie-potentiaal
* Vloeistofmembraanelektroden
* Een elektrode waarbij een vloeibare ionenwisselaar selectief de analietionen bindt, met ontwikkeling van een potentiaal. Het bestaat uit een geleidend membraan dat selectief calciumionen bindt, een interne oplossing die een vaste concentratie aan CaCl2 bevat en een zilverelektrode gecoat met AgCl als interne referentie heeft
* Kristalijnen membraanelektroden
* Membraanelektroden met kationische sites zodat ze een selectiviteit hebben tov anionen. Het membraan is vast
Gasprobes
* Bestaan uit een buisje dat een referentie elektrode, ionselectieve-elektrode en een elektrolytoplossing bevat met aan het uiteinde een dun gaspermeabelmembraan dat dienst doet als barrière tussen de interne oplossing en de analietoplossing. Water en ionen kunnen de poriën niet binnendringen
16
New cards
Factoren die kunnen bijdragen tot fouten bij pH meting kunnen uitleggen
* Kalibratiefouten
* De elektrode droog bewaren
* De elektrode bewaren in gedemineraliseerd water
* De elektrode niet schoonmaken
* Onvoldoende onderdompeling van de sonde
* De elektrode droog bewaren
* De elektrode bewaren in gedemineraliseerd water
* De elektrode niet schoonmaken
* Onvoldoende onderdompeling van de sonde
17
New cards
Directe potentiometrie versus potentiometrische titraties
Directe potentiometrie
* Techniek waarbij telkens de potentiaal van een cel waarvan de indicatorelektrode ondergedompeld is in de analytoplossing wordt vergeleken met 1 of meerdere standaardoplossingen
Potentiometrische titraties
* Hierbij wordt de verandering in potentiaal gevolg bij de toevoeging van het titrans aan de analytoplossing.
* Het biedt enkele voordelen tov directe potentiometrie
* niet afhankelijk van meting van absolute waarden van de celpotentiaal
* afzettingen op de elektrode en niet-Nernstiaanse respons hebben geen ernstige gevolgen
* potentiaal van referentie-elektrode moet niet accuraat geweten zijn
* het resultaat is direct uitgedrukt als de concentratie
* Techniek waarbij telkens de potentiaal van een cel waarvan de indicatorelektrode ondergedompeld is in de analytoplossing wordt vergeleken met 1 of meerdere standaardoplossingen
Potentiometrische titraties
* Hierbij wordt de verandering in potentiaal gevolg bij de toevoeging van het titrans aan de analytoplossing.
* Het biedt enkele voordelen tov directe potentiometrie
* niet afhankelijk van meting van absolute waarden van de celpotentiaal
* afzettingen op de elektrode en niet-Nernstiaanse respons hebben geen ernstige gevolgen
* potentiaal van referentie-elektrode moet niet accuraat geweten zijn
* het resultaat is direct uitgedrukt als de concentratie
18
New cards
Conductometrie: begrippen en definities kennen en waarden kunnen interpreteren. Wat is het effect van verdunnen op zwakke en sterke elektrolyten.
Conductometrie = het bepalen van een concentratie aan analyt obv de specifieke geleidbaarheid/ conductiviteit van een elektrolyt oplossing.
\
Specifieke geleidbaarheid
* neemt toe met de temperatuur
* onafhankelijk van de probe
* is enkel afhankelijk van de aanwezig ionen en hun concentratie
* neemt toe met de concentratie
\
Equivalent
= De hoeveelheid elektrolyt die bij volledige dissociatie aanleiding geeft tot een hoeveelheid positieve ionen met een totale lading N0 e met e de elementaire lading en N0 het getal van Avogadro
\
Zwakke elektrolyten dissocieren meer in een verdunde oplossingen (Chatelier) waardoor er meer ionen zijn die de geleidbaarheid verhogen
\
Sterke elektrolyten hebben een dalen interioneffect bij grote verdunning waardoor de geleidbaarheid toeneemt
\
Specifieke geleidbaarheid
* neemt toe met de temperatuur
* onafhankelijk van de probe
* is enkel afhankelijk van de aanwezig ionen en hun concentratie
* neemt toe met de concentratie
\
Equivalent
= De hoeveelheid elektrolyt die bij volledige dissociatie aanleiding geeft tot een hoeveelheid positieve ionen met een totale lading N0 e met e de elementaire lading en N0 het getal van Avogadro
\
Zwakke elektrolyten dissocieren meer in een verdunde oplossingen (Chatelier) waardoor er meer ionen zijn die de geleidbaarheid verhogen
\
Sterke elektrolyten hebben een dalen interioneffect bij grote verdunning waardoor de geleidbaarheid toeneemt
19
New cards
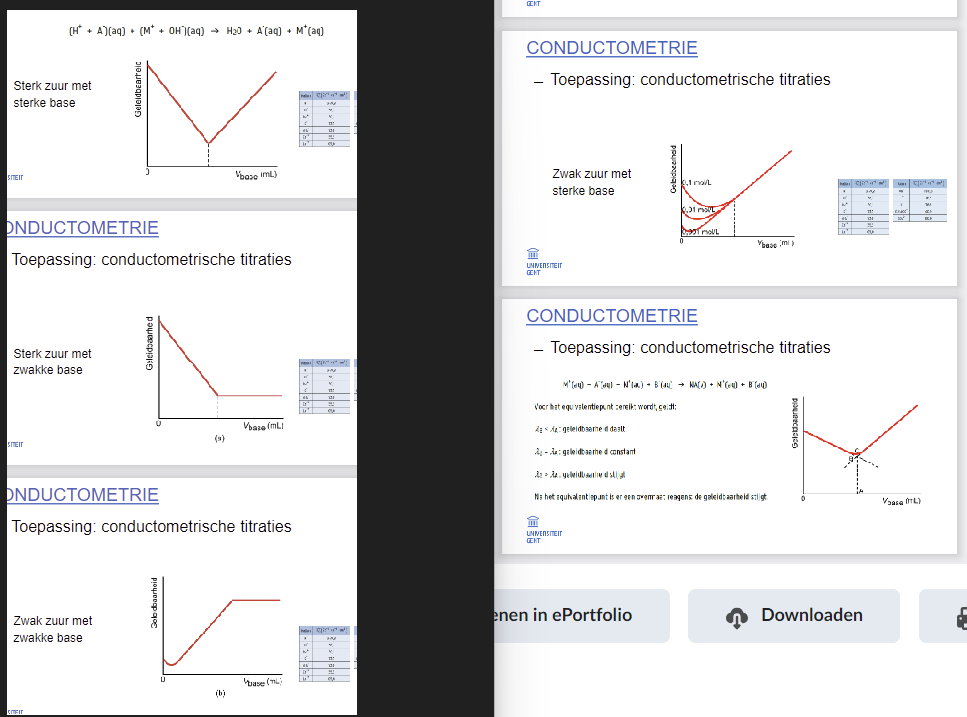
Toepassing conductometrie: titratiecurves van conductometrische titraties kunnen tekenen \n en verklaren/interpreteren
Sterk zuur + sterke base → V
\
Sterk zuur + zwakke base → \\_
\
Zwak zuur + zwakke base → U-
\
Neerslagtitraties → >/ (onderste deel van > niet)
\
Sterk zuur + zwakke base → \\_
\
Zwak zuur + zwakke base → U-
\
Neerslagtitraties → >/ (onderste deel van > niet)
20
New cards
Interactie van elektromagnetische straling met materie.
E2 - E1 = h v = h c/lambda
met h de cte van Planck
v de frequentie
lambda de golflengte
\
geexiteerde toestand = een elektron heeft stralingsenergie opgenomen en springt van de grondtoestand naar het hoger energetisch niveau
\
emisse = een geexiteerd elektron valt terug naar een lager niveau met vrijstelling van straling
met h de cte van Planck
v de frequentie
lambda de golflengte
\
geexiteerde toestand = een elektron heeft stralingsenergie opgenomen en springt van de grondtoestand naar het hoger energetisch niveau
\
emisse = een geexiteerd elektron valt terug naar een lager niveau met vrijstelling van straling
21
New cards
Gebruik van UV-VIS spectrometrie in anorganische analyse
* vormen van een covalente binding van anorganische stoffen met (kleur)reagens tot een absorberende verbinding → nieuwe absorptiemogelijkheden
* vorming van complexen tussen anorganische stoffen /elementen en ionen/ moleculen
* → nieuwe absorptiemogelijkheden door covalente bindingen tussen het analiet en ligand
* → nieuwe absorptiemogelijkheden door opsplitsing van elektronenbanen onder invloed van complexvorming
TOEPASSINGEN
* concentratiemetingen na vorming van reactieproducten of complexen
* gebruik van UV/VIS-detectie in geautoatiseerde analysesystemen
* fotometrische titraties als de kleuromslag moeilijk waarneembaar is → titratiecurve absorbantie tov toegevoegd volume
* vorming van complexen tussen anorganische stoffen /elementen en ionen/ moleculen
* → nieuwe absorptiemogelijkheden door covalente bindingen tussen het analiet en ligand
* → nieuwe absorptiemogelijkheden door opsplitsing van elektronenbanen onder invloed van complexvorming
TOEPASSINGEN
* concentratiemetingen na vorming van reactieproducten of complexen
* gebruik van UV/VIS-detectie in geautoatiseerde analysesystemen
* fotometrische titraties als de kleuromslag moeilijk waarneembaar is → titratiecurve absorbantie tov toegevoegd volume
22
New cards
Wet van Lambert-Beer + definities transmissie, absorptie, absorbantie en factoren die afwijkingen van lineariteit veroorzaken
Wet van Lambert-Beer = “Als een lichtstraal op een absorberend medium invalt, wordt een deel van het licht weerkaatst en een deel doorgelaten. De stralingsintensiteit achter het medium is dus lager.”
\
Transmissie = de verhouding van de intensiteit van de uitvallende straling op de intensiteit van de invallende straling = I/I0
\
Absorptie = 1 - T
\
Absorbantie = -log(T) = A = e C b = a C b
e = extinctiecoefficient
a = specifieke absorptiecoefficient
\
AFWIJKINGEN
Chemisch
* Analiet kan associëren, dissociëren of reageren
* Bij hoge concentratie van het analiet kan er onderlinge interactie plaatsvinden
* Bij zeer lage concentraties van het analiet maar hoge concentraties van een achtergrondelektroliet, kan het achtergrondelektroliet een effect hebben op de extinctie van het analiet
Fysisch
* De monochromator is fysisch beperkt en laat een dlambda door, je werkt dus met polychromatische straling → afwijking van extinctiecoefficient
* Strooilicht die de detector bereikt zonder door het staal geweest te zijn → verhouding I0/I wijkt af A = log((I0 + Is)/(I + Is))
* Ruis
\
Transmissie = de verhouding van de intensiteit van de uitvallende straling op de intensiteit van de invallende straling = I/I0
\
Absorptie = 1 - T
\
Absorbantie = -log(T) = A = e C b = a C b
e = extinctiecoefficient
a = specifieke absorptiecoefficient
\
AFWIJKINGEN
Chemisch
* Analiet kan associëren, dissociëren of reageren
* Bij hoge concentratie van het analiet kan er onderlinge interactie plaatsvinden
* Bij zeer lage concentraties van het analiet maar hoge concentraties van een achtergrondelektroliet, kan het achtergrondelektroliet een effect hebben op de extinctie van het analiet
Fysisch
* De monochromator is fysisch beperkt en laat een dlambda door, je werkt dus met polychromatische straling → afwijking van extinctiecoefficient
* Strooilicht die de detector bereikt zonder door het staal geweest te zijn → verhouding I0/I wijkt af A = log((I0 + Is)/(I + Is))
* Ruis

23
New cards
Waarom dient het absorbantieniveau zorgvuldig gekozen te worden (= niet te hoog, niet te laag)?
Om een minimale fout en hoge precisie te hebben. Wanneer de uitvallende straling klein is, is is elektronische ruis van belang → fout. Wanneer de invallende straling ongeveer gelijk is aan de uitvallende straling zal de relatieve fout ook groot zijn agv variaties in positie/orientatie van de cuvet.
De precisie is het hoogst bij absorbatiewaarden tussen 0,4 en 1,0, en optimaal bij 0,6.
De precisie is het hoogst bij absorbatiewaarden tussen 0,4 en 1,0, en optimaal bij 0,6.
24
New cards
Foto-elektrische apparatuur: schema van verschillende types toestellen kunnen tekenen, verschillende onderdelen en hun functie kennen
Stralingsbron
* straalt meestal continu straling uit. Afhankelijk in welk gebied men qua golflengte werkt kan een wolfraamlamp, deuteriumlamp of xenonlamp gebruikt worden.
\
Intensiteitscontrole dmv een sleet/ diafragma
* om er zeker van te zijn dat de absorbantiepieken van het spectrum binnen het lineaire bereik van de detector liggen
1. te lage intensiteit: onnauwkeurige/ onbetrouwbare gegevens
2. te hoge intensiteit: verzadiging en verlies van precisie
Door de intensiteit te optimaliseren, kunnen de absorptiepieken worden versterkt, wat resulteert in een hogere signaal-ruisverhouding en verbeterde gevoeligheid.
Bovendien kan het gebruik van een smallere spleet de resolutie en details in het spectrum verbeteren, waardoor een betere differentiatie van dichtbijgelegen absorptiepieken mogelijk is.
\
golflengteselector
* kleurfilter = filter die bestaat uit 2 kapfilters en licht in een 20 - 70 nm gebied doorlaat
* interferentiefilter = bestaat uit 2 parallelle plaatjes met daartussen een doorzichtige stof met een lage brekingsindex. Het laat licht in een 1 - 5 nm gebied door (erg duur, vooral in UV gebied)
* monochromator
* → op verschillende plaatsen in de ruimte verschillende golflengten
* → een golflengte (gebied) hieruit selecteren bij MAXimale absorptie voor hogere gevoeligheid respons van het analiet en een kleine variatie in extinctiecoefficient
* → meer lineaire lambert beer curve OOK absorbantieniveau rond 0.6
* prisma = breking van de straling in verschillende golflengten
* rooster = breking van de straling dmv reflectie
\
Cuvet = recipiënt van de monsteroplossing
\
Detector = zet het licht om naar een elektrisch signaal
* fotodiode = een receptor die zich als geleider gedraagt onder impact van een foton zodat er ontlading is van een geladen condensator dmv vrijstelling van elektronen en die na een bepaald tijdsinterval obv de residuele lading een indicatie kan geven van de uitgezonde energie. De condensator moet na een bepaalde tijd ontnieuw opgeladen worden
→ geen continue meting
→ bij vele diodes heel het spectrum simultaan meten (fotodiode-array, CTD/CCD-diode)
* fotomultiplier = Een receptor die continu de lichtintensiteit kan meten doordat bij impact van een foton een elektron uit een kathodeopp wordt vrijgesteld. Deze elektron wordt door middel van een reeks focusserende elektroden naar een dyodeketen gestuurd die het elektron multipliceert. Aan de anode worden finaal de elektronen gecollecteerd en het invallend licht berekend. Voordeel: continu, nadeel: kan nog niet zo heel klein gemaakt worden
* straalt meestal continu straling uit. Afhankelijk in welk gebied men qua golflengte werkt kan een wolfraamlamp, deuteriumlamp of xenonlamp gebruikt worden.
\
Intensiteitscontrole dmv een sleet/ diafragma
* om er zeker van te zijn dat de absorbantiepieken van het spectrum binnen het lineaire bereik van de detector liggen
1. te lage intensiteit: onnauwkeurige/ onbetrouwbare gegevens
2. te hoge intensiteit: verzadiging en verlies van precisie
Door de intensiteit te optimaliseren, kunnen de absorptiepieken worden versterkt, wat resulteert in een hogere signaal-ruisverhouding en verbeterde gevoeligheid.
Bovendien kan het gebruik van een smallere spleet de resolutie en details in het spectrum verbeteren, waardoor een betere differentiatie van dichtbijgelegen absorptiepieken mogelijk is.
\
golflengteselector
* kleurfilter = filter die bestaat uit 2 kapfilters en licht in een 20 - 70 nm gebied doorlaat
* interferentiefilter = bestaat uit 2 parallelle plaatjes met daartussen een doorzichtige stof met een lage brekingsindex. Het laat licht in een 1 - 5 nm gebied door (erg duur, vooral in UV gebied)
* monochromator
* → op verschillende plaatsen in de ruimte verschillende golflengten
* → een golflengte (gebied) hieruit selecteren bij MAXimale absorptie voor hogere gevoeligheid respons van het analiet en een kleine variatie in extinctiecoefficient
* → meer lineaire lambert beer curve OOK absorbantieniveau rond 0.6
* prisma = breking van de straling in verschillende golflengten
* rooster = breking van de straling dmv reflectie
\
Cuvet = recipiënt van de monsteroplossing
\
Detector = zet het licht om naar een elektrisch signaal
* fotodiode = een receptor die zich als geleider gedraagt onder impact van een foton zodat er ontlading is van een geladen condensator dmv vrijstelling van elektronen en die na een bepaald tijdsinterval obv de residuele lading een indicatie kan geven van de uitgezonde energie. De condensator moet na een bepaalde tijd ontnieuw opgeladen worden
→ geen continue meting
→ bij vele diodes heel het spectrum simultaan meten (fotodiode-array, CTD/CCD-diode)
* fotomultiplier = Een receptor die continu de lichtintensiteit kan meten doordat bij impact van een foton een elektron uit een kathodeopp wordt vrijgesteld. Deze elektron wordt door middel van een reeks focusserende elektroden naar een dyodeketen gestuurd die het elektron multipliceert. Aan de anode worden finaal de elektronen gecollecteerd en het invallend licht berekend. Voordeel: continu, nadeel: kan nog niet zo heel klein gemaakt worden
25
New cards
Verschil sequentieel versus simultaan toestel en enkelstraal versus dubbelstraal toestel
sequentieel = de golflengtes worden sequentieel gemeten door 1 detector vb met behulp van de rotatie van een diffractierooster
\
simultaan/ continu = de golflengtes worden gelijktijdig gemeten door verschillende delen van het spectrum op verschillende detectoren te projecteren
\
enkelstraal toestel = eerst blanco wordt in de lichtweg geplaatst, daarna in dezelfde omstandigheden de analyseoplossing
\
dubbelstraal toestel = de invallende lichtstraal wordt in 2 gesplitst die resp. door de blanco en de analyseoplossing gaan
\
simultaan/ continu = de golflengtes worden gelijktijdig gemeten door verschillende delen van het spectrum op verschillende detectoren te projecteren
\
enkelstraal toestel = eerst blanco wordt in de lichtweg geplaatst, daarna in dezelfde omstandigheden de analyseoplossing
\
dubbelstraal toestel = de invallende lichtstraal wordt in 2 gesplitst die resp. door de blanco en de analyseoplossing gaan
26
New cards
Waarom is intensiteitscontrole van invallend licht nodig?
1. om er zeker van te zijn dat de absorbantiepieken van het spectrum binnen het lineaire bereik van de detector liggen
1. te lage intensiteit: onnauwkeurige/ onbetrouwbare gegevens
2. te hoge intensiteit: verzadiging en verlies van precisie
Door de intensiteit te optimaliseren, kunnen de absorptiepieken worden versterkt, wat resulteert in een hogere signaal-ruisverhouding en verbeterde gevoeligheid.
Bovendien kan het gebruik van een smallere spleet de resolutie en details in het spectrum verbeteren, waardoor een betere differentiatie van dichtbijgelegen absorptiepieken mogelijk is.
27
New cards
Verschillende types detectoren + verschillen tussen beide kunnen bespreken
Detector = zet het licht om naar een elektrisch signaal
* fotodiode = een receptor die zich als geleider gedraagt onder impact van een foton zodat er ontlading is van een geladen condensator dmv vrijstelling van elektronen en die na een bepaald tijdsinterval obv de residuele lading een indicatie kan geven van de uitgezonde energie. De condensator moet na een bepaalde tijd ontnieuw opgeladen worden
→ geen continue meting
→ bij vele diodes heel het spectrum simultaan meten (fotodiode-array, CTD/CCD-diode)
* fotomultiplier = Een receptor die continu de lichtintensiteit kan meten doordat bij impact van een foton een elektron uit een kathodeopp wordt vrijgesteld. Deze elektron wordt door middel van een reeks focusserende elektroden naar een dyodeketen gestuurd die het elektron multipliceert. Aan de anode worden finaal de elektronen gecollecteerd en het invallend licht berekend. Voordeel: continu, nadeel: kan nog niet zo heel klein gemaakt worden
* fotodiode = een receptor die zich als geleider gedraagt onder impact van een foton zodat er ontlading is van een geladen condensator dmv vrijstelling van elektronen en die na een bepaald tijdsinterval obv de residuele lading een indicatie kan geven van de uitgezonde energie. De condensator moet na een bepaalde tijd ontnieuw opgeladen worden
→ geen continue meting
→ bij vele diodes heel het spectrum simultaan meten (fotodiode-array, CTD/CCD-diode)
* fotomultiplier = Een receptor die continu de lichtintensiteit kan meten doordat bij impact van een foton een elektron uit een kathodeopp wordt vrijgesteld. Deze elektron wordt door middel van een reeks focusserende elektroden naar een dyodeketen gestuurd die het elektron multipliceert. Aan de anode worden finaal de elektronen gecollecteerd en het invallend licht berekend. Voordeel: continu, nadeel: kan nog niet zo heel klein gemaakt worden
28
New cards
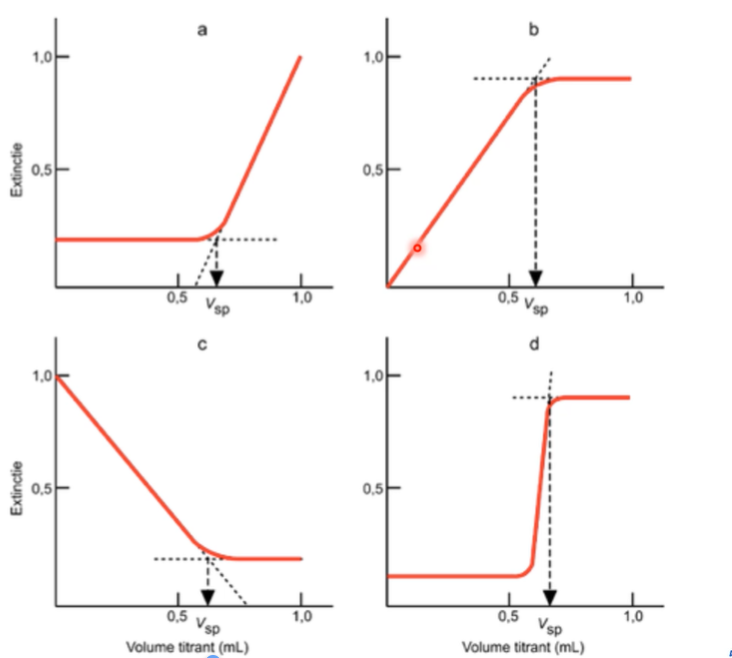
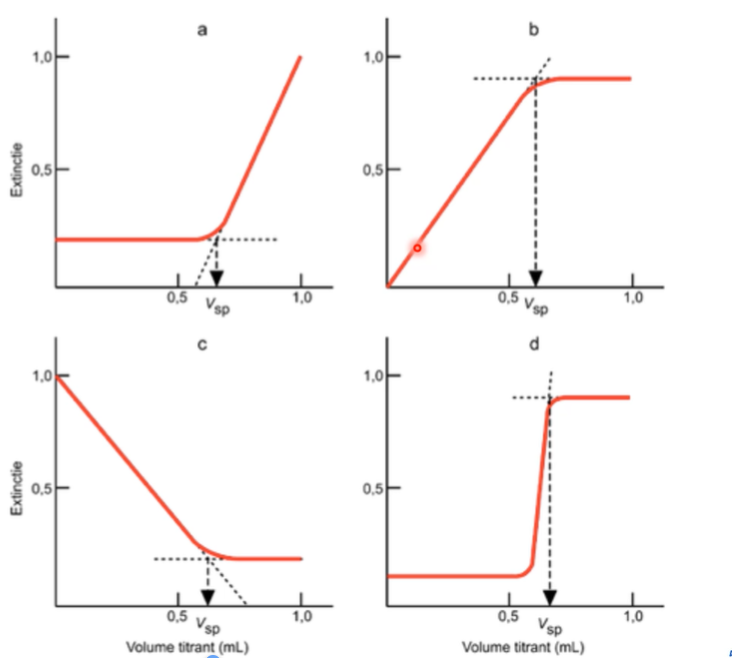
Toepassingen: curves van fotometrische titraties kunnen tekenen + bespreken (verloop uitleggen)
a)
voor sp: uitgangsproduct absorbeert niet en reactieproduct voor het equivalentieproduct ook niet
na sp: absorptie neemt toe omdat de stof die je in overmate toevoegd wel absorbeert bij die golflengte
\
b)
voor sp: analiet absorbeert niet, maar het reactieproduct wel → absorptie neemt toe
na sp: absorptie blijft constant omdat titratiereagens in overmate niet absorbeert
\
c)
voor sp: analiet absorbeert zeer sterk, het reactiereagens niet → daling in absorptie
na sp: het titrans in overmaat absorbeert niet
\
d)
voor sp: analiet absorbeert niet, het reactieproduct ook niet
bij sp: sprong door toevoeging van een indicator
na sp: overmaat titrans absorbeert niet
voor sp: uitgangsproduct absorbeert niet en reactieproduct voor het equivalentieproduct ook niet
na sp: absorptie neemt toe omdat de stof die je in overmate toevoegd wel absorbeert bij die golflengte
\
b)
voor sp: analiet absorbeert niet, maar het reactieproduct wel → absorptie neemt toe
na sp: absorptie blijft constant omdat titratiereagens in overmate niet absorbeert
\
c)
voor sp: analiet absorbeert zeer sterk, het reactiereagens niet → daling in absorptie
na sp: het titrans in overmaat absorbeert niet
\
d)
voor sp: analiet absorbeert niet, het reactieproduct ook niet
bij sp: sprong door toevoeging van een indicator
na sp: overmaat titrans absorbeert niet
29
New cards
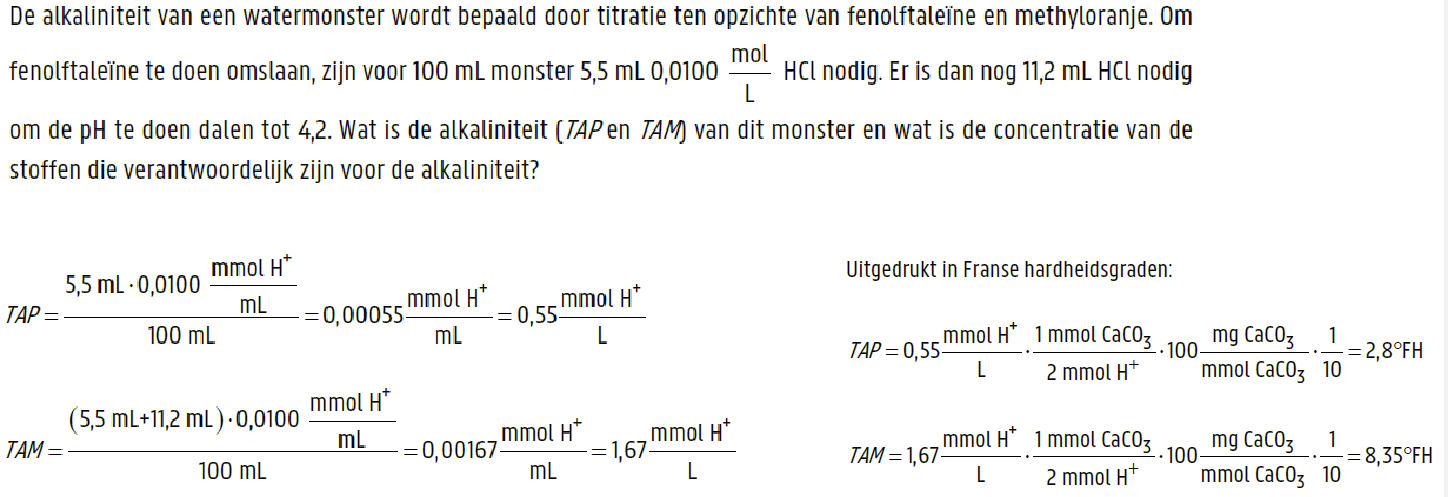
TAP en TAM
TAP = aantal mol H+ nodig om phenoftaleine om te slaan gedeeld door het volume van het monster
\
TAM = aantal mol H+ nodig om methyloranje om te slaan gedeeld door het volume van het monster
\
TAM = aantal mol H+ nodig om methyloranje om te slaan gedeeld door het volume van het monster
30
New cards
Franse en Duitse hardheidsgraden
.
