CHAP 1 CHIMIE
1/16
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
17 Terms
Comment est représenté un atome ?
A = nb nucléons = nb amasse
X = élément chimique
Z= numéro atomique = nb protons
Quelles sont les unités de la masse de l’atome et de la masse d’une mole?
Masse atome en u.m.a
Masse d’une mole en g.mol
Comment est chargé un atome ?
Électriquement neutre
C’est quoi un isotope?
Même élément, même Z, A ≠
Formule calculer masse molaire a partir pourcentage des isotopes ?
M = M(I1).%I1 + M(I2).%I2 + M(I3).%I3 + ….
M masse isotope
≠ cations et anions
Cation PERD electron(s) = chargé +
Anion gagne électron = chargé -
« Cations en a trop, il en a + donc il doit en perdre et l’anion en a pas assez il est chargé - donc il va en gagner »
Par quoi est caractérisée une orbitale atomique ? Détails
Carac par nombres quantiques n (num couche) , l (type orbitale) , m (cb OA pr catégorie d’OA) , ms (sens de la flèche)
n: nb principal : entier et n>0
l: secondaire : entier et 0≤l≤n-1
l=0 → s
l=1 → p
l=2 → d
l=3 → f
m: magnétique: entier et -l≤m≤+l
ms: de spin: +1/2 ou -1/2
Combien d’électrons max par orbitale ?
s : 2 e-
p : 6 e-
d : 10 e-
Méthodologie configuration électronique
remplir les 2electrons les orbitales avec au max s2p6d10
Attention a voir les gaz nobles (app par cœur)
Remettre dans l’ordre croissant des n
Règle de Klechkovski : 1s 2s 2p 3s 3p 4s 3D 4p 5s 4d 5p 6s

C’est quoi électron de valence ?
Ceux dont nb quantique principal n est le plus elevé ainsi que ceux qui appartiennent à des sous couches en cours de remplissage
Les autres: électrons de cœur
Représentation de Lewis des atomes
Tient compte que des e- de valence
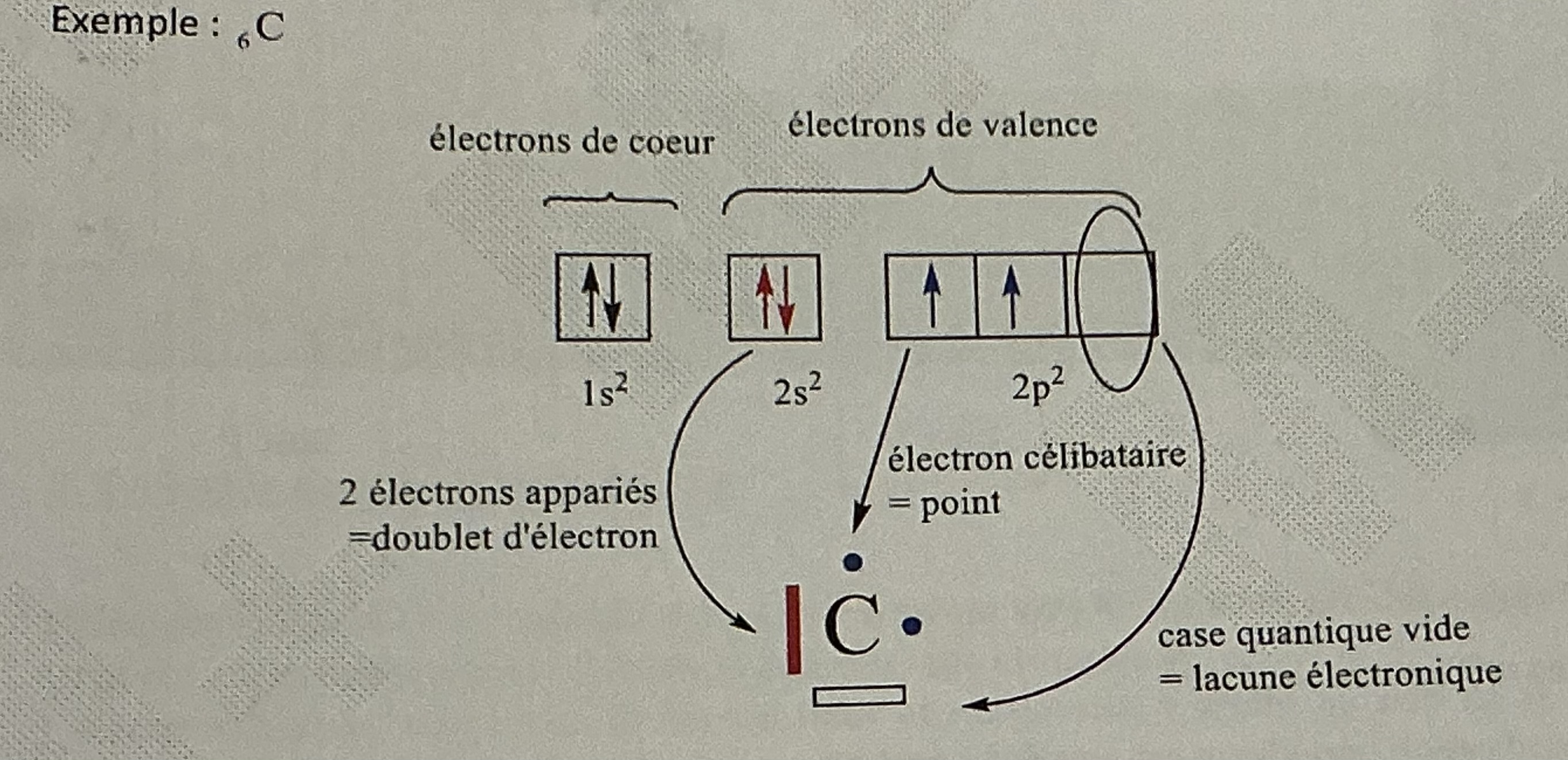
Configuration électronique anions et cations ?
Donne représentation atome état fondamental
Anion : ajoute nb e- et Cation : enlève nb e-
Classification périodique
7 Lignes = périodes + 18 colonnes
Par numéro atomique Z croissant
Par ligne : mm valeur de n valence
Par colonne: mm configuration de valence => mm propriétés chimiques
BLOC S : COLONNE 1 : ALCALINS, MÉTAUX MONOATOMIQUES, RÉDUCTEURS, DONNENT DES CATIONS M+
COLONNE 2 : ALCALINO TERREUX, MÉTAUX RÉDUCTEURS, DONNENT CATIONS M2+
BLOC D: MÉTAUX DE TRANSITION
BLOC P HALOGÈNE= MOLÉCULES DIATOMIQUES ET OXYDANTS ET DONNENT DES ANIONS X-
GAZ NOBLES= GAZ MONOATOMIQUES
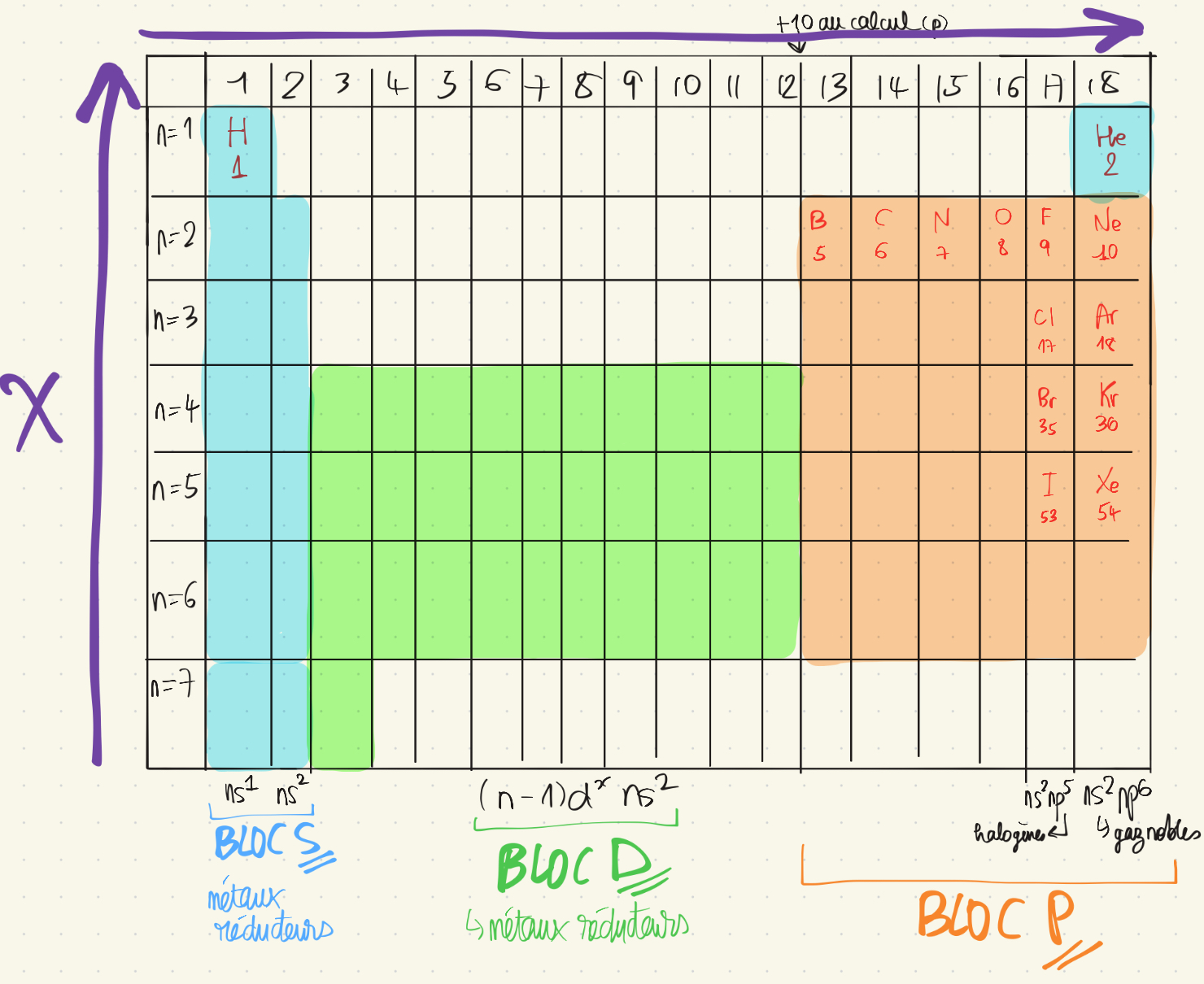
Méthode pour trouver ligne / période et colonne

POLARISATION (Évolution de la polarisabilité)
Liaisons de Van Der Waals
+ espèce grosse + polarisable
→ augmentation interaction van der waals et augmentation taille => augmentation températures de changement d’état
→ a taille idd: T chgt d’état + élevée pour la molécule la + polaire
RAYON dans classification périodique
Taille des OA augmente avec n
Rayon atomique augmente haut en bas et droite a gauche
Rayon ionique comparable au rayon atomique du meme élément ρcation < ρatome neutre < ρanion
Énergie d’ionisation El dans classification périodique
Énergie de 1ere ionisation = énergie minimale a fournir pour arracher un e- a un atome à l’état gazeux dans son état fondamental
Augm bas en haut, gauche a droite
Varie a l’inverse de l’énergie d’ionisation
Colonnes les + à gauche: éléments fortement réducteurs