Bioquimica I - Meisenberg - Cap 2 - Introducción a la estructura de proteínas
1/87
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
88 Terms
Estructura de aminoácidos
Grupo α-carboxilo, grupo α-amino, un átomo de hidrógeno y una cadena lateral R unidos al carbono α.
Las proteínas están formadas solo por:
a. L-aminoácidos
b. D-Amunoácidos
a. L-aminoácidos
*Las proteínas están formadas solo por l -aminoácidos. Los d -aminoácidos son raros en la naturaleza, aunque se encuentran en algunos productos bacterianos
El p K del grupo α-carboxilo es aproximadamente _____ y el p K del grupo α-amino está cerca de ____.
2.0
9-10
Las proteínas están formadas solo por:
Que poseen simultáneamente una carga positiva (normalmente en el grupo amino)y una carga negativa (normalmente en el grupo carboxilo) en la misma molécula.
¿Qué determina el estado de protonación de un aminoácido?
El pH de la solución en relación con los valores de pK de los grupos ionizables.
Qué es el punto isoeléctrico (pI)?
Es el valor de pH en el que el número de cargas positivas de un aminoácido se iguala al de las cargas negativas.
Grupo carboxilo y PKa
Tiene un pKa típicamente alrededor de 2-2.5.
Por debajo de su pKa, el grupo carboxilo permanece protonado (-COOH), sin carga.
Por encima de su pKa, pierde el protón y se convierte en -COO⁻, adquiriendo carga negativa.
Grupo amino y su pKa
Tiene un pKa típicamente alrededor de 9-10.
Por debajo de su pKa, el grupo amino está protonado (-NH₃⁺) y tiene carga positiva.
Por encima de su pKa, pierde el protón y queda -NH₂, sin carga.
¿Cómo se comporta un aminoácido a pH por debajo del pKa del carboxilo?
El carboxilo está protonado (-COOH, sin carga) y el amino está protonado (-NH₃⁺, carga positiva).
Resultado: el aminoácido es predominantemente un catión.
¿Cómo se comporta un aminoácido a pH por encima del pKa del amino?
El amino está desprotonado (-NH₂, sin carga) y el carboxilo desprotonado (-COO⁻, carga negativa).
Resultado: el aminoácido es predominantemente un anión.
¿Qué es el pKa de un grupo funcional en un aminoácido?
Es el pH al cual la mitad de las moléculas del grupo están protonadas y la otra mitad desprotonadas.
¿Qué ocurre con el grupo carboxilo (-COOH) cuando el pH está por debajo de su pKa?
Permanece protonado (-COOH) y no tiene carga.
¿Qué ocurre con el grupo carboxilo (-COOH) cuando el pH está por encima de su pKa?
Se desprotona a (-COO⁻), adquiriendo carga negativa.
Qué ocurre con el grupo amino (-NH₂) cuando el pH está por debajo de su pKa?
Está protonado (-NH₃⁺) y tiene carga positiva.
¿Qué ocurre con el grupo amino (-NH₂) cuando el pH está por encima de su pKa?
Se desprotona (-NH₂), perdiendo la carga positiva.
Capacidad tampón de los grupos ionizables
Cada grupo ionizable del aminoácido modula el pH cerca de su propio pKa:
Si el pH aumenta, el grupo puede liberar protones para contrarrestar el cambio.
Si el pH disminuye, el grupo puede absorber protones para mantener la estabilidad.
Este comportamiento explica por qué los aminoácidos funcionan como tampón en soluciones acuosas.
Grupos ionizables de los aminoácidos
Los grupos ionizables son aquellos grupos químicos dentro de una molécula que pueden ganar o perder protones (H⁺) dependiendo del pH del medio. Este cambio les permite adquirir una carga positiva o negativa.
En los aminoácidos, los principales grupos ionizables son:
Grupo carboxilo (-COOH)
Puede perder un protón y convertirse en -COO⁻ (carga negativa).
Su capacidad de ionizar se mide con su pKa, usualmente alrededor de 2-2.5.
Grupo amino (-NH₂)
Puede ganar un protón y convertirse en -NH₃⁺ (carga positiva).
Su pKa es típicamente alrededor de 9-10.
Cadenas laterales (R) de algunos aminoácidos
Algunos aminoácidos tienen grupos funcionales adicionales que también pueden ionizar, como:
Aspartato y glutamato (-COOH en la cadena lateral) → carga negativa a pH fisiológico.
Lisina, arginina y histidina (-NH₂ o grupos imidazol) → carga positiva a pH fisiológico.
Cisteína (-SH) y tirosina (-OH) → pueden ionizar bajo condiciones específicas.
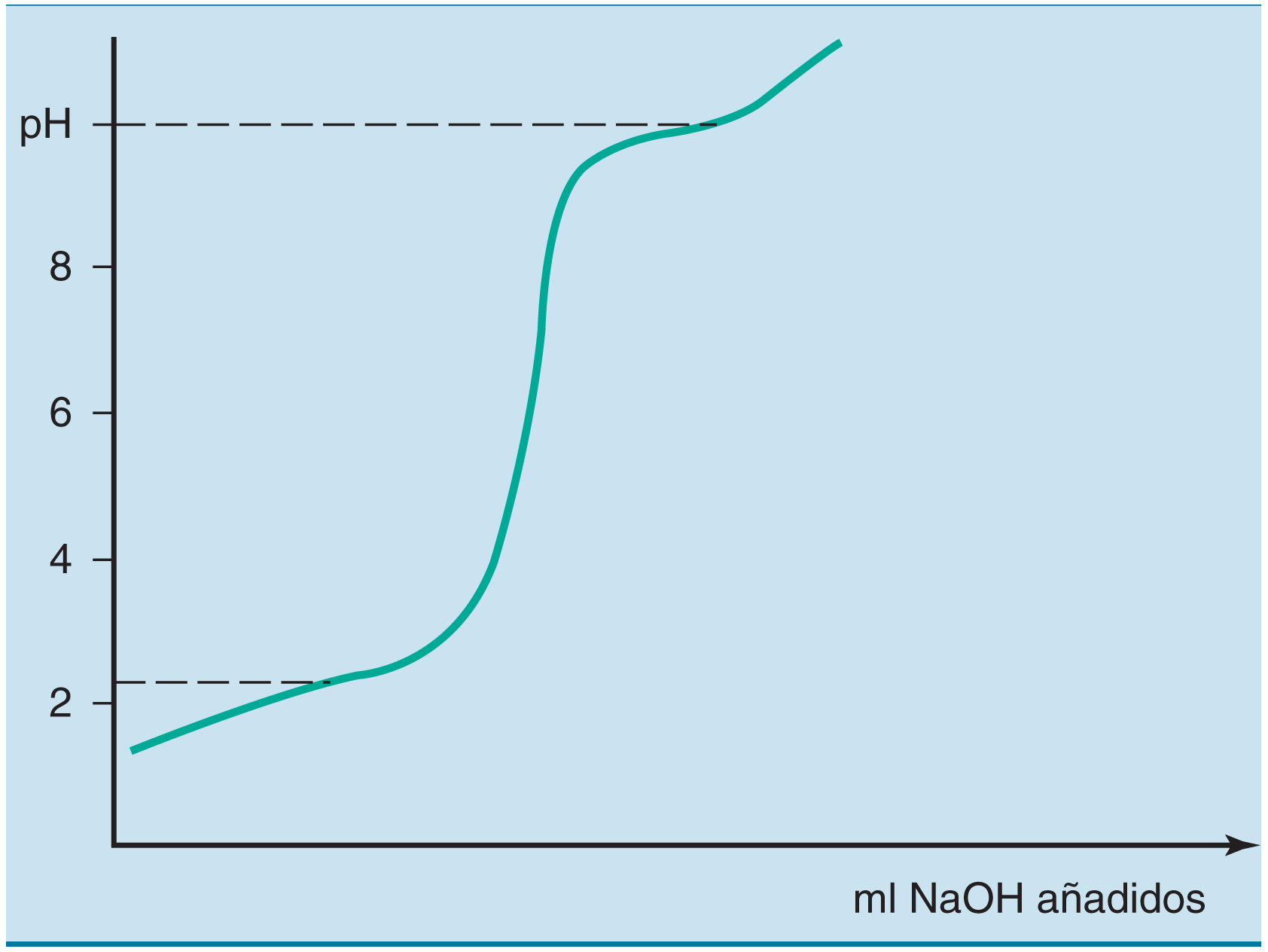
Curva de titulación
La curva de pH vs. cantidad de titulado típicamente muestra segmentos horizontales (mesetas) donde el pH cambia muy poco al añadir más base o ácido.
Cada segmento horizontal corresponde al pKa de un grupo ionizable, porque es el punto donde el grupo está parcialmente protonado y parcialmente desprotonado.
¿Qué tipo de interacciones forman las cadenas laterales de los aminoácidos?
Principalmente interacciones no covalentes (hidrófobas, enlaces de hidrógeno, fuerzas de Van der Waals), aunque algunos aminoácidos pueden formar enlaces covalentes (por ejemplo, enlaces disulfuro entre cisteínas).
¿Qué caracteriza a los aminoácidos pequeños y cuáles son ejemplos?
Ocupan poco espacio; permiten proximidad entre cadenas polipeptídicas. Ejemplos: Glicina y alanina.
¿Qué tienen en común los aminoácidos de cadena ramificada y ejemplos?
Sus cadenas laterales son hidrófobos, con cadenas laterales voluminosas. Ejemplos: Valina, leucina, isoleucina.
Aminoácidos con grupo hidroxilo y sus funciones
La serina y la treonina forman enlaces de hidrógeno con sus grupos hidroxilo. También forman enlaces covalentes con carbohidratos y con grupos fosfato.
Aminoácidos con azufre y sus particularidades
Cisteína y metionina; hidrófobos
La cisteína
a. Tiene propiedades de ácido débiles.
b. Su grupo sulfhidrilo (—SH) puede formar dentro de la proteína un enlace covalente disulfuro con la cadena lateral de otra cisteína.
Aminoácidos aromáticos:
La fenilalanina, la tirosina y el triptófano son hidrófobos, aunque las cadenas laterales de la tirosina y el triptófano también pueden formar enlaces de hidrógeno. El grupo hidroxilo de la tirosina puede formar enlaces covalentes con un grupo fosfato.
Aminoácidos ácidos
El glutamato y el aspartato tienen un grupo carboxilo en la cadena lateral que está cargado negativamente a pH 7. Los correspondientes grupos carboxamida de la glutamina y de la asparagina no son ácidos pero forman fuertes enlaces de hidrógeno. En las glicoproteínas, la asparagina es un punto de anclaje para un carbohidrato.
Aminoácidos básicos
La lisina, la arginina y la histidina llevan una carga positiva en la cadena lateral, aunque el p K de la cadena lateral de la histidina es bastante bajo.
¿Qué particularidad tiene la prolina?
Es la rareza dentro de los aminoácidos, ya que tiene un nitrógeno unido a una estructura en anillo como un grupo amino secundario. Siendo rígido y en ángulo, con frecuencia forma una curva en el polipéptido.
Se considera aminoáciods ciclicos
En los polipéptidos, los aminoácidos se mantienen unidos gracias a los
a. enlaces peptidicos
b. puentes de hidrogeno
c. enlaces de fosfodiester
d. enlaces ester
a. enlaces peptidicos
Un dipéptido se forma por
La reacción entre el grupo α-carboxilo y el grupo α-amino de dos aminoácidos.
*La reacción libera una molécula de agua
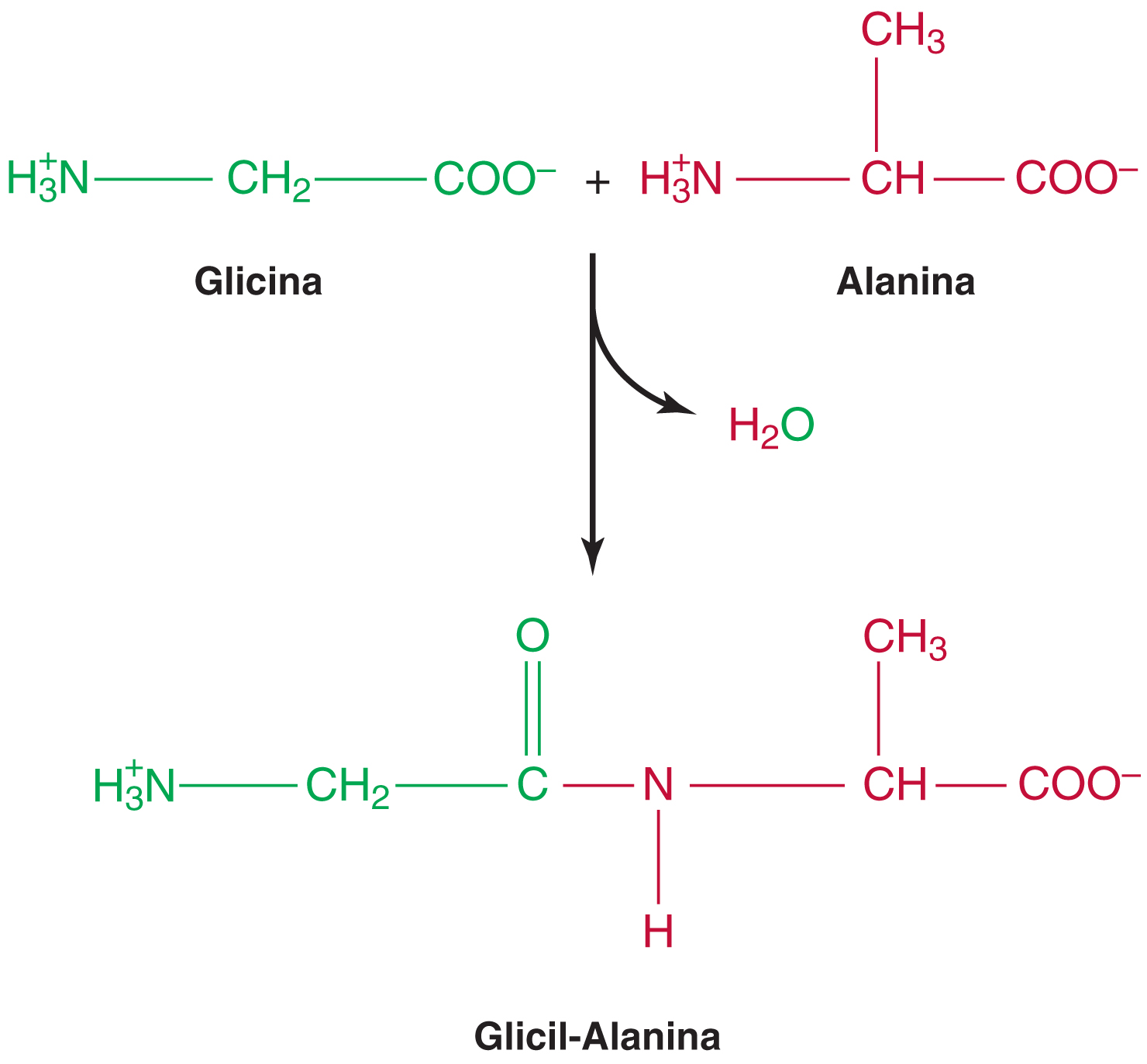
¿Qué se forma al unir dos aminoácidos y al añadir más aminoácidos?
Dos aminoácidos → dipéptido; varios aminoácidos → oligopéptido; muchos aminoácidos → polipéptido.
¿Qué extremos se distinguen en un polipéptido?
N-terminal (amino terminal): extremo con grupo amino libre, escrito a la izquierda.
C-terminal (carboxilo terminal): extremo con grupo carboxilo libre, escrito a la derecha.
¿Los enlaces peptídicos son ionizables?
No, no son ionizables, pero pueden formar enlaces de hidrógeno, contribuyendo a la solubilidad de las proteínas.
¿Qué es un enlace disulfuro y dónde se forma?
Enlace covalente entre las cadenas laterales de los residuos de dos cisteínas (-SH) mediante.
La formación de un enlace disulfuro es una reacción oxidativa en la cual el hidrógeno es transferido a una molécula aceptora.
El enlace disulfuro se puede formar entre dos cisteínas del mismo polipéptido (intracadena) o de diferentes polipéptidos (intercadena).
La reacción tiene lugar en el retículo endoplasmático (RE), donde se procesan las proteínas secretadas y las proteínas de membrana. Por tanto, la mayoría de las proteínas secretadas y las proteínas de membrana tienen enlaces disulfuro.
La degradación de proteínas con enlaces disulfuro produce el aminoácido:
cistina
Definición de estructura primaria
La estructura primaria de una proteína está definida por:
La secuencia lineal de aminoácidos.
La posición de los enlaces disulfuro.
Esta estructura determina la información necesaria para el plegamiento y la función de la proteína.
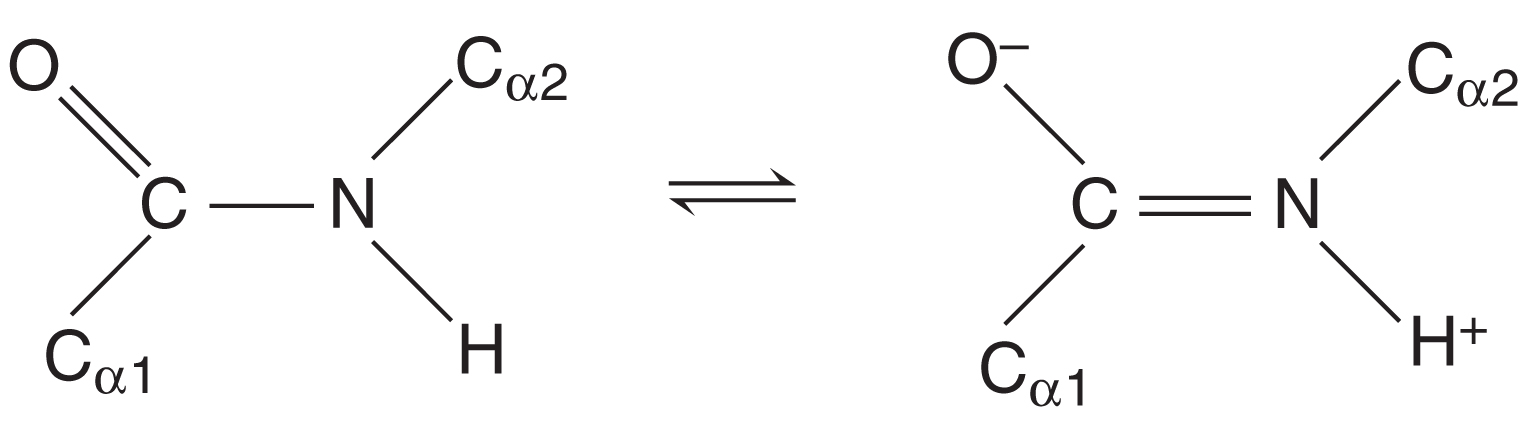
Enlace peptídico
El enlace peptídico (C—N) une aminoácidos en el polipéptido.
Aunque por convención se dibuja como un enlace sencillo, en realidad es un híbrido de resonancia entre dos estructuras, lo que le da:
Carácter parcial de doble enlace → no rota, a diferencia de un enlace C—C sencillo.
Configuración trans: los carbonos α adyacentes están enfrentados, evitando colisiones estéricas.
¿Qué caracteriza al enlace peptídico (C—N) en los polipéptidos?
Es un híbrido de resonancia con carácter parcial de doble enlace, por lo que no rota y mantiene los carbonos α en configuración trans.
¿Qué ángulos permiten la rotación de la cadena polipeptídica?
Los enlaces carbono α—nitrógeno (ϕ, phi) y carbono α—carbono del esqueleto polipeptídico (ψ, psi) sí pueden rotar, lo que permite:
Formar giros en U, hélices y otras formas complejas en la cadena polipeptídica.
Esta libertad es fundamental para la flexibilidad y diversidad estructural de las proteínas.
Tipos de proteínas según su forma: Globulares
Forma compacta, la mayoría solubles en agua.
Ejemplos: hemoglobina, mioglobina, enzimas, proteínas plasmáticas, algunas proteínas de membrana.
Tipos de proteínas según su forma: Fibrosas
Estructura alargada y parecida a un hilo.
Función principalmente estructural.
Ejemplos: queratina (pelo, piel, uñas), colágeno, elastina (matriz extracelular).
¿Qué papel juega la libertad de rotación de los ángulos phi y psi en las proteínas?
Permite que los polipéptidos se plieguen de muchas formas, formando estructuras secundarias y terciarias, esenciales para la función de la proteína.
Concepto de estructura secundaria
Es una estructura regular y repetitiva del polipéptido, estabilizada por enlaces de hidrógeno entre los enlaces peptídicos.
Surge cuando todos los ángulos ϕ y ψ son iguales.
Solo unas pocas estructuras secundarias son energéticamente favorables.
Hélice α - estructura secundaria
Forma un sacacorchos dextrógiro (giro hacia la derecha).
Propiedades:
Compacta, cada vuelta tiene 3,6 residuos de aminoácidos.
Cada aminoácido avanza 1,5 Å a lo largo del eje → una vuelta completa = 5,4 Å (0,54 nm).
Enlaces de hidrógeno:
Entre el C=O de un residuo y el N—H del residuo que está cuatro posiciones adelante.
La línea N—H—O es casi recta, lo que es energéticamente favorable.
Cadenas laterales:
Apuntan hacia fuera del eje, pueden estabilizar o desestabilizar la hélice.
Prolina: demasiado rígida, no encaja.
Glicina: demasiado flexible, puede adoptar otras conformaciones más favorables.
Hoja plegada β - estructura secundaria
Es una estructura más extensa que la hélice α; cada aminoácido avanza 3,5 Å.
Los enlaces de hidrógeno se forman entre el C=O y N—H de polipéptidos cercanos.
Puede ser:
Paralela: cadenas polipeptídicas alineadas en la misma dirección.
Antiparalela: cadenas en direcciones opuestas.
Varias hojas β pueden formar estructuras en forma de manta, con más de dos polipéptidos.
¿Qué sucede cuando varias hojas β interactúan?
Forman estructuras en forma de manta, involucrando más de dos polipéptidos.
¿Dónde se encuentran hélices α y hojas β?
En proteínas globulares y fibrosas, constituyendo la base de la estructura tridimensional y funcional de la proteína.
Proteínas globulares y estructura terciaria
Las proteínas globulares se pliegan sobre sí mismas formando estructuras compactas.
Estructuras secundarias cortas: generalmente <30 aminoácidos, alternando con regiones irregulares.
Formación de la estructura terciaria:
Predominantemente por interacciones hidrófobas entre cadenas laterales de aminoácidos.
Estas cadenas laterales forman un núcleo hidrófobo en el interior de la proteína.
Algunas proteínas presentan múltiples dominios globulares, conectados por regiones flexibles y extendidas del polipéptido.
¿Qué fuerza principal estabiliza la estructura terciaria de las proteínas globulares?
Interacciones hidrófobas entre las cadenas laterales de aminoácidos.
¿Qué son los dominios globulares en proteínas?
Subestructuras compactas dentro de un polipéptido, conectadas por regiones flexibles; algunas proteínas tienen múltiples dominios globulares.
¿Qué es la estructura cuaternaria?
Surge de interacciones entre diferentes polipéptidos (subunidades).
Solo se da en proteínas con dos o más polipéptidos.
Las subunidades pueden mantenerse juntas mediante:
Interacciones no covalentes (principalmente hidrófobas, iónicas o de hidrógeno).
Enlaces disulfuro entre cisteínas de subunidades diferentes.
Proteínas modificadas y grupos prostéticos
Todas son cuaternarias
Glicoproteínas: carbohidratos unidos covalentemente - enlaces glicosidicos
Fosfoproteínas: fosfatos unidos covalentemente - enlaces fosfatos
Grupos prostéticos: componentes no polipeptídicos unidos covalentemente o no covalentemente que son esenciales para la función de la proteína (por ejemplo, muchas coenzimas enzimáticas).
¿Qué ocurre con las proteínas cuando se destruye su estructura de orden superior?
Las proteínas pierden sus propiedades biológicas cuando se destruye su estructura de orden superior (estructuras secundaria, terciaria y cuaternaria). Esto se debe a que su función depende de la conformación tridimensional específica, que mantiene activos sus sitios funcionales y su estabilidad física.
La desnaturalización de las proteínas es irreversible.
Ej: Un huevo cocido no se vuelve a convertir en un huevo sin cocer cuando se pone en frío.
¿Qué enlaces covalentes de las proteínas se pueden romper por calor, ácidos o bases fuertes?
Los enlaces peptídicos.
*También se degradan de manera controlada mediante enzimas proteolíticas (proteasas), como ocurre durante la digestión en estómago e intestino.
¿Cómo se rompen los enlaces disulfuro en las proteínas?
Mediante agentes reductores u oxidantes, afectando la estructura terciaria y cuaternaria.
Interacciones no covalentes
Son muy frágiles al calor y responsables del plegamiento correcto y la estabilidad de la proteína.
Se incluyen interacciones hidrófobas, enlaces de hidrógeno y puentes salinos.
La rotura de estas interacciones provoca desnaturalización, incluso sin romper enlaces covalentes.
¿Qué efecto tiene el calor en las proteínas?
Provoca desnaturalización térmica, transformando la estructura ordenada en una maraña desordenada, con pérdida de actividad biológica.
¿Cómo afectan los detergentes y solventes orgánicos a las proteínas?
Desnaturalizan proteínas al romper interacciones hidrófobas entre las cadenas laterales.
Esto es porque al ser no polares, se pueden insertan entre las cadenas laterales hidrófobas de los aminoácidos.
¿Qué efecto tienen los pH extremos sobre las proteínas?
Ácidos fuertes eliminan cargas negativas, bases fuertes eliminan cargas positivas, rompiendo enlaces salinos intramoleculares y alterando la estructura.
¿Cómo actúa la urea sobre las proteínas?
Rompe los enlaces de hidrógeno y debilita las interacciones hidrófobas, desnaturalizando la proteína.
¿Por qué los metales pesados (plomo, cadmio y mercurio) desnaturalizan proteínas?
Pueden desnaturalizar las proteínas por la unión a los grupos carboxilato y, en particular, a los grupos sulfhidrilo de las proteínas.
Su afinidad por los grupos funcionales de las proteínas es una de las razones de la toxicidad de los metales pesados.
¿Por qué la homeostasis es crítica para la estabilidad de las proteínas?
Mantiene temperatura, pH y concentración de iones dentro de rangos que preservan la estructura de orden superior y la función proteica.
*Sutiles cambios en el entorno físico no rompen los enlaces covalentes, pero desorganizan las interacciones no covalentes
¿Qué diferencia principal existe entre proteínas globulares y fibrosas en cuanto a solubilidad?
Las proteínas globulares son generalmente solubles en agua, mientras que las fibrosas son insolubles y cumplen funciones estructurales.
¿Cómo afecta un aumento moderado de la concentración de sal a la solubilidad de las proteínas globulares?
Aumenta su solubilidad porque los iones de la sal neutralizan las cargas eléctricas de las proteínas, reduciendo la atracción electrostática entre moléculas.
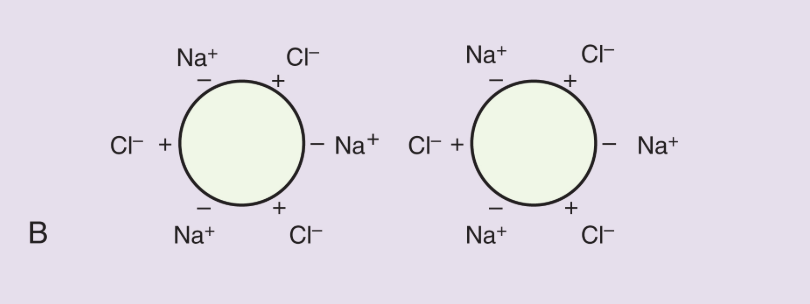
¿Qué sucede con las proteínas en concentraciones muy altas de sal?
Se precipitan porque la mayoría de las moléculas de agua quedan atrapadas en las capas de hidratación de los iones de sal, limitando el solvente disponible para las proteínas.
¿Qué efecto tiene el pH en la solubilidad de las proteínas?
La solubilidad es mínima en el punto isoeléctrico (pI), donde las proteínas tienen igual número de cargas positivas y negativas, favoreciendo la formación de enlaces salinos intermoleculares.
¿Qué ocurre si se añade un solvente orgánico miscible en agua, como etanol, a una solución proteica?
Puede precipitar proteínas al competir por el agua disponible, pero la precipitación es reversible y no destruye permanentemente sus propiedades biológicas.
¿Por qué los iones de sal aumentan la solubilidad de proteínas globulares a bajas concentraciones?
Porque neutralizan cargas superficiales, evitando que las proteínas se agreguen por interacciones electrostáticas.
Enlaces salinos intermoleculares.
Los enlaces salinos intermoleculares son interacciones electrostáticas que se forman entre grupos cargados de diferentes moléculas. En el contexto de las proteínas:
Se producen entre cargas opuestas en aminoácidos (por ejemplo, un grupo carboxilato de aspartato o glutamato con un grupo amino de lisina o arginina) de moléculas proteicas vecinas.
Son importantes para la agregación o precipitación de proteínas, especialmente cerca del punto isoeléctrico (pI), donde la proteína tiene igual número de cargas positivas y negativas.
A diferencia de los enlaces covalentes, los enlaces salinos son interacciones no covalentes, por lo que son reversibles y dependen de factores como pH, fuerza iónica y concentración de sal.
La adición de sal a baja concentración puede neutralizar parcialmente estas cargas, evitando que se formen enlaces salinos y aumentando la solubilidad de las proteínas.
Por el contrario, cuando el pH es cercano al pI, estas interacciones se maximizan, favoreciendo la precipitación proteica.
V o F: A diferencia de la desnaturalización, la precipitación es reversible y no destruye de manera permanente las propiedades biológicas de las proteínas.
V
¿Por qué las proteínas absorben radiación ultravioleta y no luz visible?
Las proteínas son incoloras porque no absorben luz visible
En cambio, absorben radiación UV principalmente en 190 nm (causad por enlaces peptídicos) y 280 nm (causado po cadenas laterales aromáticas de tirosina y triptófano).
*Los ácidos nucleicos absorben a 260 nm, mayor que el de las proteinas
¿Qué principio permite la separación de proteínas por electroforesis?
La electroforesis separa proteínas según su proporción carga-masa, moviéndose hacia el polo opuesto según su carga neta:
pH > pI → carga negativa → se mueve hacia el ánodo.
pH < pI → carga positiva → se mueve hacia el cátodo.
pH = pI → carga neta cero → se queda inmóvil.
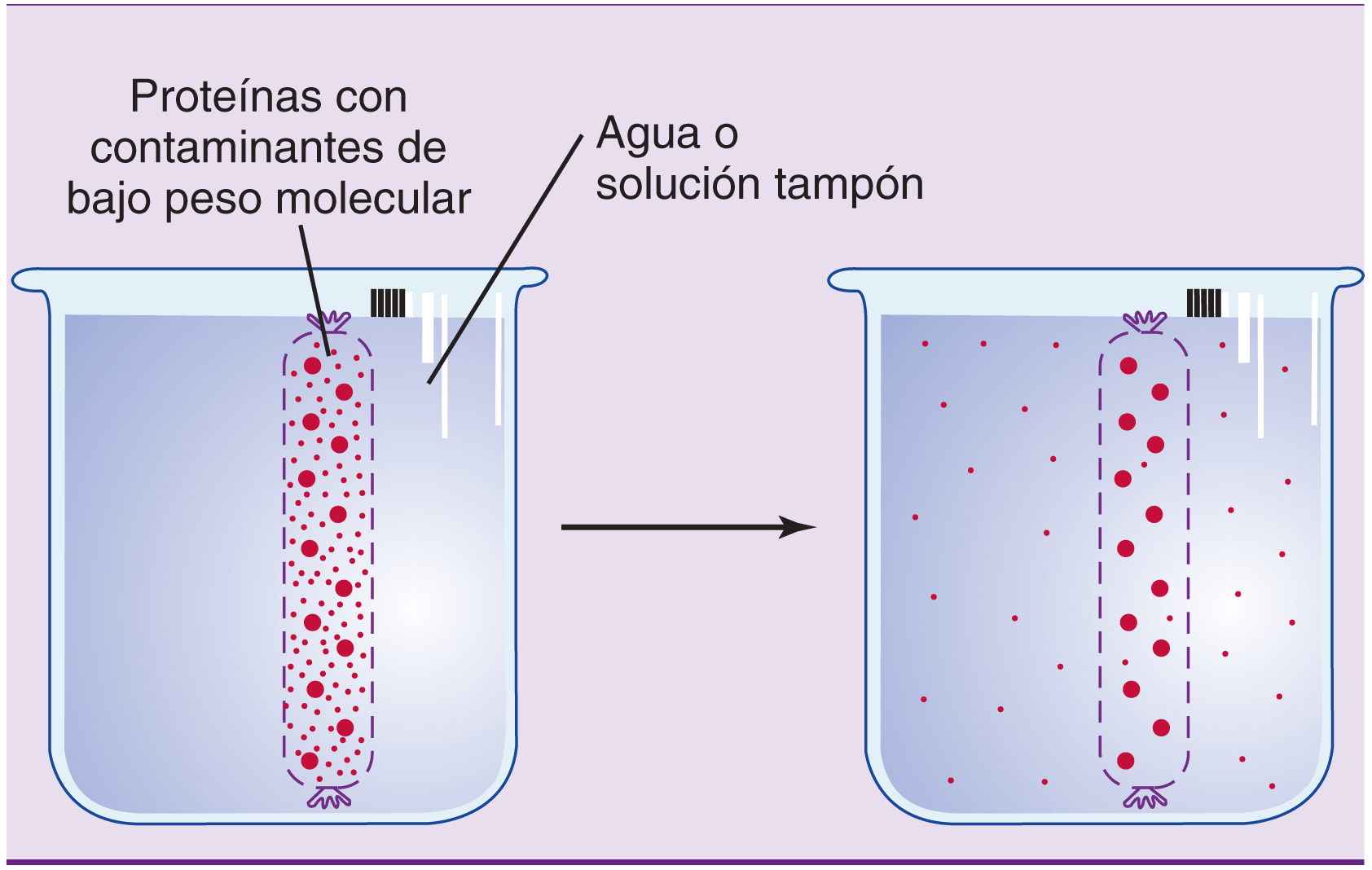
Diálisis
Se usa en el laboratorio para separar las proteínas de las sales o de otros pequeños contaminantes.
La proteína se mete en una pequeña bolsa de celulosa porosa ( fig. 2.13 ) . Los poros permiten que las sales y las pequeñas moléculas salgan fuera de la bolsa, pero las proteínas grandes se quedan retenidas.
La diálisis de los pacientes renales está basada en el mismo principio
¿Cómo afecta el reemplazo de un aminoácido a la movilidad electroforética?
Solo cambia la movilidad si se altera la carga. Ejemplo:
Glutamato → Aspartato: no cambia, misma carga.
Glutamato → Valina: cambia, se elimina una carga negativa.
¿Qué son los agregados proteicos amiloides?
Proteínas mal plegadas que forman fibrillas ricas en hoja β, difíciles de degradar. Se depositan en órganos, causando amiloidosis, que puede provocar daño cardíaco, renal u otros.
Normalmente, las proteínas que pierden su conformación nativa (su estructura tridimensional funcional) son detectadas y degradadas por proteasas, enzimas que cortan proteínas. Esto ocurre tanto dentro de la célula como en el medio extracelular, evitando la acumulación de proteínas no funcionales.
¿Qué pasa si esto no ocurre?
Algunas proteínas mal plegadas se reorganizan en fibrillas de hoja β, que pueden implicar varios polipéptidos y son difíciles de degradar. Estas fibrillas forman el material llamado amiloide, llamado así por su apariencia similar al almidón, y su acumulación está asociada a enfermedades. A pesar de que el amiloide no es muy tóxico y no provoca respuesta inmunológica, puede dañar los órganos en los que se deposita. Los depósitos de amiloide causan alrededor de 20 enfermedades diferentes.
Cambio estructural típico:
Una proteína globular, que normalmente tiene una estructura flexible y orden superior (hélices α, hojas β cortas y dominios globulares), puede replegarse de manera anormal hacia una conformación con alto contenido en hoja plegada β.
La amiloidosis puede originarse por:
Proteínas normales sobreproducidas: cadenas ligeras de inmunoglobulina, proteína amiloide A sérica (SAA), amilina (IAPP) en diabetes tipo 2.
Proteínas estructuralmente anormales: transtiretina mutante, microglobulina β₂ en pacientes con hemodiálisis prolongada.
Enfermedades neurodegenerativas y amilosis
Muchas formas de amiloidosis evitan el sistema nervioso central porque los amiloides que se forman fuera del cerebro son rechazados por la barrera hematoencefálica. Sin embargo, cuando los agregados de proteínas mal plegadas se forman en el cerebro, causan enfermedades neurodegenerativas.
En el sistema nervioso, los agregados proteicos causan enfermedades neurodegenerativas:
Proteína tau: Cuando esta excesivamente fosforilada forma agregados filamentos en los axones, provocando su muerte → Alzheimer y demencia frontotemporal.
β-amiloide: se acumula en placas seniles en Alzheimer, formado por escisión de la proteína precursora APP.
α-sinucleína: se deposita en gránulos citoplasmáticos, formando cuerpos de Lewy n neuronas → en Parkinson.
Un tipo inusual de neurodegeneración está causada por agregados de proteína priónica (PrP). Explica:
La proteína priónica normal (PrP C) se encuentra en la superficie de las neuronas. Cuando se convierte en su forma anormal (PrP Sc), puede inducir el mal plegamiento de otras moléculas de PrP, formando agregados tóxicos que causan enfermedades transmisibles como la Creutzfeldt-Jakob y el kuru.
Tiene implicaciones genéticas, y se dice que es “contagiosa“
El componente de una proteína globular soluble en agua que es más probable que esté presente el centro de la molécula en lugar de en su superficie es:
A Una cadena lateral de glutamato.
B Una cadena lateral de histidina.
C Una cadena lateral de fenilalanina.
D Un grupo fosfato unido covalentemente a una cadena lateral de serina.
E Un oligosacárido unido covalentemente a una cadena lateral de asparagina.
C Una cadena lateral de fenilalanina.
En proteínas solubles en agua, las cadenas laterales hidrofóbicas tienden a ocultarse en el núcleo de la proteína para evitar el contacto con el agua.
Las cadenas laterales polares o cargadas suelen estar en la superficie, donde pueden interactuar con el agua o con otras moléculas.
A. Glutamato → cargado negativamente, hidrofílico, se encuentra en la superficie. ❌
B. Histidina → polar y parcialmente cargada, generalmente en la superficie o cerca de sitios activos. ❌
D. Grupo fosfato en serina → polar, se encuentra en la superficie. ❌
E. Oligosacárido en asparagina → polar, se encuentra en la superficie.
La siguiente estructura es un oligopéptido que está acetilado en su amino terminal y tiene un grupo amida en su carboxi terminal, haciendo no ionizables a estos grupos terminales. Este oligopéptido tendrá un p I próximo a:
Acetilo-Ala-Glu-His-Ser-Lys-Gly-amida
A 4,3.
B 5,1.
C 6,0.
D 7,5.
E 10,8.
D 7,5.
El plasma sanguíneo del ser humano contiene alrededor de un 7% de proteína. Estas proteínas plasmáticas tienen unos valores de p K cercanos a 4 o 5. En el tubo de ensayo, estas proteínas formarán un precipitado insoluble después de someterlas a todos los tratamientos siguientes excepto:
A Hervir el suero durante 5 minutos.
B Añadir cloruro sódico en una concentración del 35%.
C Ajustar el pH a 4,5.
D Hervir el suero con 6 N ácido clorhídrico durante 10 horas.
E Mezclar un volumen de plasma con dos volúmenes de alcohol puro.
D Hervir el suero con 6 N ácido clorhídrico durante 10 horas.
Un ingeniero genético quiere conseguir atletas con una concentración aumentada de hemoglobina en los eritrocitos para mejorar el suministro de oxígeno a los músculos. Para ello, tiene que aumentar la solubilidad en agua de la hemoglobina. ¿Cuál de los siguientes cambios de aminoácidos en la superficie de la molécula de hemoglobina es más probable que aumente su solubilidad en agua?
A Arg → Lys.
B Leu → Phe.
C Gln → Ser.
D Ala → Asn.
E Ser → Ala.
D Ala → Asn.
5
Tu abuela se ha vuelto cada vez más olvidadiza durante los últimos 2 años. La semana pasada se perdió volviendo de un colmado que está a solo unas manzanas. Uno de los tratamientos que tal vez podría ayudarla sería un fármaco que:
A Reduzca la síntesis de transtiretina.
B Reduzca la formación de inmunoglobulinas.
C Inhiba la actividad de la β-secretasa.
D Reduzca la formación de α-sinucleína.
E Añada grupos fosfato a la proteína tau.
C Inhiba la actividad de la β-secretasa.
En su 100.° cumpleaños, tu bisabuelo te comenta que el doctor le ha dicho que el corazón se le está debilitando. La causa más probable de esto es una forma plegada de manera anómala de:
A Proteína amiloide A sérica.
B β 2 -microglobulina.
C β-amiloide.
D Proteína priónica.
E Transtiretina.
E Transtiretina.
Las cadenas laterales de los aminoácidos determinan:
La carga, polaridad e hidrofobicidad de las proteínas y también participan en la formación de enlaces intracatenarios e intercatenarios.
Grupos prostéticos,
Aminoácidos modificados y componentes accesorios como hidratos de barbano, lípidos y estructuras más compleja que están presentes en muchas proteinas
Ej: Grupo Hemo de la hemoglobina
El unico aminoacido que no es α-aminoácido, sino un α-iminoácido.
Prolina