Diversité des polypeptide et purification des protéines 
1/19
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
20 Terms
Variabilité des polypeptides pour une protéine
kamm il y a 20 acides aminés différents pour chaque position d’acides aminés dans la protéine nous avons 20 choix et donc au total
20^n avec n positions
→ bcp bcp bcp de protéines possibles
Quelle est la protéine la plus grande
titine avec +34’000 a.a.
Reihenfolge
= séquence
→ structure primaire
la séquence de l’insuline
Elle est composé d’une chaîne A et une chaîne B relié par des ponts disulfures Inter chaînette. Il y a aussi un pont disulfure Intras chaînette sur A. les ponts disulfures se font sur les cystéine.
Importance de la pureté de la protéines
il faut purifier la protéine pour pouvoir l’analyser, c’est-à-dire trouver sa séquence d’a.a. et son activité enzymatique
Problème pour la purification
il n’y a peut-être pas beaucoup d’exemplaires de cette protéine
la protéine qui nous intéresse et parmi des milliers d’autres protéines
une stratégie de purification est nécessaire
je dois pouvoir l’observer au cours de la purification
critères grâce auquel on peut différencier les protéines
les propriétés physico-chimiques
solubilité
charge ionique
polarisation
taille
spécificités des liaisons
quelle procédure utilise-t-on si
Une protéine à une solubilité spécifique
salting out / salage/ aussalzen
il y a un principe avec d’abord du salting in les ions du sel dissout dans l’eau masquent la charge effective de la protéine. Si on augmente la concentration de sel dans l’eau et donc des ions ceci vont avoir tendance à plutôt interagir avec les molécules d’eau, ignorant la protéine et les protéines précipiteront ensemble
il faut donc une concentration de sel spécifique pour précipiter la protéine voulue
quelle procédure utilise-t-on si la protéine a
une charge ionique
ion exchange chromatographie
Électrophorèse
isoélectrique focusing
quelle procédure utilise-t-on si la protéine a
polarité spécifique
hydrophobic interaction chromatographie
quelle procédure utilise-t-on si la protéine a
une taille spécifique
gel filtration chromatographie
SDS page
quelle procédure utilise-t-on si la protéine a des liaisons spécifiques
affinity chromatography
La chromatographie
il y a deux phases, une solide et une liquide.
Une phase stationnaire polaire
exemple cellulose du papier
une phase mobile apolaire
exemple: essence
→ les substances se séparent selon leur polarité, en effet les molécules polaires auront tendance à s’accrocher à la phase stationnaire polaire elle aussi et les molécules à polaire seront poussés avec le liquide
Chromatographie en colonne
C’est un peu le même principe que la chromatographie sur papier mais à la place d’utiliser la capillarité on utilise une pompe qui fait circuler en liquide dans une colonne. Les molécules qui ont une meilleurs affinité avec la face solide prendront plus de temps à être nettoyées
ion exchange chromatography (anion exchange)
il y a une paroi composée de molécules positives, la solution qui traverse cette paroi, contient des acides aminés. Les acides aminés négatifs resteront collés contre la paroi positive seulement les acides aminés positifs sortiront de l’autre côté
qu’est-ce que ça veut dire qu’une protéine eat pure à 98 %?
Dans un mélange de sang molécules 98 molécules seront la protéine souhaitée
Électrophorèse
Nous faisons passer un courant électrique dans un gel. la cathode (- car on force un courant) est vers le début et l’anode (+) vers la fin. les molécules négatives (donc la plupart des protéines à un pH 9 se déplaceront jusqu’à l’anode
Afin de visualiser les protéines nous pouvons utiliser des couleurs comme les anticorps
SDS page ressemble à l’électrophorèse mais normalement c’est plutôt pour les trier par taille
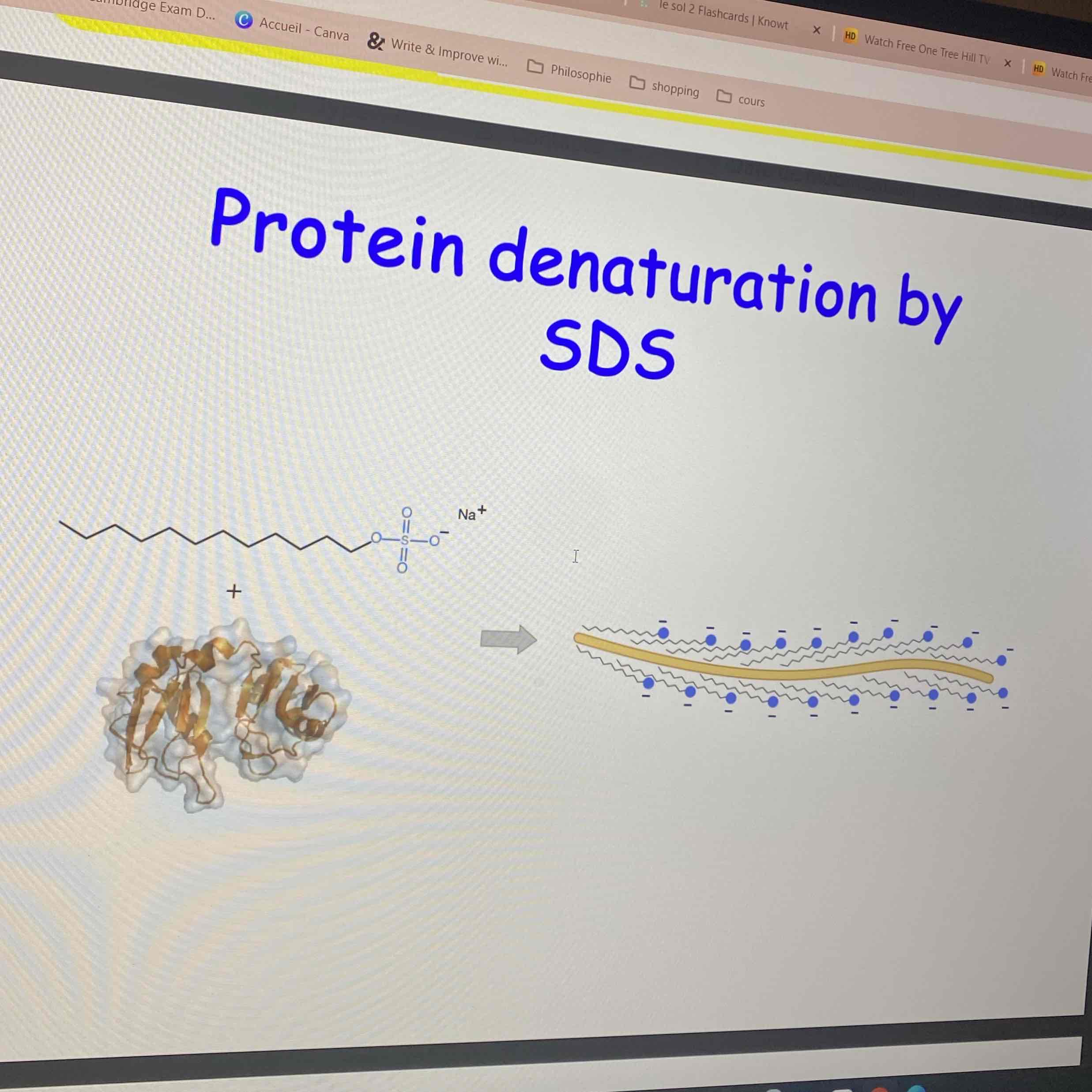
dénaturation des protéines par SDS
nous pouvons déplier une protéine si nous utilisons des molécules d’une certaine charges qui vont former une couche autour de celle-ci et l’empêcher de se refermer
Pourquoi séquencer des protéines?
trouver la structure et la fonction
comparer des séquences et comprendre l’évolution
faire des tests de protéines
→ maintenant on séquence au niveau des protéines et de l’ADN
L’évolution des protéines
théorie de Darwin
il y a la sélection d’un avantage
si une mutation homozygote elle étale alors elle disparaît/ sinon elle peut rester présenter un autre avantage (ex anémie falciforme)