Chapitre 3 : Les principales méthodes de dosage
1/108
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
109 Terms
Quelles sont les principales techniques utilisées en laboratoire de chimie clinique ?
Spectrophotométrie (UV et visible)
Méthodes électrochimiques :
Ampérométrie
Conductimétrie
Ces méthodes sont de moins en moins utilisées et appelées à disparaître
Méthodes immunologiques
Techniques séparatives
LC-MS/MS : spectrométrie de masse couplée à une chromatographie en phase liquide
Enzymologie
Point of care / Self-patient testing (réalisé par le patient ou le personnel - test de grossese, autotest covid)
I. Dosage par spectrophotométrie
I. Dosage par spectrophotométrie
Quel est le principe général du dosage par spectrophotométrie
La technique repose sur l’absorption de la lumière (visible ou UV) par une substance
Cette absorption permet de quantifier la substance présente dans l’échantillon
Quel est l’exemple donné d’utilisation de la spectrophotométrie en chimie clinique ?
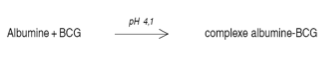
Le dosage de l’albumine à pH 4,1
À ce pH, l’albumine devient un cation
Elle se lie au vert de bromocrésol (BCG)
Cette liaison forme un complexe albumine-BCG
Ce complexe absorbe la lumière dans les bleu-vert

Comment la concentration en albumine est-elle estimée par spectrophotométrie ?
Plus il y a d’albumine → plus il y a de complexes albumine-BCG
Plus le complexe est présent → plus l’intensité de la couleur bleu-vert est élevée
La concentration en albumine est proportionnelle à l’intensité mesurée
Pourquoi la spectrophotométrie n’est-elle pas une méthode spécifique ?
Parce que d’autres substances peuvent aussi se lier au BCG à pH 4,1
Elles peuvent également générer une couleur dans les bleu-vert
Cela peut entraîner une interférence avec le dosage de l’albumine
Pourquoi la spectrophotométrie est-elle malgré tout largement utilisée pour le dosage de l’albumine ?
Peu coûteuse
Simple à mettre en œuvre
Accessible à tout laboratoire équipé d’un petit spectrophotomètre
L’albumine est hautement concentrée dans le sérum (~40 g/L)
Donc une petite erreur due à d’autres constituants a peu d’impact
Quels types d’appareils sont généralement équipés pour réaliser la spectrophotométrie ?
Les gros analyseurs automatisés de chimie
Beaucoup d’analyses de routine y sont réalisées selon cette technique
Quel exemple illustre l'utilisation des UV en spectrophotométrie pour doser un ion inorganique ?
Le phosphate est dosé avec du molybdate d’ammonium
En présence d’acide sulfurique, formation de phosphomolybdate d’ammonium
Ce complexe absorbe dans l’ultraviolet
Quels sont les avantages et limites des dosages par spectrophotométrie ?
Avantages :
Faciles à mettre en œuvre
Peu coûteux
Tout terrain
Rapides
Très robustes
Inconvénient :
Manque de spécificité
II. Dosage des marqueurs biologiques par l’immunoanalyse
II. Dosage des marqueurs biologiques par l’immunoanalyse
La courbe de précipitation d’Heidelberg
La courbe de précipitation d’Heidelberg
Quelle est la base des dosages par immunoanalyse ?
L’interaction spécifique entre un anticorps et un antigène
Cette interaction permet de mesurer des marqueurs biologiques
Qu’est-ce que la courbe de précipitation d’Heidelberg ?
Une courbe illustrant la formation et la dynamique des complexes antigène-anticorps
Se divise en trois zones selon la concentration en antigène
Qu’observe-t-on dans la zone I de la courbe de Heidelberg ?
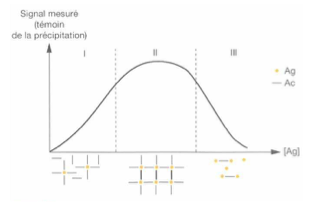
Formation de complexes antigène-anticorps
Apparition d’un précipité ou trouble
Ces complexes diffusent ou absorbent un rayon lumineux ou laser
L’absorbance est proportionnelle à la concentration d’antigène
Qu’observe-t-on dans la zone II de la courbe de Heidelberg ?

Équivalence entre les concentrations en antigène et anticorps
Formation d’un réseau gélifié et bien structuré
Qu’observe-t-on dans la zone III de la courbe de Heidelberg ?

Excès d’antigène
Dissociation des complexes antigène-anticorps
Diminution de l’absorbance
Solution devient claire
Quelles zones de la courbe de Heidelberg sont utilisées pour les méthodes immunométriques ?

Zone I : utilisée pour la turbidimétrie et la néphélométrie

Quel est le principe de l’immunoturbidimétrie ?
On mesure la lumière transmise à travers une solution trouble
Exemple : dosage de la β-2-microglobuline dans l’urine
Étapes :
On établit un blanc : urine limpide, 100 % de lumière transmise
On ajoute un anticorps anti-β-2-microglobuline fixé à des particules de latex (pour augmenter leur taille)
Formation de complexes antigène-anticorps → apparition d’un trouble
La diminution de la lumière transmise est proportionnelle à la concentration en β-2-microglobuline
Mesure réalisée avec un spectrophotomètre
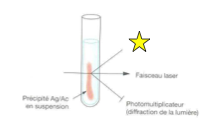
Quel est le principe de l’immunonéphélométrie ?
On mesure la lumière diffusée par les complexes antigène-anticorps
Un laser ou faisceau lumineux traverse la solution
Le rayon est diffracté par les complexes
Un photomultiplicateur placé en angle mesure la lumière diffusée
Plus il y a d’antigène → plus le trouble est important → plus la lumière est diffractée
L’intensité de la lumière diffusée est proportionnelle à la concentration en β-2-microglobuline
Quelle est la différence principale entre la turbidimétrie et la néphélométrie ?
Turbidimétrie :
Moins sensible
Moins coûteuse
Utilisable avec un simple spectrophotomètre
Néphélométrie :
Plus sensible
Plus onéreuse
Nécessite un appareillage spécifique pour mesurer la lumière diffusée
Sur quels types d'appareils peut-on réaliser la turbidimétrie et la néphélométrie ?
Turbidimétrie :
Réalisable sur tous les automates de chimie équipés d’un spectrophotomètre
Néphélométrie :
Réalisable uniquement sur des néphélomètres dédiés
Quelles précautions doit-on prendre lors de l'utilisation de ces techniques ?
Attention à la présence de particules en suspension :
Poussières
Macroglobulines
Agrégats non spécifiques
Ces éléments peuvent fausser la mesure de la lumière transmise ou diffusée
Nécessité d’opérer dans des solutions diluées
Utilisation de l’ultracentrifugation
Effet crochet
Effet crochet
Qu’est-ce que l’effet crochet (hook effect) en immunoanalyse ? (Pas vu)
C’est un piège analytique observé dans la 3ᵉ zone de la courbe d’Heidelberger
Il se produit lorsqu’il y a un excès très important d’antigène dans l’échantillon
Cet excès détruit les complexes antigène-anticorps au lieu d’en former davantage
Que se passe-t-il lorsque l’effet crochet est présent ?
Le trouble diminue paradoxalement malgré une concentration d’antigène très élevée
Le signal mesuré est plus faible
Résultat : un patient très pathologique peut avoir un résultat normal voire faussement bas
Comment les automates modernes détectent-ils l’effet crochet ?
Ils mesurent la cinétique d’apparition du trouble
Si la cinétique est trop rapide, cela indique une concentration anormalement élevée d’antigène
L’automate procède alors à une dilution automatique de l’échantillon
Cela permet de confirmer ou éliminer un effet crochet
Dans quels milieux peut-on utiliser la turbidimétrie et la néphélométrie pour doser des protéines ?
Plasma
Urine
Liquide céphalo-rachidien (LCR)
Et autres liquides biologiques
Quels types de protéines peut-on doser avec la turbidimétrie et la néphélométrie ?
Protéines présentes à des concentrations de l’ordre du mg/L
Types de protéines :
Marqueurs de réponse inflammatoire :
CRP
Haptoglobine
Marqueurs du statut nutritionnel :
Albumine
Pré-albumine
Marqueurs du statut martial :
Transferrine
Marqueurs de l’immunité humorale :
Immunoglobulines
Marqueurs de la fonction rénale (glomérulaire ou tubulaire) :
Cystatine C
β-2-microglobuline
III. Dosage d’anticorps ou d’antigènes marqués par immuno-analyse
III. Dosage d’anticorps ou d’antigènes marqués par immuno-analyse
Quels sont les deux grands types de dosages par immunoanalyse marquée ?
Mode compétitif
Mode non-compétitif (aussi appelé dosage sandwich)
Mode compétitif
Mode compétitif
Quel est le principe général du mode compétitif ?
Un anticorps de capture est fixé sur un support solide (cupule, bille, tube, etc.)
On ajoute :
Le sérum du patient contenant l’antigène à doser (ex : œstradiol)
Une forme marquée de cet antigène (avec un marqueur : enzyme, fluorophore, iode radioactif…)
Quel est l'exemple classique illustrant un dosage compétitif ?
Dosage de l’œstradiol dans le sérum
Anticorps anti-œstradiol fixé sur un support
Compétition entre l’œstradiol du patient et l’œstradiol marqué (ex : iode-125)
Si le marqueur est l’iode 125, la méthode est appelée RIA (Radio Immuno Assay)
Comment interprète-t-on le résultat d’un dosage compétitif ?
Après incubation pour équilibrer les deux oestradiols, lavage pour éliminer les éléments non fixés
On mesure le signal du marqueur (ex : radioactivité)
Relation inverse :
Plus le signal est élevé, moins il y a d’antigène dans l’échantillon
Plus il y a d’antigène dans l’échantillon, plus il prend la place du marqueur → signal diminué
Quelle forme a la courbe de calibration en dosage compétitif ?
Courbe décroissante
Concentration faible → signal élevé
Concentration forte → signal faible
Mode non compétitif
Mode non compétitif
Quel est le principe du dosage non-compétitif (sandwich) ?
Utilise deux anticorps spécifiques dirigés contre deux épitopes différents de la même molécule
Le premier anticorps est fixé au support solide (anticorps de capture)
Le second anticorps est marqué (enzyme, fluorescence, iode radioactif…)
Quelle est la procédure du dosage sandwich (non-compétitif) ?
Incubation du sérum du patient avec le support solide portant l’anticorps
La molécule à doser (ex : TSH) se fixe sur le premier anticorps
Ajout du second anticorps marqué, dirigé contre un autre épitope de la molécule
Incubation puis lavage
Mesure du signal du marqueur
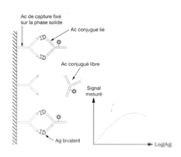
Quelle est la relation entre le signal mesuré et la concentration de l’analyte en dosage sandwich ?
Le signal est directement proportionnel à la concentration de l’analyte dans l’échantillon
Pourquoi le mode non-compétitif est-il plus spécifique que le mode compétitif ?
Parce qu’il nécessite la reconnaissance de deux épitopes différents sur la molécule cible
Cela donne deux confirmations indépendantes de la présence de l’analyte
Quel est le principe d’un test sérologique ?
On fait l’inverse d’un dosage classique
On fixe des antigènes sur un support solide
On dose ensuite les anticorps circulants présents dans le sérum du patient
Donne un exemple de test sérologique.
Test COVID-19 sérologique
On fixe des particules virales du coronavirus sur un support
On incube avec le sérum du patient
Si le patient a été infecté ou vacciné → il a des anticorps IgG ou IgM
Ces anticorps se fixent aux antigènes
Un anticorps secondaire marqué (anti-IgG ou anti-IgM) est ajouté pour détecter le complexe
Quelle est la différence entre anticorps monoclonaux et polyclonaux ?
Anticorps monoclonal :
Ne reconnaît qu’un seul épitope
Anticorps polyclonal :
Peut reconnaître plusieurs épitopes
Obtenu en immunisant un animal de grande taille
Dans quel cas peut-on utiliser un dosage en mode non-compétitif ?
Il faut que l’antigène ait au moins deux épitopes distincts
Ces épitopes doivent être suffisamment éloignés
Exemples d’antigènes adaptés :
TSH
HCG
Parathormone
Peptides
Dans quel cas faut-il utiliser un mode compétitif ?
Lorsque la molécule est petite et ne possède qu’un seul épitope
Exemples :
Stéroïdes
Certains médicaments
IV. Dosage par immunoassay enzymatique (EIA : Enzyme Immunoessay)
IV. Dosage par immunoassay enzymatique (EIA : Enzyme Immunoessay)
Technique ELISA
Technique ELISA
Qu’est-ce que la méthode EIA (Enzyme Immunoassay) ?
Technique de dosage immunologique utilisant un traceur enzymatique
La version la plus connue est l’ELISA (Enzyme-Linked Immunosorbent Assay)
Quel est le principe du dosage ELISA ?
Une phase solide porte les anticorps (ou antigènes)
On ajoute le sérum contenant l’antigène (ou l’anticorps) à doser
Un 2ᵉ anticorps marqué est ajouté pour générer un signal coloré
Interprétation :
En mode non-compétitif : plus de couleur → plus d’analyte
En mode compétitif : plus de couleur → moins d’analyte
Quels sont les avantages de la méthode ELISA ?
Très sensible : permet de détecter de faibles concentrations
Possibilité d’utiliser divers traceurs :
Enzymatiques
Fluorescents
Luminescents
Méthode tout terrain, utilisable dans tous les laboratoires
Alternative au RIA (Radio Immuno Assay), qui :
Utilise de l’iode radioactif
A une durée de vie limitée (~120 jours) à cause de la demi-vie limité de l’iode
Produit des déchets radioactifs
Quels sont les inconvénients de la méthode ELISA ?
Très sensible aux conditions opératoires :
pH, température, volume…
Nécessite parfois des volumes importants (ex : 100 µL)
Risque d’erreur lié au pipetage :
Habilité de l’opérateur
Qualité de la pipette
Semi-automatisable :
Certains automates peuvent pipeter, incuber et lire l’absorbance
Limitation importante :
Un seul analyte par plaque
Exemple :
Dosage des IgG contre la toxoplasmose nécessite un kit spécifique
Dosage simultané des IgM nécessite un deuxième kit distinct
Révélation de l’activité enzymatique
Révélation de l’activité enzymatique
Quels sont les trois types de techniques de révélation de l’activité enzymatique ?
Colorimétrie
Fluorimétrie
Chimiluminescence
Quel est le principe de la révélation enzymatique par colorimétrie ?
On utilise un conjugué enzymatique (ex : phosphatase alcaline)
On ajoute le substrat de l’enzyme
L’enzyme agit sur le substrat → formation d’un produit coloré
La coloration produite est mesurée → reflète l’activité enzymatique
Quel est le principe de la fluorimétrie ?
Le marqueur utilisé est fluorescent
Le fluorophore est excité plusieurs fois rapidement
Méthode plus sensible que la colorimétrie
Quel est le principe de la chimiluminescence ?
Utilisée uniquement dans les gros automates de chimie
Repose sur la génération d’un flash lumineux
Ce flash est dû à l’oxydation d’un ester d’acridinium
Technique extrêmement sensible, encore plus que la fluorimétrie
Technique Multiplex
Technique Multiplex
Pourquoi utilise-t-on des techniques multiplex ?
Pour contourner la limite de l’ELISA (1 analyte/plaque)
Permet de doser plusieurs molécules proches en un seul test
Avec un volume très faible de sérum
Quel est le principe de la technique multiplex ?
Utilise des billes magnétiques (jusqu’à 50) revêtues de :
Une couleur spécifique
Un anticorps unique
On incube les billes avec le sérum du patient
Chaque bille capture son antigène d’intérêt
Un aimant est utilisé pour les regrouper → on lave
Un 2ᵉ anticorps marqué est ajouté
Une caméra identifie les billes et mesure l’intensité du signal pour chaque complexe
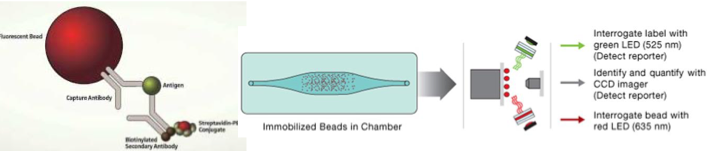
Quels sont les avantages et limites de la technique multiplex ?
Avantages :
Permet de doser plusieurs molécules à la fois
Très petit volume de sérum nécessaire
Limites :
Ne peut pas être appliquée à tous les types d’analytes
Réservée à des substances proches (ex : interleukines)
V. Microarrays
V. Microarrays
Que sont les microarrays et dans quel domaine sont-ils utilisés ?
Utilisés surtout pour le diagnostic des allergies
Exemple : immunoCAP ISAC (test multiplex IgE spécifique)
Quel est le principe de fonctionnement des microarrays ?
Petites puces sur lesquelles des allergènes sont fixés dans des puits
Exemples d’allergènes : poil de chien, chat, cheval…
On incube avec le sérum du patient
Si IgE spécifiques sont présents → ils se fixent sur l’allergène
Ajout d’un anticorps anti-IgE marqué fluorescent
Lecture sur un fluorimètre puits par puits
Donne une quantification des IgE spécifiques
Quels sont les avantages des microarrays ?
Possibilité de greffer plus d’une centaine d’allergènes
Permet de mesurer de nombreux paramètres en un seul test
Très faible volume de sérum nécessaire (ex : 20 µL)
Utile chez les enfants (quelques gouttes suffisent)
Quel est le principal inconvénient des microarrays ?
Coût élevé : environ 150 € par analyse
VI. Enzymologie
VI. Enzymologie
Quelles sont les deux grandes catégories d’enzymes circulantes dans le plasma ?
Enzymes à rôle physiologique spécifique dans le plasma
Enzymes présentes en transition, libérées par des cellules mortes
Quels sont des exemples d’enzymes qui ont un rôle spécifique dans le plasma ?
Enzymes de la coagulation
Rénine
Lipoprotéine lipase
Ces enzymes :
Activent, clivent, ou interviennent directement dans un processus physiologique
Sont actives dans le plasma
Qu’est-ce qu’une enzyme en transition dans le plasma ?
Une enzyme libérée dans la circulation après la mort cellulaire
Elle n’exerce pas de rôle actif dans le plasma
Elle est destinée à être éliminée/dégradée
Quels sont des exemples d’enzymes en transition ?
Lactate déshydrogénase (LDH)
Transaminases : TGO (AST) et TGP (ALT)
Créatine phosphokinase (CPK)
Pourquoi trouve-t-on des enzymes en transition dans la circulation lors d’un infarctus ?
L’infarctus provoque une nécrose cellulaire
Libération du contenu intracellulaire, y compris les enzymes
Cela conduit à une élévation des concentrations plasmatiques d’enzymes comme LDH ou TGO
Ces enzymes sont-elles spécifiques d’un organe ?
Non
Elles sont présentes dans plusieurs tissus : cœur, muscles, foie, reins, etc.
Une augmentation indique une nécrose ou lyse cellulaire, mais pas la localisation précise
Quelles sont les deux façons de doser une enzyme ?
Par mesure d’activité enzymatique :
On ajoute le substrat spécifique à l’échantillon
On mesure la quantité de produit formé
Par mesure de masse/concentration :
On utilise une méthode immunologique avec des anticorps dirigés contre l’enzyme
Donne un exemple d’enzyme pouvant être dosée par ces deux méthodes.
Rénine
Comment dose-t-on l’activité de la rénine ?
On ajoute de l’angiotensinogène au sérum du patient
On incube à 37°C pendant 1 heure
La rénine transforme l’angiotensinogène en angiotensine I
Après 1h, on dose la quantité d’angiotensine I produite
Le résultat reflète l’activité de la rénine
Comment dose-t-on la masse de rénine ?
On utilise une paire d’anticorps anti-rénine
Ces anticorps capturent la rénine présente dans l’échantillon
Le signal mesuré est proportionnel à sa concentration
Les résultats des deux méthodes de dosage (activité vs masse) sont-ils comparables ?
Non
La mesure d’activité peut être faussée par des inhibiteurs de la rénine
Le dosage par masse peut manquer de sensibilité
Les deux méthodes ne sont pas directement transposables
Quel est l’exemple classique de dosage enzymatique utilisant le NAD+/NADH ?
Substrat utilisé : lactate
Enzyme : LDH (présente dans le sérum du patient)
Coenzyme : NAD+
Réaction catalysée :
Lactate + NAD+ → Pyruvate + NADH + H⁺
Le NADH formé absorbe à 340 nm, alors que le NAD+ absorbe à 260 nm
On mesure l’apparition de NADH à 340 nm
Plus il y a de NADH → plus il y a de LDH active dans le sérum
Dosage de substrat grâce à des enzymes
Dosage de substrat grâce à des enzymes
Peut-on utiliser des enzymes pour doser un substrat ?
Oui, c’est une méthode très utilisée
Exemple classique : dosage du glucose
Quelle est la technique de référence pour doser le glucose ?
La technique à l’hexokinase
Quel est le principe de la méthode à l’hexokinase pour doser le glucose ?
Réaction 1 :
Glucose + ATP → Glucose-6-phosphate (G-6-P) + ADP
Catalysée par l’hexokinase
Attention : l’hexokinase n’est pas spécifique du glucose
Elle phosphoryle aussi d’autres sucres comme le fructose
Comment la méthode à l’hexokinase devient-elle spécifique au glucose ?
En ajoutant une deuxième enzyme : glucose-6-phosphate déshydrogénase (G-6-PDH)
Réaction 2 :
G-6-P + NADP⁺ → Gluconate-6-phosphate + NADPH + H⁺
Ce que l’on mesure :
L’apparition du NADPH, qui absorbe dans l’UV
Pourquoi l’apparition du NADPH reflète-t-elle la concentration de glucose ?
La quantité de NADPH formé est proportionnelle au G-6-P
Le G-6-P est directement formé à partir du glucose dans la 1ʳᵉ réaction
Donc : NADPH ↔ G-6-P ↔ Glucose
Quel est l’intérêt d’utiliser deux enzymes pour le dosage du glucose ?
Cela permet de rendre la méthode spécifique du glucose malgré le manque de spécificité de l’hexokinase seule
C’est une technique fiable et de référence en laboratoire
VII. Dosages par chromatographie liquide couplée à un spectromètre de masse (LCMS/MS)
VII. Dosages par chromatographie liquide couplée à un spectromètre de masse (LCMS/MS)
Qu’est-ce que la méthode LC-MS/MS ?
LC-MS/MS = chromatographie liquide couplée à une spectrométrie de masse en tandem
Technique très sensible et très spécifique
Permet de doser précisément de nombreuses petites molécules biologiquement actives
Dans quels cas utilise-t-on la LC-MS/MS ?
Pour doser :
Des médicaments
Des hormones stéroïdiennes (ex : œstradiol, cortisol, aldostérone, progestérone…)
Des hormones peptidiques
Pourquoi les hormones stéroïdiennes sont-elles difficiles à doser par des méthodes immunologiques ?
Elles ont une structure très proche (même noyau de base issu du cholestérol)
Elles diffèrent par de légères modifications chimiques :
Double liaison
Groupe OH
Ajout sur la chaîne latérale
Leur activité biologique est très différente malgré ces petites variations
Les anticorps utilisés en méthode compétitive peuvent présenter :
Un manque de spécificité
Des réactions croisées
Quels avantages présente la LC-MS/MS par rapport aux méthodes immunologiques ?
Permet de doser individuellement chaque molécule stéroïdienne
Possibilité de doser plusieurs molécules simultanément dans un seul run
Meilleure précision et spécificité
Quel est le principal inconvénient de la spectrométrie de masse (LC-MS/MS) ?
Coût très élevé : entre 300 000 et 400 000 €
Nécessite :
Du personnel hautement qualifié
Une formation approfondie
Demande des étapes préparatoires complexes :
Extraction liquide-liquide
Extraction solide-liquide
Pourquoi continue-t-on à utiliser d’autres méthodes malgré la supériorité de la LC-MS/MS ?
Parce que d’autres automates permettent des dosages moins coûteux
Ils sont plus simples à utiliser, même s’ils sont moins spécifiques
VIII. Standardisation des méthodes et traçabilités des dosages
VIII. Standardisation des méthodes et traçabilités des dosages
Quel est un des grands problèmes des techniques de dosage vues en chimie clinique ?
La standardisation et la traçabilité des dosages
Pourquoi la standardisation est-elle problématique en chimie clinique ?
Parce que beaucoup de biomarqueurs n’ont pas de standards internationaux disponibles
Chaque fabricant utilise son propre standard
Résultat : entre deux fabricants, les résultats pour un même échantillon peuvent différer fortement
Donne un exemple illustrant le problème de standardisation entre fabricants.
Dosage de la parathormone :
Avec un kit Roche → résultat : 100
Avec un kit Abbott → résultat : 140
Les valeurs de référence changent aussi → cacophonie dans les résultats
Quel serait l’idéal en termes de standardisation ?
Avoir pour chaque substance dosée :
Un standard de référence/Un matériau de référence primaire
Quel exemple est donné comme matériau de référence primaire ?
Le carbonate de calcium (CaCO₃) pour étalonner les dosages du calcium
Pureté : 99,907 % ± 0,021 %
La concentration de calcium est déterminée par des méthodes chimiques ou physiques
Que fait-on du CaCO₃ pour en faire un standard ?
On le met en solution (puisqu’à l’état solide, il est inutilisable directement)
On pèse une quantité précise pour la dissoudre → création d’un calibreur primaire en phase liquide