2_5.2 Enzymatik
1/16
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
17 Terms
Was passiert, wenn Enzyme oder Proteine Oligomere bilden?
Manche Enzyme/Proteine bilden Oligomere (Komplexe aus mehreren Untereinheiten)
Diese Untereinheiten wechselwirken miteinander
Substrat- oder Ligandenbindung an eine Untereinheit → kann benachbarte Untereinheit mitaktivieren
Beispiel: Kooperativität von Hämoglobin
Was ist eine allosterische Bindungsstelle bei Enzymen?
Enzyme besitzen zusätzlich zur Substratbindungsstelle eine allosterische Bindungsstelle
Dort kann ein Agonist binden
Die Bindung beeinflusst die Affinität und Aktivität des Enzyms
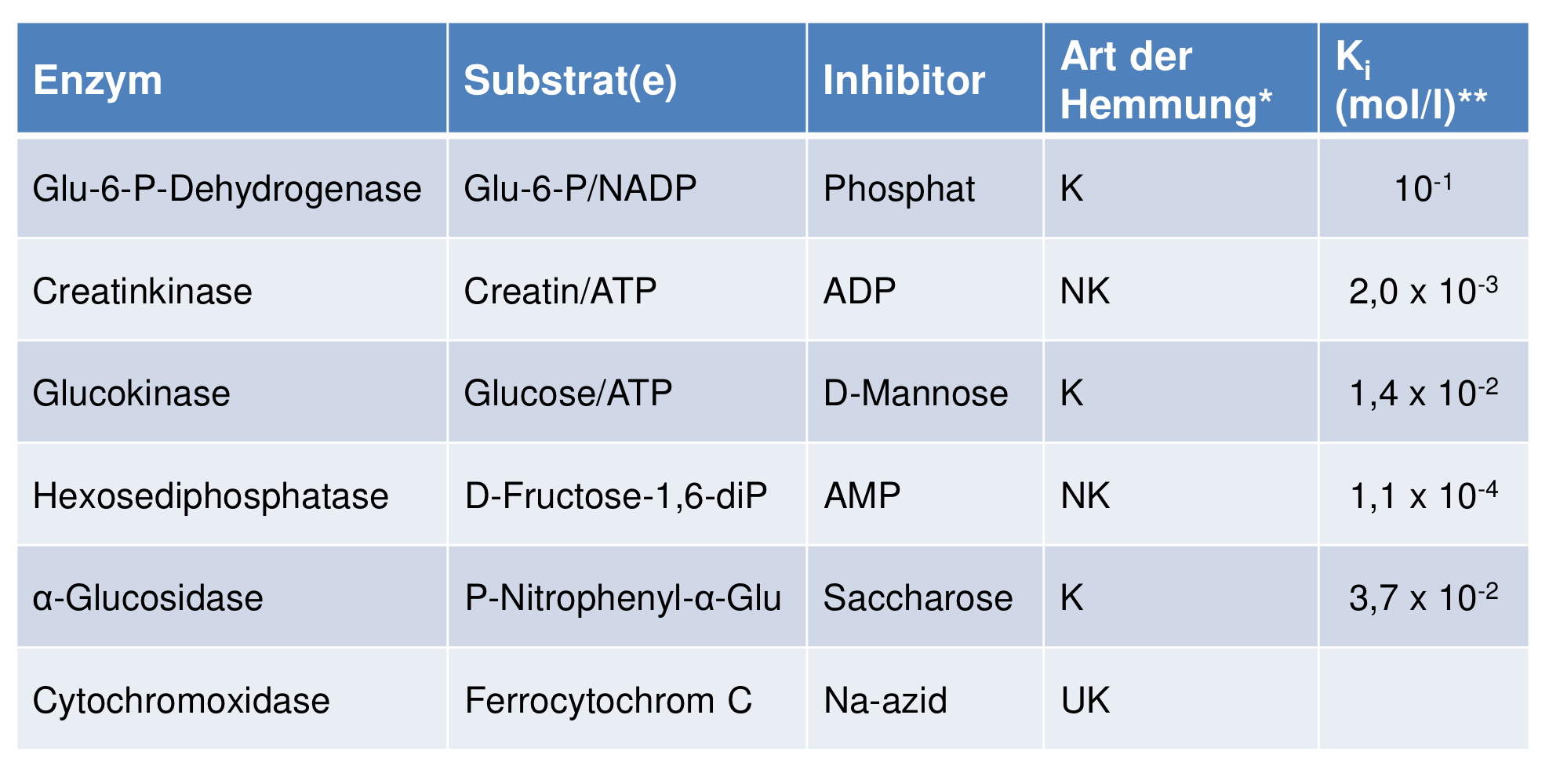
Hemmungsart | Bindungsort des Inhibitors | Beeinflussung durch Erhöhung der Substratkonzentration |
Kompetitive Hemmung | Inhibitor ______ mit dem Substrat um die ______ | Hemmung lässt sich ______ |
Nicht-kompetitive Hemmung | Inhibitor bindet an eine ______ ______ des Enzyms | Hemmung lässt sich ______ |
Unkompetitive Hemmung | Inhibitor bindet nur, nachdem das Substrat hat ______ ______ | Hemmung lässt sich ______ |
Hemmungsart | Bindungsort des Inhibitors | Beeinflussung durch Erhöhung der Substratkonzentration |
Kompetitive Hemmung | Inhibitor konkurriert mit dem Substrat um die Bindungsstelle | Hemmung lässt sich zurückdrängen |
Nicht-kompetitive Hemmung | Inhibitor bindet an eine andere Bindungsstelle des Enzyms | Hemmung lässt sich nicht zurückdrängen |
Unkompetitive Hemmung | Inhibitor bindet nur, nachdem das Substrat bereits gebunden hat | Hemmung lässt sich nicht zurückdrängen |
Bsp reversibler Inhibitoren
Faktoren, die die katalytische Aktivität von Enzymen beeinflussen
pH-Wert
Temperatur
Warum wird die katalytische Aktivität von Enzymen vom pH-Wert beeinflusst?
− generelle Veränderungen der Proteinstruktur, Denaturierung
− Veränderungen der Konformation im katalytischen Zentrum
→ Ladungszustand saurer/basischer Aminosäureketten
pH-Optima von Enzymen
im Bereich 4,5 bis 8,0
jedes Enzym hat einen optimalen pH-Bereich
Bsp: Chymotrypsin pH 7.8, Pepsin pH 2.0
Wie die Temperatur die katalytische Aktivität von Enzymen beeinflusst? Geben einen Bsp

Beispiele Reaktionen zum Einsatz von Enzymen in der Lebensmittelanalytik
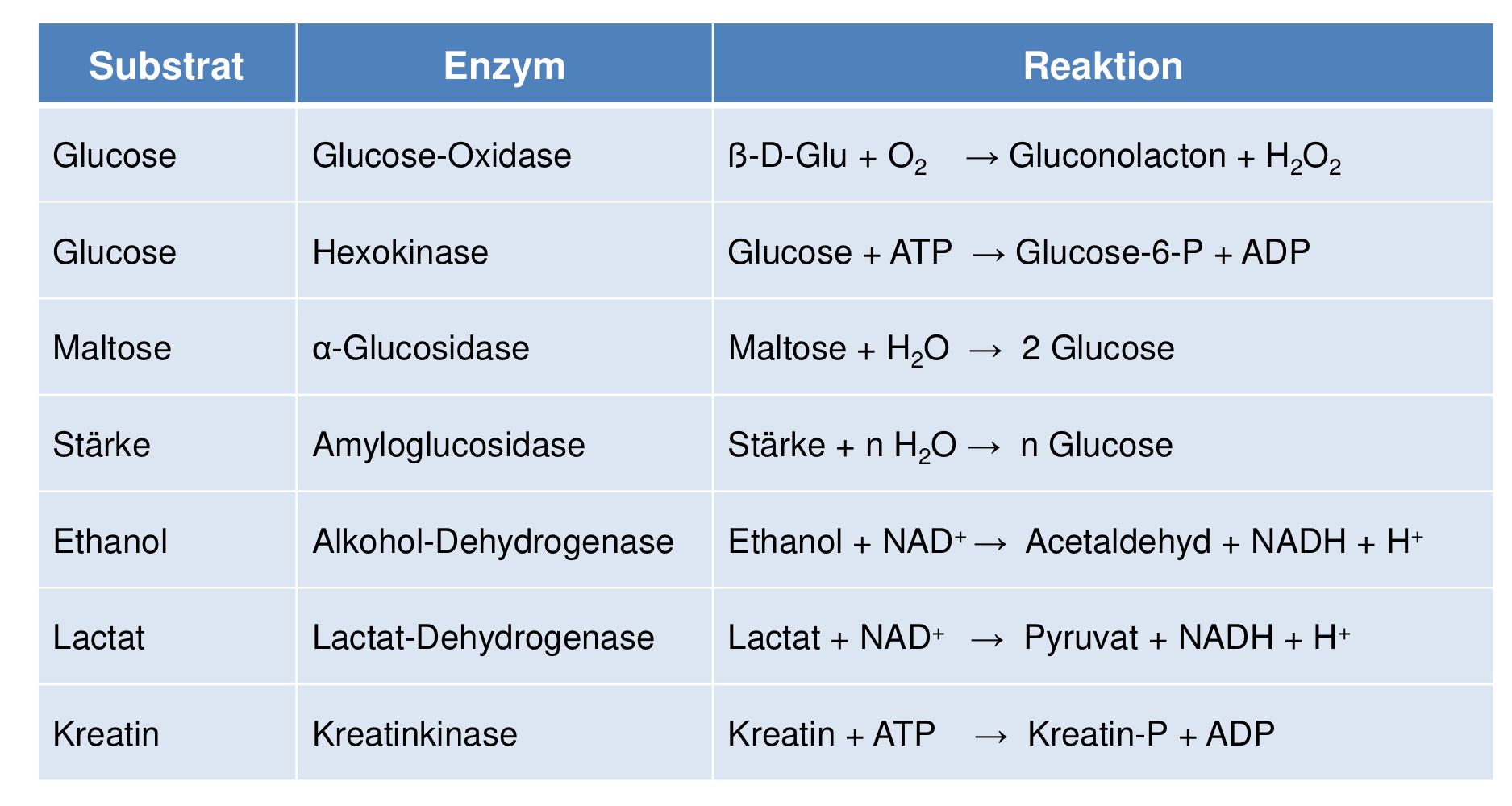
Beispiele zum Einsatz von Enzymen in der Lebensmitteltechnologie
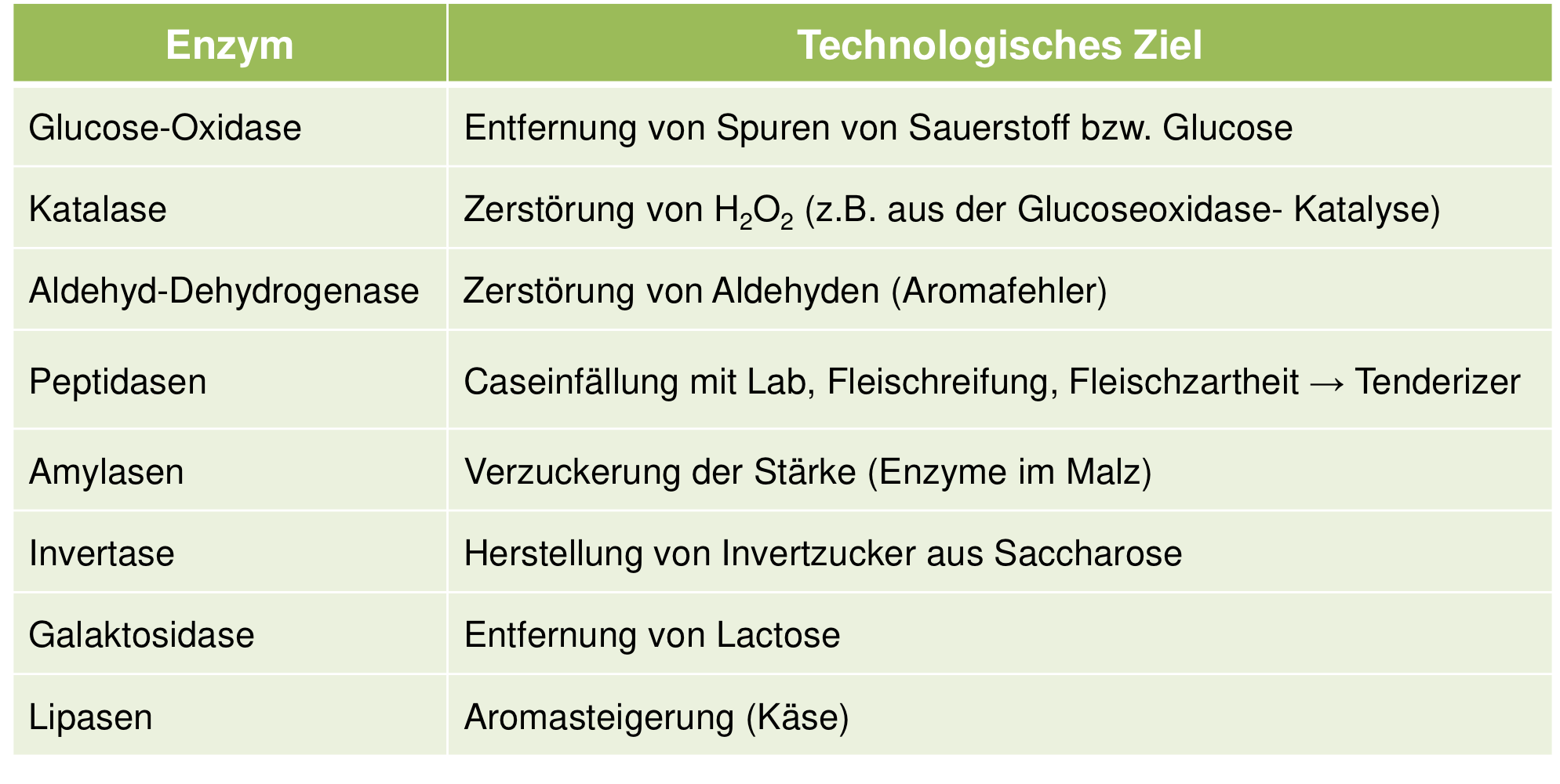
Welche Enzyme werden verwendet, um Fleisch künstlich zart zu machen?
Wie werden die Enzyme angewendet?
Zartmacher (tenderizer)
pflanzlicher Enzympräparate (Papain, Bromelain und Ficin)
⇒ verbessert die Qualität von minderwertigeren Fleischstücken
Enzyme entweder auf die Fleischstücke gegeben oder vor der Schlachtung dem lebenden Tier injiziert
Auswirkungen von Papain, Bromelain und Ficin auf das Fleisch
greifen Bindegewebe an (Kollagen, Elastin),
Überdosierung: Zersetzung von Actin
Was hydrolysieren Lipasen?
hydrolysieren Triglyceride an der Öl-Wasser-Grenzfläche einer Emulsion.
Was passiert bei Lebensmittelverderb durch Lipasen?
Freisetzung freier Fettsäuren → Aromadefekte
Welche erwünschten Effekte haben Lipasen in Lebensmitteln?
− Bildung typischer Aromanoten in Käse
(Bildung geringer Konzentrationen an C4 bis C8 Fettsäuren aus Milchfett)
− Brotbacken (Getreidelipasen)
Bildung von Mono- und Diglyceriden
Brot ist stabiler gegen Altbackenwerden
gleichmäßigere Porenstruktur der Krume
Was sind Amylasen? Wie wird es in LM verwendet?
Amylasen: stärkeabbauenden Enzymen
beim Bierbauen
=> geschrotetes Malz wird mit Brauwasser angeteigt; teilweiser Abbau der Polymere durch Enzyme des Malz
Welche Amylaseaktivitäten sind während der Keimung im Rahmen der Malzbereitung besonders hoch?
hohe α- und β-Amylaseaktivitäten