Amides, acides aminl, peptides et protéines.
1/12
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
13 Terms
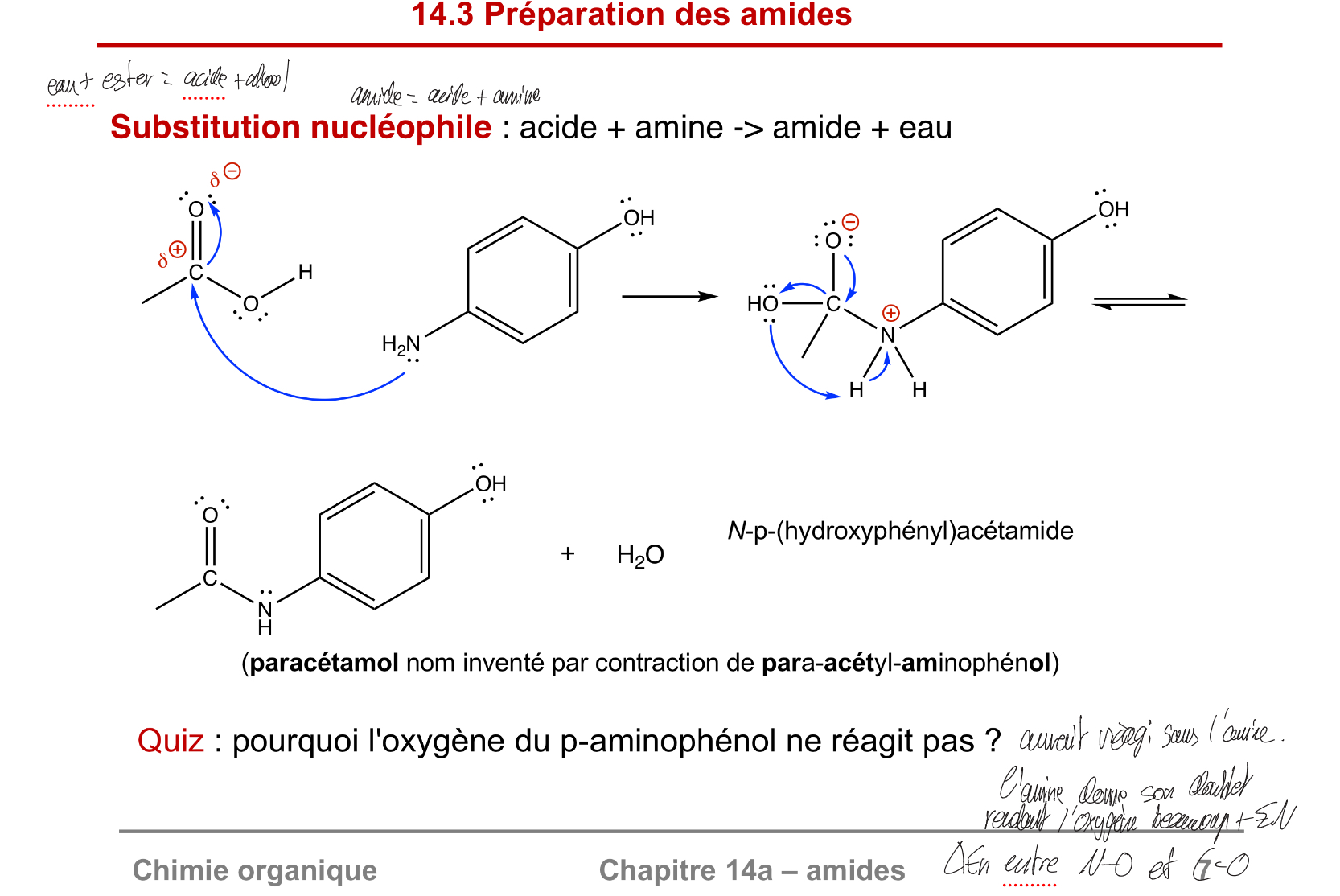
Préparation des amides
acide + amine → amide + eau
Le O du OH ne réagit pas car l’amine rend l’autre O beaucoup plus En
Si on veut la réaction inverse. Hydrolyse des amides : amide + eau → acide + amine
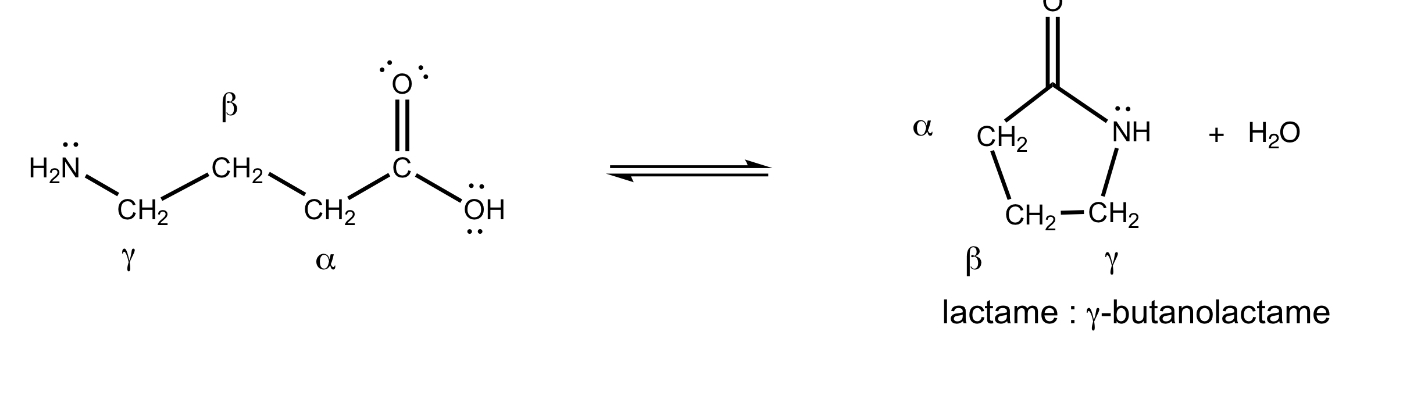
Lactame
amide cyclique
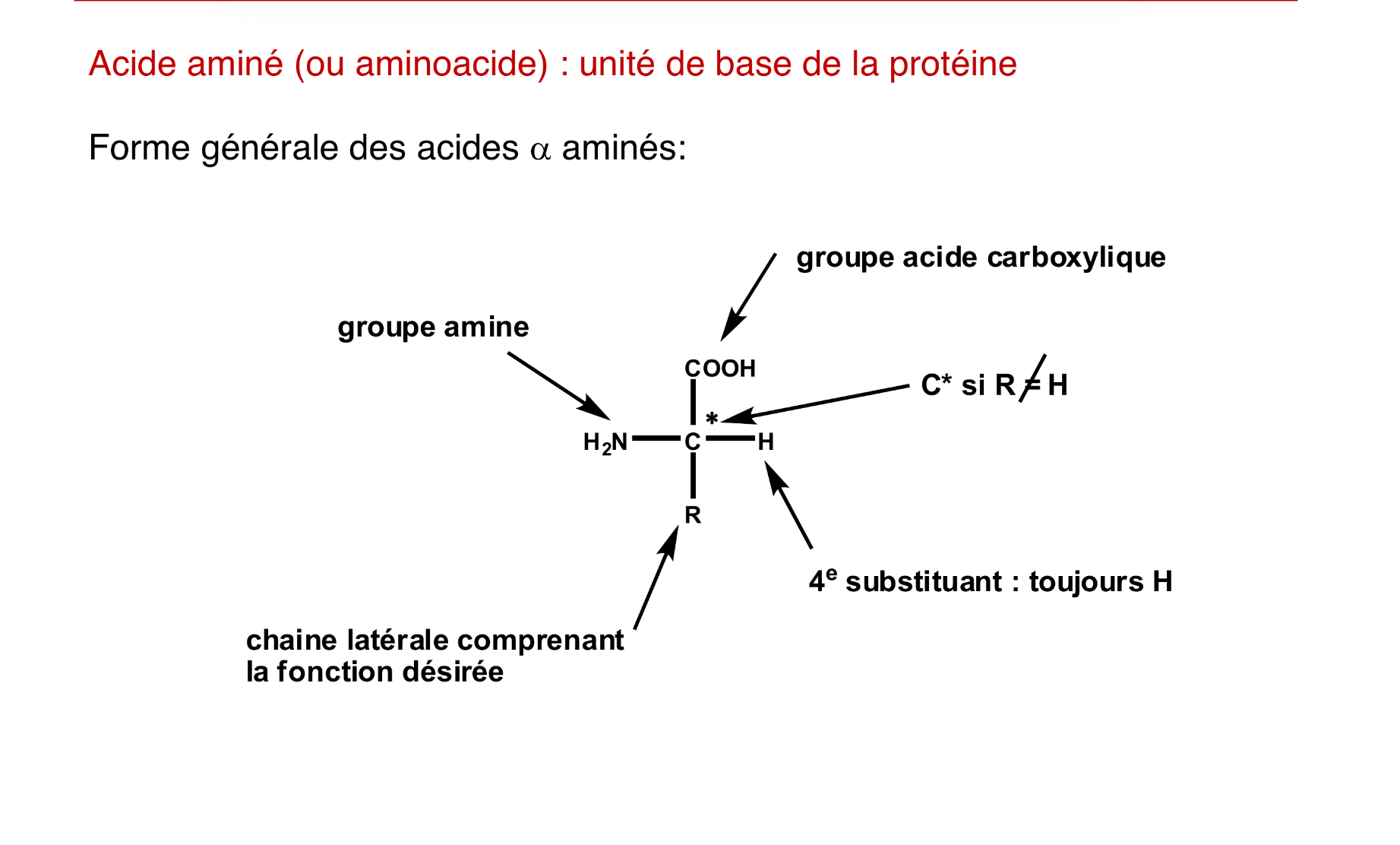
composition d’un acide aminé
unité de base de la protéine
méthode de Fischer
Tous les acides aminés sont énatiomères L → gauche

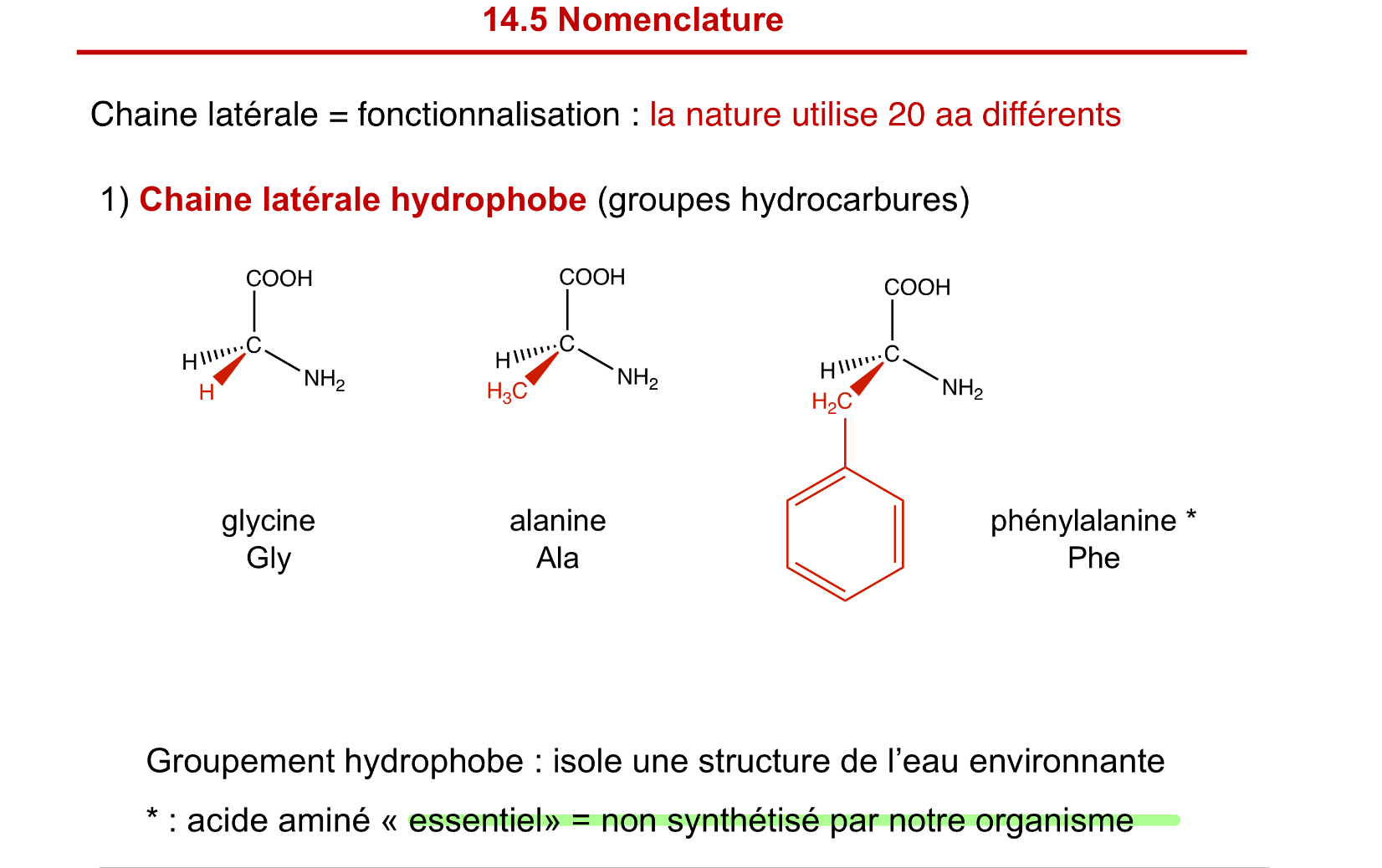
chaine hydrophobe des aa
glycine, alanine, phénylalanine
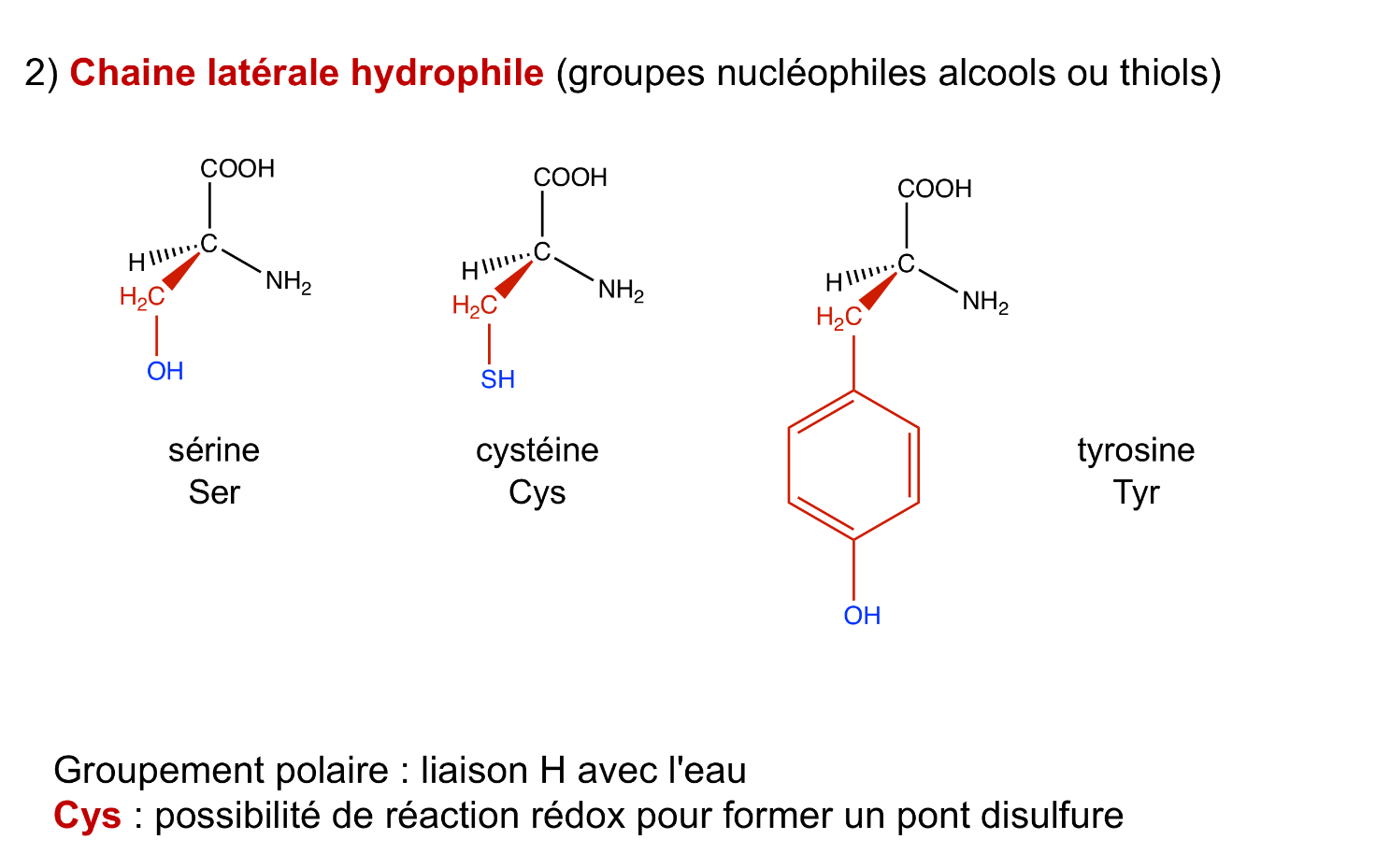
Chaine hydrophile des aa
sérine, cystéine, tyrosine
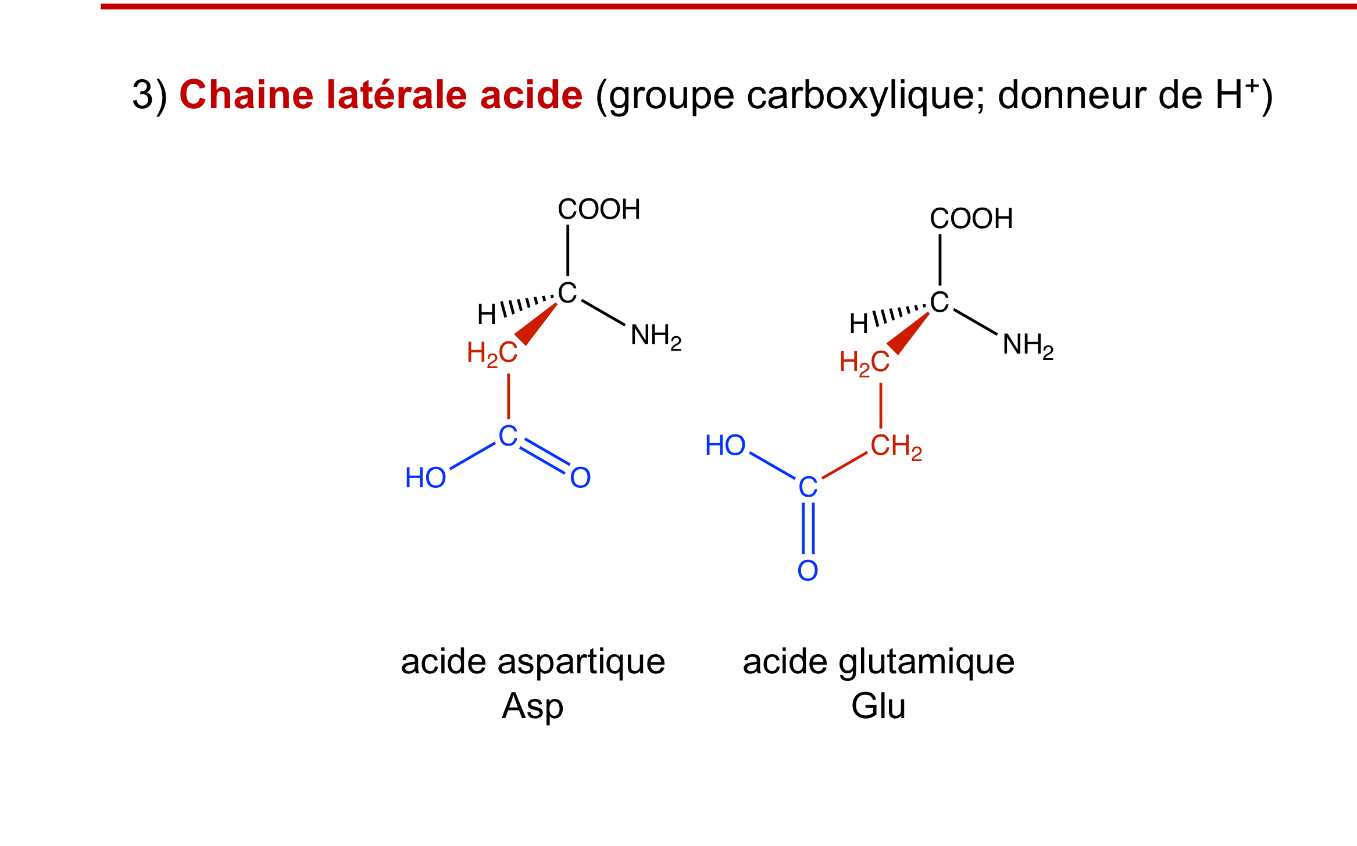
Chaine acide des aa
acide aspartique, acide glutamique
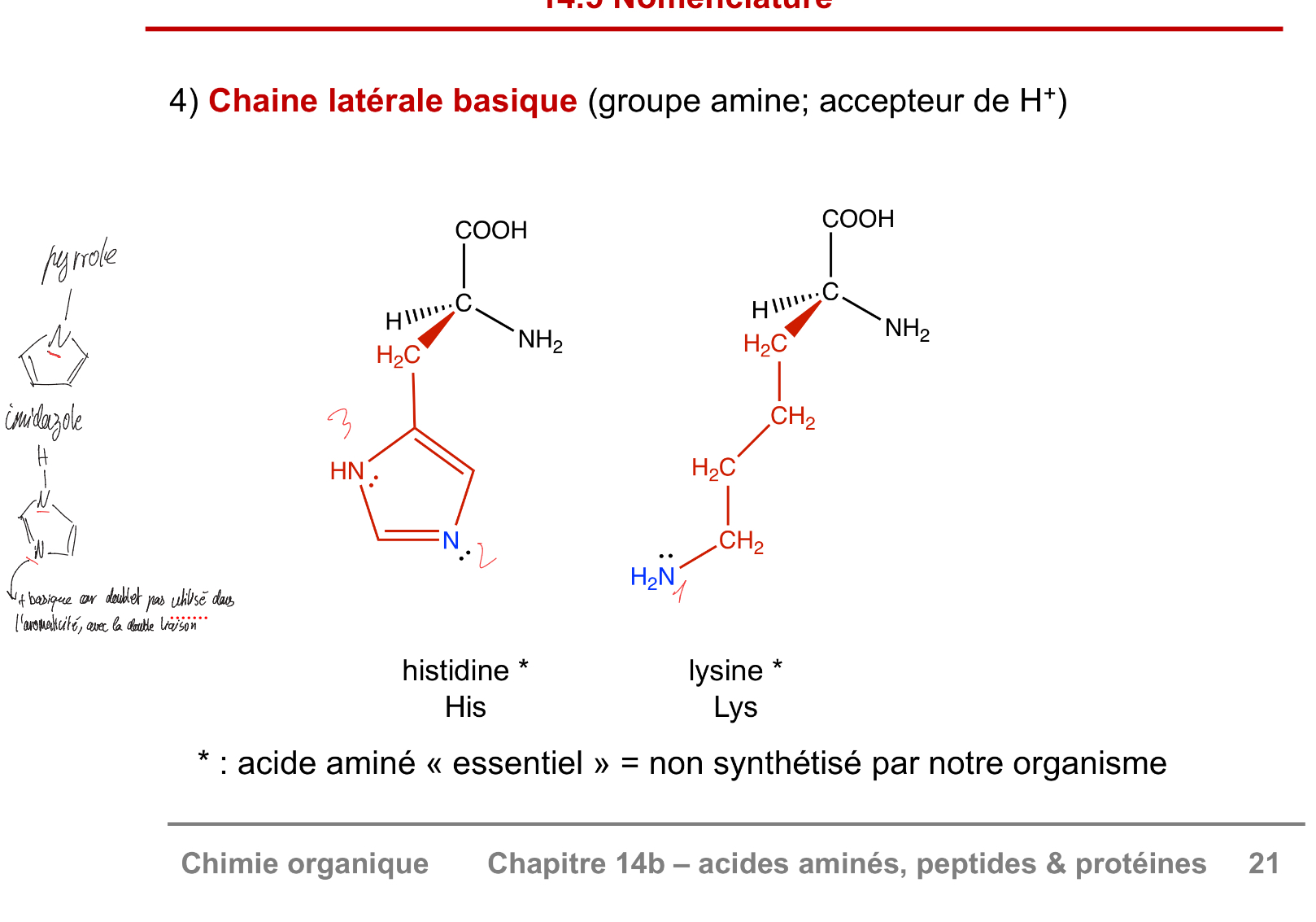
Chaine basique
histidine et lysine
Propriétés des acides aminés et les zwitterions
Lorsque c’est chargé mais que la charge nette est = 0
1) Propriétés de sel
2)Amphotère, le domaine du zwitterion est entre les 2 pKa
3) Point isolélectrique
4) Pont disulfure, liaison covalente entre 2 cystéines (aa avec du soufre)

Point isoélectrique
Où toutes les molécules sont sous forme de zwitterion. pl = 1/2(pKa1 + pKa2)
C’est au point isoélectrique, que la solubilité baisse dans l’eau car les molécules se lient entre eux et minimisent les interactions avec l’eau.
On applique un courant qui fait bouger les molécules chargées, + la charge est importante + elle bouge rapidement
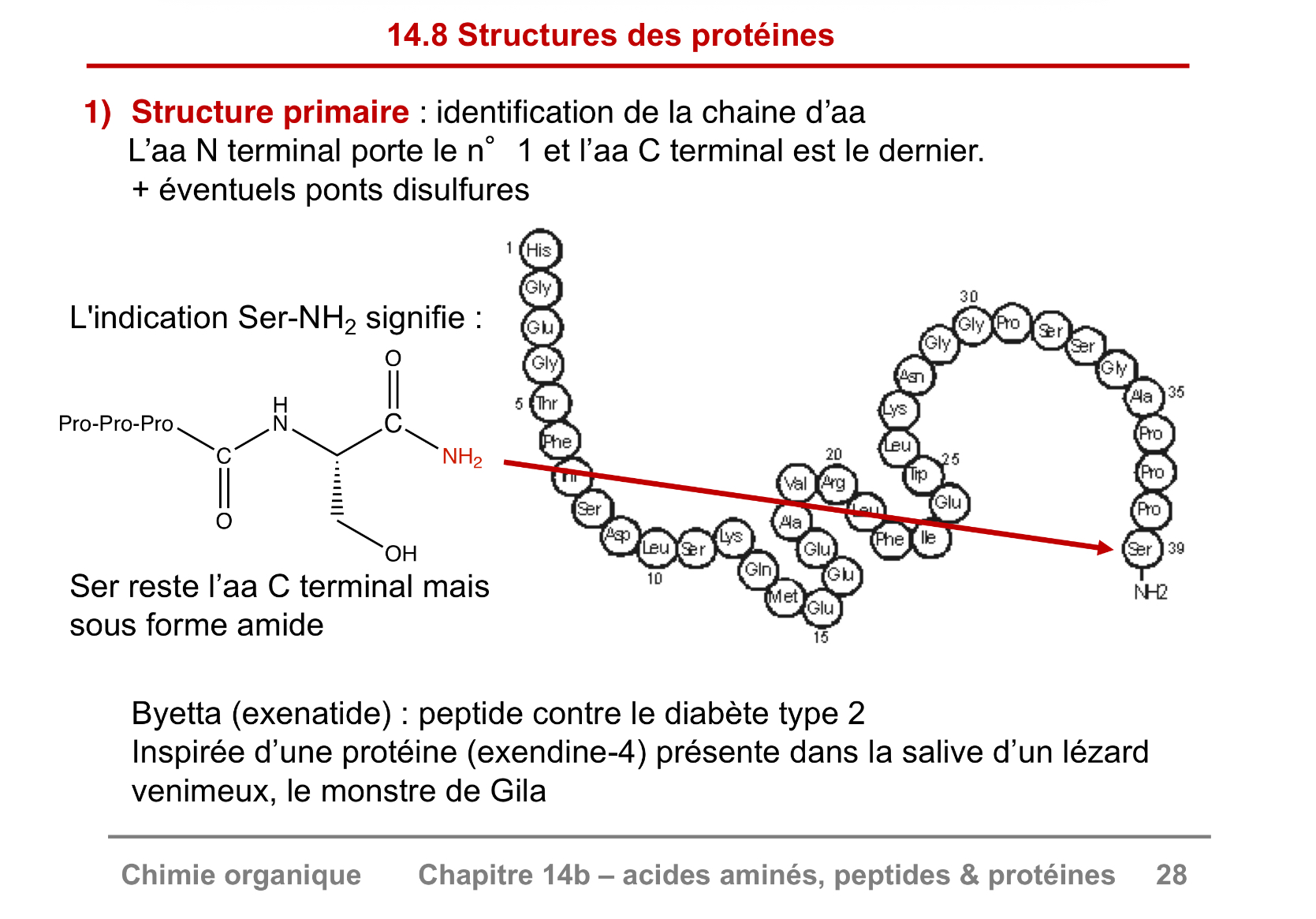
Structure primaire des protéines
aa N terminal porte le n1 et l’aa C terminal est le dernier
structure secondaire
en forme d’hélice alpha et feuillet B
structure tertiaire et quaternaire
Tertiaire :
-Forme de protéines allongées → insoluble dans l’eau.
-Forme de protéines globulaires → solubles dans l’eau
Quaternaire :
Ensemble de plusieurs protéines pour une fonction.