8-Transduction du signal
1/46
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
47 Terms
Fonction des récepteurs à activité tyrosine kinase (RTK)
Famille de récepteurs contrôlant la croissance, la différenciation, la survie et le métabolisme cellulaire
Quelles molécules détectent les RTK ?
Ils détectent :
l’insuline et Insuline like Growth Factor 1 (IGF-1)
Epidermal Growth Factor (EGF)
Platelet-Derived Growth Factor. (PDGF)
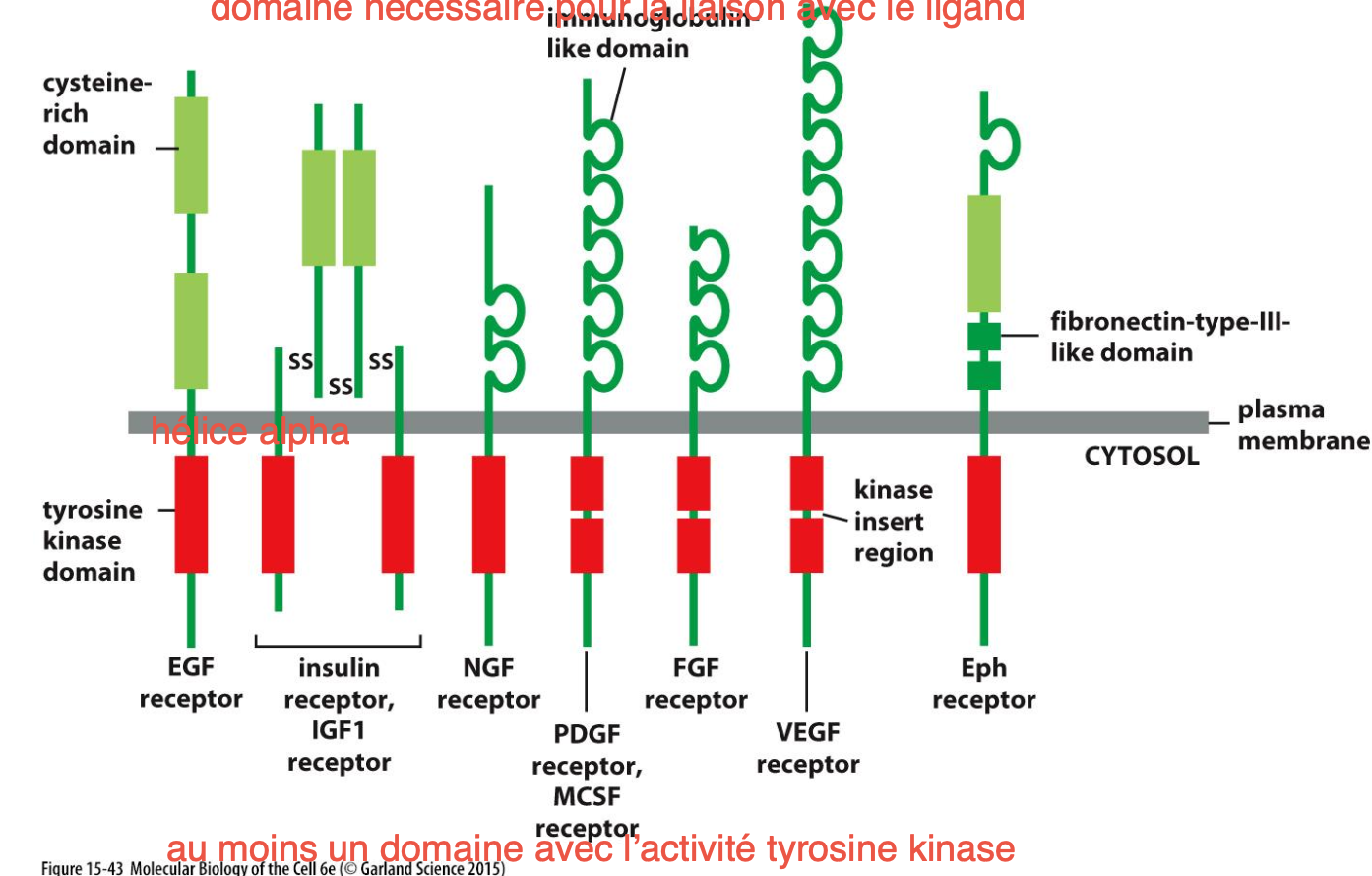
Structure des RTK :
C’est une protéine transmembranaire qui possède :
un ou plusieurs domaines extracellulaire pour la liaison avec le ligand
Une hélice transmembranaire
Un à deux domaines cytoplasmiques à activité tyrosine kinase qui s’autophosphoryle pour initier la signalisation cellulaire.
des sites de liaisons pour d’autres protéines formant un complexe de signalisation lorsque le récepteur est activé
Comment s’activent les récepteurs RTK ?
Le domaine kinase s’active lorsque les récepteurs forment un dimère
Quels sont les 2 façons pour dimériser le récepteur ?
Liaison avec un ligand qui fait un pont entre les deux RTK et les dimérisent
Liaison avec le ligand permettant de changer la conformation pour qu’ils puissent se dimériser.
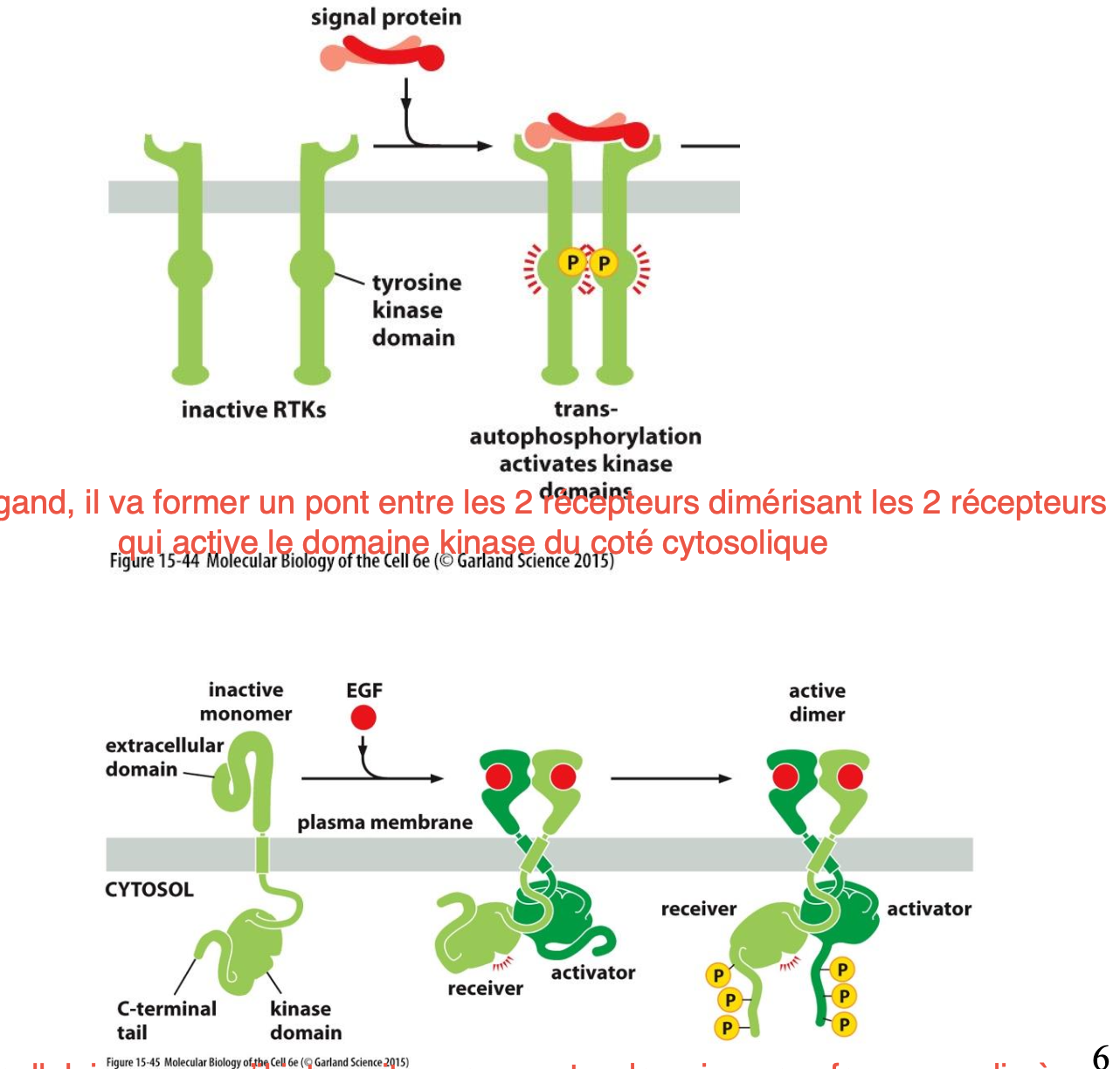
Comment s’autophosphoryle le dimère ?
Initialement, les deux domaines kinases sont faiblement actifs, mais lorsqu’ils se rapprochent pour former un dimère, les deux domaines kinases peuvent phosphoryler l’un et l’autre dans leur lèvre d’activation.
Cette phosphorylation ouvre les lévres d’activation des RTK augmentant l’activité des domaines kinases grâce à une meilleure liaison de l’ATP ou du substrat.
La kinase active peut maintenant phosphoryler d’autres Tyr dans la partie cytosolique du récepteur permettant de former un site de liaisons afin de former un complexe de signalisation.

Comment est-ce que recrutent RTK des autres protéines de signalisation ?
Ils recrutent des protéines de signalisation via des domaines de liaisons aux phosphotyrosines comme SH2 et le domaine PTB et les protéines qui se lieront à ces domaines peuvent elles aussi être phosphorylées.
Particularité du récepteur pour PGDF ?
Contient 5 sites d’autophosphorylation régulant différentes voies de signalisation en aval.
2 sites (740 et 751) pour la voie de signalisation avec PI3-kinase
1 site (771) pour l’activation de certaines protéines G
2 sites (1009 et 1021) pour initier la signalisation avec l’activation des phospholipases.
Structure des protéines Ras :
petite protéine G monomérique avec une activité GTPase comme la sous-unité alpha des protéines G trimériques
Comment est régulé l’activité des Ras ?
Contrôlé par la régulation GTP/GDP par GEF et GAP
Modification post-traductionnelle comme la farnésylation (ajout d’un groupe lipidique) ou la palmitolation qui ancrent la protéine à la membrane, très importante pour son activité.
Cite 3 protéines Ras et leurs fonctions :
H-Ras/K-Ras/N-Ras :
pour la signalisation des récepteurs tyrosine kinase
Rheb :
Active mTOR pour stimuler la croissance cellulaire
Rap1 :
active l’intégrine pour l’adhésion grâce aux cAMP.
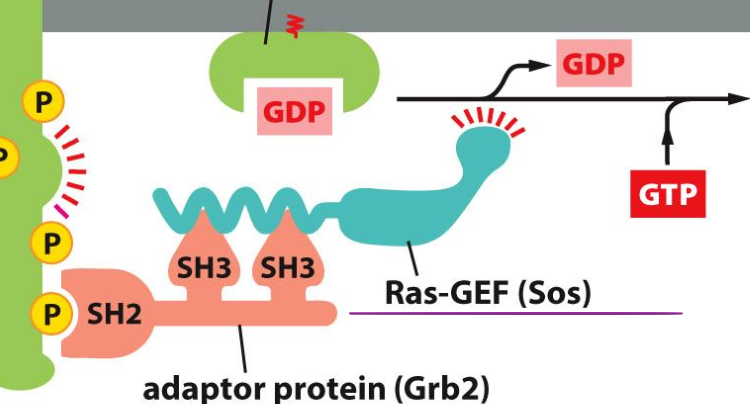
Comment est-ce que RTK active les protéines Ras ?
L’autophosphorylation grâce à la liaison avec le ligand va permettre de lier GRB2, permettant à SOS (riche en proline) de se lier aux SH3 de GRB2 et de se rapprocher des protéines Ras.
Les SOS ont une activité GEF qui va changer GDP en GTP activant la protéine Ras
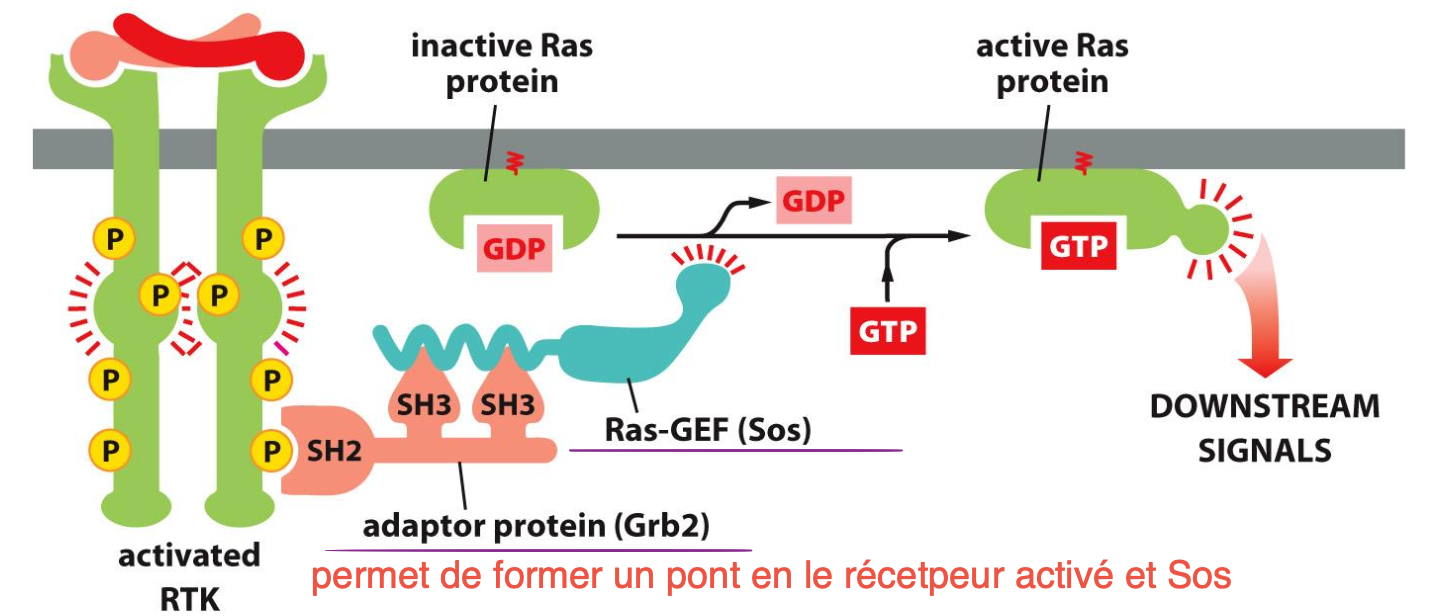
Structure de GRB2 :
Contient un domaine SH2 se liant à la phosphotyrosine de RTK
2 domaines SH3 qui se fixent à SOS riche en proline
Structure de SOS :
Son of Sevenless
Rôle de GEF (échange de nucléotides) se liant au domaine SH3 de GRB2 car riche en proline et est amenée tout proche de la protéine Ras.
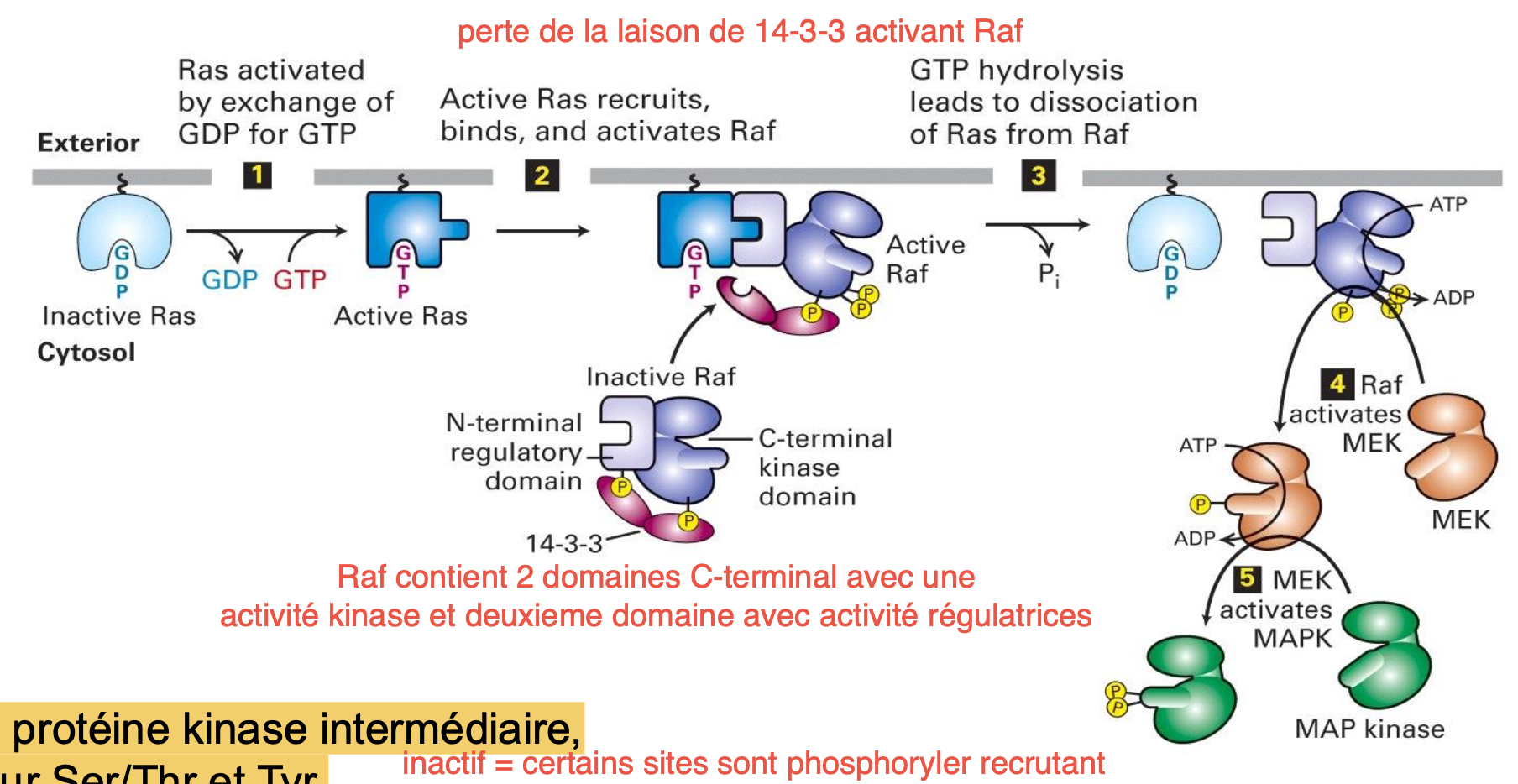
Qu’est-ce que Raf ?
C’est une famille de Ser/Thr kinases cytosolique qui contient un domaine kinase et un domaine régulateur.
Explique le mécanisme de la cascade de signalisation par l’intermédiaire de la kinase Raf :
Ras-GTP va se lier au N-terminal de Raf ce qui va retirer la protéine 14-3-3 qui inhibait l’activité de Raf en interagissant avec ces phosphorylations.
Raf activé va ensuite activé une kinase intermédiaire MEK qui elle peut activer MAP kinase puis → recrutement de facteurs de transcription
Explique le contrôle de la transcription par activation de MAPK :
Lorsque MAPK s’activent, ils se dimèrisent qui se déplacent au noyau activant TCF, un facteur de transcription spécifique par une phosphorylation directe
MAPK cytoplasmique active la kinase p90RSK, qui se déplace au noyau pour activer SRF, permettant de contrôle avec l’aide de TCF la transcription.

Caractéristiques des phosphatidylinositol-3 kinases (PI3K)
important pour la prolifération et la survie cellulaire
divisé en 4 classes, de I à IV selon la structure primaire, la régulation et la spécificité du substrat lipidiques
Structure des PI3K de classe I :
hétérodimères composé d’une sous-unités régulatrices contenant des domaines SH2 et d’une sous-unités catalytique.
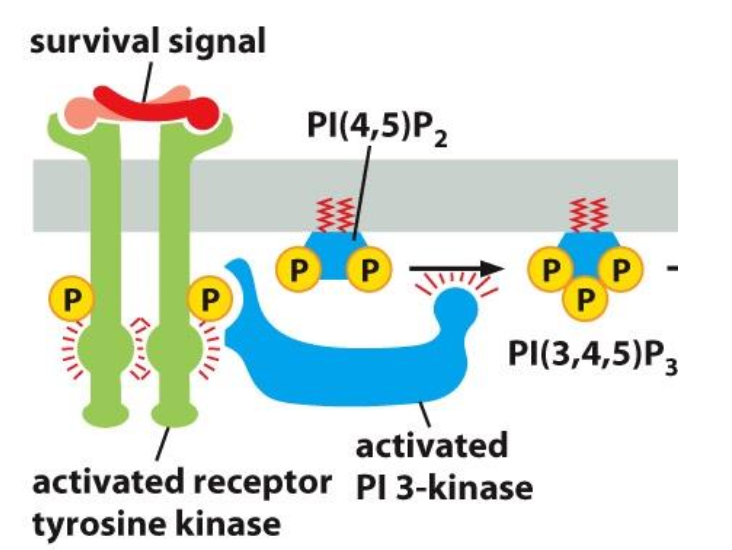
Qu’est-ce qui se passe lorsque RTF s’active pour PI3K ?
PI3K est recruté vers le récepteur et s’active par phosphorylation.
PI3K catalyse la phosphorylation des phosphoinositols en P3 du cycle inositol.
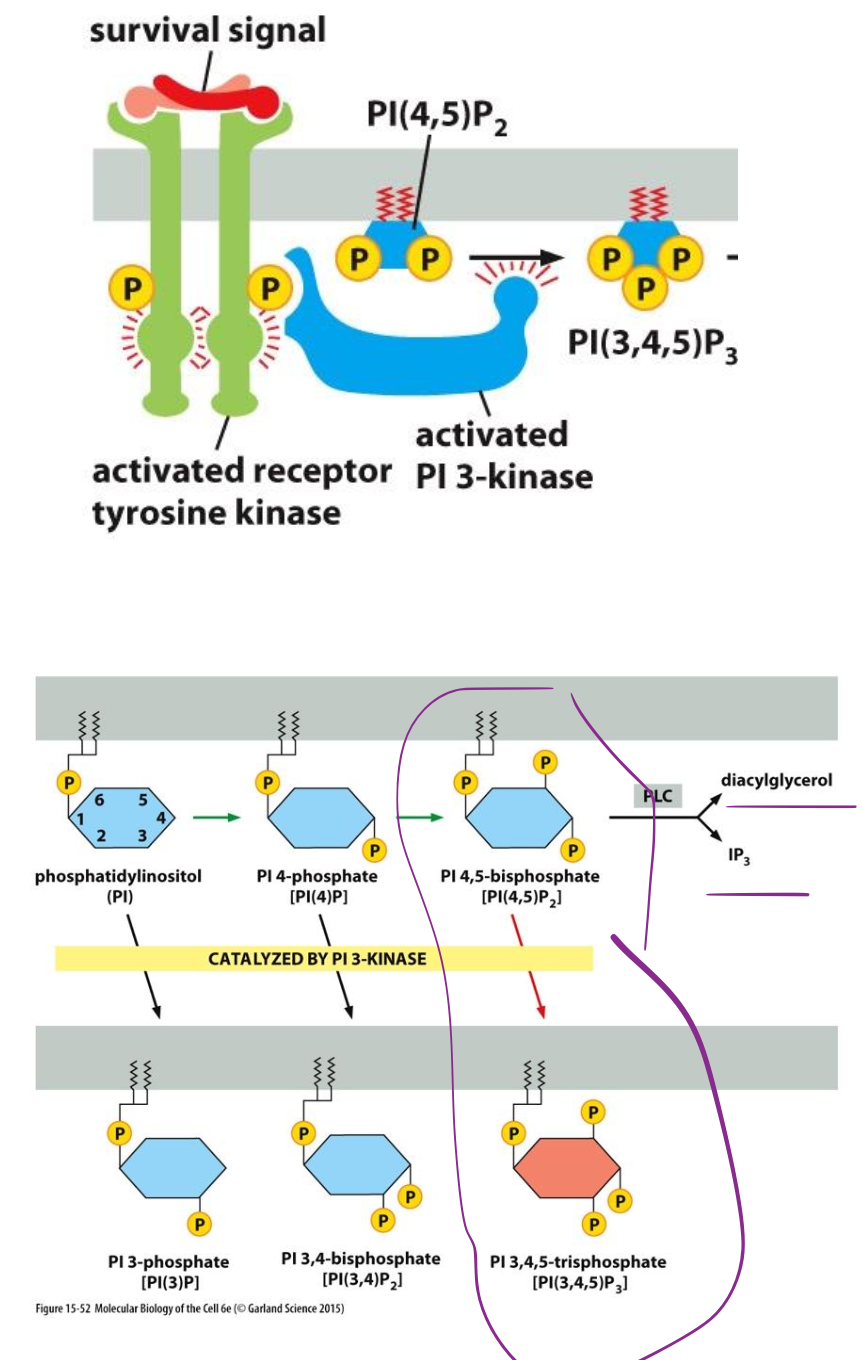
Quelle est la différence entre phosphoinositol et phosphoinositides ?
phosphoinositol : PI
phosphoinositides : PIP
Ajout de phosphate
Qu’est-ce qui se passe après la phosphorylation des PI ?
Les phosphoinositides comme PI(3,4,5) peuvent maintenant ancrer des protéiens dans la membrane et interagissent avec PKB (Akt). L’activation de PKB va phosphoryler Bad qui inhibe l’action inhibitrice de l’apoptose ou activer mTORC1

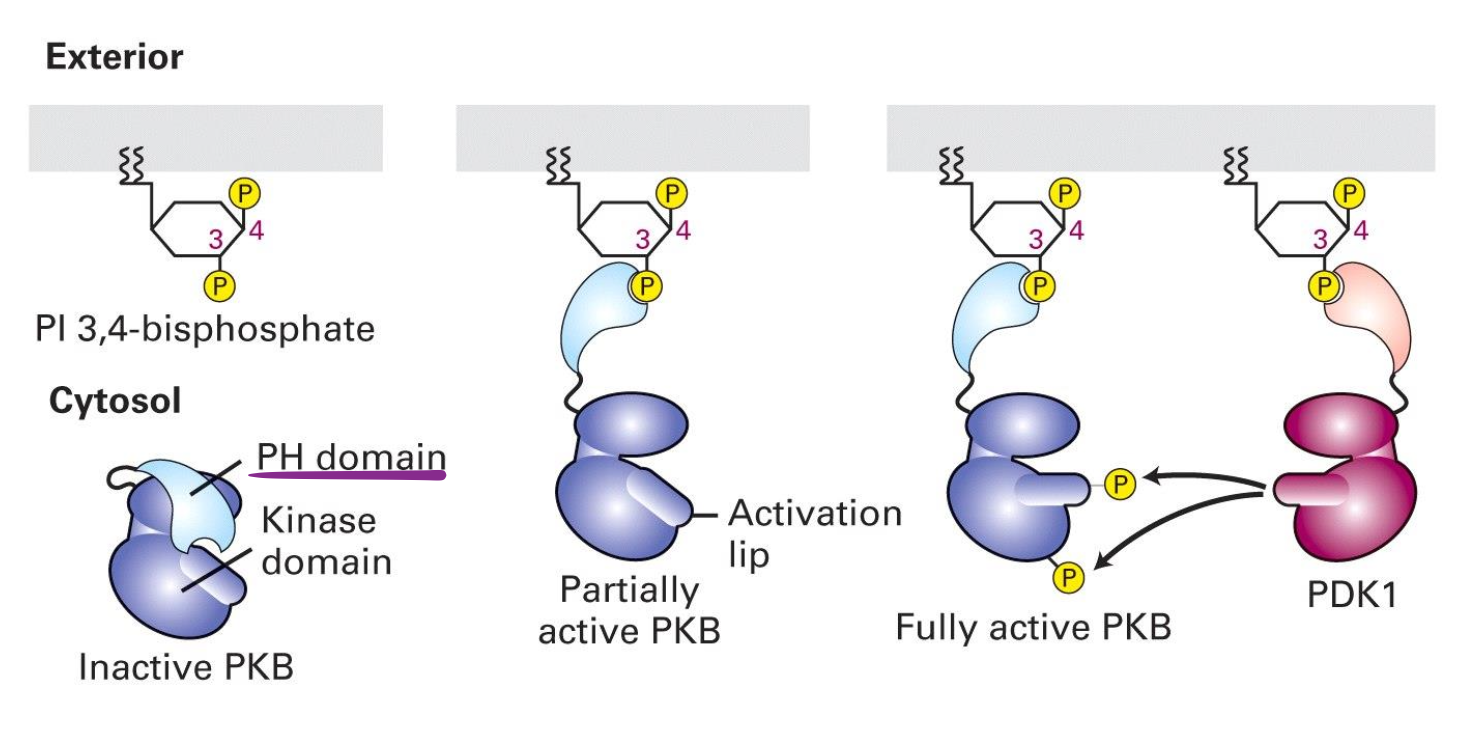
Mécanisme de PKB et PDK1 :
possède un domaine PH qui se lie aux phosphoinositides produits par PI3K.
PKB est inactif dans le cytosol mais devient partiellement activé lorsqu’elle s’ancre à la membrane plasmique.
PDK1 phosphoryle PKB au niveau du lip du site catalytique activant complétement PKB.
Lorsque que PKB est activé, il quitte la membrane et phosphoryle des protéines impliqués dans l’apoptose, inhibant leur fonction pour la survie cellulaire
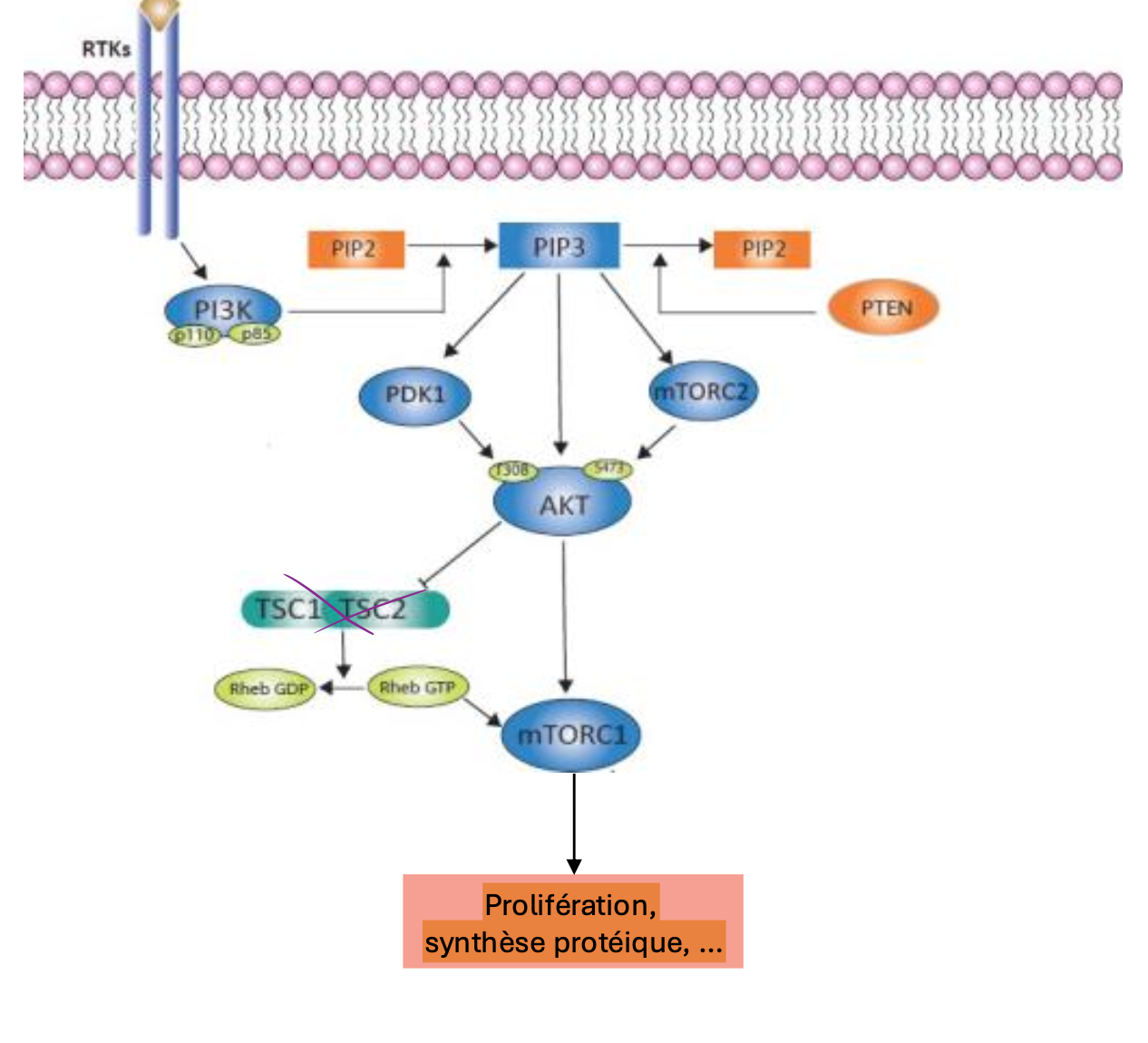
Comment est-ce que les RTKs activent mTORC1 ?
Activation de PI3K-Akt par RTK, essentiel pour activer mTOR → production de PIP3
Recrutement de PKB (Akt) à la membrane
PBK phosphoryle TSC2, un inhibiteur de Rheb
Rheb-GTP active mTORC1, stimulant la synthèse protéique et la croissance cellulaire
Caractéristiques et fonctions des cytokines :
Petite protéien soluble
Régulation de la physiologie cellulaire
Croissance
Différenciation
Système immunitaire
Donne des exemples de cytokines et leurs fonctions :
Prolactine : différenciation de la glande mammaire
EPO : production d’érythrocytes
G-CSF : production de granulocytes
IL-2 : activation des cellules T
IL-4 : activation des cellules B
Interférons : réponse antivirale
TNF-alpha : inflammation
Caractéristiques et fonctionnement des récepteurs de cytokines de type I :
Protéine transmembranaire sans activité enzymatique
Associé à des tyrosines cytosoliques JAK avec 2 domaines kinases
La liaison avec le ligand entraine une dimérisation, permettant aux JAK de se phosphoryler l’un et l’autre permettant d’initier la signalisation.
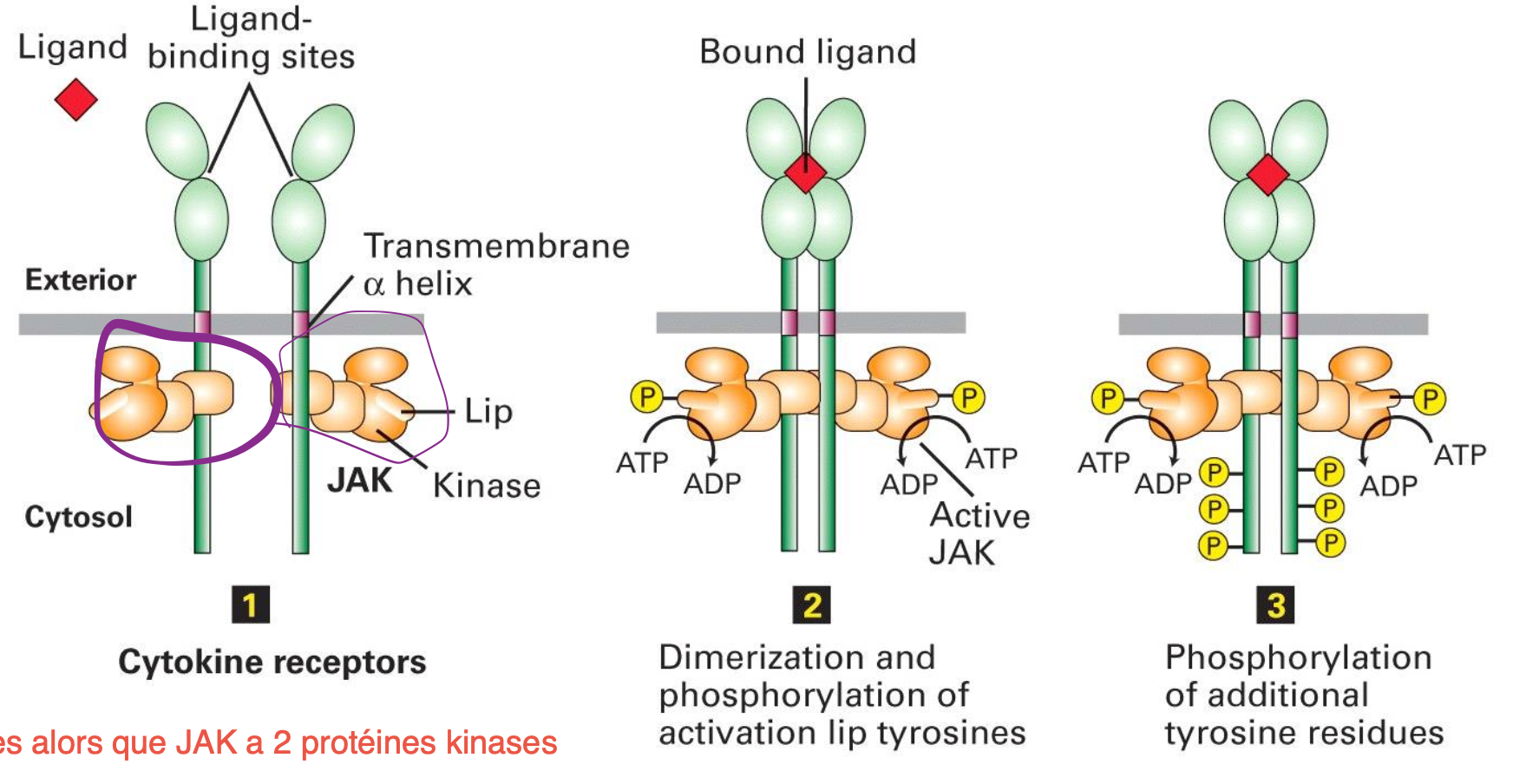
Est-ce que les récepteurs de cytokines ont une activité enzymatique ?
Non mais sont liés à JAK1/2 et TYK2 kinases
Qu’est-ce que des interleukines ?
Ce sont un groupe de cytokines exprimés et sécrétées par les leucocytes.
Constitué de 4 hélices pliées ensemble.
Combien est-ce que tous les récepteurs de cytokine de type I ont de sous-domaines dans leur domaine ?
2 sous domaine composé de 7 brins beta.
Qu’est-ce que permet la liaison d’une molécule de cytokine à son récepteur ?
La dimérisation de deux récepteurs monomères
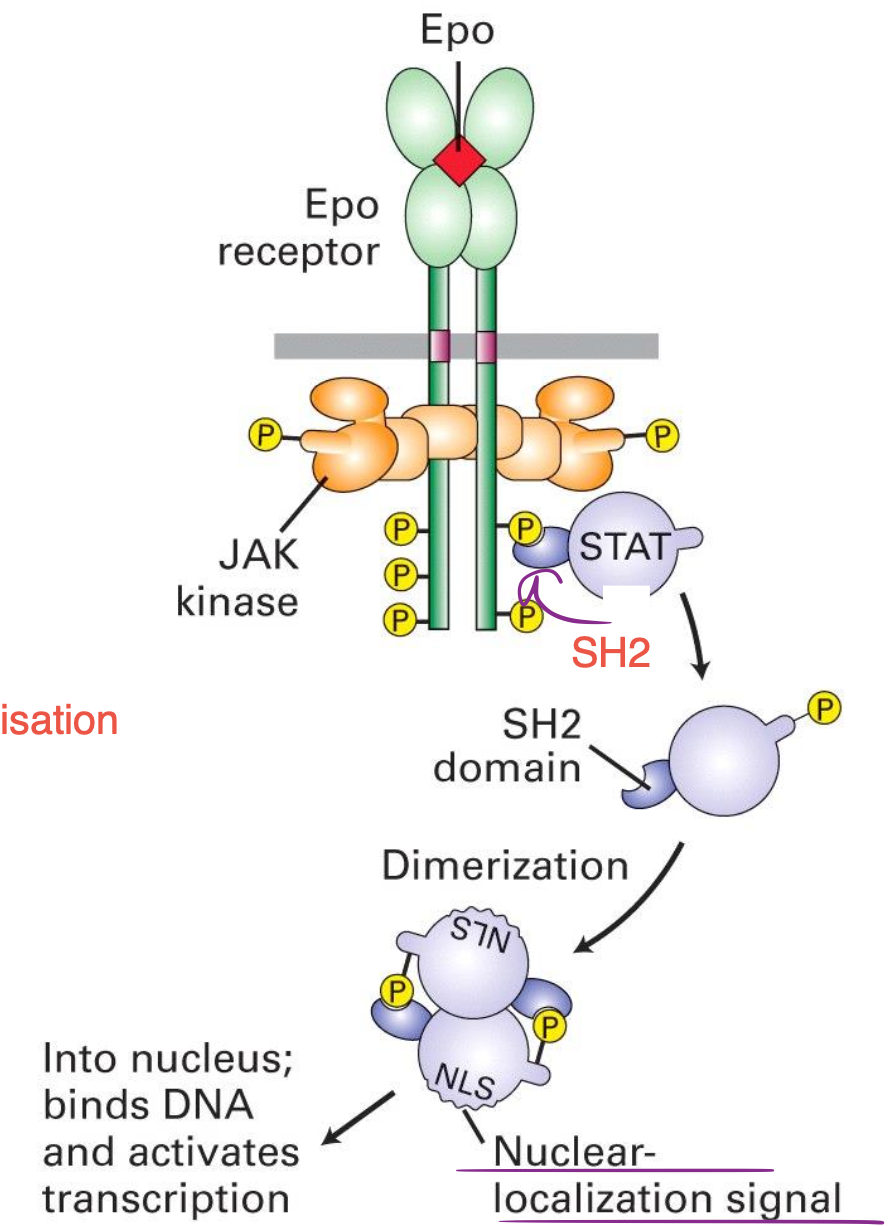
Explique le mécanisme de signalisation par les récepteurs de cytokines :
Le facteur STAT contient un domaine SH2 qui peut se lier aux phosphotyrosines du récepteur de cytokines, ce qui va phosphoryler STAT et le dissocier du récepteur.
Dans le cytosol, STAT se dimèrise avec un mécanisme de liaison SH2-Phospho-Tyr.
La dimérisation de STAT expose un signal de localisation nucléaire activant la transcription après la translocation dans le noyau.
Donnez un exemple de récepteur de type II :
Les récepteurs des interférons
Caractéristiques des 2 types de récepteurs d’interférons :
Type I :
IFN-α, IFN-β et IFN-ω se liant à un récepteur commun à la surface des cellules
Type II :
IFN-γ se fixe à un récepteur distinct pour initier la signalisation.
A quoi sert STAT1/2 ?
Contrôle l’expression des ISG, indispensables à la défense antivirale et antibactérienne
Caractéristiques des récepteurs TNF :
Structure : récepteurs transmembranaires avec un domaine extracellulaire riche en cystéine pour la liaison avec le ligand.
Agis sous forme de trimères
Signalisation : Ils n’ont pas d’activité enzymatique donc recrutent des adaptateurs intracellulaire comme TRADD, TRAF, FADD, pour activer des voies comme NF-kB, MAPK, ou induire l’apoptose.
Les lymphocytes T cytotoxiques se lient à ces récepteurs pour les tuer.
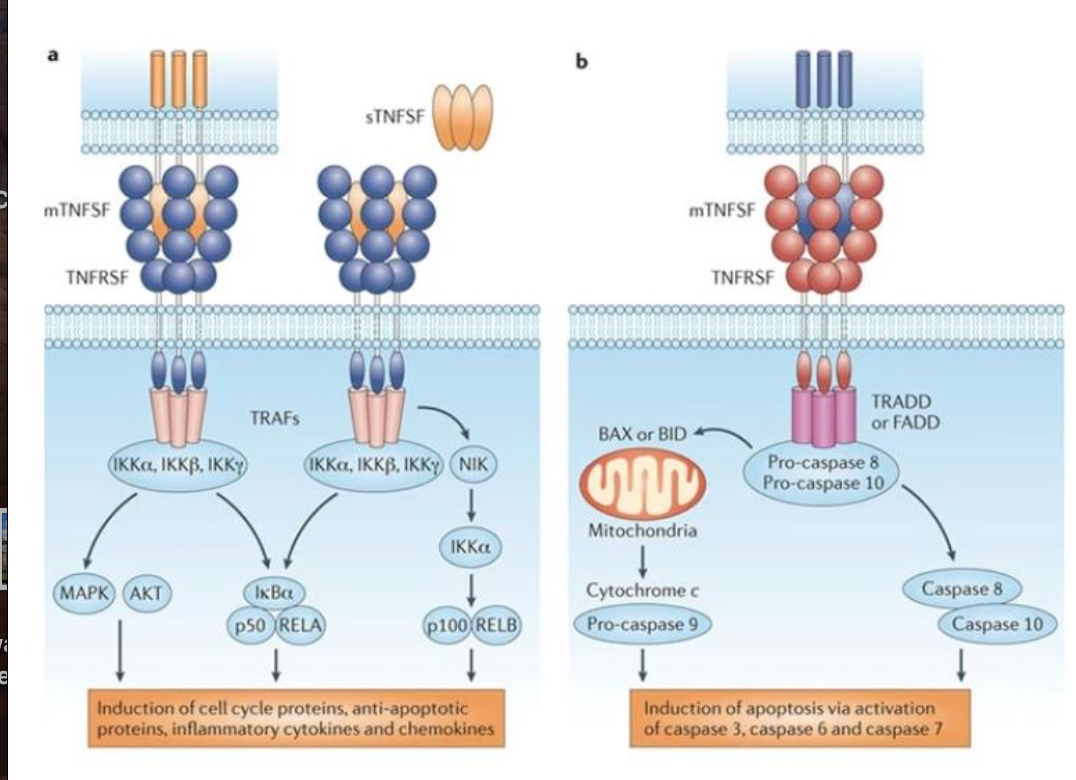
Quelle est la fonction des récepteurs TNF ?
Régulent le développement et l’activité des systèmes immunitaires, nerveux, osseux chez les mammifères
Donne des exemples de ligand pour les récepteurs TNF :
TNF, lymphotoxine,
ligand inducteur d’apoptose : FASL, TRAIL
Fonction de la famille TGF-beta :
Prolifération et différenciation
développement
migration e.g. pour la cicatrisation
matrice extracellulaire
régulation du système immunitaire
contrôle du développement de la tumeur
Quelle est la structure de TGF-ß ?
Deux monomères liés par un pont disulfure. Chaque sous-unité comporte 3 ponts disulfures intra-chaîne.
Des agents réducteurs peuvent casser les ponts disulfures, les désactivant.
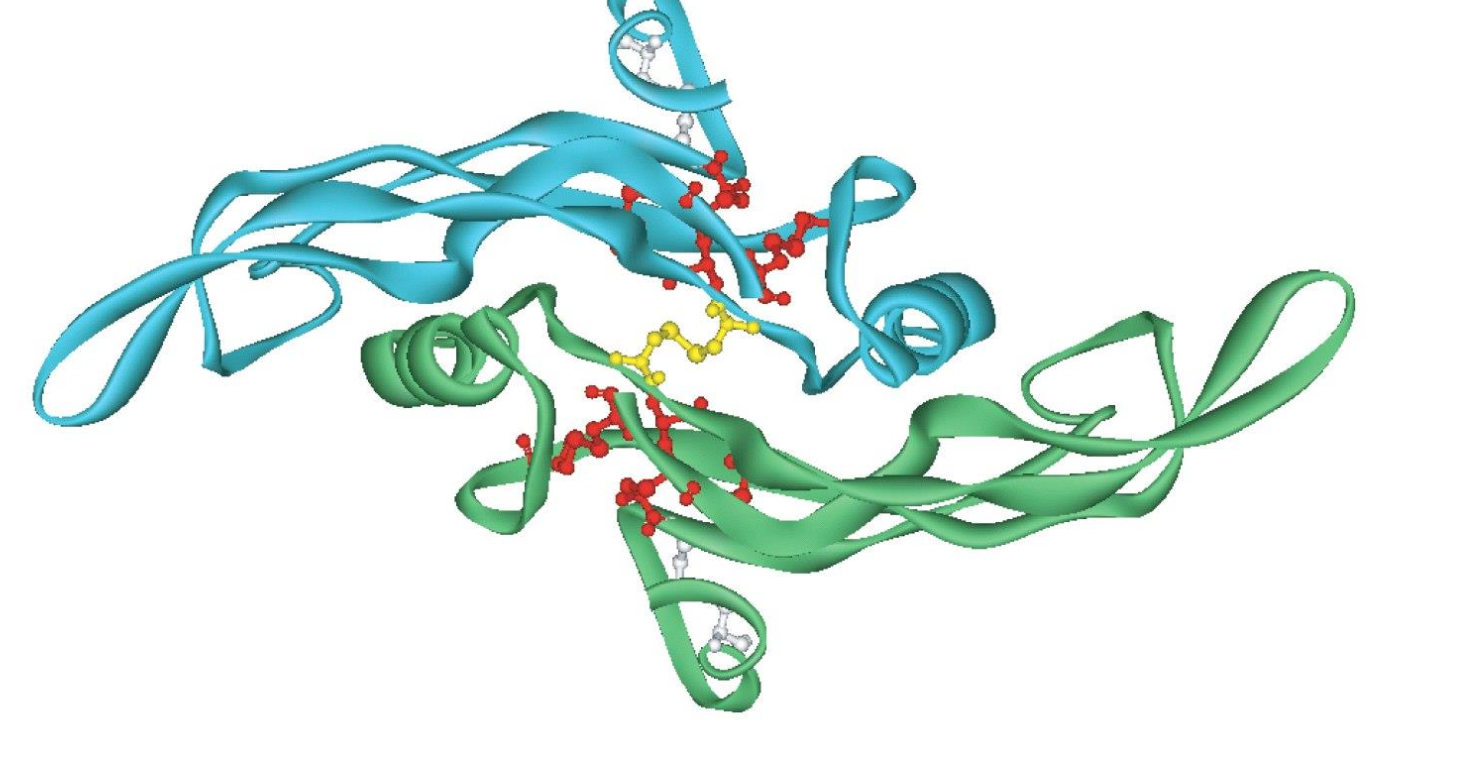
Fonction et rôles des 3 types de récepteurs du TGF-ß :
Récepteurs de type III :
dépourvu d’activité catalytique
concentrre le TGF-ß à la surface cellulaire
Récepteurs de type I et II :
protéine transmembranaire dimèriques avec une activité sérine/thréonine kinase intrinsèque.
Important pour la signalisation
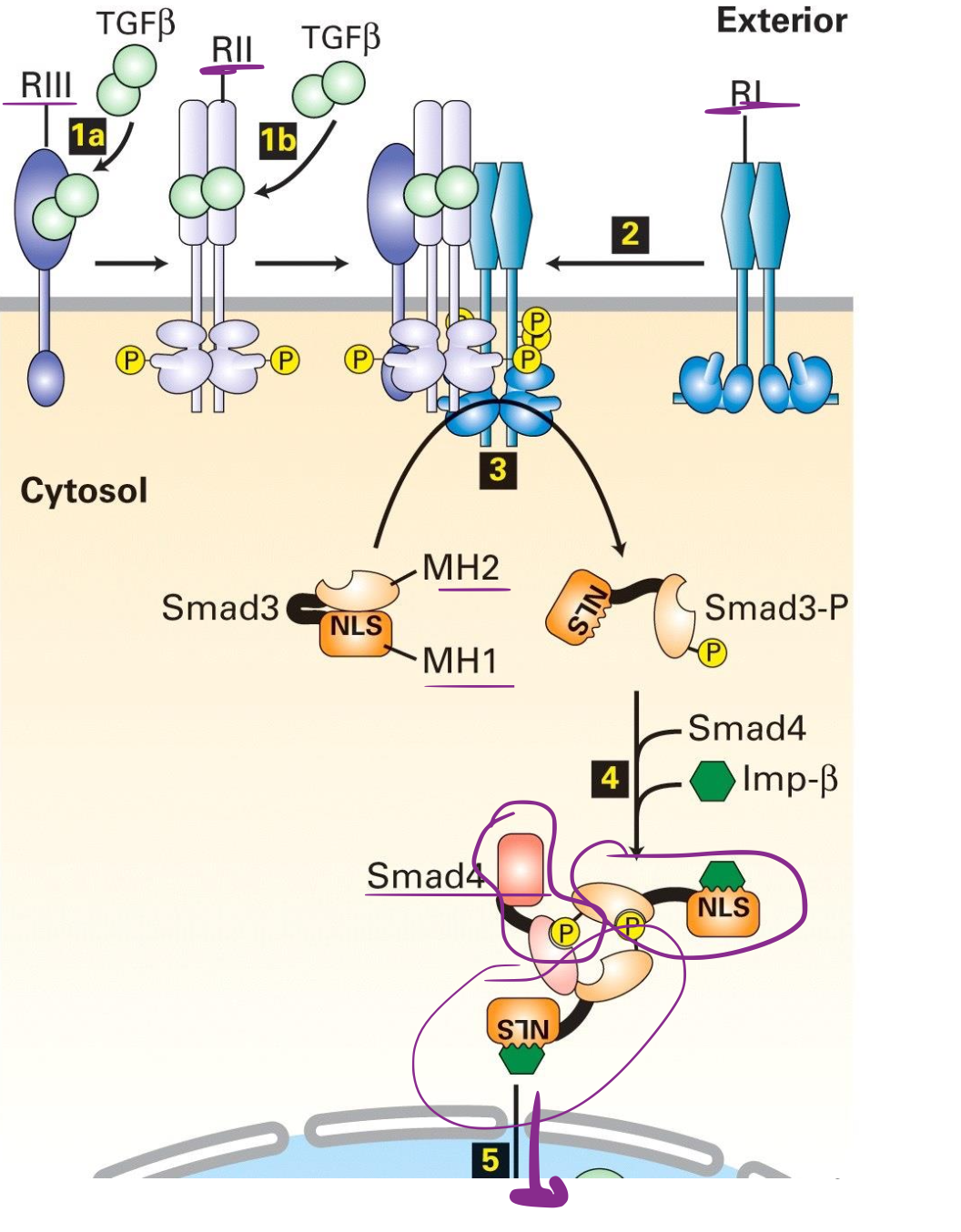
Explique le mécanisme de signalisation de TGF-ß
Le récepteur de type II est une kinase sérine/thréonine toujours actif alors que le récepteur de type I est toujours inactif
TGF-ß se lie à RII grâce à la concentration de TGF-ß par le récepteur de type III
RI se lie à RII-TGF-ß et RII phosphoryle RI → RI activé
RI phosphoryle les protéines en aval notamment les protéines SMAD transmettant le signal vers le noyau pour réguler la transcription.

Comment se passe la signalisation de RI vers l’initiation de la transcription ?
RI va phosphoryler Smad3 dans le domaine MH2
Formation du complexe Smad4, avec la dimérisation de Smad3 lié à Smad4 formant un complexe actif.
Les Smad3 contiennent un signal de localisation nucléaire et fait migrer le complexe Smad4 vers le noyau.
Le complexe se lie à l’ADN (sur des élements de liaisons Smad dans les promoteurs des gènes cibles)
A quel stade est contrôlé TGF-ß ?
Transcriptionnelle
Post-transcriptionnelle lors de la sécretion de la protéine et de sa maturation
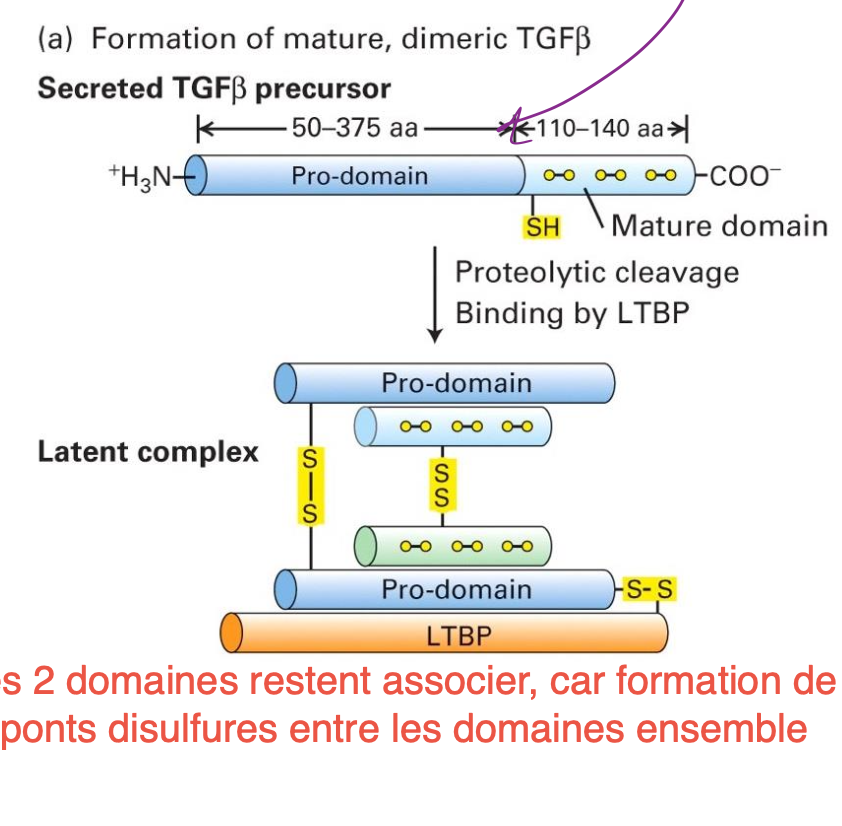
Comment est contrôlé la signalisation de TGF-ß ?
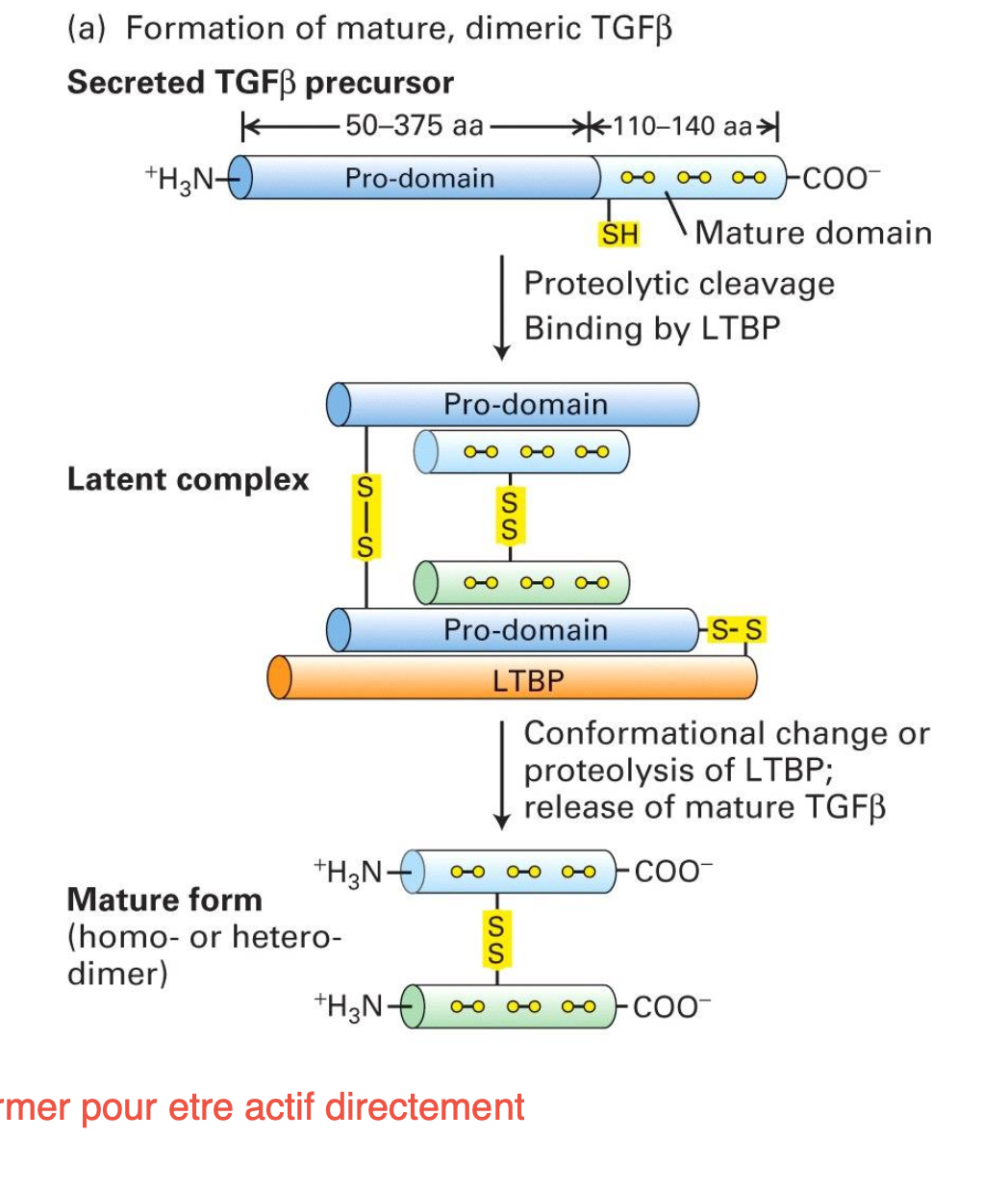
TGF-ß est très grand et a besoin de maturation par un procesus protéolytique.
La maturation donne un TGF-ß latent constitué de TGF-ß mature dimérique, son prodomaine précurseur et LTBP. Les domaines sont tous liés par des ponts disulfures donc reste inactif à cause de la liaison avec le pro-domaine et LTBP.
Comment est activé TGF-ß ?
libération du dimère TGF-ß avec le clivage protéolytique de la protéine LTBP dans le milieu extracellulaire à cause d’un changement local de pH e.g. lors d’une inflammation.
Comment est désactivé TGF-ß ?
Si le dimère TGF-ß se lie à un plusieurs protéine extracellulaire de la matrice