CM3: L'ENVIRONNEMENT INTESTINAL
1/3
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
4 Terms
im occ
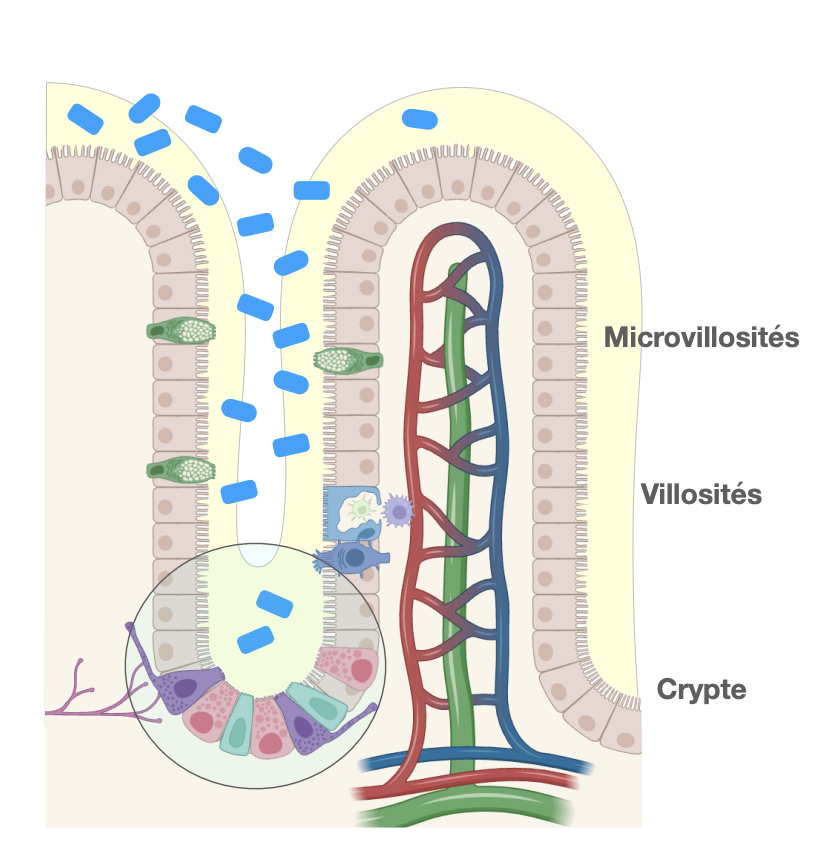
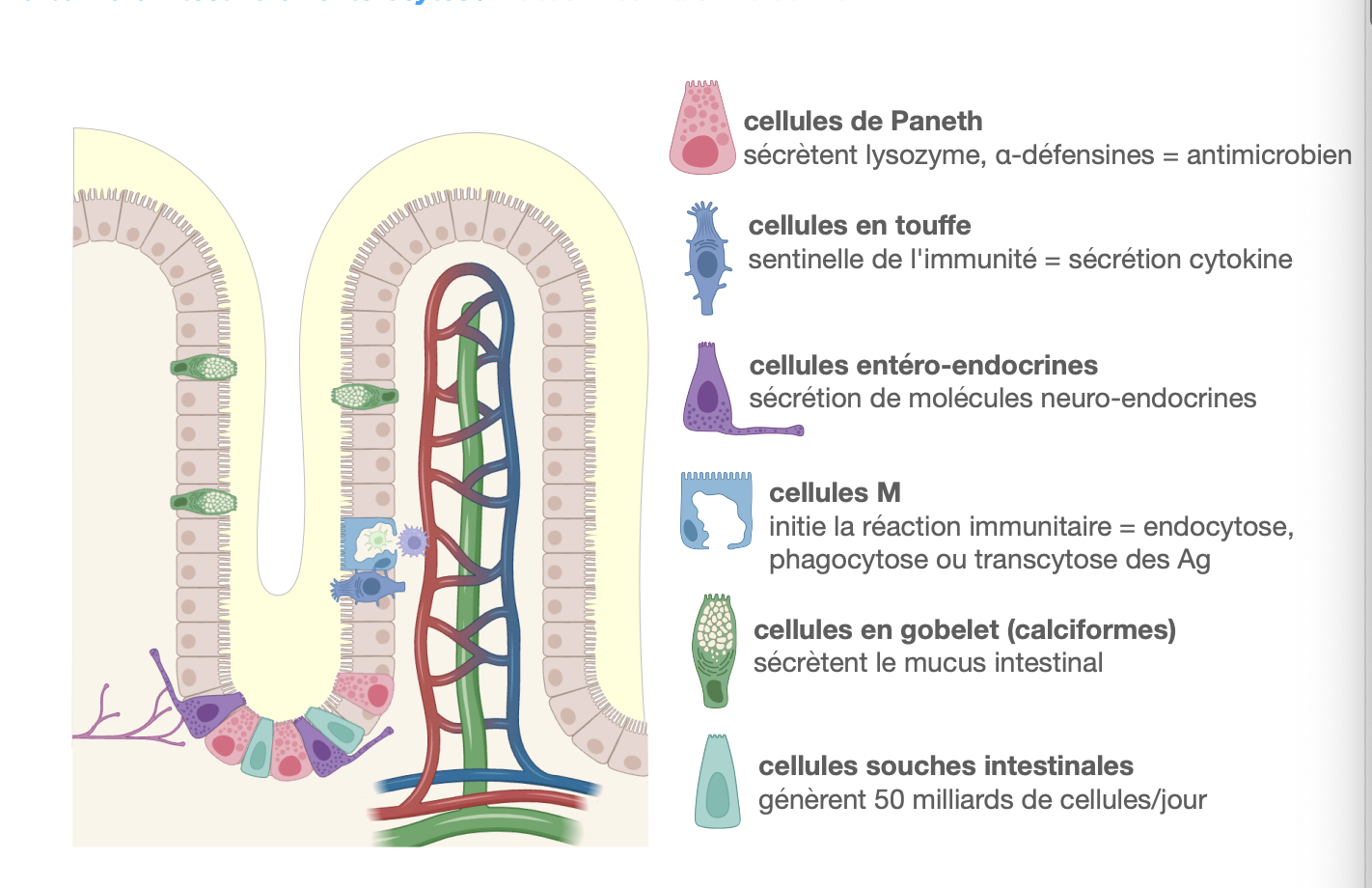
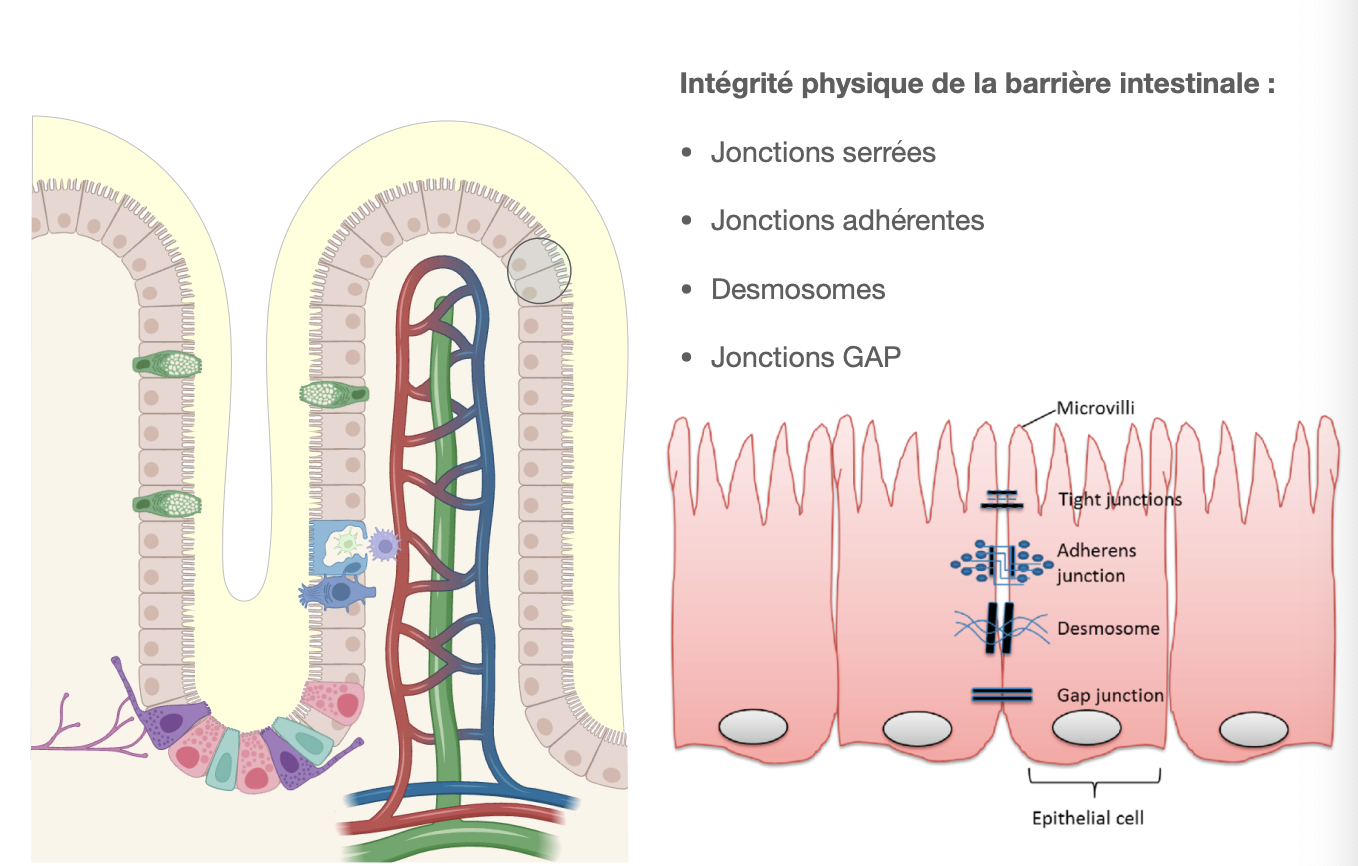
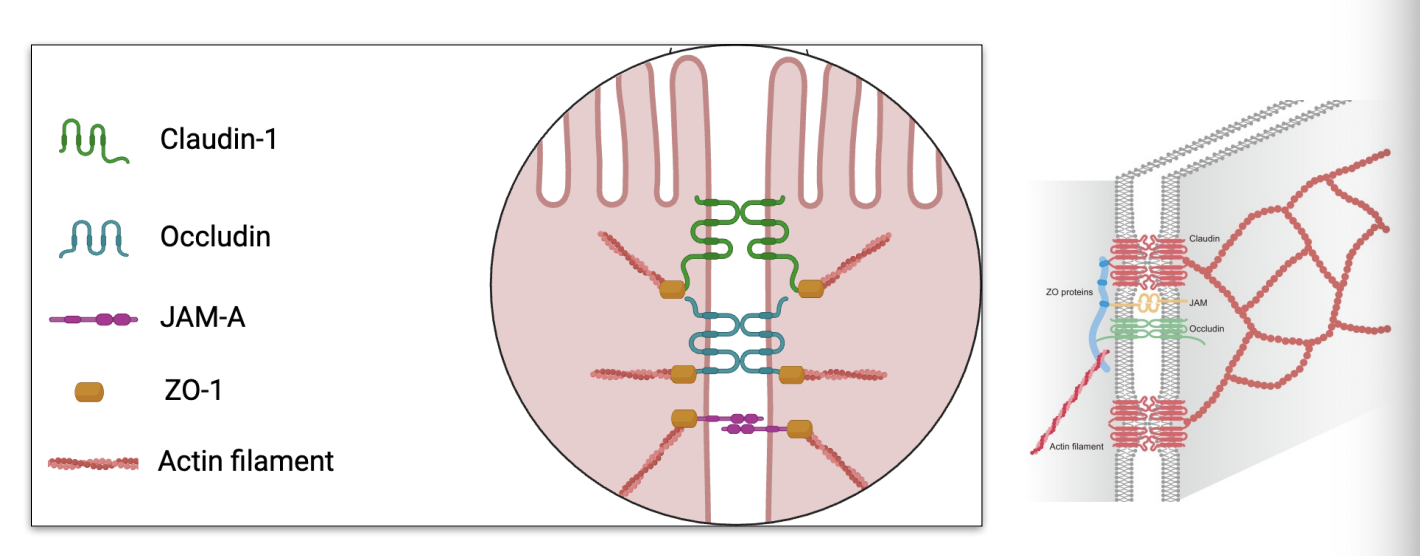
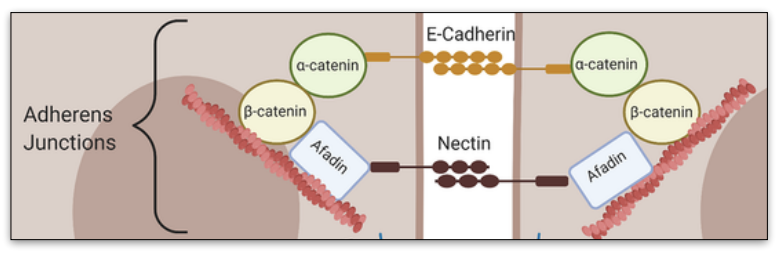
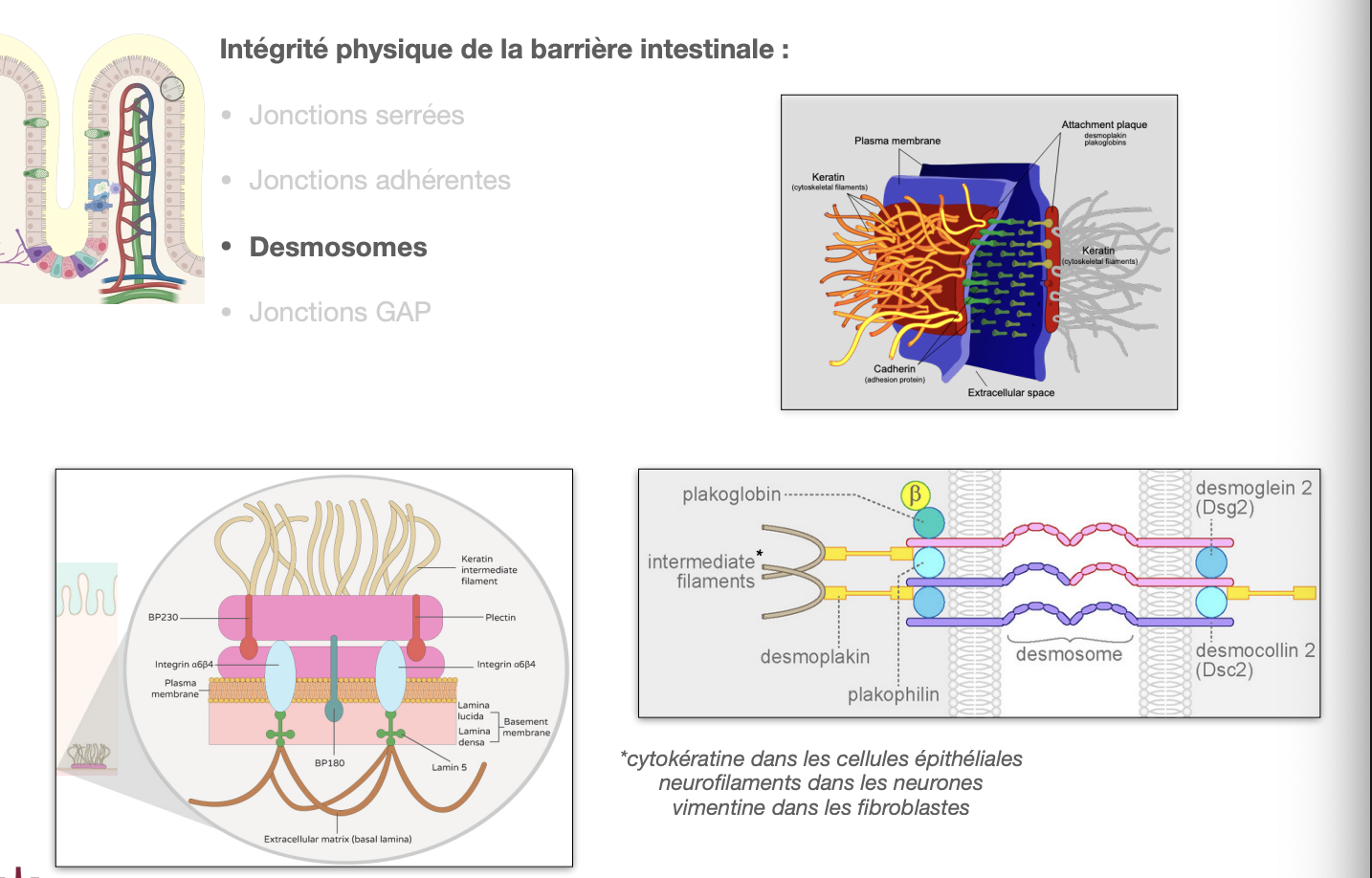
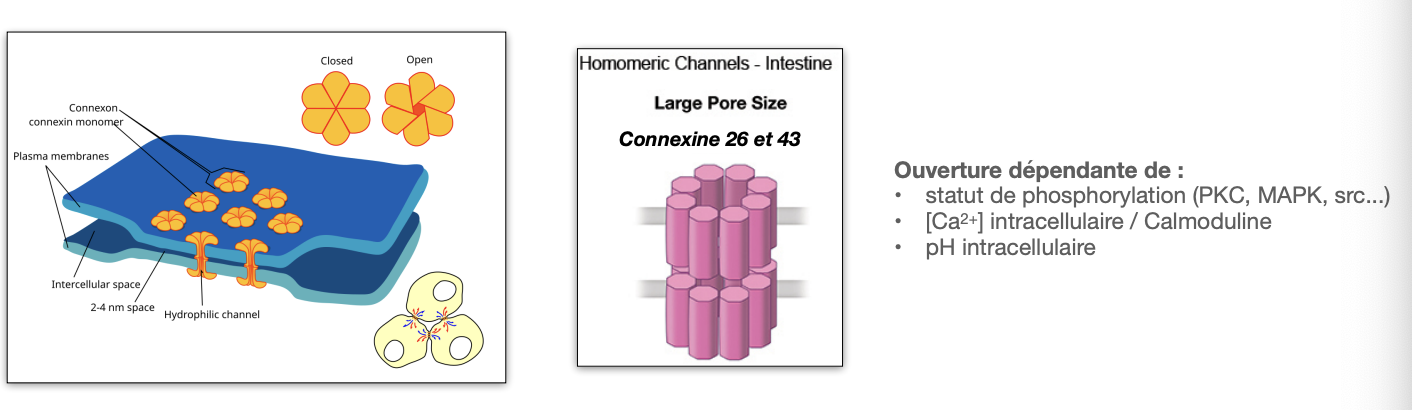
La barrière intestinale : entérocytes
Fonctionnalité de la barrière intestinale :
Quels sont les 5 principaux médiateurs assurant la fonctionnalité de la barrière intestinale ?
Rôle principal de la PGI₂ / prostacycline ?
Fonctions clés de la glutamine (Gln) ?
Effets majeurs du tryptophane (Trp) ?
Contributions du butyrate et du zinc (Zn) ?
PGI₂, Gln, Trp, butyrate, Zn : molécules nutritives ou signalétiques essentielles à la barrière intestinale, à la microcirculation et à l’immunité.
PGI₂ (prostaglandine de la famille des eicosanoïdes) — dérivée de l’acide arachidonique (C20:4) et sécrétée par les cellules entéroendocrines :
stimule la microcirculation (effet anti-apoptotique, ↑ NADPH, ↑ adhésion cellulaire via AMPc),
maintient la barrière épithéliale (jonctions serrées, survie cellulaire),
régule la motilité (ralentit le transit, favorise l’équilibre hydrosodé).
Glutamine — acide aminé semi-essentiel :
carburant des entérocytes, essentiel à leur croissance et survie (cycle de Krebs),
renforce la barrière intestinale (↑ claudine, occludine, ZO-1),
antioxydant (↑ G6PDH, NADPH, glutathion),
module l’immunité (↑ IgA, cytokines anti-inflammatoires).
Tryptophane (Trp) — acide aminé semi-essentiel :
métabolisé en indoles (voie microbienne), kynurénine (voie hôte), sérotonine (5-HT),
système immunitaire : indoles via AhR → ↑ IL-22, ↓ TNFα, IL-6 → effet anti-inflammatoire,
barrière intestinale : ↑ mucines, jonctions serrées,
fonction intestinale : la sérotonine module péristaltisme et sécrétion électrolytique.
Butyrate : acide gras à chaîne courte, carburant des colonocytes, maintient l’intégrité muqueuse du côlon,
↑ protéines de jonction (via AMPK, Akt), ↑ mucines,
anti-inflammatoire (↓ NF-κB, ↑ IL-10, ↑ Treg, ↑ IgA).
Zinc (Zn) : oligo-élément cofacteur enzymatique,
essentiel à la réparation cellulaire et à l’activité anti-oxydante,
maintient jonctions serrées (ZO-1), mucus, et sécrétion d’IgA,
renforce la résistance aux pathogènes et la régénération de l’épithélium.
La barrière intestinale : mucus intestinal
Quelles cellules produisent le mucus intestinal et où se situent-elles ?
Quelle est la composition et l’organisation du mucus intestinal ?
Quelles sont les principales mucines intestinales et leurs domaines structuraux caractéristiques ?
Quelles sont les étapes majeures de la biosynthèse des mucines ?
Quelles interactions assurent la formation du gel de mucus et sa fonction protectrice ?
1) Cellules productrices :
→ Les cellules caliciformes (ou cellules en gobelet), intercalées entre les entérocytes, sécrètent le mucus.
→ Elles sont particulièrement abondantes dans l’intestin grêle et le côlon.
→ Le mucus forme une double couche :
interne : dense, adhérente, sans bactéries,
externe : lâche, colonisée par le microbiote.
2) Composition et organisation :
→ Le mucus est constitué principalement de mucines (protéines hautement glycosylées), de glycolipides, d’électrolytes et d’eau.
→ Les mucines sont sécrétées sous forme compacte (neutralisées par Ca²⁺) puis gonflent après exocytose par changement de pH.
→ Ce réseau viscoélastique protège l’épithélium et sert de barrière physique, chimique et microbienne.
3) Mucines intestinales et structure :
→ Principales : MUC2 (majoritaire), MUC5AC, MUC5B, MUC6, MUC19.
→ Organisation :
Domaine N-terminal : riches en domaines vW (von Willebrand D1–D3) pour la multimerisation.
Région centrale : riche en chaînes O-glycosidiques (VNTR) formant des brins rigides hydrophiles.
Domaine C-terminal : contient cystine knot (CK) permettant la dimérisation.
→ Les O-glycanes sont formés de N-acétylgalactosamine, galactose et N-acétylglucosamine.
4) Biosynthèse :
→ Étapes :
Transcription du gène MUC → traduction de l’apomucine (dans le RE).
N-glycosylation et dimérisation dans le RE.
O-glycosylation dans le Golgi (ajout des chaînes sucrées).
Assemblage et empaquetage dans le TGN → granules de sécrétion.
Exocytose à la surface apicale → formation du réseau de gel.
5) Formation du gel et interactions :
→ Dans la granule : les mucines sont condensées par ponts ioniques Ca²⁺ entre groupements négatifs.
→ À l’exocytose, la chute de Ca²⁺ et le pH acide déclenchent un changement conformationnel exposant les domaines hydrophobes.
→ Le réseau de gel est stabilisé par :
liaisons covalentes (ponts disulfures),
liaisons hydrophobes,
ponts salins et interactions électrostatiques,
neutralisation des charges des glycanes.
→ Ce maillage forme une barrière protectrice dynamique, lubrifiante et imperméable aux pathogènes.
3. HÉTÉROSIDES (GLYCOPROTÉINES, PROTÉOGLYCANES, GLYCOLIPIDES) 🟩 PARTIE QUESTIONS
A. Généralités
29. Qu’est-ce qu’un hétéroside ?
30. Où sont-ils synthétisés et dégradés ?
B. Glycoprotéines
31. Quelle est leur localisation ?
32. Quelle différence avec les protéoglycanes ?
33. Quelles sont les deux formes de glycosylation ?
34. Où se déroule leur biosynthèse ?
35. Donne un exemple biologique.
C. Protéoglycanes
36. Quelle est leur structure ?
37. Quelle est la composition d’un GAG ?
38. Où se trouvent-ils ?
39. Cite quelques GAGs importants.
40. Quelle est la particularité de l’acide hyaluronique ?
D. Glycolipides
41. Quelle est leur composition ?
42. Quelle est leur fonction ?
A. Généralités
29. → Molécule contenant une partie glucidique (sucre) liée à une partie non glucidique (protéine ou lipide).
30. → Synthèse : REG + Golgi ; dégradation : lysosomes.
B. Glycoprotéines
31. → Membranaires ou sécrétées.
32. → Glycanes plus courts et ramifiés, non monotones.
33. → N-glycosylation (sur Asn) et O-glycosylation (sur Ser/Thr).
34. → RE (assemblage de la chaîne) → Golgi (trimming et extension des sucres).
35. → Déterminants antigéniques des groupes sanguins (A, B, O) via N-glycosylation de la protéine membranaire.
C. Protéoglycanes
36. → Protéine centrale liée à des chaînes linéaires de glycosaminoglycanes (GAGs).
37. → Répétition de disaccharides formés d’une hexosamine et d’un acide uronique, souvent sulfatés.
38. → Tissus conjonctifs, MEC, cartilage, peau, vaisseaux.
39. → Hyaluronate, chondroïtine sulfate, héparane sulfate, dermatane sulfate, kératane sulfate.
40. → Non sulfaté, forme des agrégats volumineux de protéoglycanes dans la MEC.
D. Glycolipides
41. → Oligosaccharide lié à un glycérol de diglycéride ou à une sphingosine (sphingolipide).
42. → Marqueurs de reconnaissance cellulaire et composants structuraux des membranes.