Le cytosol
1/50
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
51 Terms
Qu’est ce que le cytosol/hyaloplasme ?
phase liquide, translucide où baignent les organites mais aussi de nombreuses autres petites molécules.
Quelle est la différence entre cytoplasme et cytosol ?
Cytoplasme : cytosol + organites
Cytosol : uniquement la phase liquide (sans organites)
Que contient l’espace cytosolique non occupé par les organites ?
Le cytosquelette, les petites molécules, les vésicules, le système endosomal, lysosomal, phagosomes, etc…
Quels rôles joue le cytosquelette ?
Maintenir la forme de la cellule
Servir de transport intracellulaire
Assurer un système d’ancrage
Quelle proportion du volume occupe le cytosol dans une cellule classique ?
Environ 50% du volume, l’autre moitié étant occupée par les organites
De quoi est composé le cytosol ?
85% d’eau
AAs, acides gras, glycérol et sucres
ions (Na+ qté - , Potassium K+ qté ++, Cl-, Mg2+, Ca2+)
Gaz dissous (O2 et CO2)
inclusions lipidiques, glycogène (stockage sucres et lipides)
enzymes en très grand nombre, d’acides nucléiques et des nucléotides (ARNm ou ARNr).
protéines du cytosquelette organisés
Qu’est ce qui fait varier la viscosité du cytosol ?
interactions des protéines (fibreuses ou globulaires) :
interactions fortes : cytosol plutôt visqueux (consistance d’un gel)
interactions faibles : le cytosol plutôt fluide.
Comment se déroule la glycolyse dans le cytosol ?
glucose entre dans la cellule, et est rapidement transformé en glucose-6-phosphate
consomme de l’énergie par hydrolyse d’ATP
Se déroule exclusivement dans le cytosol en anaérobie
Quelles molécules peut synthétiser le cytosol ?
la totalité de ses propres protéines (enzymes, constituants du cytosquelette)
la majorité des protéines mitochondriales (protéines fonctionnelles et structurelles)
la totalité des protéines contenues dans le nucléoplasme
protéines extrinsèques de la membrane plasmique (celles sur la face cytosolique)
protéines G (capable d'hydrolyser le GTP)
Qu’est ce que le code génétique ?
Un dictionnaire qui associe les codons (triplets de bases de l’ARNm) aux acides aminés
Quelle est la seule partie variable dans un ARNm ?
Les bases azotées (A, U, C, G)
Combien existe-t-il de bases et d’acides aminés différents ?
4 bases pour 20 acides aminés
Quel est le codon initiateur universel ? et les codons stop ?
codon initiateur : méthionine (AUG)
codons stop : UAA, UAG, UGA
Quels acides aminés sont codés par un seul codon ?
La méthionine (AUG) et le tryptophane (UGG)
Quelles sont les 3 propriétés du code génétique ?
Universel : identique pour tous les organismes vivants (animaux, plantes, bactéries, virus)
Dégénéré : un même AA peut être codé par plusieurs codons. (troisième base qui diffère)
Non chevauchant : l’ARNm est lu codon par codon, triplet par triplet du point de départ au point de terminaison
Quel complexe permet la traduction des protéines ?
Les ribosomes
Comment fonctionnent ces ribosomes ?
recoivent des éléments nécessaires à la traduction dont les ARNt (apportent AAs) et l’ARNm (information qui sera à traduire)
Composé de 2 unités : la petite sous-unité et la grande sous-unité qui elle contient peptidyl transférase (enzyme capable d’accrocher successivement un AA à la chaîne polypeptidique en cours d’élaboration)
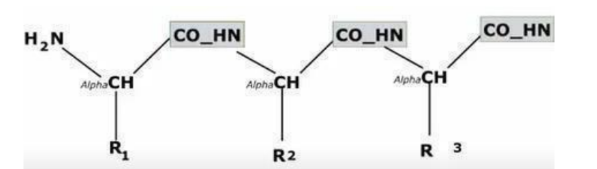
Qu’est ce qu’une chaine peptidique ? et quelles liaisons forment-elles ?
Succession d’acides aminés liés par des liaisons amide (CO-HN) entre l’extrémité COOH d’un premier AA avec l’extrémité NH2 de l’AA suivant.
Quelles sont les 3 étapes de la traduction ?
Initiation : assemblage du ribosome sur l’ARNm
Élongation : accrochage des AAs les uns aux autres via la formation de liaisons peptidiques
Terminaison : libération de la chaine polypeptidique
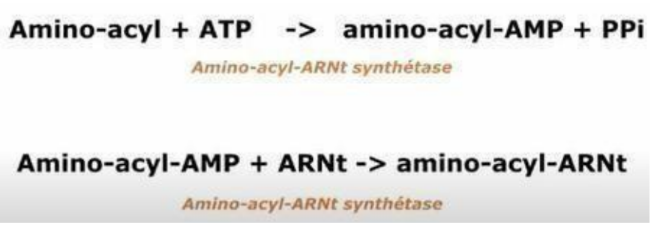
Comment se déroule l’activation de la méthionine durant l’initiation ?
activation de la méthionine : l’amino-acyl ARNt synthétase (enzyme) accroche la méthionine à un ARNt initiateur
enzyme utilise de l’ATP pour transformer l’AA d’abord en une molécule intermédiaire : amino-acyl-AMP (libère donc 2 pyrophosphates)
accroche l’acide aminé activé (amino-acyl) à l’extrémité 3’ de l’ARNt.
→ molécule prête à l’emploi : l’amino-acyl-ARNt (acide aminé fixé à son ARNt prêt à participer à la traduction)
Que se passe-t-il au niveau des ribosomes lors de l’initiation ?
Au début, les deux sous-unités du ribosome sont dissociées :
4 à 6 facteurs d’initiation (eIF4f, eIF4a et eIF4b) et une hélicase (enzyme ATP-dépendant) s’associent au niveau de la coiffe de l’ARNm (5’)
rejoints par la petite sous-unité associée à d’autres facteurs d’initiation : eIF2A + GTP + MET-ARNt
ensemble se place sur le site P et commence la lecture de l’ARNm via une hélicase
complexe rencontre un codon AUG → facteur eIF2A hydrolyse le GTP auquel il est lié → dissociation des facteurs d’initiation
grosse sous-unité se fixe à la petite sous-unité → complexe ribosomal de 80S fonctionnel.
Comment se déroule l’élongation ?
activation de l’amino-acyl ARNt (ARNt chargé) avec du GTP et deux facteurs eEF1
liaison de l’ARNt dans le site A du ribosome (petite sous-unité)
chaîne d’acides aminés qui était en construction sur le site P est transférée sur l’acide aminé du site A : transpeptidation (chaîne grandit de 1 acide aminé)
libération de l’ARNt (qui était sur le site P)
translocation du site A au site P grâce à eEF2 et hydrolyse du GTP
Comment se déroule la terminaison de la traduction ?
Ribosome arrive à un codon stop et s’arrete dans site A
facteur eRF se lie au codon stop et provoque l’hydrolyse du peptidyl- ARNt et libère le peptide dans le cytoplasme.
Quels facteurs d’addressage des protéines existe-t-il et vers où dirigent-ils cet addressage ?
SRP : réticulum
NLS : noyau
Quelles sont les différentes modifications de protéines réalisables par le cytosol ?
Phosphorylation-déphosphorylation
Enlèvement Méthionine
Méthylation, Carboxylation, Acétylation, Sulfatation de certains AAs
Glycosylation (O-glycosylation)
Accrochage d’acides gras
Conformation 3D et possibilité +/- dépliement par les protéines de choc thermique
Ubiquitination (= dégradation)
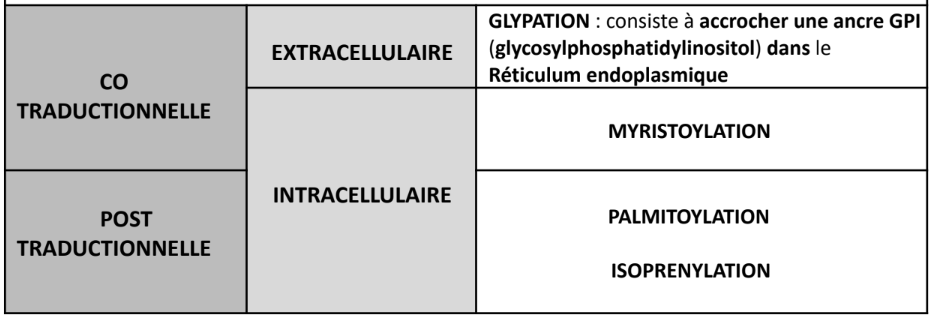
Quelles sont les différentes formes d’accrochage des acides gras ?
Quelles sont les caractéristiques des HSP ?
localisation variable
activité ATPasique sauf ubiquitine
Rôle dans intégrité des autres protéines cellulaires, adressage, modifications post- traductionnelles et dégradation des protéines.
Quelles sont les 2 types d’HSP qui existent ?
HSP constitutives : permanentes => ubiquitine
HSP inductibles : apparaissent lors de phénomène de stimulation ou de stress et sont absentes à l’état normal
Quelles sont les différentes fonctions des protéines HSP ?
acquisition de la forme tridimensionnelle des protéines
déshabillage des vésicules
dimérisation des récepteurs
Comment la protéine HSP assure-t-elle le déshabillage des vésicules ?
clathrine + adaptine = formation de vésicules par bourgeonnement
HSP 70 constitutive permet de retirer le manteau de clathrine de cette vésicule → peut se diriger vers d’autres compartiments
désassemblage du manteau permet aussi de recycler clathrine et adaptine
Comment les HSP assurent-elles la dimérisation des récepteurs nucléaires ?
Hormones stéroides (hydrophobes) traversent la membrane et se fixent sur HSP90 qui inactivent les récepteurs nucléaires
Complexe récepteur-hormone libère HSP90 → dimérisation des récepteurs et fixation ADN sur séquences HRE
→ Déclenche transcription gènes cibles
Comment les anti-hormones peuvent-elles inhiber cette voie de transmission ?
Empechent HSP de se détacher du récepteur → hormone ne peut pas se fixer
Empechent complexe hormone-récepteur de se fixer sur ADN → pas de transcirption
Bloquent directement la transcription
De quoi dépend la concentration d’une protéine ?
vitesse de synthèse
durée de vie
vitesse de dégradation
Quels sont les 2 types de protéases qui existent ?
protéases à pH acide (lysosomes)
protéases à pH neutre (protéasomes, exopeptidase, clipase, caspase)
De quoi dépend la durée de vie des protéines ?
nature du premier AA
présence de séquence spécifiques qui augmentent la vitesse de dégradation (PEST, D-Box)
AAs déstabilisants (Ile), moyennement déstabilisants (leu), stabilisants (mét/gly)
Quelle protéine est nécessaire à la dégradation par l’intermédiaire du protéasome ?
ubiquitine
Comment se déroule cette dégradation par le protéasome ?
Accrochage covalent de plusieurs molécules d’ubiquitine (sur lysine).
L’ubiquitine se fixe sur E1 → activation
Transfère sur E2 puis s’assemble à E3
E3 sélectionne la protéine à dégrader en fonction du coté N-ter
transfert de l’ubiquitine sur la protéine à dégrader
Adressage du substrat au protéasome (20S ou 26S) avec enzymes qui dégradent les protéines en petit peptides
recyclage de l’ubiquitine
transformation des petits peptides en acides aminés par les exopeptidases dans le cytosol
Quels sont les AAs résistants à la dégradation ubiquitaire ?
Méthionine
sérine
alanine
thréonine
glycine
cystéine
Quels sont les AAs favorisant la dégradation rapide ?
Arginine
lysine
histidine… (demi-vie ~30 min)
Dans quel autre mécanisme le protéasome joue-t-il un role important ?
Dans l’immunité (infections virales)
Quelles sont les étapes de cette dégradation virale par le protéasome ?
Fixation du pathogène sur un récepteur
Endocytose et formation d’une vésicule
Ubiquitinylation de cette vésicule et dégradation des prot virales en petits peptides par protéasome
Passage des peptides antigéniques vers RE où molécules CMH I les transportent vers membrane (exocytose)
Reconnus par récepteurs CD8 des lymphocytes T et activation du système immunitaire
Quelles autres protéines peuvent aussi etre dégradées par le protéasome ?
protéines cytosoliques avec des anomalies structurelles ou défaut d’addressage
Qu’est ce qu’une protéine G?
molécule capable de fixer du GTP/GDP et libérer des phosphates
synthétisées dans le cytosol et peuvent subir accrochage de résidus d’acide gras
Quelles protéines G ne néessitent pas l’accrochage d’acides gras pour leur activité fonctionnelle ?
dynamine
protéine SAR
Quels sont les 2 grands groupes de protéines G ?
grandes protéines G (hétérotrimériques)
petites protéines G (monotrimériques)
Quelles sont les caractéristiques des grandes protéines G ?
3 sous-unités
accrochage permanent à la membrane
associés à la membrane et participent aux flux de membrane
role dans la transmission de signaux hydrosolubles (couplés à RCPG à 7 domaines transmembranaires)
action irréversible
Quelles sont les caractéristiques des petites protéines G ?
Associées temporairement à la membrane
Rôle principal : hydrolyse du GTP
Plusieurs familles avec des rôles très différents :
ARF : bourgeonnement de vésicules, flux membranaire
Rab : flux membranaires, formation et transport des vésicules et mécanismes d’endocytose
Ras : activées par des récepteurs membranaires et agissent sur phénomènes de prolifération et de cycle cellulaire
Dynamine : fermeture et internalisation de vésicules à cavéoles et à clathrines lors de l’endocytose
Rho & Rac : organisation du cytosquelette
Pourquoi le calcium est-il important pour la cellule ?
Ses variations de concentration intracellulaire déclenchent de nombreux phénomènes cellulaires
Quelles protéines font intervenir le calcium pour fonctionner ?
Protéines contractiles
Où le calcium est il stocké ?
mitochondire
REG
Noyau
Golgi
Comment fonctionne la calmodulline ?
Se lie simultanément à 4 ions Ca2
Intervient dans la phorphorylation/déphosphorylation des protéines cytosoliques