Kaarten: biochemie H2: De chemie van de cel | Quizlet
1/21
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
22 Terms
Hoe kan een eiwit zich perfect opvouwen zodat het werkzaam is?
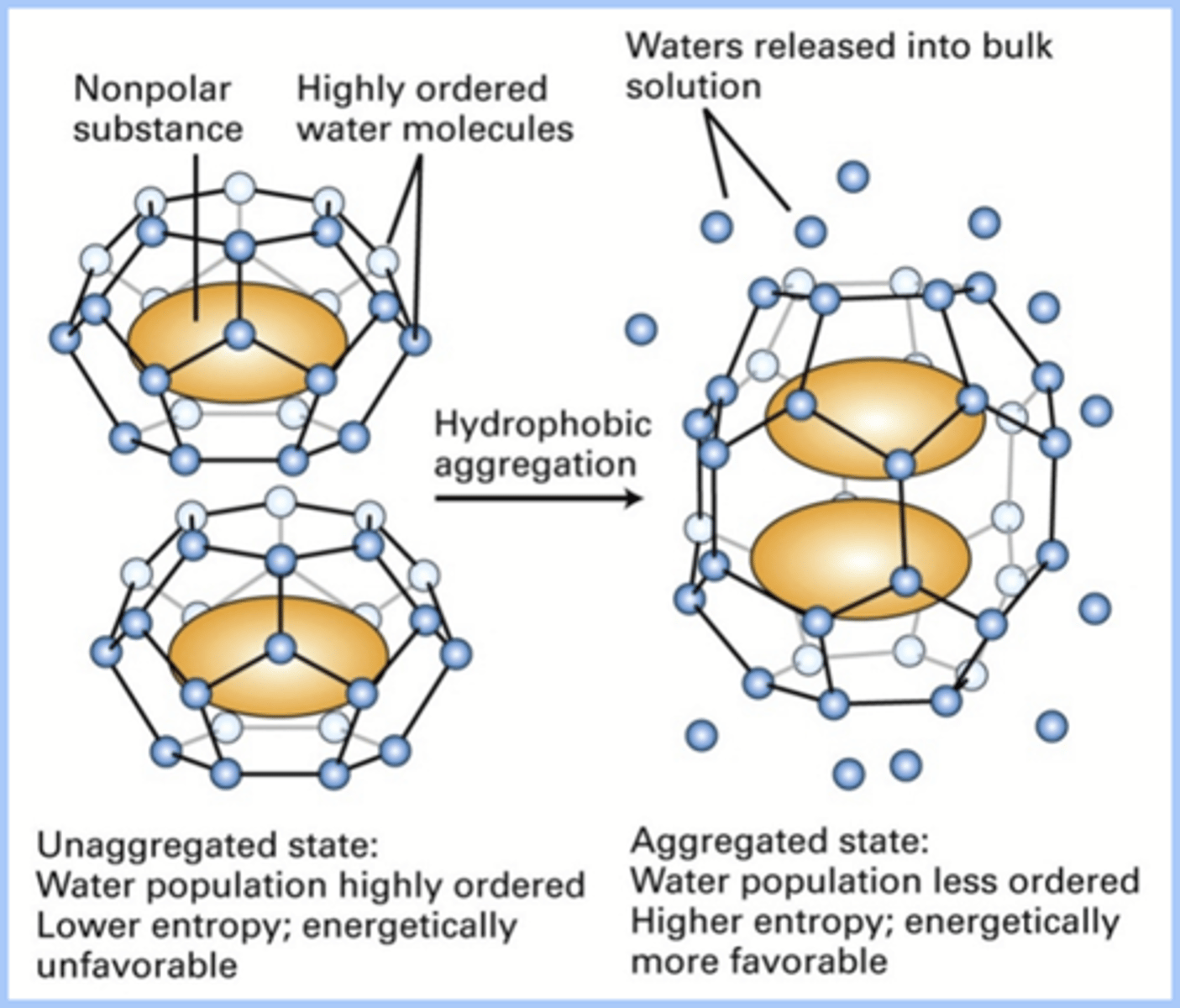
Door het hydrofoob effect -> zie foto (blauwe bolletjes zijn water
Een hydrofoob iets in water wilt graag zo ver mogelijk weg -> kooiachtige structuur
Spontaan gaat het water van 2 moleculen (kooien) elkaar opzoeken en H-bruggen vormen
Door de vorming van zoveel mogelijk niet-covalente interacties
-Hydrofobe interacties
-H-bruggen
-Ionische interacties
-Van der Waals interacties
->zie quizlet hoofdstuk 3!!
-> een macromolecule/polymeer krijgt spontaan zijn werkzame 3D structuur =zelf-assemblage
Wat bepaalt de chemische eigenschappen van een atoom?
Het aantal valentie-elektronen, de atomen met hetzelfde aantal VE staan op het PSE in de verticale groepen
->zelfde chemische eigenschappen maar verschillende massa
Wat kan je zeggen over covalente bindingen met Koolstof (C)?
Ze zijn heel stabiel -> er is veel bindingsenergie nodig om ze te breken
UV-licht (van de zon) kan covalente bindingen breken, zichtbaar licht kan dat niet
-> de ozonlaag houdt veel UV-licht tegen daarom dat we kunnen leven op aarde
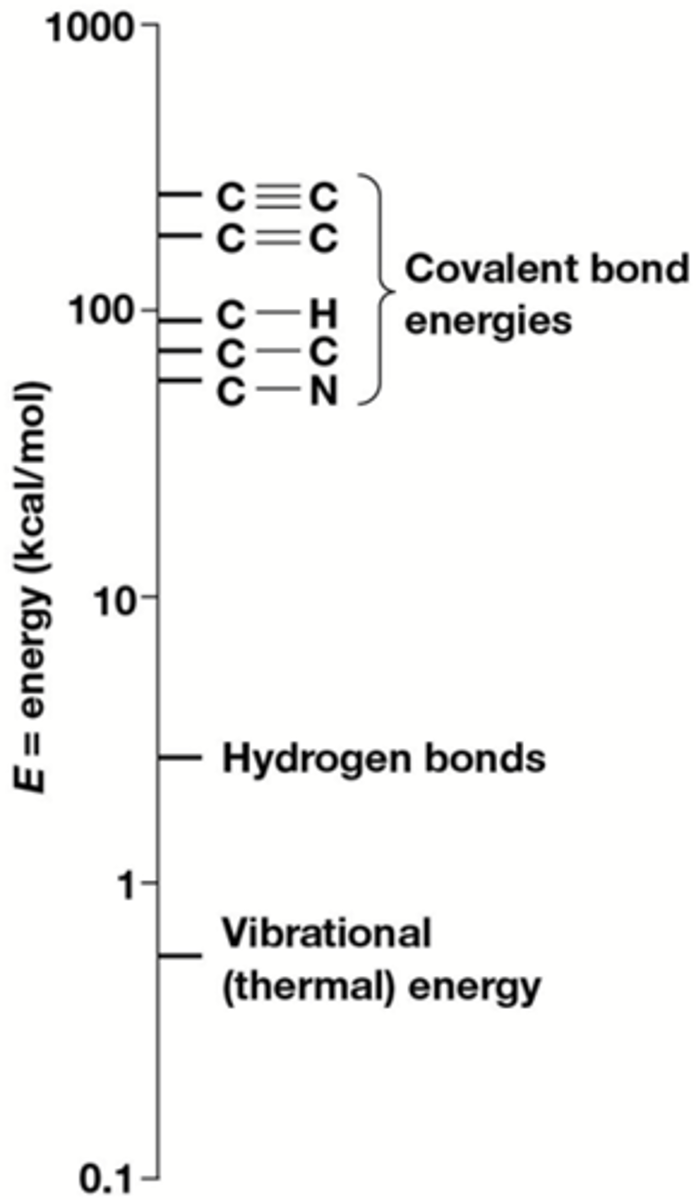
Wat is thermische energie?
energie van willekeurige beweging van atomen en moleculen
Wat is bindingsenergie?
de energie vereist om 1 mol bindingen te breken, uitgedrukt in (k)cal*/mol.
Bindingsenergieën :
-C-N, 70 kcal/mol
-C-O, 84 kcal/mol
-C-H, 99 kcal/mol
-C-C, 83 kcal/mol
-C=C, 146 kcal/mol
-C≡C, 212 kcal/mol
-> hoe meer bindingen hoe meer energie nodig om ze te breken
*een calorie is de hoeveelheid energie nodig om 1g water 1°C op te warmen
Wat zijn polaire bindingen?
Polaire bindingen zijn te wijten aan verschillen in elektronegativiteit tussen H, C en N, O, S.
Een polaire molecule heeft een positieve en een negatieve kant. Atoom met hoogste ENW= negatief, atoom met laagste ENW= positief.
Moleculen in een rooster plaatsen zich zo dat de nagatieve en postieve kanten naar elkaar gericht zijn (magneet). Deze krachten tussen die moleculen zijn dipoolkrachten. Het zijn zwakke elektrostatische aantrekkingskrachten
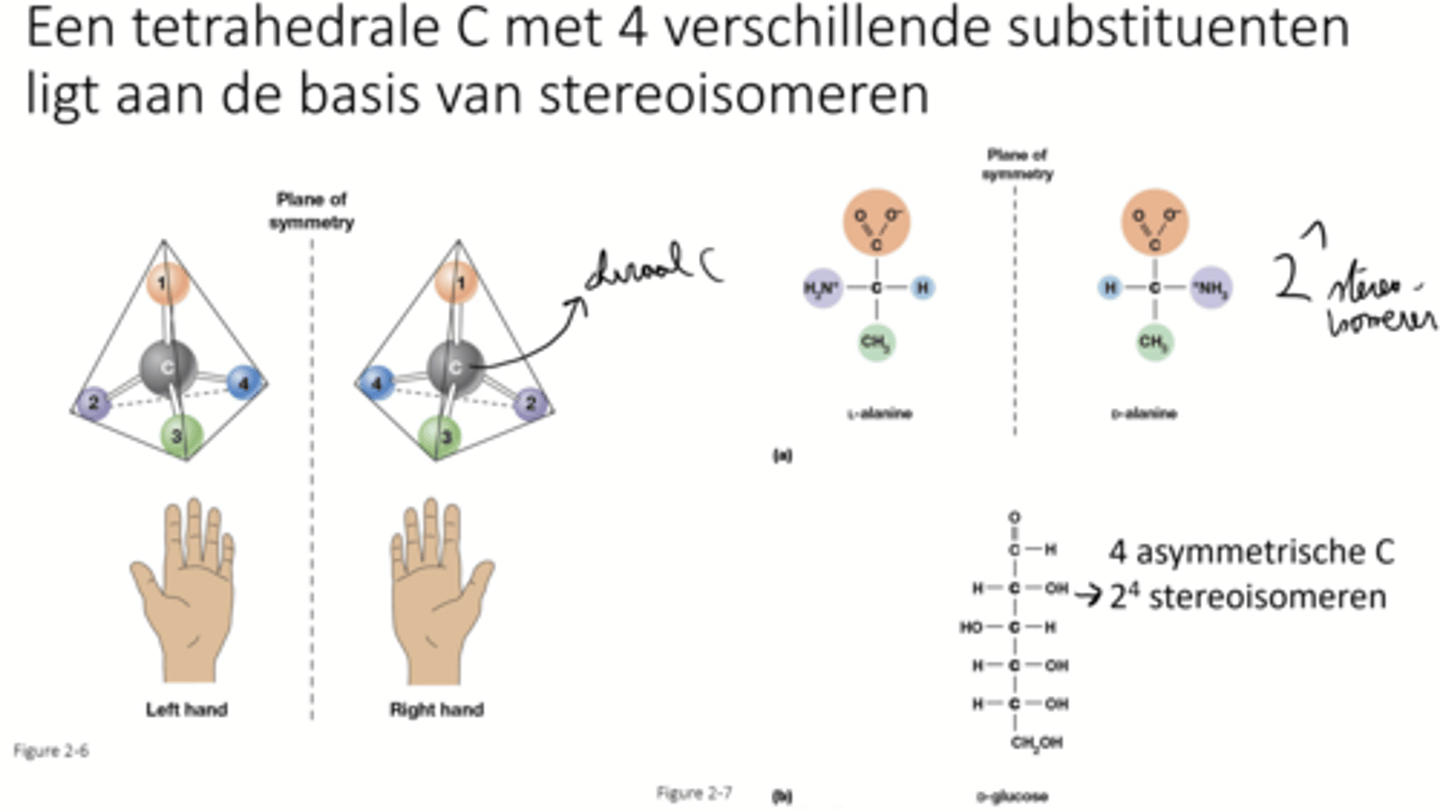
stereo isomeren
Wat is de solvent (oplosmiddel) van de cel?
Water
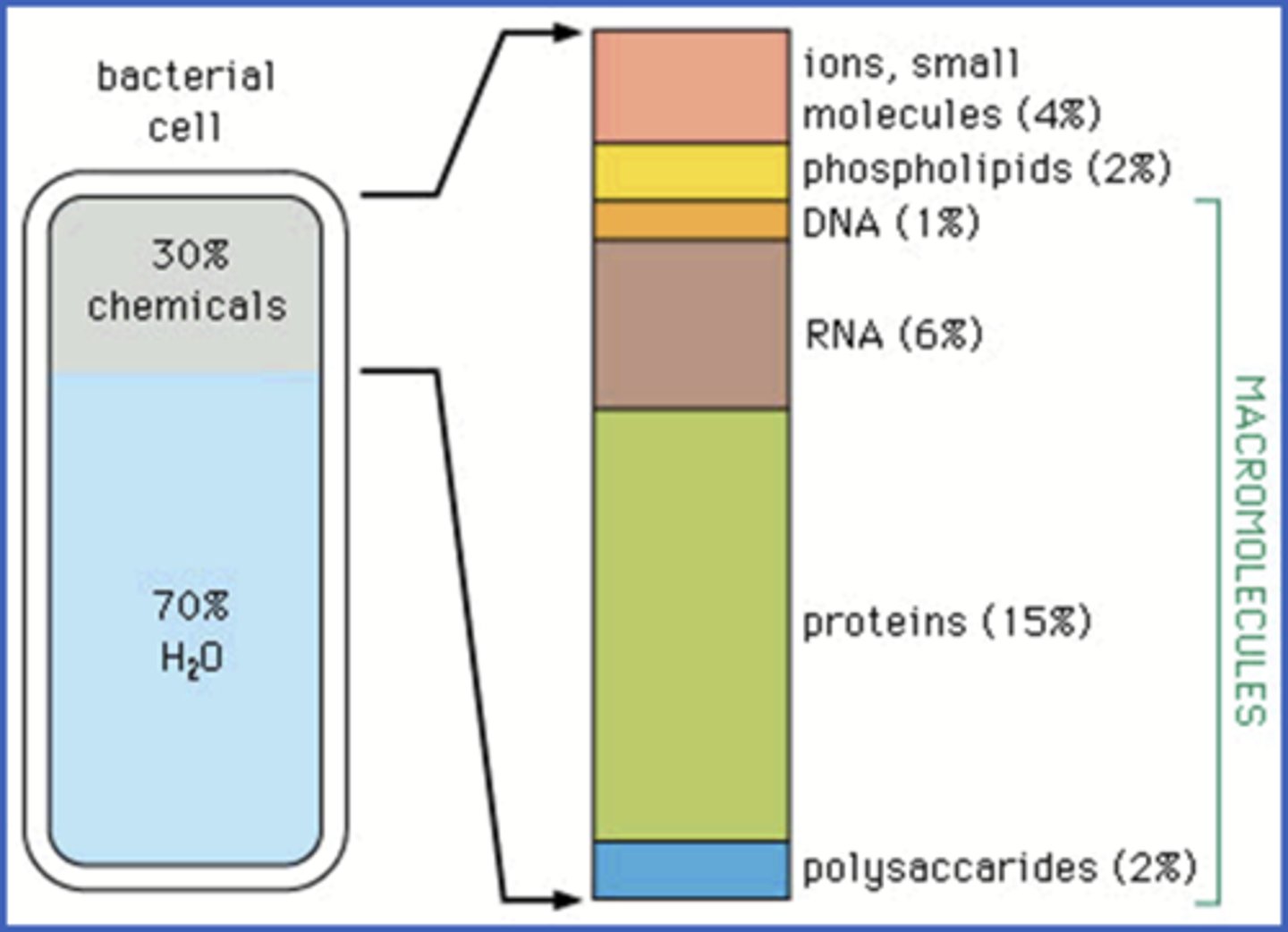
Wat kan je zeggen over het watermoleculen?
(hoekgrootte, polariteit, cohesie tussen watermoleculen?
De hoek van 104,5° bepaalt sterk het leven zoals we het nu kennen!
->Daarom is het een polair molecule
->Maakt waterstofbruggen (voorgesteld door blauwe puntjes) omdat er een positief en negatief deel is
->H-brug is geen covalente binding!
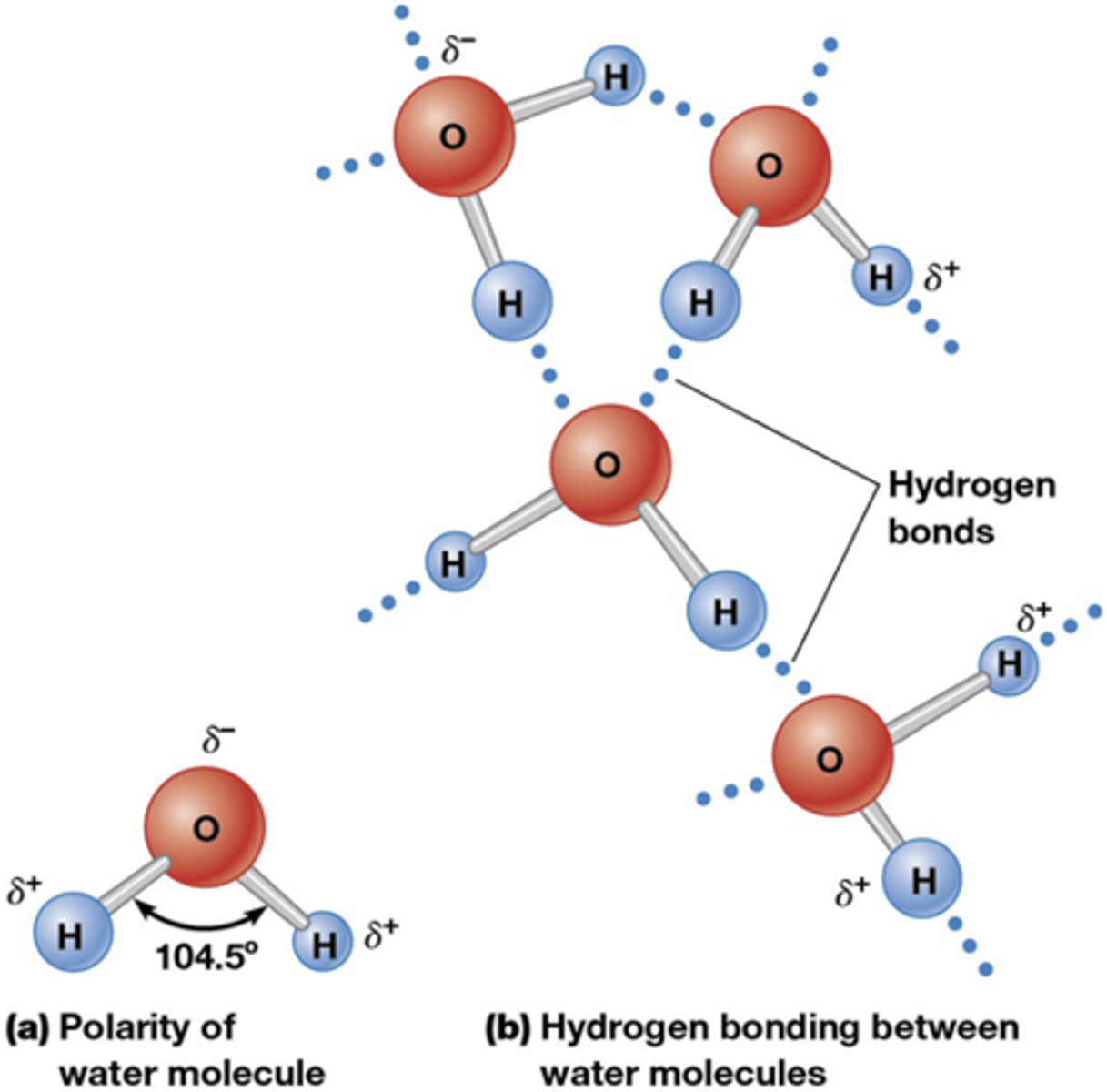
Wat zijn de gevolgen van de waterstofbruggen?
Hoge waarden voor:
-oppervlaktespanning
-kookpunt
-soortelijke warmte [warmte die moet geabsorbeerd worden om 1 g H2O 1°C op te warmen (1 cal/g)] => houdt de lichaamstemperatuur op peil want er is veel warmte verlies bij celademhaling
-verdampingswarmte [warmte die nodig is om 1g water te doen verdampen] => zweten is een uitstekend afkoelmiddel!
->Perfecte buffer om onze lichaamstemperatuur op peil te houden
![<p>Hoge waarden voor:</p><p>-oppervlaktespanning</p><p>-kookpunt</p><p>-soortelijke warmte [warmte die moet geabsorbeerd worden om 1 g H2O 1°C op te warmen (1 cal/g)] => houdt de lichaamstemperatuur op peil want er is veel warmte verlies bij celademhaling</p><p>-verdampingswarmte [warmte die nodig is om 1g water te doen verdampen] => zweten is een uitstekend afkoelmiddel!</p><p>->Perfecte buffer om onze lichaamstemperatuur op peil te houden</p>](https://knowt-user-attachments.s3.amazonaws.com/61e97fbd-23cf-429c-a42a-1598266a8383.png)
Wat doen hydrofiele, hydrofobe en amfipatische stoffen in water?
Hydrofiele stoffen: Ionen en polaire groepen (zoals OH, SH, C=O, NH₂) vormen waterstofbruggen en lossen op in water.
Hydrofobe stoffen: Niet-wateroplosbaar; verstoren de waterstructuur.
Amfipatische stoffen*: Hebben zowel een hydrofobe als polaire of geladen kant, wat hun interactie met water beïnvloedt.
*Een amfifiele of amfipatische verbinding bevat zowel hydrofobe als hydrofiele eigenschappen. Algemene amfifiele stoffen zijn zeep, detergenten en lipoproteïnen.
pH en bufferwerking van water
pH: -log [H⁺]; de zuurgraad van een oplossing (pH water = 7)
pKa: -log Kₐ
Henderson-Hasselbalch vergelijking:
pH = pKa + log [A⁻]/[HA]
-> Gebruikt om de pH van een buffersysteem te berekenen.
-> hoe dichter een buffer bij de fysiologische pH (7,35 - 7,45) zit hoe beter de buffer in ons lichaam werkt
->water kan dus als buffer werken
HA staat voor het ongeïoniseerde zuur (de vorm die nog een proton, H⁺, vast heeft). Dit is de protondonor in het zuur-basereactie.
A⁻ staat voor de geconjugeerde base (de vorm waarin het zuur een proton heeft afgegeven). Dit is de base die ontstaat nadat HA zijn H⁺ heeft afgegeven. (chatgpt)
![<p>pH: -log [H⁺]; de zuurgraad van een oplossing (pH water = 7)</p><p>pKa: -log Kₐ</p><p>Henderson-Hasselbalch vergelijking:</p><p>pH = pKa + log [A⁻]/[HA]</p><p>-> Gebruikt om de pH van een buffersysteem te berekenen.</p><p>-> hoe dichter een buffer bij de fysiologische pH (7,35 - 7,45) zit hoe beter de buffer in ons lichaam werkt</p><p>->water kan dus als buffer werken</p><p>HA staat voor het ongeïoniseerde zuur (de vorm die nog een proton, H⁺, vast heeft). Dit is de protondonor in het zuur-basereactie.</p><p>A⁻ staat voor de geconjugeerde base (de vorm waarin het zuur een proton heeft afgegeven). Dit is de base die ontstaat nadat HA zijn H⁺ heeft afgegeven. (chatgpt)</p>](https://knowt-user-attachments.s3.amazonaws.com/f7cc3983-0297-4d4c-bd56-4b21ad9647a9.png)
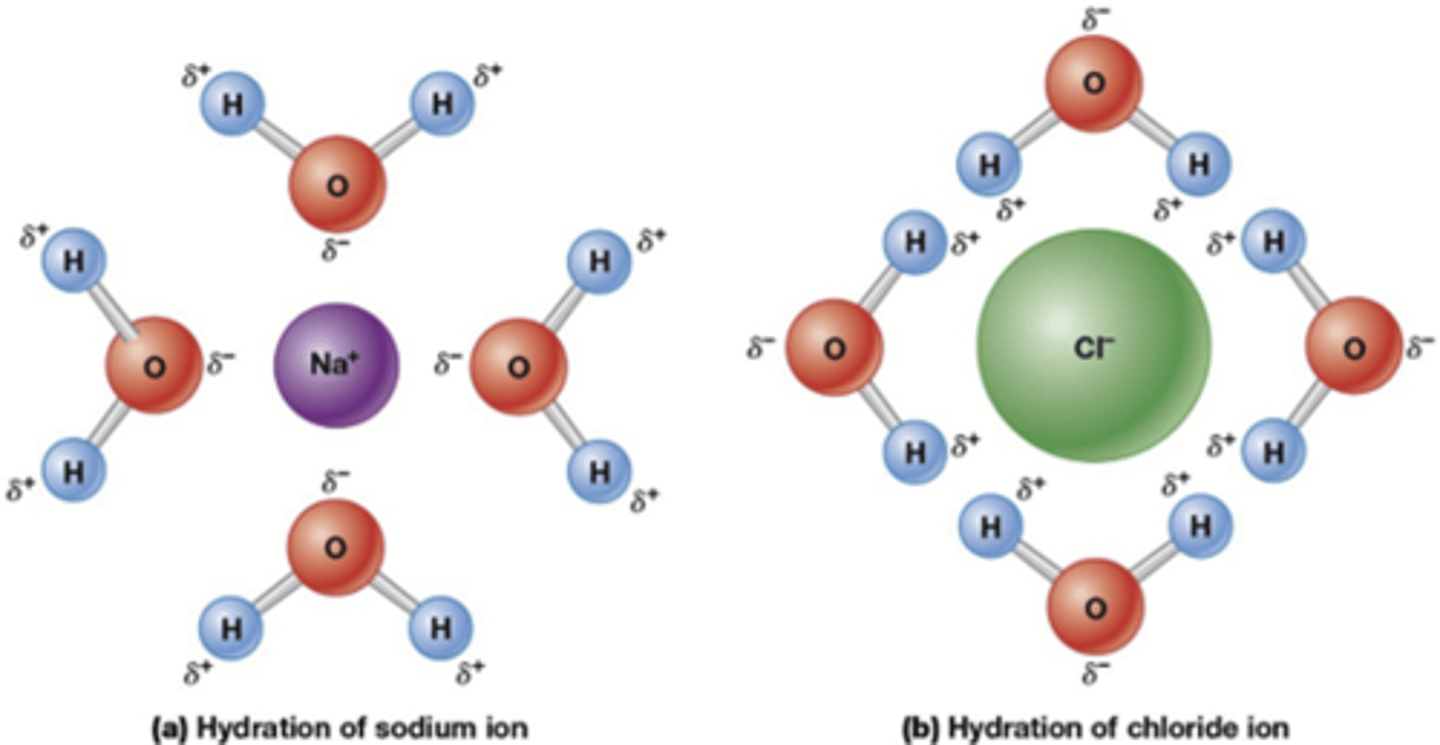
Hoe werkt MRI?
Door een oscillerend magnetisch veld aan en af zetten, die energie wordt elke keer losgelaten
-> radiogolven die we detecteren
De snelheid van de energie heeft te maken met het aantal water in de cel
-> meer/minder water in tumoren dan in gezond weefsel en zo kunnen we deze zien
Een MR of MRI (Magnetische resonantie / Magnetic Resonance Imaging) is een onderzoekstechniek die gebruik maakt van sterke magneetvelden en radiogolven (geen röntgenstraling) om organen en andere lichaamsweefsels gedetailleerd in kaart te brengen.
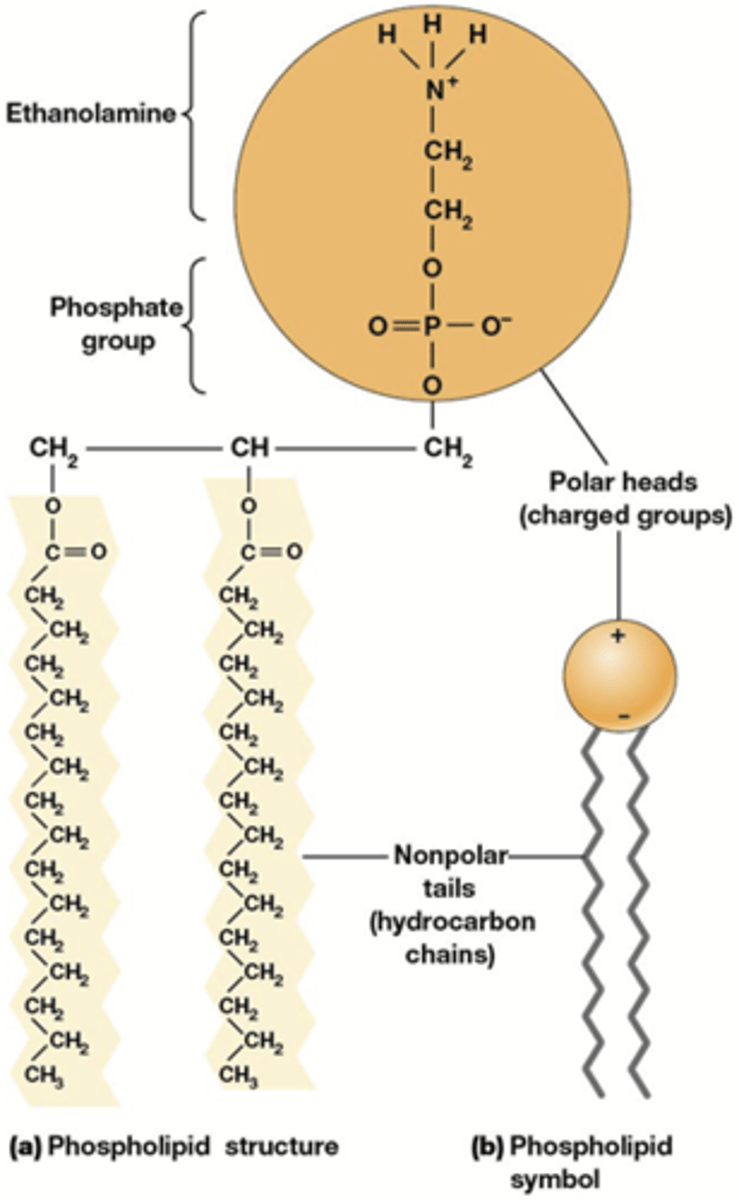
celmembraan
Fysieke barriere tussen cel(organel) en omgeving
-> vormt een selectief permeabele barriere
= vormen een lipidendubbellaag (7-8 nm)
Cellulaire membranen bestaan hoofdzakelijk uit fosfolipiden, glycolipiden, membraaneiwitten en sterolen* (vb. cholesterol in dierlijke cellen).
= amfipatische moleculen
*zie celbio
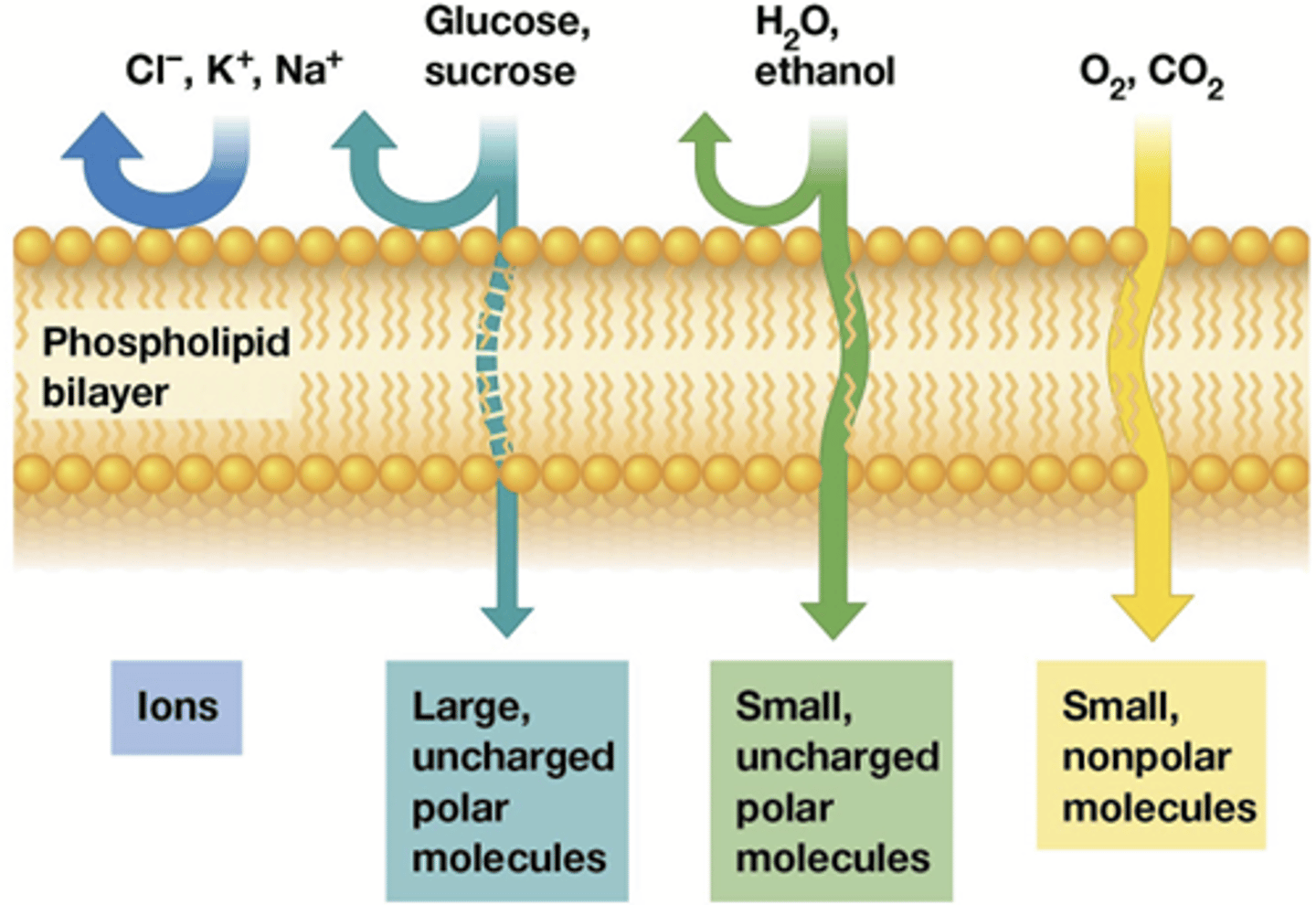
Wat kan er wel en wat kan er niet door de selectief permeabele lipidendubbellaag (zie ook celbio H2)
enkel kleine apolaire moleculen!
-geladen (ionen geraken er nooit door) < ongeladen
-groot < klein (Mr < 100)
-vaak transporteiwitten nodig voor geladen ionen
Als de protonen erdoor zouden kunnen zou er geen gradient kunnen ontstaan en zou celademhaling niet werken
wat zijn mono- en polymeren?
Monomeren zijn de kleine, enkelvoudige moleculen die als bouwstenen fungeren voor grotere structuren. Een monomeer kan zich binden met andere monomeren door chemische bindingen om polymeren te vormen.
Polymeren/macromoleculen zijn grote moleculen die bestaan uit herhalende eenheden van monomeren die chemisch aan elkaar zijn verbonden. Een polymeer kan honderden tot duizenden monomeren bevatten. Ze worden gesynthetiseerd (gemaakt) door polymerisatie
Voorbeelden:
Monomeer: Glucose is een monomeer van zetmeel.
Polymeer/macromolecule: Zetmeel is een polymeer dat bestaat uit vele glucosemoleculen aan elkaar gekoppeld.
Wat heb je nodig voor polymerisatie?
-Monomeren
-energie
-in het geval van nucleinezuren (ook een polymeer) en eiwitten (ook een polymeer van aminozuren) ook nog erfelijke informatie nodig!
Afbraak (hydrolyse) van macromoleculen vereist geen energie! (wel water)
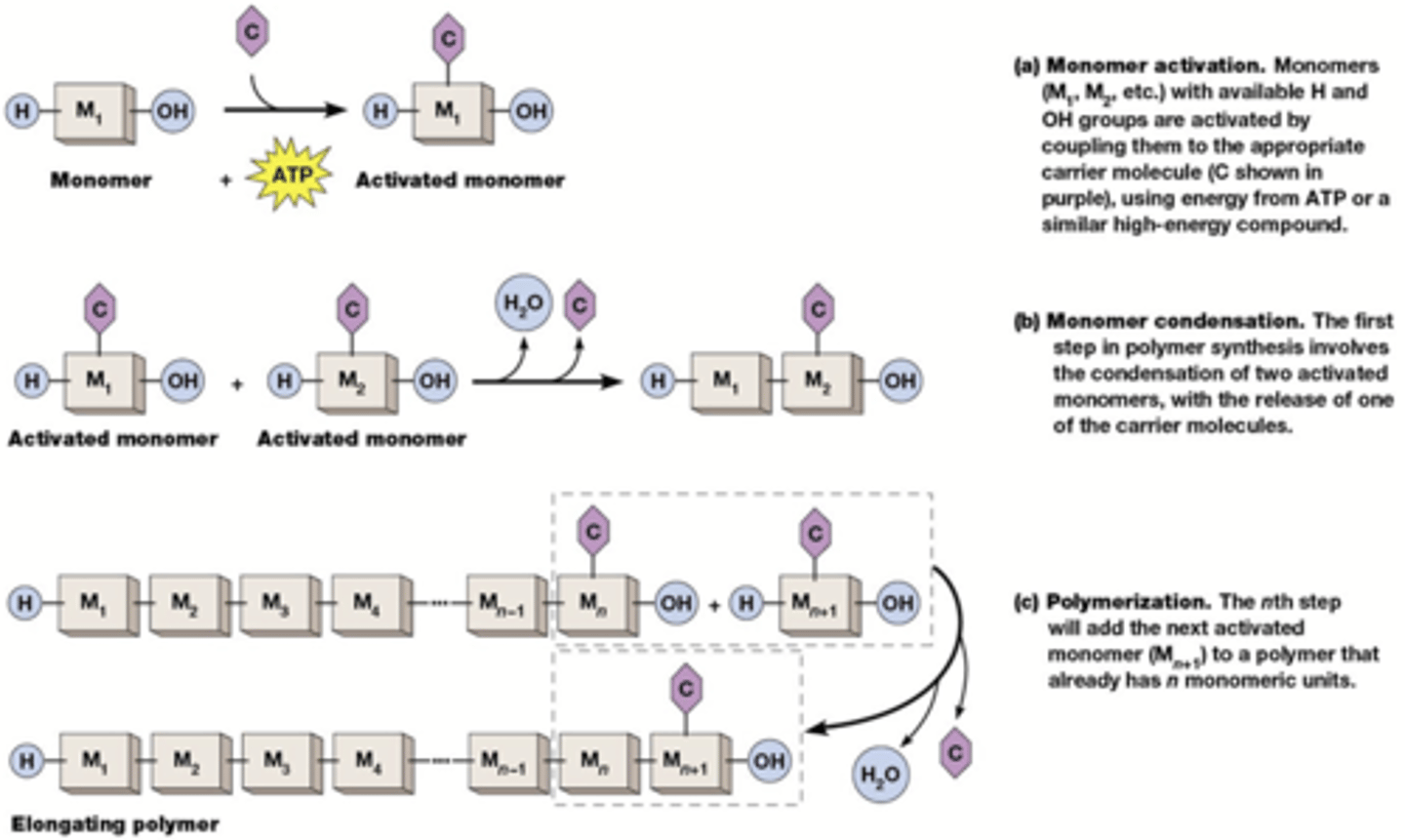
Hoe worden macromoleculen gesynthetiseerd?
De monomeren worden geactiveerd om condensatie mogelijk te maken. Activatie vereist een koppeling aan een carrier (tRNAs voor eiwitsynthese, ADP of UDP voor suikers, (d)NTP''s (ATP GTP CTP UTP TTP) voor nucleïnezuren).
Condensatie met eliminatie van een molecule water (condensatiereactie). De energie voor koppeling is uiteindelijk afkomstig van ATP of een andere energierijke verbinding.
Macromoleculen hebben een directionaliteit: de chemie aan beide uiteinden is verschillend.
Hoe kan de 3D structuur kapot gaan?
temperatuur, pH (dissociatiereacties tussen zuren en basen),
zout, ureum, alcohol, … => denaturatie= de natieve conformatie verandert

In de werkelijkheid krijgen eiwitten hulp bij de vouwing, leg uit
Door moleculaire chaperonen=eiwitten die het vouwingsproces helpen
-Ongeveer 1/3 van de E. coli eiwitten kan niet correct vouwen zonder hulp van chaperonen.
-Chaperonen helpen eiwitten om correct te vouwen zonder zelf deel uit te maken van de uiteindelijke structuur.
-Ze binden tijdelijk aan eiwitten tijdens vouwing om incorrecte structuren te voorkomen.
-Chaperonen zijn belangrijk in stresssituaties (bijv. koorts) om eiwitten te beschermen tegen denaturatie.
-ze hebben geen extra informatie
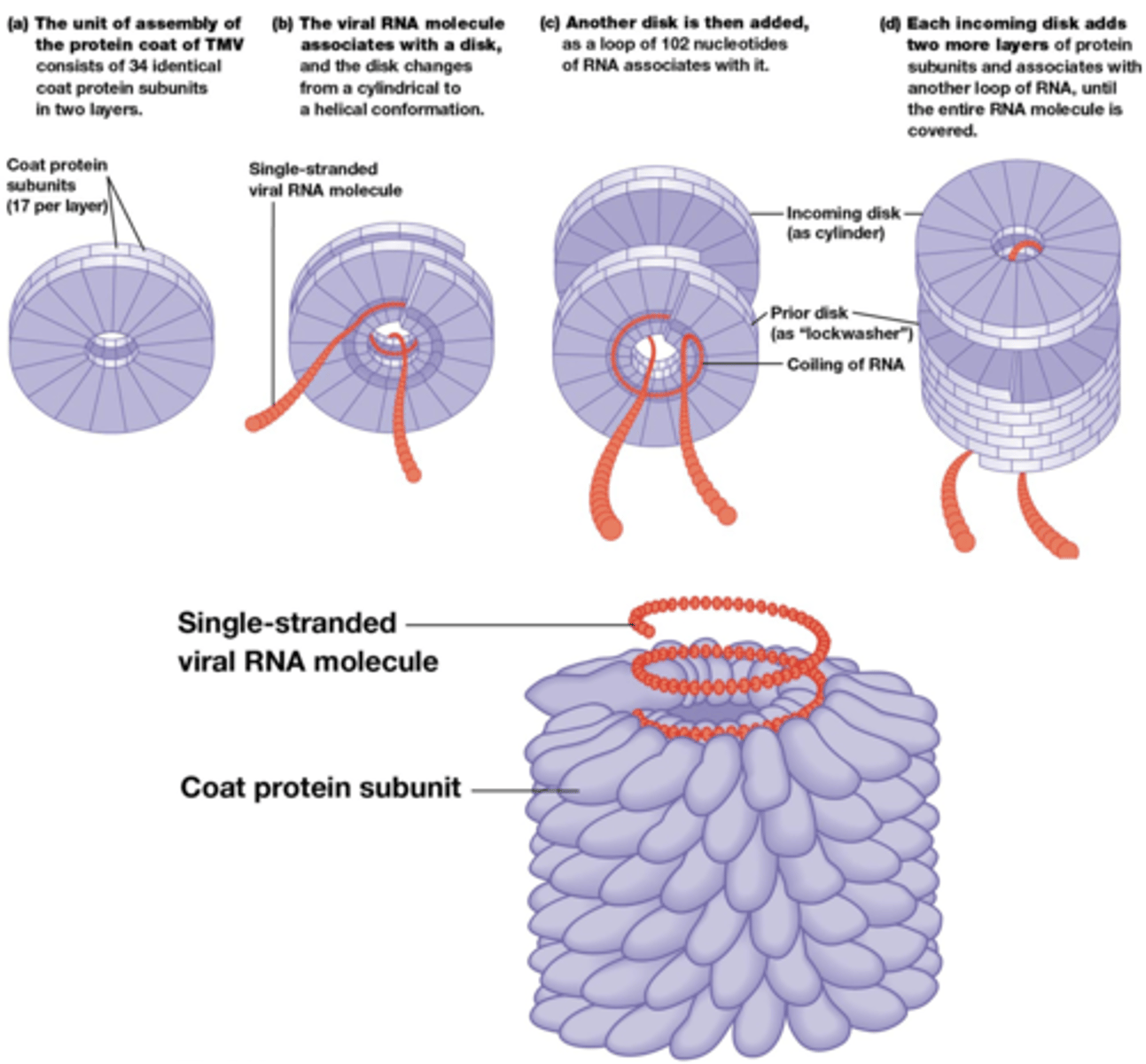
Welke complexere structuren doen aan zelf-assemblage?
Ribosomen
Membranen
Virussen
foto: Tabak mozaïek virus (rna en manteleiwitten in een ploegbuis en je krijgt het tabak mozaiek virus)
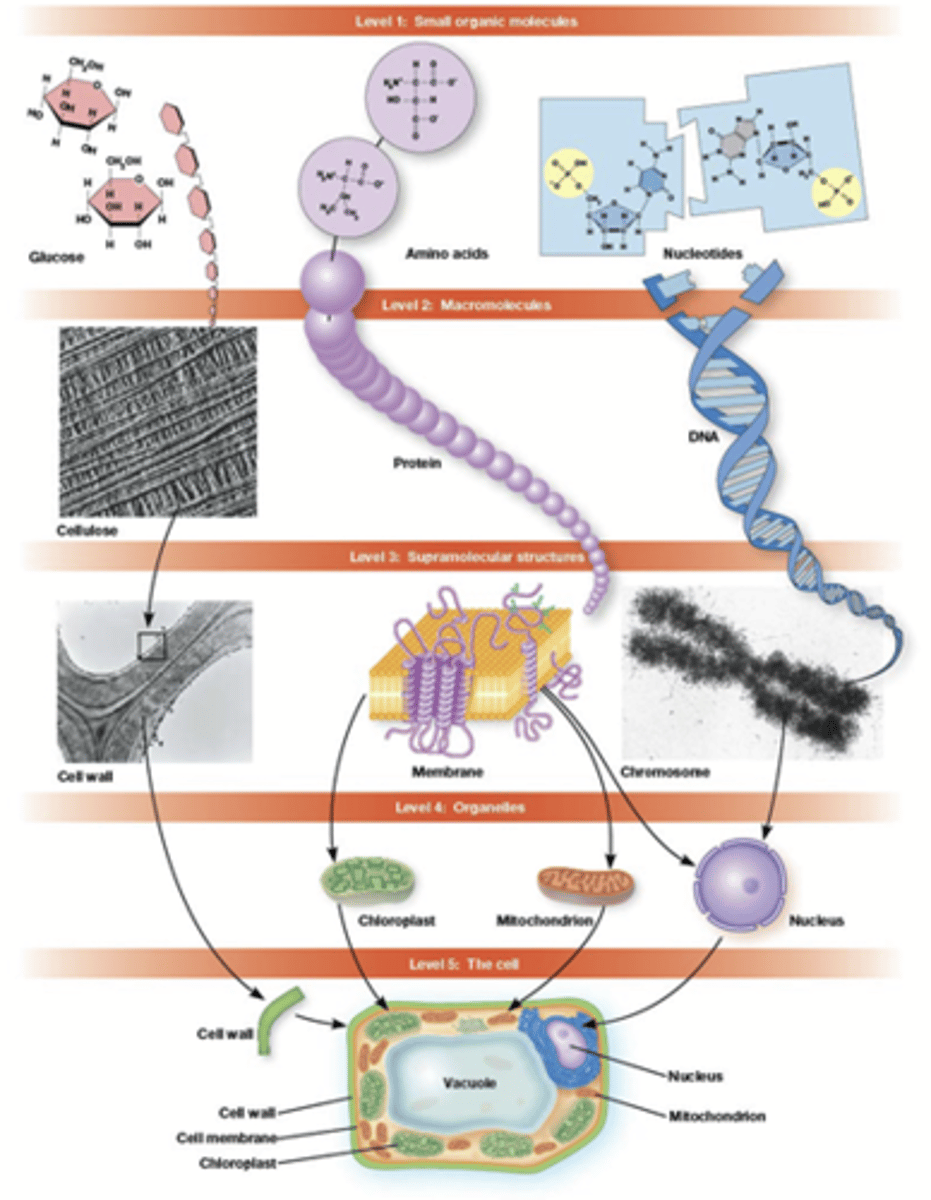
Wat is de hierarchische assemblage?
kleine macromoleculen -> iets complexere moleculen -> nog complexere moleculen
slechts ongeveer 30 kleine precursor moleculen:
20 AZ, 5 basen, suikers, lipiden ...
toch bestaat de hele cel uit deze complexe structuren
Dit systeem garandeert een kwaliteit; bij elke stap wordt een kwaliteitscontrole uitgevoerd (bv: bij DNA-replicatie)