POJMY - STAVBA ELEKTRONOVÉHO OBALU
1/14
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
15 Terms
ORBITAL
elektron má duální charakter, tedy chová se jako částice i jako vlnění nelze popsat přesnou polohu
prostor ve kterém se s 96% pravděpodobností nachází elektron
popisován kvantovými čísly
KVANTOVÁ ČÍSLA
HLAVNÍ KVANTOVÉ ČÍSLO
VEDLEJŠÍ KVANTOVÉ ČÍSLO
MAGNETICKÉ KVANTOVÉ ČÍSLO
SPINOVÉ KVANTOVÉ ČÍSLO
HLAVNÍ KVANTOVÉ ČÍSLO
značíme n, jeho hodnota je rovna periodě, ve které daný prvek leží
určuje energii elektronu v atomu, příslušnost k jedné z energetických vrstev
Nabývá hodnot l až nekonečno, čísel přirozených
Elektrony se stejným n tvoří elektronovou vrstvu (slupku)
VEDLEJŠÍ KVANTOVÉ ČÍSLO
značíme l, nabývá hodnot od 0 po n-1 (pouze celá čísla)
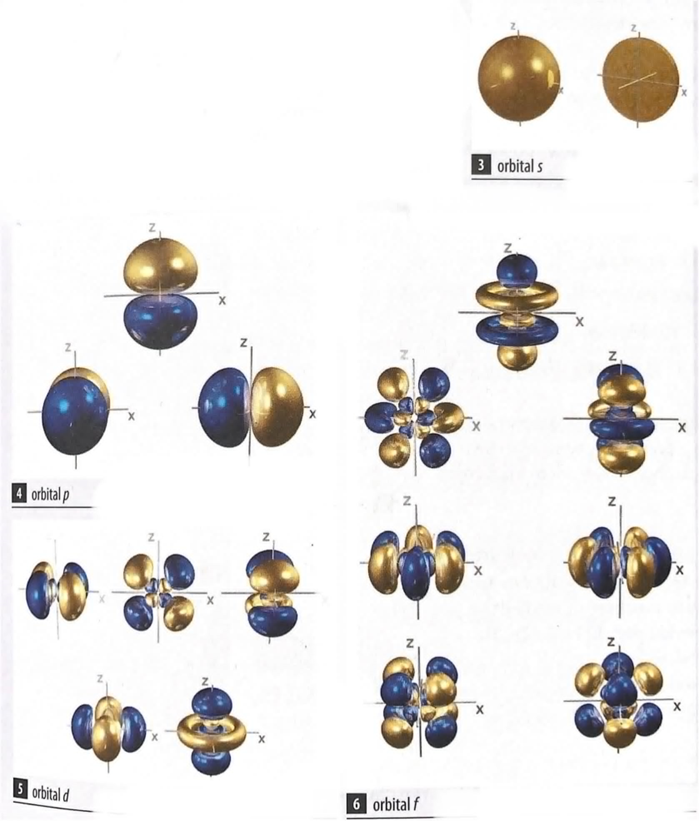
určuje tvar a E orbitalu:
- 0 s orbital (koule)
- 1 p orbital (prostorová osmička)
- 2 d orbital (dvě prostorové osmičky)
- 3 f orbital (složitý tvar)
- 4,5,6 není definováno
MAGNETICKÉ KVANTOVÉ ČÍSLO
značíme m, nabývá hodnost od -l do +l
určuje orientaci orbitalu v prostoru
degenerované orbitaly = orbitaly, které mají stejné hlavní, vedlejší kvantové číslo a liší se pouze magnetickým kvantovým číslem
pro l=0 m=0, pro l=1 m = -1,0,+1,…
SPINOVÉ KVANTOVÉ ČÍSLO
značíme s, nabývá hodnot +-1/2
určuje vnitřní moment hybnosti elektronu (rotaci)
pro dva elektrony v jednom orbitalu bude nabývat opačné hodnoty pro každý z nich
ORBITALY
Orbital s – kulovitě symetrický, pro dané n existuje jeden orbital s
Orbitaly p – má 3 možné prostorové orientace, pro dané n existují 3 orbitaly p
Orbitaly d – má 5 možných prostorových orientací, pro dané n existuje 5 orbitalů d
Orbitaly f – má 7 možných prostorových orientací pro dané n existuje 7 orbitalů f
VALENČNÍ ELEKTRONY
el., které se nacházejí v nejvyšší energetické vrstvě atomového obalu
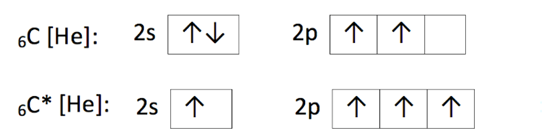
EXCITACE
nucené vypuzení elektronu do vyšší energetické vrstvy, označuje se * u značky prvku
IONIZACE
proces vzniku iontu, odebrání el.- kationt, dodání el. - aniont
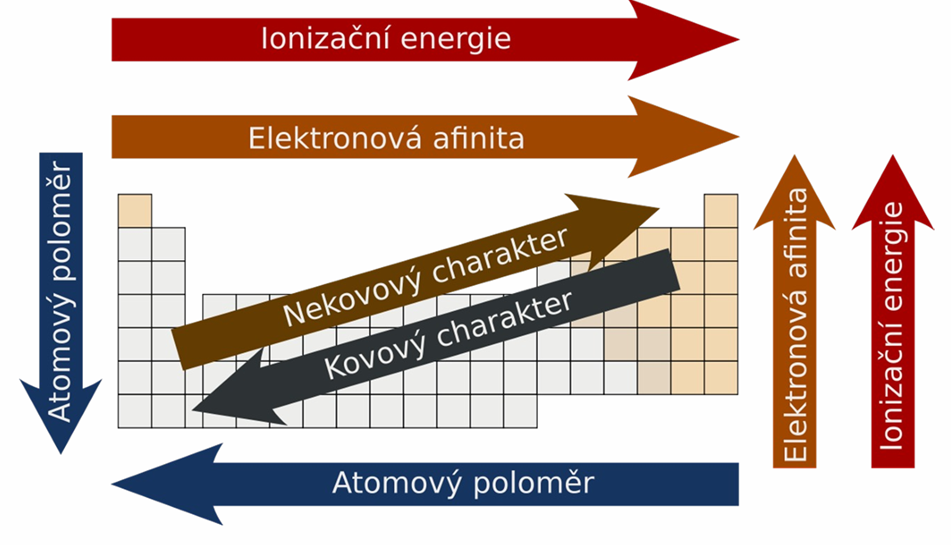
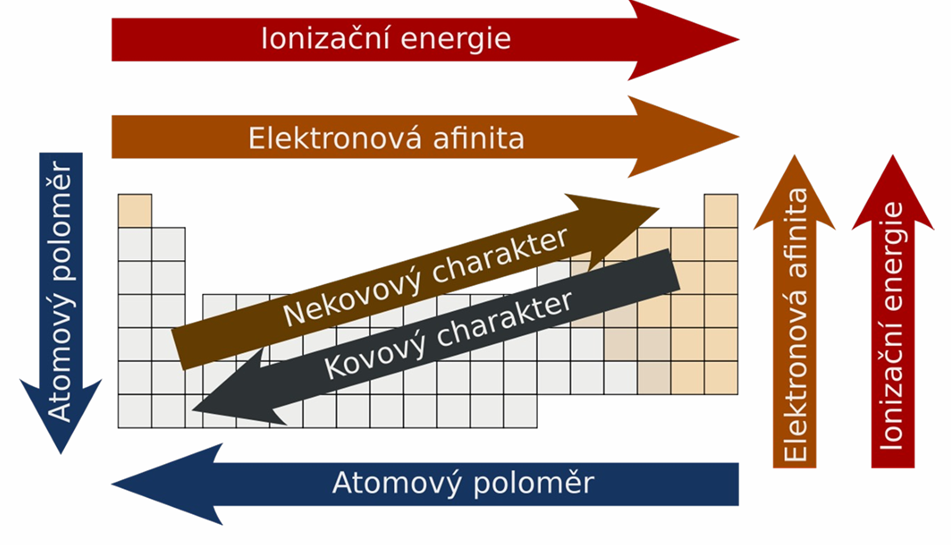
IONIZAČNÍ ENERGIE
energie nutná pro oddělení elektronu z elektroneutrálního atomu (kJ/mol)
pozn.: 1. ionizační energie je u prvků 1. skupiny velmi malá (je žádoucí, aby se zbavili elektronu), zato 2. ionizační energie je u atomů těchto prvků velmi vysoká (již dosáhli rovnovážného stavu a je nežádoucí zbavovat se dalšího elektronu)
ELEKTRONOVÁ AFINITA
schopnost atomu přijmout elektron (schopnost tvořit anion), = hodnota energie, která se uvolní nebo spotřebuje, když atom přijme el. (kJ/mol)
ELEKTRONEGATIVITA
schopnost prvku v rámci molekuly přebírat jinému prvku vazebné elektrony, u vzácných plynů kromě helia je NULOVÁ