Genetik Abitur-Karteikarten | Quizlet
1/92
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
93 Terms
Woraus bestehen Proteine?
Aminosäuren
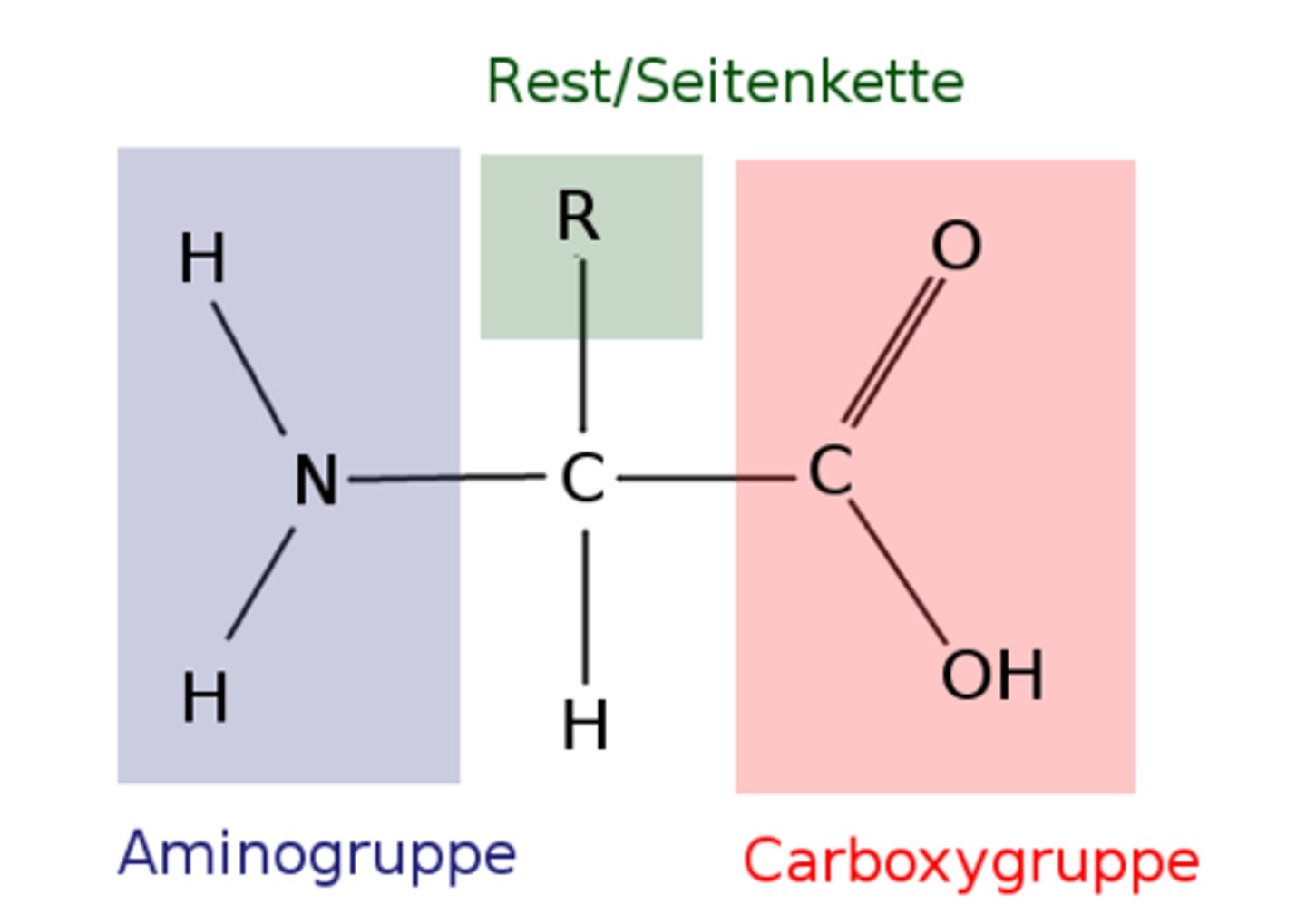
Wie ist der Aufbau von Aminosäuren?
Aminogruppe, Carboxylgruppe und individueller Rest
Wie viele Aminosäuren gibt es?
20
Peptidbindung
Bindung zwischen zwei Aminosäuren; Carboxylgruppe und Aminogruppe verbinden sich unter Abspaltung von Wasser
Dipeptid
2 Aminosäuren
Polypeptid
mehrere Aminosäuren
Aus wie viele AS besteht ein Protein?
mehr als 100 AS
Primärstruktur eines Proteins
Abfolge der Aminosäuren (Aminosäurenfrequenz)
Tertiär- und Quartärstruktur
Raumstrukturformen, die der Sekundärstruktur übergeordnet sind
Sekundärstruktur eines Proteins
räumliche Anordnung der Primärstruktur
Wo liegen die Informationen für Primär-, Sekundär-, Tertiär- und Quartärstruktur?
In der DNA liegt nur Information für die Primärstruktur von Proteinen vor, alle anderen Proteinstrukturen finden sich von selbst zusammen („self assembly")
Eigenschaften von Enzymen
- das aktive Zentrum der Enzyme arbeitet nach dem Schlüssel-Schloss-Prinzip
- sind Substratspezifisch, können also nur ein bestimmtes Substrat binden
- sind wirkungsspezifisch, Substrat wird nur in einer bestimmten Art gespalten
- Enzym bleibt unverändert nach einem Enzym-Substrat-Komplex
Ligase
setzt 2 Substrate zu einem Produkt zusammen
Lyase
spaltet ein Substrat zu 2 Produkten oder mehreren
Hydrolase
spaltet das Substrat mit Wasser zu H und OH à spaltet in Peptide à Aminosäuren
Isomerase
Substrat verändert die Konformation
Transferase
Überträgt ein Teil des Substratmolekül auf ein zweites Substrat
RGT-Regel
...besagt, dass in der anorganischen Chemie, Reaktionen durch Hitze beschleunigt werden. Eine Erhöhung von 10° erhöht die Reaktionsgeschwindigkeit um das zwei-drei fache. (Maximum bei Lebewesen bei 40° à Denaturierung der Enzyme)
Cofaktoren
Metallionen, Coenzyme und Vitamine
Michaelis-Menten-Konstante
Bei konstanter Enzymkonzentration nimmt die Reaktionsgeschwindigkeit (v) mit steigender Substratkonzentration zu und erreicht schließlich einen Sättigungswert (KM-Wert). Dieser ist spezifisch für jedes Enzym
Averys Transformationsversuche
Bei dem Gemisch in dem die DNase, die DNA zerstört findet keine Transformation der R-Bakterien statt, weshalb die DNA der Träger für die Erbinformation sein muss
Griffith Transformationsversuche
In seinem Versuch zeigte er, dass die R-Bakterien die Erbinformation von den abgetöteten S-Bakterien aufgenommen haben und somit eine Kapsel bilden konnten, sodass das Immunsystem der Maus diese nicht töten konnte.
Verpackung der DNA
· DNA besteht aus einer Doppelhelix
· Basen (Adenin, Thymin, Cytosin und Guanin) kommen in einem 1:1 Verhältnis vor
--> Chargaff-Regel
RNA
- Ribose
- Adenin, Uracil, Cytosin, Guanin
- Einfachhelix
- Übertragung von genetischen Informationen
- Übersetzung von Proteinen
- Kann durch die Zellkernmembran diffundieren
DNA
- Desoxyribose
- Adenin, Thymin, Cytosin, Guanin
- Doppelhelix
- Speicherung des Erbguts
konservative Replikation
Die ursprüngliche Doppelhelix bleibt erhalten. Eine zweite Doppelhelix bildet sich durch exaktes Übereinanderlegen neu
semikonservative Replikation
Die beiden DNA-Stränge der ursprünglichen Doppelhelix trennen sich auf und jeder Strang wird auf Grund der komplementären Basenpaarung
--> richtige Hypothese
disruptive Replikation
die ursprüngliche DNA zerbricht in einzelne Stücke und setzt sich mit neuen Molekülen zu 2 neuen Strängen zusammen
Replikation der DNA
· Topoisomerase entwindet die Doppelhelix
· Helicase löst die Wasserstoffbrückenbindungen zwischen den Basen auf
· Die einzelnen DNA- Stränge liegen nun in Form einer Replikationsgabel offen, an der sich die komplementären Basen anlagern können
· DNA-Polymerase setzt an einen Primer an
· Bei Prokaryoten beginnt die Replikation an einer festen Stelle, der ORI-Region à die Replikation erfolgt an der ringförmigen DNA in beide Richtungen gleichschnell
· Bei Eukaryoten läuft die Replikation langsamer ab und beginnt in der S-Phase des Zellzyklus an mehreren Öffnungspunkten, den Replikons
· Eine kontinuierliche Replikation ist nur in 5' zu 3' Richtung (am führenden Strang) möglich, da Nukleotide nur an das 3' Ende des neu synthetisierten Stranges binden können
· DNA-Polymerase kann nur in 5' zu 3' Richtung Nukleotide an die ursprüngliche DNA anlagern
· Beim 3' zu 5' Strang (nachfolgendem Strang) werden Okazaki-Fragmente angeheftet, die
à DNA-Polymerase muss immer wieder neu an den Strang ansetzen und dadurch entstehen Fragmente ànur am 3' Ende können Nukleotide angeknüpft werden
· Ligase verknüpft anschließend diese Okazaki-Fragmente zu einem kompletten Kettenmolekül
PCR-Verfahren
· Nötige Bestandteile: die zu vervielfältigende DNA, DNA-Nukleotide, Taq-Polymerase (hitzeresistente DNA-Polymerase), 2 Primer mit definierter DNA- Sequenz und einen Thermocykler
1. Denaturierung (94°): Wasserstoffbrückenbindungen werden aufgelöst, sodass die DNA in Einzelsträngen vorliegt
2. Hybridisierung (60°): Primer binden komplementär an je einen Einzelstrang
3. Polymerisierung (72°): hitzeresistente Taq-Polymerase setzt an Primer an und synthetisiert einen neuen Strang in 5' zu 3' Richtung, läuft aber in 3' zu 5' Richtung am codogenen Strang entlang
Wofür werden PCR verwendet?
· Weiterverwendung zur DNA-Sequenzierung (Analyse der Aminosäuren)
· Verwandtschaftsanalyse durch die Gelelektrophyrese
Topoisomerase
Entwindet die Doppelhelix
Helicase
- löst die Wasserstoffbrückenbindungen zwischen den Basen auf à nur in einem bestimmten Bereich
- durchtrennt die DNA in ihre Stränge
öffnet die Replikationsgabel
Primase (RNA- Polymerase)
- synthetisiert den RNA-Primer (ein kurzes komplementäres RNA-Stück
Startmolekül
(am Leitstrang nur 1x, am Folgestrang mehrere Male!)
DNA- Polymerase
- Benötigt das Startmolekül RNA- Primer (am Leitstrang einen und am Folgestrang mehrere!)
Arbeitet in 5' zu 3' Richtung
Ligase
- Verbindet die Okazaki-Fragmente zu einem vollständigen DNA-Strang
Wo findet die Proteinbiosynthese statt?
Im Zellplasma
Initiationsphase
1. RNA- Polymerase erkennt den Promotor, eine spezifische Basensequenz auf der DNA als Bindungsstelle
2. RNA - Polymerase läuft an der DNA in 5' zu 3' Richtung (des neu synthetisierten Strangs) entlang und öffnet den Doppelstrang blasenartig am Promotor
-> Die Informationen auf dem Matrizenstrang/ codogenen Strang wird in 3' zu 5' Richtung abgelesen
Elongation
1. RNA-Polymerase fügt komplementär zum codogenen Strang (Matrizenstrang) Basenpaare zusammen (Nukleosid-Triphosphate werden an das 3' Ende unter der Abspaltung von 2 Phosphatresten angeknüpft)
2. Es entsteht ein einzelsträngiger mRNA-Strang, der Ribose anstatt Desoxyribose und Uracil anstatt Thymin beinhaltet
Termination
1. Ein Stoppsignal, Terminator (Stoppcodon UGA, UGA, UAA) beendet die Transkription
2. Die mRNA wird zur Weiterverarbeitung frei gegeben à (bei Eukaryoten/ Eucyten anschließend noch die Spleißung)
· Dieser Prozess läuft in Procyten als auch in Eucyten gleich ab. Allerdings findet bei Eucyten anschließend eine Prozessierung statt. Dabei werden aus der sogenannten prä-mRNA, die Introns entfernt. Nur die Exons beinhalten die nötige Information, um das gewünschte Protein herzustellen, Erst nach der Prozessierung, verlässt die fertige mRNA den Zellkern und gelangt ins Cytoplasma. à „Spleißung"
Translation
· mRNA wird zu einem Protein bzw. einer Aminosäurefrequenz übersetzt
1. die kleine Untereinheit des Ribosoms lagert sich an dem mRNA-Strang an
2. die große Untereinheit lagert sich darüber und hat 3 Bindungsstellen für die tRNA, die die Aminosäuren trägt
3. Nach dem Schlüssel-Schloss-Prinzip lagert sich die tRNA an die mRNA an, dessen Anticodon mit dem Codon des ersten Dreierstelle der Basensequenz innerhalb der A-Stelle des Ribosoms passt
4. das Ribosom rückt drei Stellen weiter, die tRNA befindet sich nun an der P-Stelle, die A-Stelle ist freu und wird von einer neuen tRNA besetzt
5. die beiden neuen Aminosäuren der tRNA's verbinden sich nun
6. das Ribosom rückt wieder weiter. Die erste tRNA ist nun an der E-Stelle des Ribosoms und wird frei gegeben. Sie kann in der tRNA- Synthethase mit einer neuen Aminosäure beladen werden
7. Das Ribosom läuft so lange an der mRNA entlang, bis es auf ein Stoppcodon trifft. Dort wird die Translation abgebrochen.
8. die entstandene Polypeptidkette nimmt aufgrund der Molekülstruktur eine spezifische Tertiärstruktur an und bildet so ein fertiges Protein
Der genetische Code
· Triplett- Code setzt sich aus 3 Basen zusammen
· Ist universell (wird in fast allen Organismen gleich abgelesen)
· Ist degeneriert/ redundant --> jedes Basentriplett codiert nur eine Aminosäure aber eine Aminosäure wird durch mehrere Basentripletts codiert
· Ist kommafrei -->Codons schließen lückenlos aneinander an
· Ist nicht überlappend --> eine Base ist immer nur Bestandteil eines Codons
· Wird in 5' zu 3' Richtung abgelesen
Je 3 Nukleotide codieren eine Aminosäure
Die ein Gen ein Polypeptid Hypothese (Molekulare Wirkungsweise von Genen)
· These besagt, dass ein DNA-Abschnitt (ein Gen) eine bestimmte Polypeptidkette also ein Protein codiert
· Jedoch bestehen Gene nicht nur aus einzelnen zusammenhängenden DNA- Abschnitten, sondern können auch aus vielen kleinen Stücken bestehen
· Der Begriff „Gen" ist daher durch seine vielfältigen Aspekte nicht genau definierbar
· Strukturgene, Regulatorgene, Springende Gene, Überlappende Gene und die Existenz von Introns und Exons beweisen, dass ein „Gen" nicht nur ein Polypeptid codiert
der genetische Fingerabdruck
ist ein für jedes Individuum einzigartiges Profil (wird mit Hilfe von Molekulare Markern erstellt durch die Gelelektrophorese)
Spontanmutation
· DNA- Basen- Triplett verändert sich, die entstehende Aminosäurensequenz jedoch nicht
· verändertes DNA-Triplett codiert immer noch die gleiche Aminosäure aufgrund der Redundanz des genetischen Codes
neutrale, stumme Mutation
· Bildung einer falschen Aminosäure durch ein codiertes Basen- Triplett
· kann die Aktivität eines Enzyms verringern, indem eine Aminosäure, die sich im aktiven Zentrum des Enzyms befindet, verändert wird
Nonsense - Mutation: (nonsense = Unsinn)
· Verfrühter Stopp einer Polypeptidkette, durch Veränderung eines Tripletts einer Aminosäure, das zum Stoppcodon wird
· Polypeptid ist meist funktionslos
Rastermutation
· Verschobenes Leseraster: Basentripletts werden durch Insertion oder Deletion verändert, sodass sie kein Vielfaches von 3 mehr sind
· Basentripletts werden verschoben
· es werden komplett neue Aminosäuren gebildet (da sie kommafrei abgelesen werden)
· meist entsteht eine funktionslose Polypeptidkette
Punktmutationen
· Deletation Base wird entfernt
· Insertion Base wird hinzugefügt
· Substitution Base wird ersetzt
Bedeutung der Mutationen für die Evolution
Mutationen haben in den meisten Fällen negative Auswirkungen, jedoch bilden Mutation und Rekombination die Grundlage für genetische Vielfalt und ermöglichen eine ständige Anpassung der Lebewesen an wechselnde Umweltbedingungen.
Genetische Vielfalt ist für die Stabilisierung der Art sowie für die Evolution der Organismen von Grundlegender Bedeutung (stabilisierende und transformierende Selektion)
Reperaturmechanismen
Fotoreaktivierung, Postreplikations - Reparatur, Excisionsreperatur
Fotoreaktivierung
erfolgt durch DNA- Fotolasen (Enzyme), die durch sichtbares Licht aktiviert werden und z.B.: Thymindimere wieder trennen
Postreplikations - Reparatur
- Fehlpaarung, die während der DNA- Replikation entstanden sind, werden korrigiert → falsches Nucleotid im Tochterstrang
- beteiligte Enzyme können Fehlpaarungen erkennen und zwischen dem elterlichen und DNA-Strang und dem neusynthetisierten Tochterstrang unterscheiden (durch Methylgruppen)
Excisionsreperatur (excisere = herausschneiden)
- Endonuklease erkennt Schadstellen an der DNA-Strang
1. der betroffene Strang vor und nach dem Dimer wird durch eine Excision entfernt. Die entstandene Lücke füllt die Polymerase durch komplementäre Basenpaarung auf.
2. der intakte komplementäre Strang dient als Kopiervorlage. Das neusynthetisierte DNA-Stück wird durch Ligase mit dem reparierten DNA-Strang verknüpft
·Lactose- Operon- Model
- Substratinduktion
- (je mehr Laktose desto mehr Enzyme, je weniger desto weniger Enzyme)
--> POSITIVE RÜCKKOPPLUNG
- Enzymsynthese wird durch das Substrat ausgelöst (induziert)
Tryptophan-Operon
- Endproduktrepression
- (genau gleich nur je mehr Tryptophan, desto weniger Enzyme und je weniger Tryptophan desto mehr Enzyme)
→ NEGATIVE RÜCKKOPPLUNG
- je mehr Tryptophan hergestellt wird desto weniger Enzyme gibt es
Transkriptionsfaktoren
TATA-Box
Bereich an dem die Basen Thymin und Adenin häufig vorkommen
Enhancer
verstärkt die Transkription
Silencer
dämpft die Transkription
Wie viele Chromosmen hat der Mensch
· Insgesamt hat der Mensch 46 Chromosomen (23 vom Vater und 23 von der Mutter)
→ sie bilden einen homologes Chromosomenpaar
· 44 Autosome Chromosomen (22 homologe Chromosomenpaare)
· 2 Gonosome Geschlechtschromosomen (x und y à 1 Chromosomenpaar)
Autosomal-dominant
- Männer und Frauen erkranken mit gleicher statistischer Häufigkeit (nur ein Hinweis - kein Beweis!)
- Genotypisch Kranke sind auch phänotypisch krank
- Man findet in der Regel phänotypisch Erkrankte in jeder Generation.
- Phänotypisch kranke Kinder haben mindestens ein phänotypisch krankes Elternteil.
- Phänotypisch kranke homozygote Eltern können gesunde Kinder bekommen (heterozygot erkrankt und homozygot gesund)
- Bei einer erhöhten Häufigkeit einer rezessiven Krankheit, kann Inzest/ Inzucht ein Faktor sein
Autosomal-rezessiv
- Männer und Frauen erkranken mit gleicher statistischer Häufigkeit (nur ein Hinweis - kein Beweis!)
- Merkmalsträger sind in der Regel nicht erkrankt (nur wenn sie das defekte Gen homozygot haben - also zweimal!)
- Das Merkmal kann Generationen überspringen.
Phänotypisch kranke Kinder können phänotypisch gesunde Eltern haben.!
Gonosomal-dominant
- Es gelten alle bisherigen (oben genannten) Aussagen des autosomal-dominanten Erbgangs
- Wenn der Vater krank und die Mutter gesund ist, dann sind alle Töchter krank und alle Söhne gesund (=> der ist Erbgang gonosomal dominant)
- Wenn der Vater gesund und die Mutter krank ist, dann sind Töchter und Söhne im gleichen Verhältnis krank
Gonosomal-rezessiv
- Es erkranken mehr Männer als Frauen (nur ein Hinweis - kein Beweis)
- Phänotypisch gesunde Eltern, können phänotypisch kranke Söhne, aber keine kranken Töchter haben.
- Das Merkmal kann Generationen überspringen
- Frauen sind nur dann phänotypisch krank, wenn der Vater phänotypisch krank und die Mutter gleichzeitig Konduktorin war
Y-Chromosomal
· Y- Chromosom enthält fast keine Informationen
· Es wären nur Männer betroffen
· Jeder Sohn eines erkrankten Vaters wäre ebenfalls krank
Epigenetik
Alle Gene unterliegen einem Regulationsmechanismus, bei dem spezifische Proteine die Kontrolle über die Genaktivität ausüben. Die DNA bleibt dabei unverändert. Durch Einflüsse zum Beispiel der Ernährung können DNA-Abschnitte chemisch verändert werden, wodurch sie dauerhaft abgeschaltet (Methylierung) oder angeschaltet (Acetylierung) werden. Die Modifikation an der DNA (oder Histonen) bezeichnet man als Epigenetik.
DNA-Methylierung bei Eukaryoten
· spezielle Enzyme (DNA-Methyltransferasen) sorgen dafür, dass an bestimmten Stellen der DNA- Methylgruppen angehängt werden
→ Durch die Methylierung wird die Raumstruktur der DNA verändert
→ Die RNA-Polymerase wird blockiert und die Transkription verhindert (betroffene Gene sind abgeschaltet)
· dieser Vorgang ist reversibel und die Basensequenz verändert sich nicht; Methylierungszustand ist reversibel und kann mitotisch/meiotisch übertragen werden
· Durch eine Demethylase können die Methylgruppen entfernt und die Gene wieder angeschaltet werden
Histon-Modifikation
· Veränderung der Chromatinstruktur hat Einfluss auf die Genaktivität; Histone regulieren die dreidimensionale Struktur der aufspiralisierten DNA und bestimmen damit die Ablesbarkeit einzelner Bereiche
· Acetylierung: lockere Wicklung (Euchromatin)
→ Histontransferase lagert Acetylgruppen an Histone → Lockerung der DNA → Transkription möglich
· Deacetylierung: enge Wicklung (Heterochromatin) → Histon-Deacetylase spaltet Acetylgruppen von Histon ab → Transkription nicht möglich → Gen abgeschaltet
Restriktionsenzyme
- spalten DNA-Doppelstrang, wirken wie biochemische Scheren
- hochspezifisch → schneidet nur Erkennungssequenz (Palindrom)
- schneiden entweder glatt (blunt ends) oder versetzt (sticky ends)
- schneidet nur nicht von Methylgruppen geschützte DNA
CRISPR-cas9
Gentransfer
RNA-Interferenz
· siRNA (small interfering RNA) ein für Therapiezwecken konstruiertes mRNA-Stück
· künstlich hergestellte mRNA setzt komplementär an die Ziel-mRNA
· da es keine doppelte mRNA gibt, wird die mRNA abgebaut
· das Protein was durch die mRNA codiert wird, kann kein Protein herstellen (da es abgebaut wird)
· bei Viren kann die Zelle nicht mehr infiziert werden, da die Proteine an der Zellmembran nicht mehr hergestellt werden
· Virus stirbt dennoch trotzdem nicht, da dieser im Körper überdauert
· siRNA wird in die Blutbahn injiziert
Mitose Metaphase
Zwei-Chromatiden-Chromosomen reihen sich in Äquatorialeben auf
Mitose: Prophase
Kondensation des Chromatins; Auflösung der Kernmembran, Zwei- Chromatiden-Chromosomen werden erkennbar, Zentromer verbindet Schwesterchromatiden, Spindelapparat bildet sich
Mitose: Anaphase
Schwesterchromatiden trennen sich, Ein Chromatid-Chromosomen werden von Spindelapparat zu Polen gezogen
Mitose: Telophase
Spindelapparat löst sich auf, Kernmembran bildet sich um getrennte Chromatiden, Ein-Chromatid- Chromosomen entschrauben sich zu Chromatidfäden, Zellteilung wird beendet
Mitose: Cytokinese
Trennung des Cytoplasmas, Bildung neuer Zellmembranen
Meiose
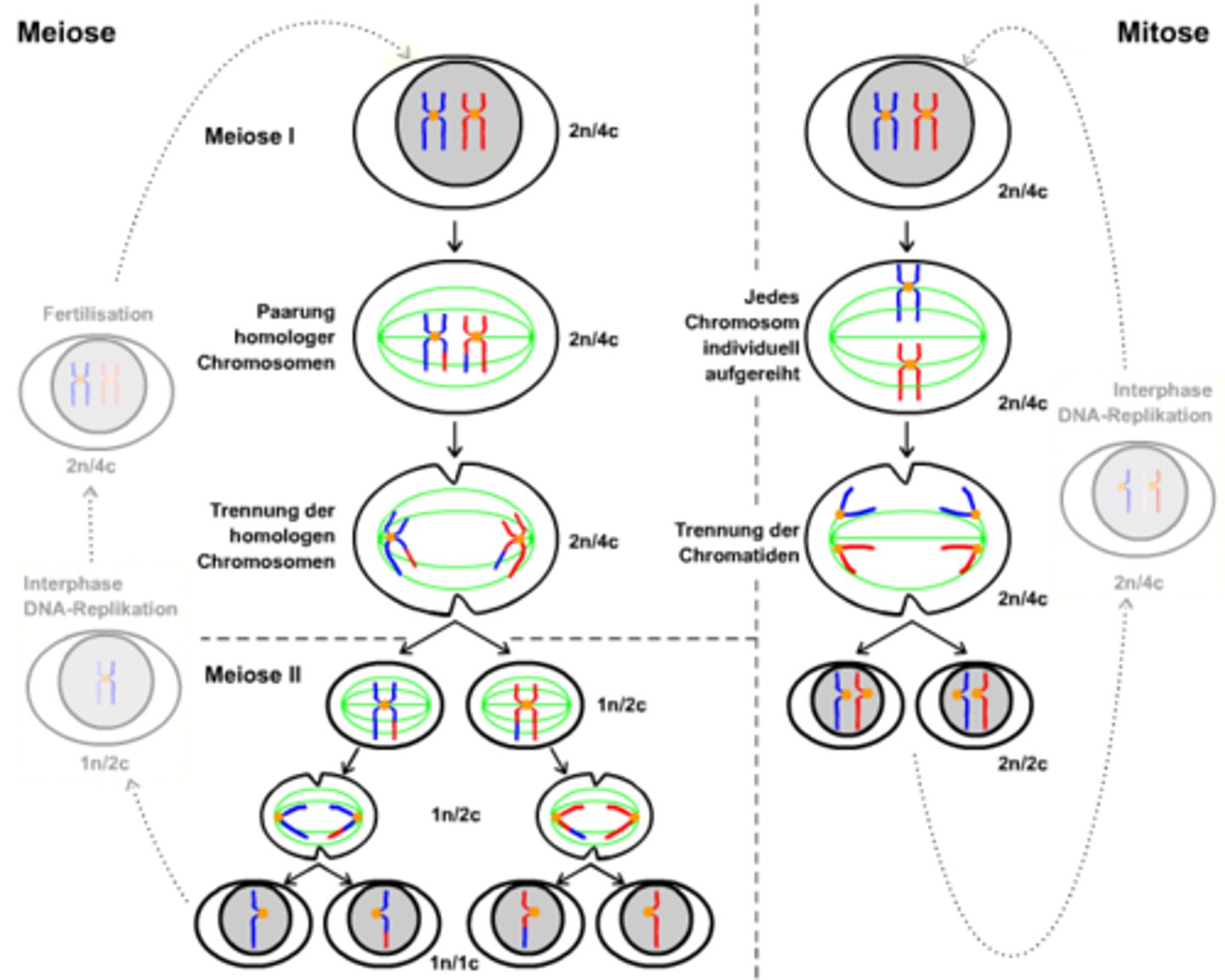
Meiose 1. Reifeteilung
Trennung der homologen Chromosomen
Meiose 2. Reifeteilung
Trennung der Schwesterchromatiden
Interchromosomale Rekombination:
zufällige Verteilung der homologen Chromosomen bei der Meiose (1.Reifeteilung, Metaphase 1)
Bildet Grundlage für genetische Variabilität der Keimzellen
Intrachromosomale Rekombination
Austausch von Abschnitten der Chromosomen durch Crossing- Over
(Prophase 1)
Numerische Chromosomenanomalie
· Veränderung/ Anomalie in der Anzahl der Chromosomen
Strukturelle Chromosomenanomalie
· Veränderung/ Anomalie in der Struktur der Chromosomen
Balancierte Chromosomenanomalie
· durch Translokation
Uniformitätsregel
Kreuzt man zwei reinerbige Rassen einer Art, die sich in einem Merkmal unterscheiden, so sind die Nachkommen in der ersten Filialgeneration bezüglich dieses Merkmals alle gleich
Spaltungsregel
Kreuzt man die Bastarde aus der ersten Filialgeneration untereinander, so treten die Merkmale der P-Generation in der zweiten Filialgeneration im Verhältnis von 3:1 (bei dominant-rezessivem Erbgang) wieder auf
Rekombinationsregel
kreuzt man 2 Individuen ein er Art die sich in Merkmalen unterscheiden, für die sie reinerbig sind, bilden sich in der Filialgeneration neue Merkmalskombinationen aus und Nachkommen mit Merkmalskombinationen in einem Zahlenverhältnis von 9:3:3:1
Protoonkogene
- steuern Wachstum, Teilung, Differenzierung von Zellen
- mutiert oder entartet durch Viruseinfluss o. Fehlsteuerung
- zieht häufig Krebserkrankung mit sich, da Kontrollfunktion des Gens versagt
- Ein Protoonkogen, das ras-Gen codiert das ras-Protein. Dieses ist an der Weiterleitung von Signalen beteiligt, die das Wachstum (also die Teilung) der Zelle veranlasst. Diese Wachstumssignale kommen von außerhalb der Zelle und müssen bis in den Zellkern gelangen.
Ist das ras-Gen mutiert, codiert es ein verändertes Protein (Mutein), welches keine Wachstumssignale mehr von außen benötigt; es gibt den Befehl zur Zellteilung weiter, ohne ein Signal von außen bekommen zu haben
Onkogene
defekte Protoonkogene
Tumorsupressorproteine
· Unterdrücken/verhindern Krebs, hemmen das Zellwachstum
· durch DNA-Schäden aktiviert u. codiert Protein P53, dass Gene ausschalten kann;
· P53 greift bei Zellentartung u. stoppt den Zellzyklus u. leitet Apoptose ein
· bei einem Defekt des Gens tritt keine Apoptose ein
· Das Tumor-Suppressor-Gen p53 (auch p53 Tumorsuppressogen) liegt auf dem 17. Chromosom. Es ist besonders bedeutsam, da es bei ca. jedem zweiten Tumor ausgefallen ist.
· Das Tumor-Suppressor-Gen p53 codiert einen Transkriptionsfaktor (p53-Protein), dieser stoppt den Zellzyklus in der G1-Phase. Dadurch wird es möglich, DNA-Schäden zu reparieren oder bei irreparablen Schäden die Apoptose einzuleiten.
Bei einer p53-Mutation fehlt dieser regulierende Sicherheitsschritt, Fehler werden nicht mehr entfernt und die Zelle kann zur Krebszelle werden
Stammzellen:
undefinierte, unspezialisierte Zellen, die Funktionen übernehmen durch Spezialisierung; sind überall im Körper vertreten