CM7 Utilisation du sucre (glycolyse / pentoses / glycogène)
1/20
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
21 Terms
1) Rôle & localisation Questions
1.1 Qu’est-ce que la glycolyse et à quoi sert-elle principalement ?
1.2 Où a lieu la glycolyse et dans quels types cellulaires est-elle indispensable ?
1.3 Jusqu’où s’arrête la glycolyse et pourquoi parle-t-on de voie « catabolique majeure » ?
🔹 2) Bilan & phases Questions
2.1 Quel est le bilan stœchiométrique global en conditions aérobies ?
2.2 Que devient ce bilan en anaérobie (fermentation lactique) ?
2.3 Quelles sont les deux phases de la glycolyse et leur coût/gain en ATP ?
🔹 3) Étapes clés & enzymes Questions
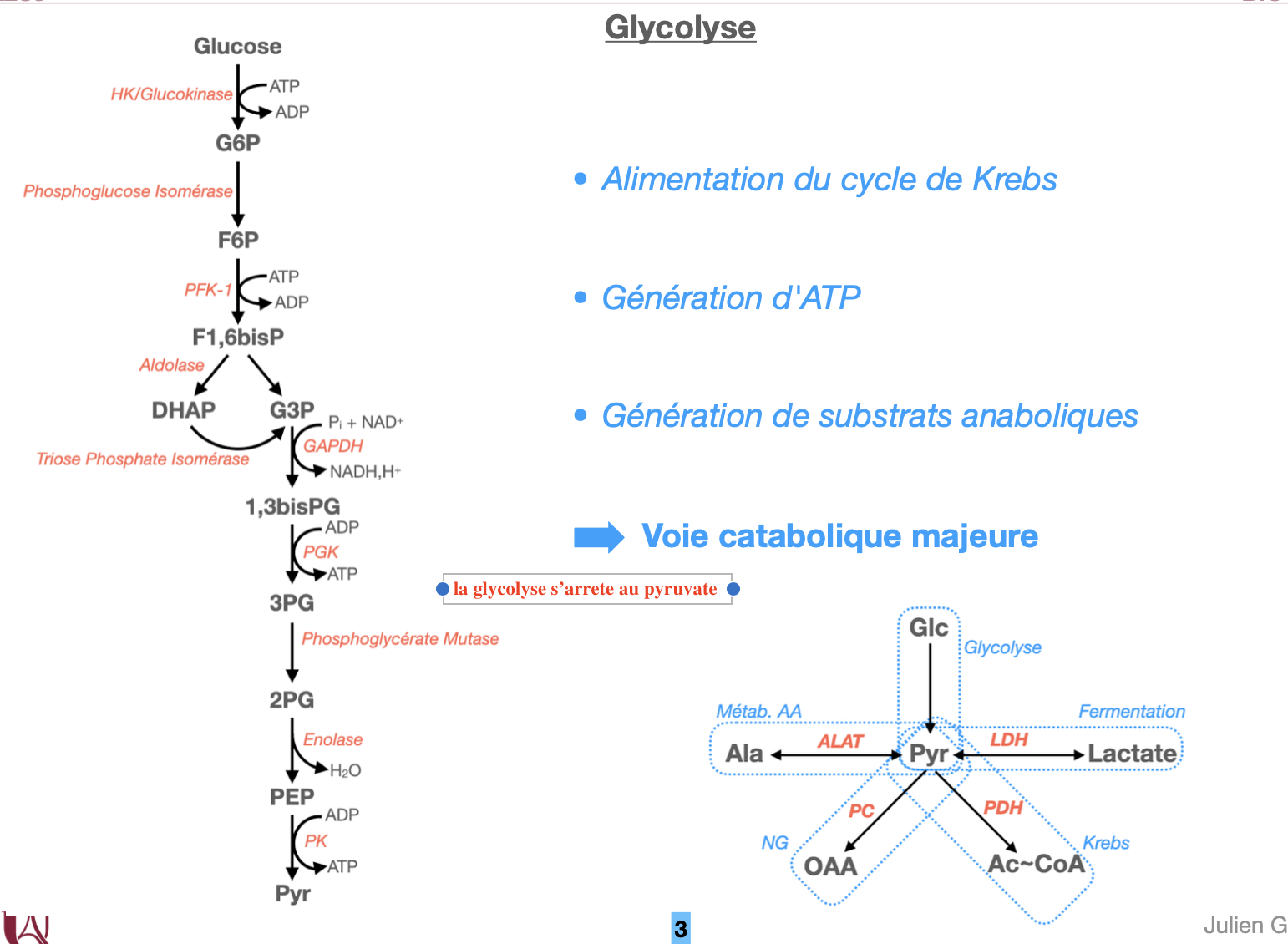
3.1 Quelles sont les trois étapes irréversibles et leurs enzymes ?
3.2 Quelle est l’étape d’engagement (commitment step) et pourquoi ?
3.3 Quelles réactions produisent l’ATP et le NADH ?
Réponses
1.1 Quoi. Suite de 10 réactions convertissant glucose → 2 pyruvates, avec production d’ATP (phosphorylation au niveau du substrat) et de NADH. Pourquoi. Elle alimente le cycle de Krebs (via l’acétyl-CoA), fournit de l’ATP rapide et des précurseurs anaboliques (G6P, F6P, G3P, 3-PG, PEP).
1.2 Où/Quand. Dans le cytosol de toutes les cellules. Indispensable chez les érythrocytes (pas de mitochondries), dans les tissus hypoxiques ou à fort besoin énergétique immédiat (muscle en effort, tumeurs—effet Warburg).
1.3 Quoi. La glycolyse s’arrête au pyruvate ; la suite dépend de l’oxygène et du métabolisme de la cellule. Pourquoi « majeure » ? Elle est ubiquitaire, rapide, et connecte de multiples voies (Krebs, fermentation lactique, néoglucogenèse, métabolisme des AA/lipides).
2.1 Bilan aérobie (par glucose).
Glc+2 ADP+2 Pi+2 NAD+→2 pyruvates+2 ATP+2 NADH+2 H+ +2 H2O
Les 2 NADH cytosoliques donnent ~3–5 ATP mitochondriaux selon la navette utilisée (malate-aspartate vs glycérol-3-phosphate).
2.2 Fermentation lactique. Le NADH est réoxydé par la LDH : pyruvate→lactate\text{pyruvate} \rightarrow \text{lactate}pyruvate→lactate. Bilan net : 2 ATP / glucose (pas de gain oxydatif).
2.3 Phase d’investissement (réactions 1–5) : –2 ATP (HK/GK et PFK-1).
Phase de rendement (réactions 6–10) : production +4 ATP (PGK, PK) et +2 NADH (GAPDH). Net = +2 ATP.
3.1 Irréversibles (ΔG très négatif) :
Hexokinase/Glucokinase (HK/GK) : Glc → G6P (ATP→ADP).
Phosphofructokinase-1 (PFK-1) : F6P → F1,6BP (ATP→ADP).
Pyruvate kinase (PK) : PEP → Pyruvate (ADP→ATP).
3.2 PFK-1 est la commitment step : après F1,6BP, le carbone est dirigé vers la glycolyse ; en amont, G6P peut partir vers glycogène ou voie des pentoses.
3.3 NADH : GAPDH (G3P → 1,3-bisPG).
ATP : PGK (1,3-bisPG → 3-PG) et PK (PEP → Pyr).
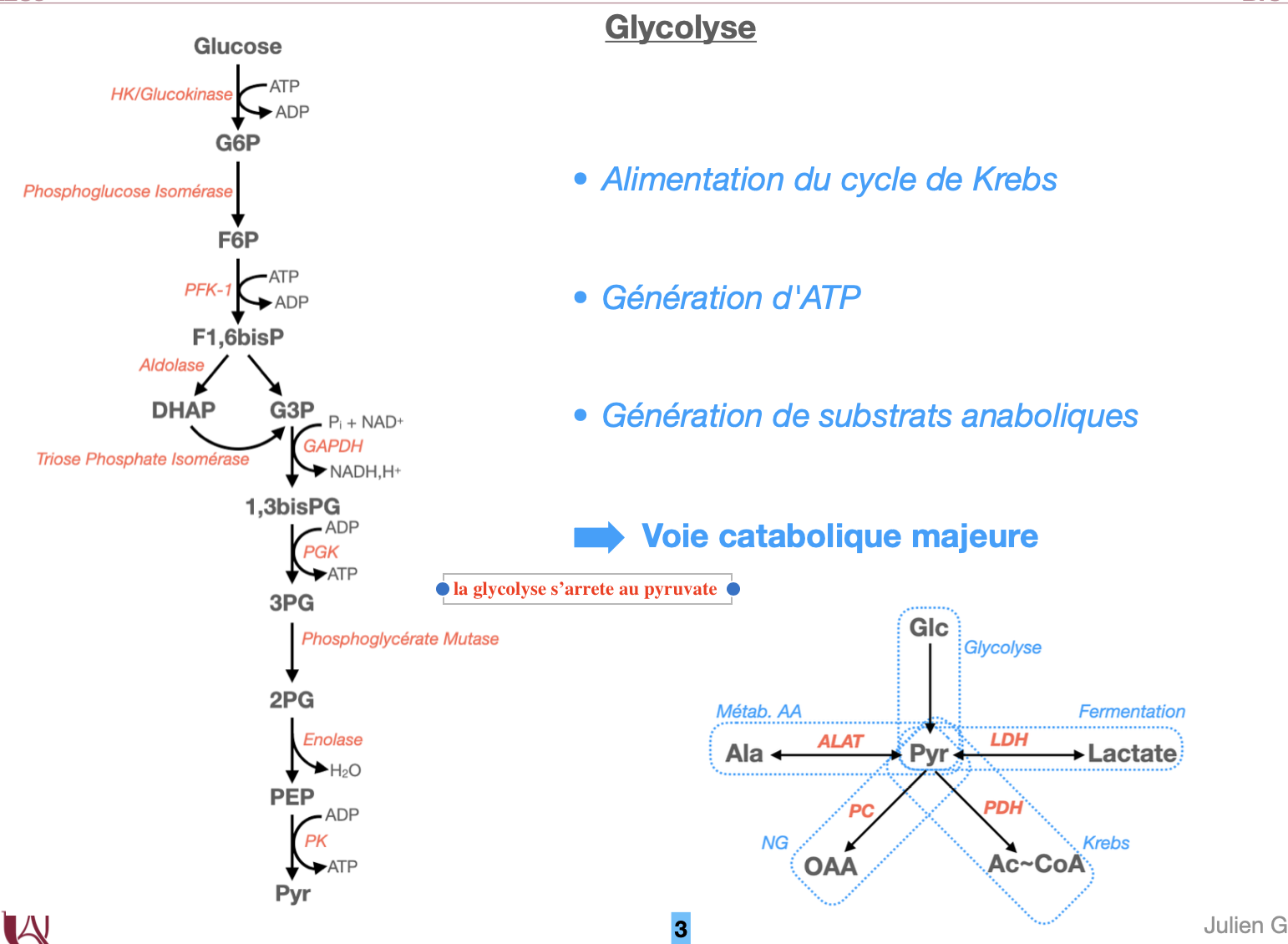
Schématiser le carrefour du pyruvate.
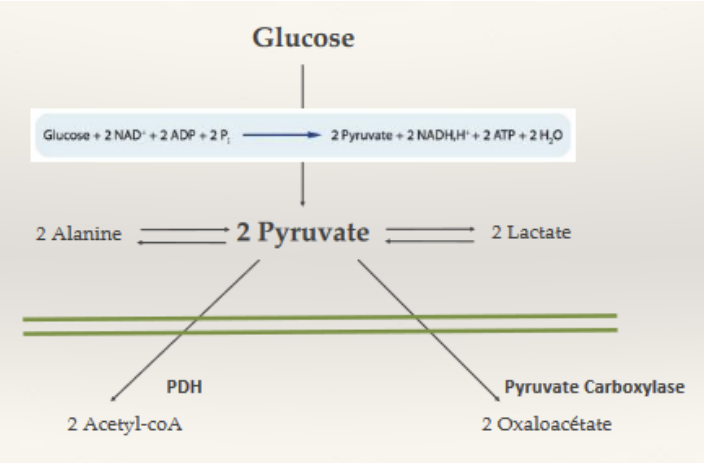
Quelles sont les sources du glucose ?
Comment se fait le transport du glucose ?
Quels sont les différents types de GLUT ?
Quelles remarques faire sur les organes insulino-dépendants ?
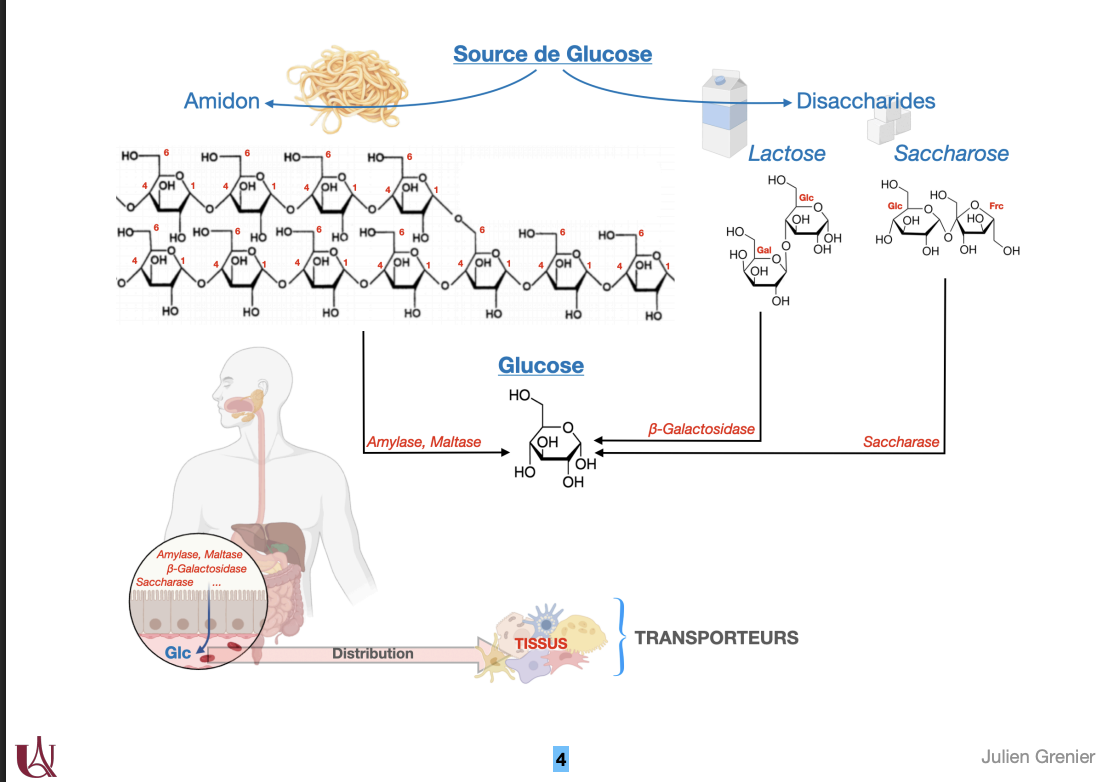
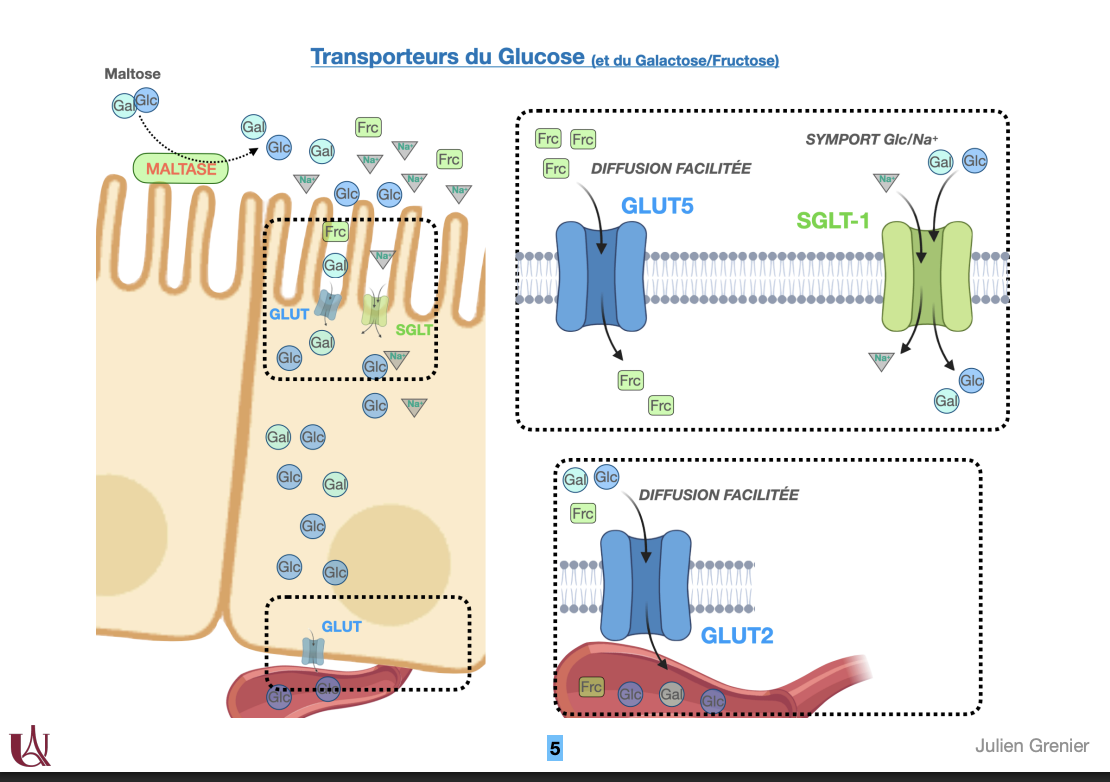
1) Sources du glucose
Quoi : Glc provenant des glucides alimentaires (amidon, disaccharides) et des voies endogènes (glycogénolyse, néoglucogenèse).
Quand : Post-prandial (après repas) surtout alimentaire ; jeûne/exercice → surtout endogène.
Où : Digestion dans intestin grêle ; production endogène foie (± rein).
Comment :
Amidon → α-amylases (salive/pancréas) puis maltase/isomaltase → glucose.
Lactose (Gal-Glc) → β-galactosidase/lactase → Gal + Glc.
Saccharose (Glc-Frc) → sucrase → Glc + Frc.
Glycogénolyse → libération de Glc (foie → sang ; muscle pour lui-même).
Néoglucogenèse (lactate, alanine, glycérol → Glc).
Pourquoi : Maintenir la glycémie et alimenter les tissus glucodépendants (cerveau, GR…).
2) Transport du glucose
Quoi : Passage du Glc de la lumière intestinale → sang → cellules via SGLT (transport actif secondaire) et GLUT (diffusion facilitée).
Quand : Continu ; ↑ après repas (absorption), modulé par insuline dans certains tissus.
Où :
Entérocyte apical : SGLT1 (symport Na⁺/Glc ou Na⁺/Gal).
Entérocyte apical pour Frc : GLUT5.
Entérocyte basolatéral : GLUT2 vers le sang.
Tissus périphériques : GLUT spécifiques. (Rein : SGLT2 réabsorption, sortie GLUT2 — bonus utile.)
Comment : SGLT utilise le gradient Na⁺ créé par Na⁺/K⁺-ATPase ; GLUT = uniport suivant le gradient.
Pourquoi : Assurer un flux efficace de Glc depuis l’alimentation et sa distribution tissulaire.
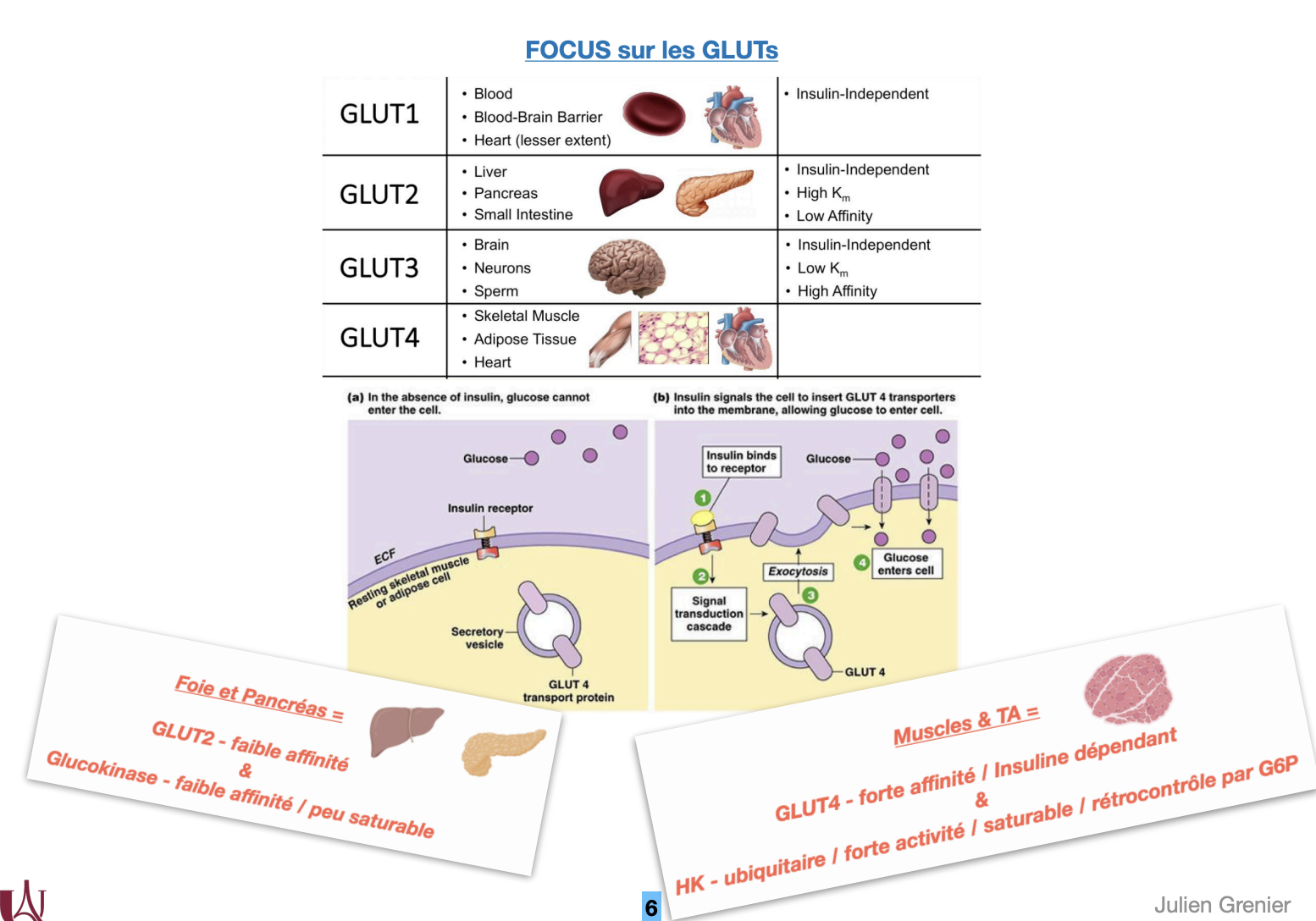
3) Types de GLUT
Quoi : Transporteurs facilités du Glc (et Frc pour GLUT5), insulino-indépendants sauf GLUT4.
Où/Quand/Comment/Pourquoi (par type) :
GLUT1 – Km bas (haute affinité) ; GR, barrière hémato-encéphalique ; captage basal constant.
GLUT2 – Km élevé (faible affinité, forte capacité) ; foie, cellules β pancréatiques, intestin basolatéral ; agit comme capteur de glycémie et voie de sortie/entrée à haut débit.
GLUT3 – Très haute affinité ; neurones ; assure l’apport prioritaire.
GLUT4 – Insulino-dépendant ; muscle squelettique, myocarde, tissu adipeux ; translocation à la membrane stimulée par insuline (et exercice/AMPK).
GLUT5 – Fructose (pas Glc) ; bord apical intestinal ; absorption du Frc alimentaire.
4) Organes insulino-dépendants : remarques
Quoi : Tissus dont l’entrée de Glc est contrôlée par l’insuline via GLUT4.
Où : Muscle squelettique, cœur, tissu adipeux.
Comment : Insuline → récepteur → PI3K-Akt → exocytose des vésicules GLUT4 → ↑ captage de Glc ; contraction musculaire active AMPK → translocation GLUT4 même sans insuline.
Pourquoi : Diriger le Glc post-prandial vers les réservoirs (TA) et vers les consommateurs (muscle).
Contre-exemples utiles : Foie & pancréas captent le Glc via GLUT2 (insulino-indépendant) et l’enzyme GK (faible affinité, non inhibée par G6P) — ils répondent à la glycémie, pas à la translocation GLUT. Cerveau/GR utilisent GLUT1/3 → apport prioritaire même sans insuline.
im occ
1) Sources du glucose
Quoi : Glc provenant des glucides alimentaires (amidon, disaccharides) et des voies endogènes (glycogénolyse, néoglucogenèse).
Quand : Post-prandial (après repas) surtout alimentaire ; jeûne/exercice → surtout endogène.
Où : Digestion dans intestin grêle ; production endogène foie (± rein).
Comment :
Amidon → α-amylases (salive/pancréas) puis maltase/isomaltase → glucose.
Lactose (Gal-Glc) → β-galactosidase/lactase → Gal + Glc.
Saccharose (Glc-Frc) → sucrase → Glc + Frc.
Glycogénolyse → libération de Glc (foie → sang ; muscle pour lui-même).
Néoglucogenèse (lactate, alanine, glycérol → Glc).
Pourquoi : Maintenir la glycémie et alimenter les tissus glucodépendants (cerveau, GR…).
2) Transport du glucose
Quoi : Passage du Glc de la lumière intestinale → sang → cellules via SGLT (transport actif secondaire) et GLUT (diffusion facilitée).
Quand : Continu ; ↑ après repas (absorption), modulé par insuline dans certains tissus.
Où :
Entérocyte apical : SGLT1 (symport Na⁺/Glc ou Na⁺/Gal).
Entérocyte apical pour Frc : GLUT5.
Entérocyte basolatéral : GLUT2 vers le sang.
Tissus périphériques : GLUT spécifiques. (Rein : SGLT2 réabsorption, sortie GLUT2 — bonus utile.)
Comment : SGLT utilise le gradient Na⁺ créé par Na⁺/K⁺-ATPase ; GLUT = uniport suivant le gradient.
Pourquoi : Assurer un flux efficace de Glc depuis l’alimentation et sa distribution tissulaire.
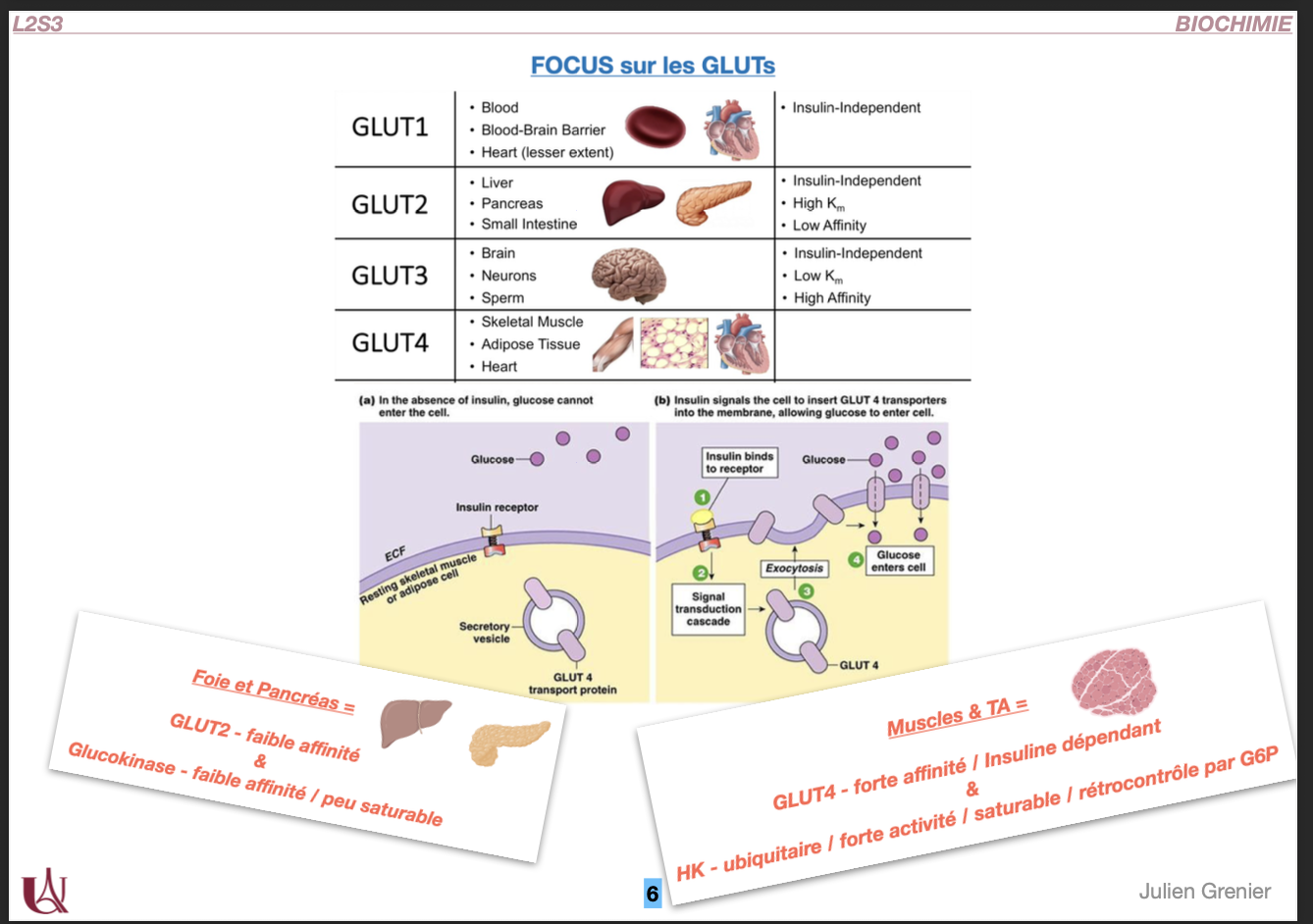
3) Types de GLUT
Quoi : Transporteurs facilités du Glc (et Frc pour GLUT5), insulino-indépendants sauf GLUT4.
Où/Quand/Comment/Pourquoi (par type) :
GLUT1 – Km bas (haute affinité) ; GR, barrière hémato-encéphalique ; captage basal constant.
GLUT2 – Km élevé (faible affinité, forte capacité) ; foie, cellules β pancréatiques, intestin basolatéral ; agit comme capteur de glycémie et voie de sortie/entrée à haut débit.
GLUT3 – Très haute affinité ; neurones ; assure l’apport prioritaire.
GLUT4 – Insulino-dépendant ; muscle squelettique, myocarde, tissu adipeux ; translocation à la membrane stimulée par insuline (et exercice/AMPK).
GLUT5 – Fructose (pas Glc) ; bord apical intestinal ; absorption du Frc alimentaire.
4) Organes insulino-dépendants : remarques
Quoi : Tissus dont l’entrée de Glc est contrôlée par l’insuline via GLUT4.
Où : Muscle squelettique, cœur, tissu adipeux.
Comment : Insuline → récepteur → PI3K-Akt → exocytose des vésicules GLUT4 → ↑ captage de Glc ; contraction musculaire active AMPK → translocation GLUT4 même sans insuline.
Pourquoi : Diriger le Glc post-prandial vers les réservoirs (TA) et vers les consommateurs (muscle).
Contre-exemples utiles : Foie & pancréas captent le Glc via GLUT2 (insulino-indépendant) et l’enzyme GK (faible affinité, non inhibée par G6P) — ils répondent à la glycémie, pas à la translocation GLUT. Cerveau/GR utilisent GLUT1/3 → apport prioritaire même sans insuline.
Quelles sont les deux enzymes en jaune ici ?
Pourquoi parle-t-on de « phase de préparation » ?
Qu’a-t-on à la fin de la phase de préparation ?
Quel est le rôle de la première phosphorylation ?
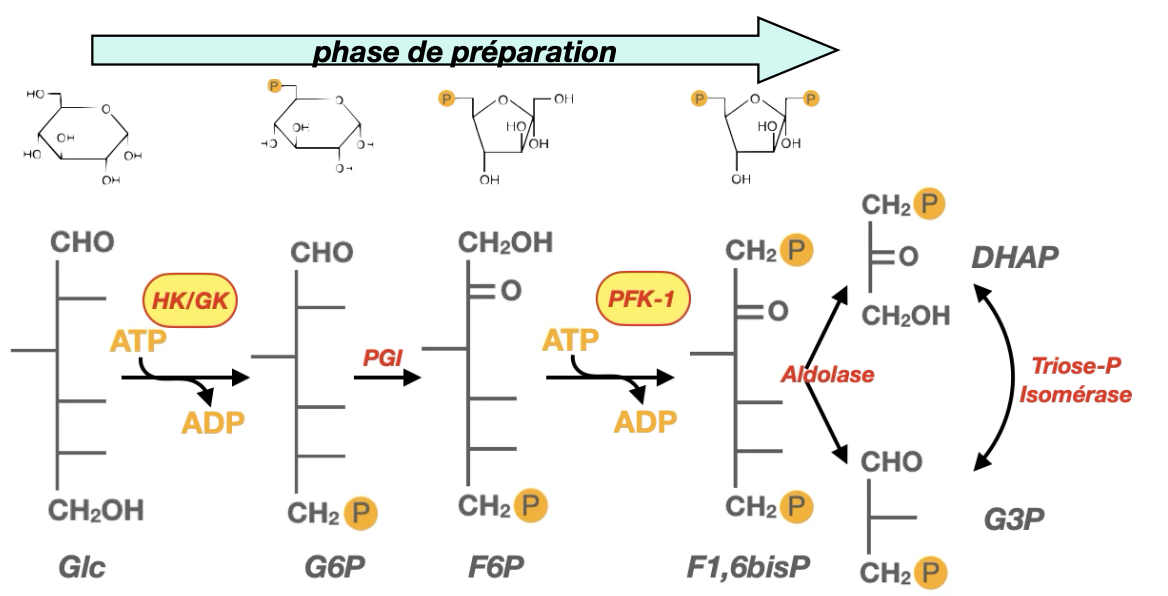
1) Quelles sont les deux enzymes en jaune ici ?
Quoi : Hexokinase/Glucokinase (HK/GK) et Phosphofructokinase-1 (PFK-1).
Quand/Où : premières et troisièmes étapes de la glycolyse cytosolique, respectivement.
Comment/Pourquoi : elles consomment 2 ATP au total pour activer le sucre et orienter irréversiblement le flux glycolytique (PFK-1 = commitment step).
2) Pourquoi parle-t-on de « phase de préparation » ? (parce qu’on prépare le C6 à la catabolise en phosphorylant ?)
Quoi : c’est la phase d’investissement (réactions 1→5) où l’on prépare le glucose C6 à être clivé en deux trioses énergétiquement « amorcés ».
Quand/Où : avant la phase de rendement, dans le cytosol.
Comment : double phosphorylation (HK/GK puis PFK-1) + isomérisation (PGI) ⇒ formation de F1,6BP qui sera scindé (aldolase) en DHAP et G3P ; l’anion phosphate reste lié pour permettre plus tard la phosphorylation au niveau du substrat.
Pourquoi :
Activer chimiquement le sucre (liaisons phosphate riches en énergie de transfert).
Rendre le clivage symétrique en donnant deux trioses phosphorylés utilisables.
Engager le métabolite vers la glycolyse (PFK-1 irréversible).
3) Qu’a-t-on à la fin de la phase de préparation ?
Quoi : 1 G3P + 1 DHAP (interconvertibles par triose-phosphate isomérase). Fonctionnellement, la voie poursuit avec 2 × G3P.
Quand/Où : après l’aldolase puis TPI, toujours dans le cytosol.
Comment : coût net –2 ATP (HK/GK et PFK-1).
Pourquoi : disposer de deux trioses activés prêts pour la phase de rendement (production de NADH et d’ATP).
4) Quel est le rôle de la première phosphorylation ? (emprisonner le glucose)
Quoi : Glucose → G6P par HK/GK.
Quand/Où : tout début de la glycolyse, cytosol après l’entrée via GLUT.
Comment : consommation d’1 ATP ; le G6P chargé (–2) ne traverse pas les GLUT.
Pourquoi :
« Emprisonner » le glucose dans la cellule (empêcher sa sortie).
Abaisser la [Glc] libre intracellulaire ⇒ favoriser son entrée continue via GLUT.
Préparer le sucre aux voies en aval (glycolyse, glycogénogenèse, PPP) sans rétro-diffusion.
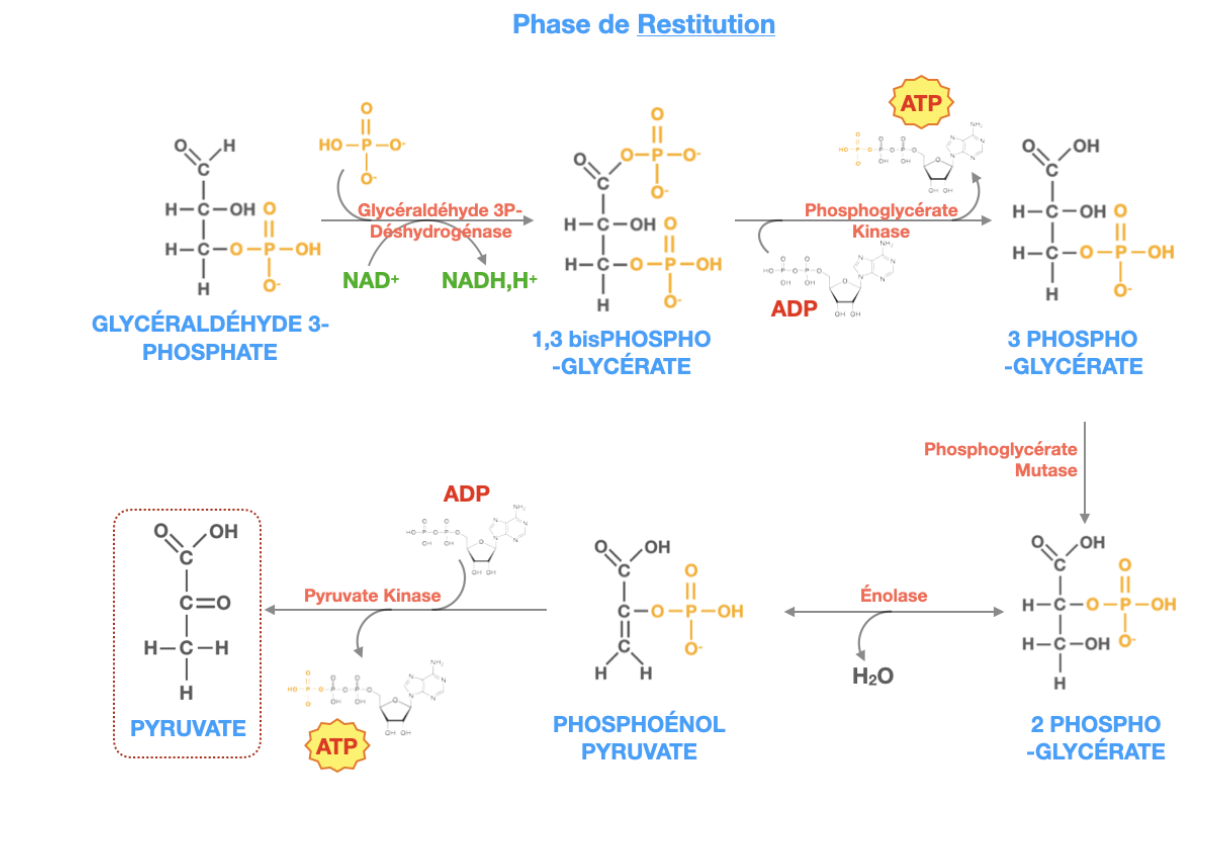
Expliquer la « phase de restitution » illustrée (réactions, enzymes, ce qui se passe).
Combien d’ATP sont produits par chaque phase de restitution et au total par glucose ?
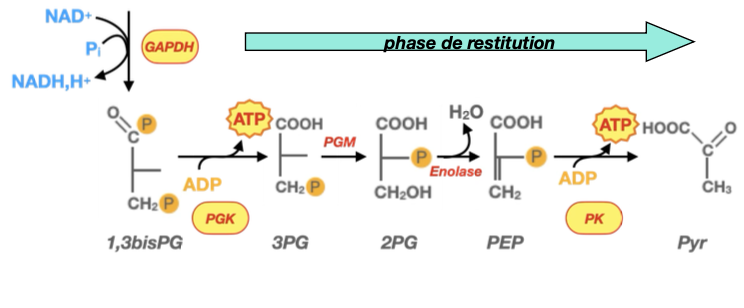

2) Combien d’ATP par phase de restitution ? (et total)
Phase de restitution n°1 (PGK) : 1 ATP par triose ⇒ 2 ATP par glucose.
Phase de restitution n°2 (PK) : 1 ATP par triose ⇒ 2 ATP par glucose.
Total “pay-off” : 4 ATP produits + 2 NADH.
Bilan net de la glycolyse (en tenant compte des –2 ATP investis au début) : +2 ATP / glucose (et 2 NADH cytosoliques).
Quelles sont les trois réactions irréversibles de la phase de restitution ?
Qu’est-ce que cela implique pour la néoglucogenèse ?
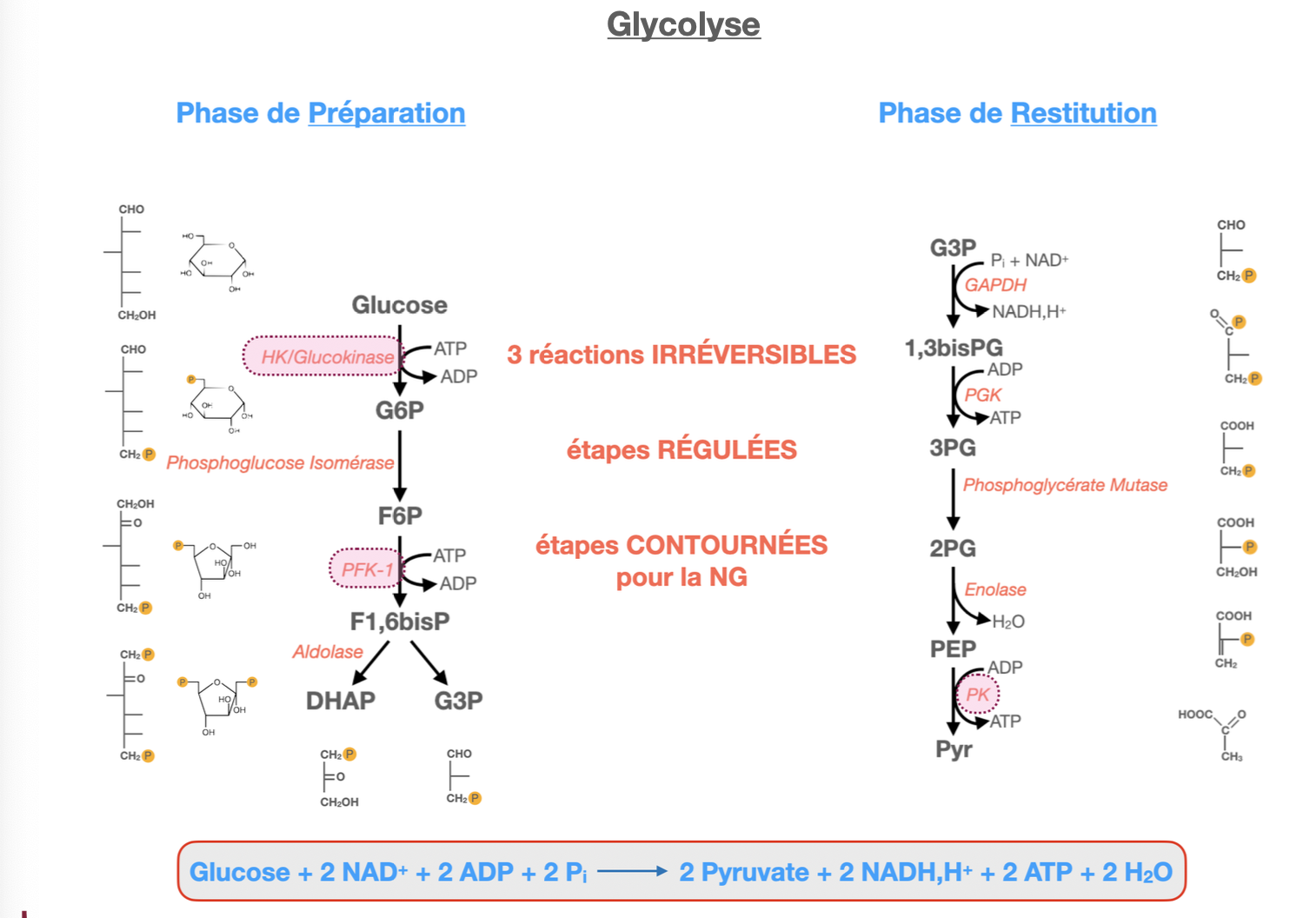
1) Quelles sont les trois réactions irréversibles de la phase de restitution ? (NB : il y a trois réactions irréversibles au total dans la glycolyse)
Quoi : Dans toute la glycolyse, les 3 étapes irréversibles sont :
Hexokinase/Glucokinase (HK/GK) : Glc → G6P (phase de préparation).
PFK-1 : F6P → F1,6BP (phase de préparation, commitment step).
Pyruvate kinase (PK) : PEP → Pyruvate (phase de restitution).
Important : dans la phase de restitution elle-même, la seule réaction irréversible est la PK.
Pourquoi : ΔG très négatifs (fortement exergoniques) : piégeage du glucose, orientation du flux (PFK-1) et « tirage » final (tautomérie énol→céto du pyruvate).
2) Qu’est-ce que cela implique pour la néoglucogenèse ? (il faut contourner les réactions irréversibles)
Quoi : Les voies inverses directes sont impossibles ; la néoglucogenèse utilise des dérivations enzymatiques (bypasses).
Comment/Où/Pourquoi :
Contourner HK/GK : Glucose-6-phosphatase (RE lisse hépatique/renal) : G6P → Glucose (déphosphorylation pour libérer le glucose).
Contourner PFK-1 : Fructose-1,6-bisphosphatase (FBPase-1) : F1,6BP → F6P (régulée inversement au couple PFK-1/F2,6BP).
Contourner PK (en 2 étapes, mitochondrie ↔ cytosol) :
Pyruvate carboxylase (PC, biotine, ATP) : Pyruvate → Oxaloacétate (OAA) (mitochondrie).
PEP carboxykinase (PEPCK, GTP) : OAA → PEP (cytosol ou mitochondrie selon tissu), avec navette malate/aspartate si besoin pour exporter l’équivalent réducteur.
Bilan énergétique (de 2 pyruvates à 1 glucose) : 4 ATP + 2 GTP + 2 NADH consommés — le coût compense l’irréversibilité énergétique de la glycolyse.
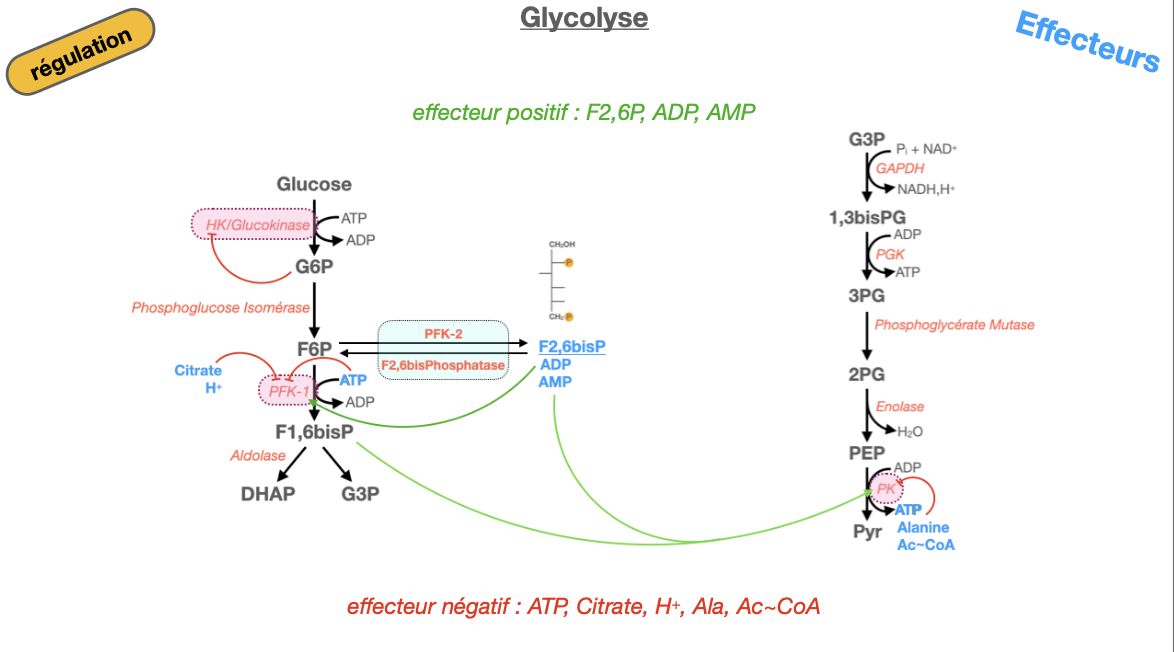
Glycolyse regulation: glycolyse : effecteur positif? effecteur negatif?
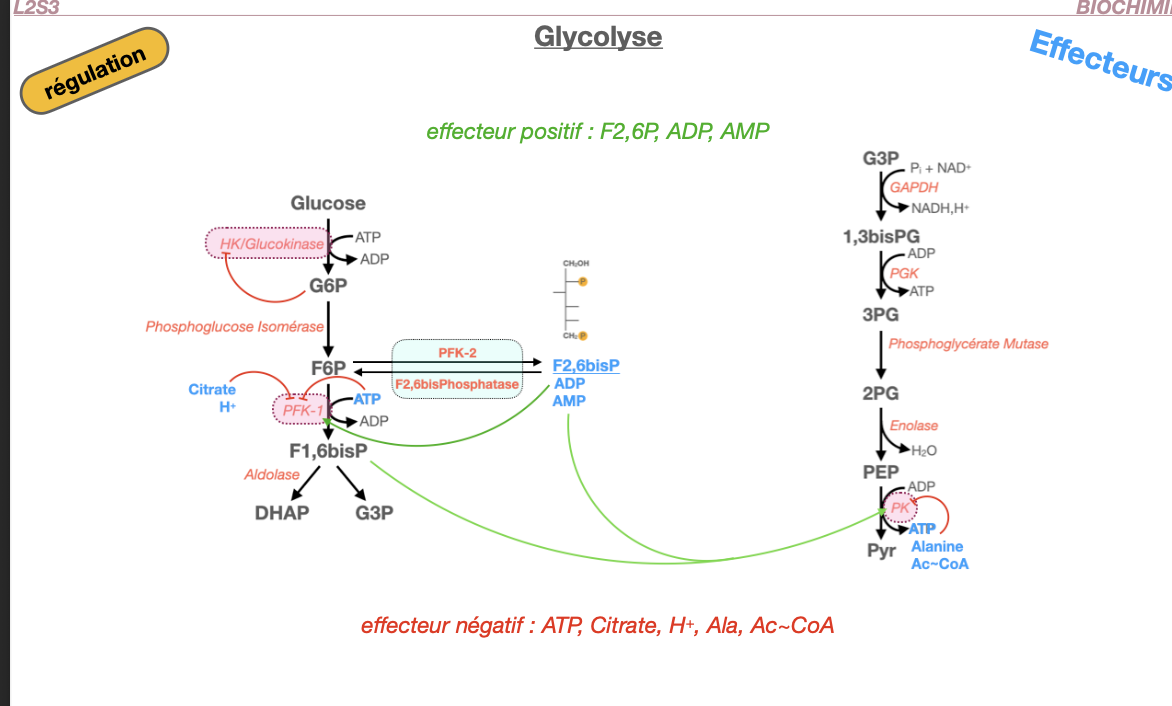
Quels sont les effecteurs positifs de la glycolyse ?
Quels sont les effecteurs négatifs de la glycolyse ?
Quelle est leur action précise (enzymes cibles et conséquences) ?1) Effecteurs positifs
AMP, ADP → activent PFK-1 (signal de faible charge énergétique) ⟶ ↑ flux glycolytique.
F2,6BP (formé par PFK-2) → active fortement PFK-1 et inhibe la FBPase-1 (bascule vers glycolyse).
F1,6BP → active PK (feed-forward) ⟶ favorise la formation de pyruvate.
(Insuline, via déphosphorylation de PFK-2/FBPase-2 dans le foie) ⟶ ↑ F2,6BP ⟶ ↑ PFK-1.
2) Effecteurs négatifs
ATP → inhibe PFK-1 (site allostérique) et inhibe PK (abondance d’énergie) ⟶ ↓ flux.
Citrate → inhibe PFK-1 (signal d’un cycle de Krebs déjà nourri).
H⁺ (acidose musculaire) → inhibe PFK-1 (protège d’une chute de pH due au lactate).
Alanine (foie, issue du pyruvate) → inhibe PK (l’anabolisme AA a la priorité).
Acétyl-CoA → inhibe PK (et oriente le pyruvate vers la PC pour l’anaplérose/NG).
(Glucose-6-phosphate) → inhibe l’Hexokinase (rétro-contrôle ; GK hépatique non inhibée par G6P, modulée par GKRP/insuline).
3) Action précise (enzymes/conséquences)
PFK-1 = étape d’engagement :
• Activée par AMP/ADP et F2,6BP ⟶ ↑ F1,6BP ⟶ ↑ flux.
• Inhibée par ATP, citrate, H⁺ ⟶ ↓ flux et bascule vers néoglucogenèse (via ↓ F2,6BP au foie).PK (hépatique surtout) :
• Activée par F1,6BP (feed-forward).
• Inhibée par ATP, alanine, acétyl-CoA ; glucagon/adrénaline → phosphorylation (PKA) → inactive ⟶ épargne le glucose en jeûne.HK/GK :
• HK freinée par G6P (piégeage ajusté).
• GK régulée à long terme par insuline (↑ expression) et GKRP (séquestration nucléaire quand F6P ↑, relâchée par F1P).
im occ
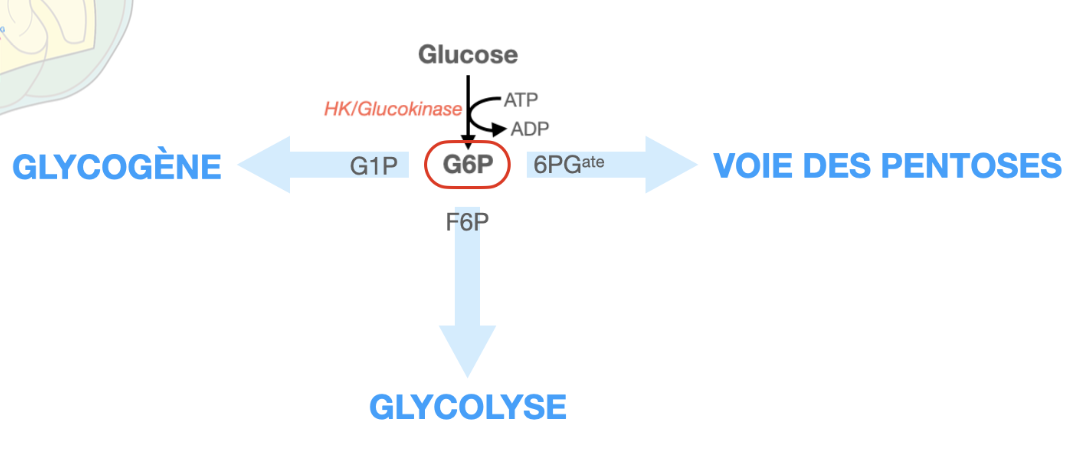
Schématiser le carrefour du G6P
La voie des pentoses est-elle ubiquitaire ?
À quoi sert-elle (NADPH,H⁺, pouvoir réducteur) ?
À quoi servent les pentoses synthétisés et quand sont-ils produits (si on ne fait que la partie oxydative) ?
Combien de pentoses obtient-on quand on fait la voie des pentoses en entier ?
Quelle est son équation-bilan ?
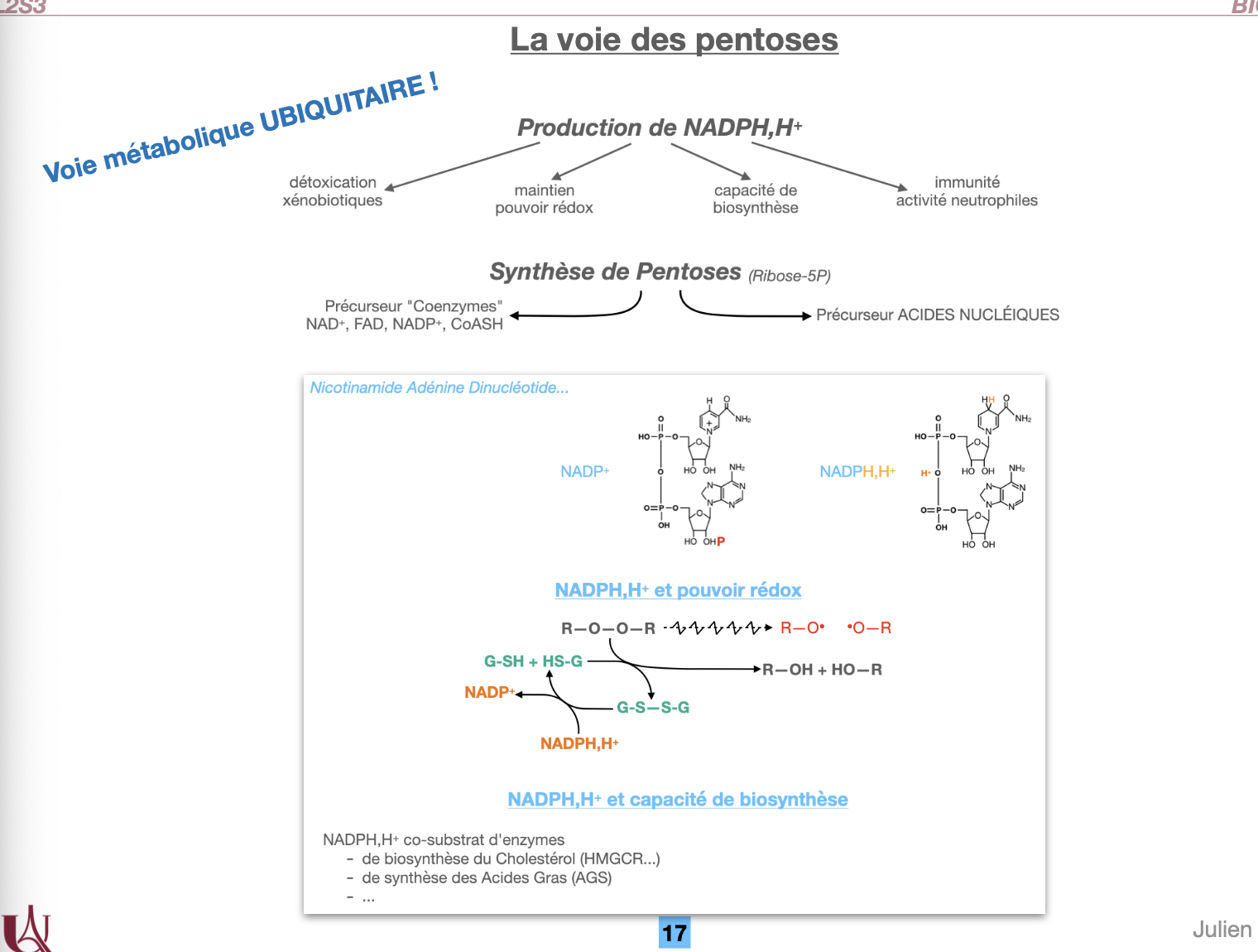
1. La voie des pentoses est-elle ubiquitaire ?
✅ Oui.
C’est une voie métabolique ubiquitaire, présente dans toutes les cellules, car elle répond à des besoins universels :
production de NADPH,H⁺ (pouvoir réducteur)
production de ribose-5-phosphate (précurseur des acides nucléiques et coenzymes).
2. À quoi sert-elle (NADPH,H⁺ et augmentation du pouvoir réducteur) ?
La voie des pentoses est la principale source de NADPH,H⁺ dans la cellule.
Le NADPH,H⁺ sert à :
Maintenir le pouvoir réducteur intracellulaire (régénération du glutathion réduit GSH → lutte contre les ROS, détoxication des xénobiotiques).
Biosynthèse réductrice : acides gras, cholestérol, hormones stéroïdes.
Immunité : le NADPH est utilisé par les neutrophiles dans la NADPH oxydase pour générer des espèces réactives de l’oxygène (ROS) microbicides.
3. À quoi servent les pentoses synthétisés et quand sont-ils produits (si on ne fait que la partie oxydative) ?
Les pentoses (ribose-5-phosphate) servent de précurseurs :
à la synthèse des acides nucléiques (ADN, ARN),
à la synthèse de certains coenzymes : NAD⁺, FAD, CoA, etc.
👉 Si la cellule réalise uniquement la phase oxydative, alors elle produit surtout NADPH,H⁺ et un peu de ribulose-5-phosphate (qui peut être isomérisé en ribose-5-phosphate).
Cela arrive surtout quand le besoin en NADPH est prioritaire (ex. foie, tissu adipeux, glandes surrénales, neutrophiles).
4. Combien de pentoses obtient-on quand on fait la voie des pentoses en entier ?
En réalité, si on fait l’ensemble du cycle (partie oxydative + partie non oxydative), le système peut réarranger les sucres (C5 ↔ C3 + C6) et ne pas accumuler de pentoses.
👉 Donc si on fait tourner la voie au complet avec recyclage → 0 pentose net produit, mais beaucoup de NADPH,H⁺.
Cela correspond au cas où le but principal est le NADPH, pas la synthèse de nucléotides.

🔹 LA VOIE DES PENTOSES
1. Généralités
1. La voie des pentoses est-elle ubiquitaire ?
2. Où se déroule-t-elle dans la cellule ?
3. Quels sont les produits principaux de la voie des pentoses ?
4. Quelles sont les réactions irréversibles de la voie ?
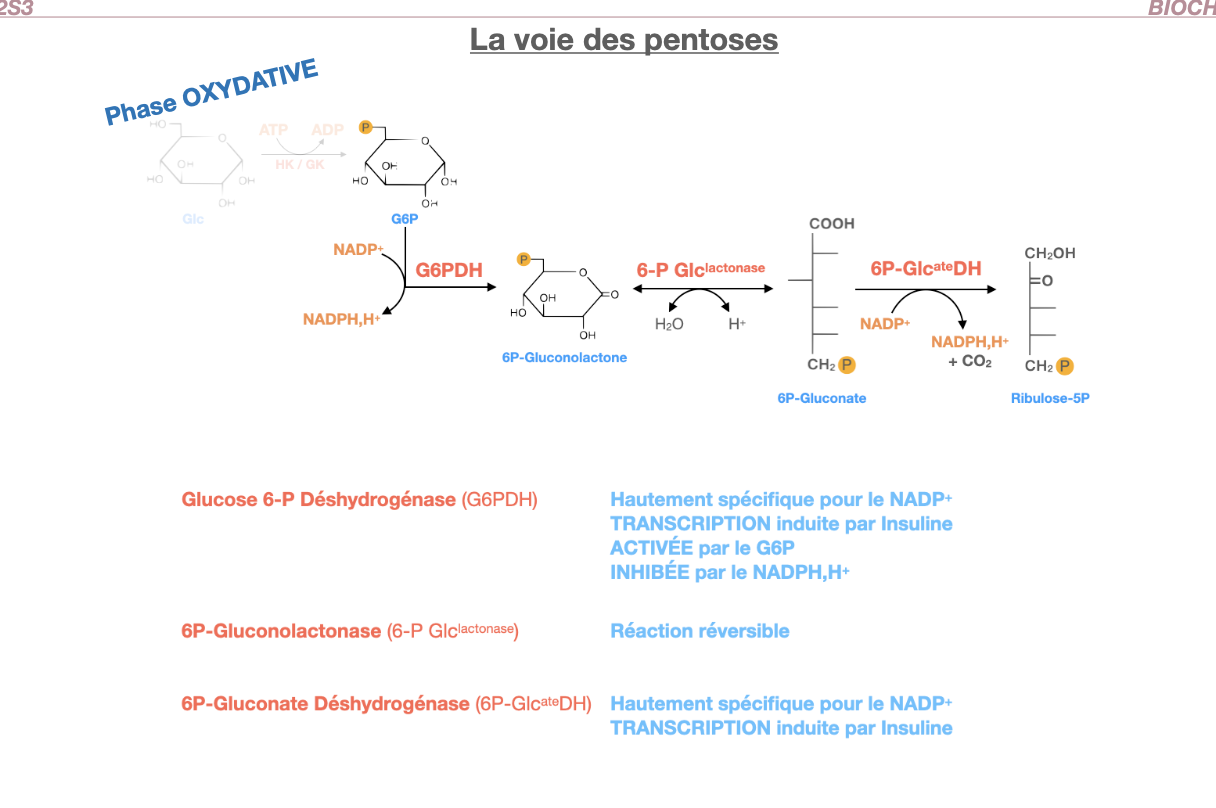
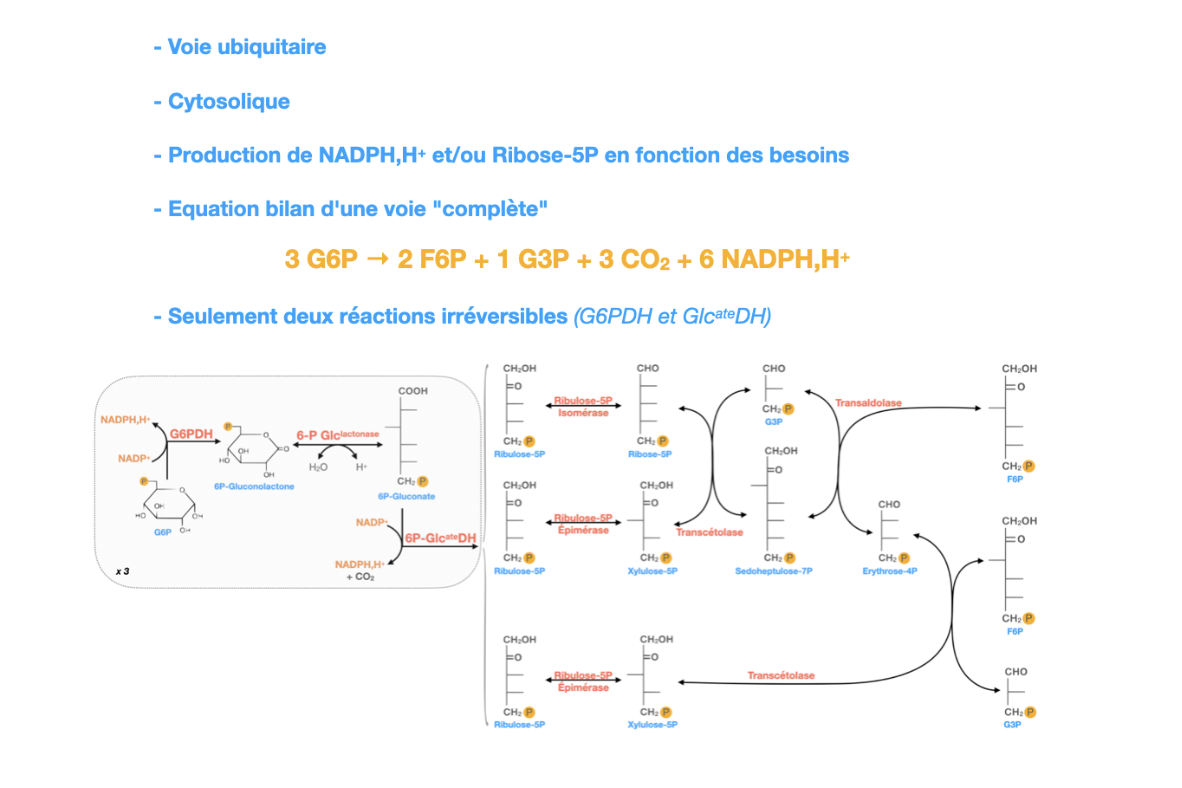
✅ Oui, c’est une voie ubiquitaire, présente dans toutes les cellules car les besoins en NADPH,H⁺ et en ribose-5-phosphate sont universels.
Elle est cytosolique, contrairement à la chaîne respiratoire qui est mitochondriale.
Les produits principaux sont :
NADPH,H⁺ → pouvoir réducteur (biosynthèse, détoxication, immunité).
Pentoses (ribose-5-phosphate) → précurseurs des acides nucléiques et coenzymes.
Seules deux réactions sont irréversibles : catalysées par la G6P déshydrogénase (G6PDH) et la 6P-gluconate déshydrogénase (6P-GlcDH).
2. Rôle métabolique
5. À quoi sert le NADPH,H⁺ produit ?
6. À quoi servent les pentoses synthétisés ?
7. Quand les pentoses sont-ils synthétisés (si on ne fait que la phase oxydative) ?
8. Combien de pentoses obtient-on quand on fait tourner la voie complète ?
Le NADPH,H⁺ est utilisé pour :
maintenir le pouvoir réducteur (glutathion réduit, détoxication des xénobiotiques),
la biosynthèse (acides gras, cholestérol, stéroïdes),
l’activité des neutrophiles (NADPH oxydase → ROS).
Les pentoses (ribose-5-phosphate) servent à la synthèse des acides nucléiques (ADN, ARN) et des coenzymes (NAD⁺, FAD, CoA, etc.).
Si la cellule fait seulement la phase oxydative, elle produit du NADPH,H⁺ et du ribulose-5-phosphate, qui peut être isomérisé en ribose-5-P.
👉 C’est le cas si la cellule a besoin de nucléotides (division cellulaire, prolifération).Si la voie complète (oxydative + non oxydative) fonctionne en mode production de NADPH seul, les pentoses formés sont recyclés → aucun pentose net n’est produit.
3. Régulation enzymatique
9. Quelle est l’enzyme clé de la voie des pentoses et comment est-elle régulée ?
10. Quelles sont les caractéristiques de la 6P-gluconolactonase ?
11. Quelles sont les caractéristiques de la 6P-gluconate déshydrogénase ?
L’enzyme clé est la Glucose-6-P Déshydrogénase (G6PDH) :
Hautement spécifique du NADP⁺.
Sa transcription est induite par l’insuline (stimulation en période post-prandiale, riche en glucose).
Elle est activée par le G6P (substrat).
Elle est inhibée par le NADPH,H⁺ (rétrocontrôle négatif).
La 6P-gluconolactonase hydrolyse le 6P-gluconolactone en 6P-gluconate.
Réaction réversible, non limitante.
La 6P-gluconate déshydrogénase :
Transforme le 6P-gluconate en ribulose-5-P avec libération de CO₂.
Produit une 2ème molécule de NADPH,H⁺.
Elle aussi est hautement spécifique du NADP⁺.
Sa transcription est induite par l’insuline.
4. Équation-bilan
12. Quelle est l’équation-bilan de la partie oxydative de la voie des pentoses ?
13. Quelle est l’équation-bilan d’une voie complète (oxydative + non oxydative) ?

Le carrefour du G6P
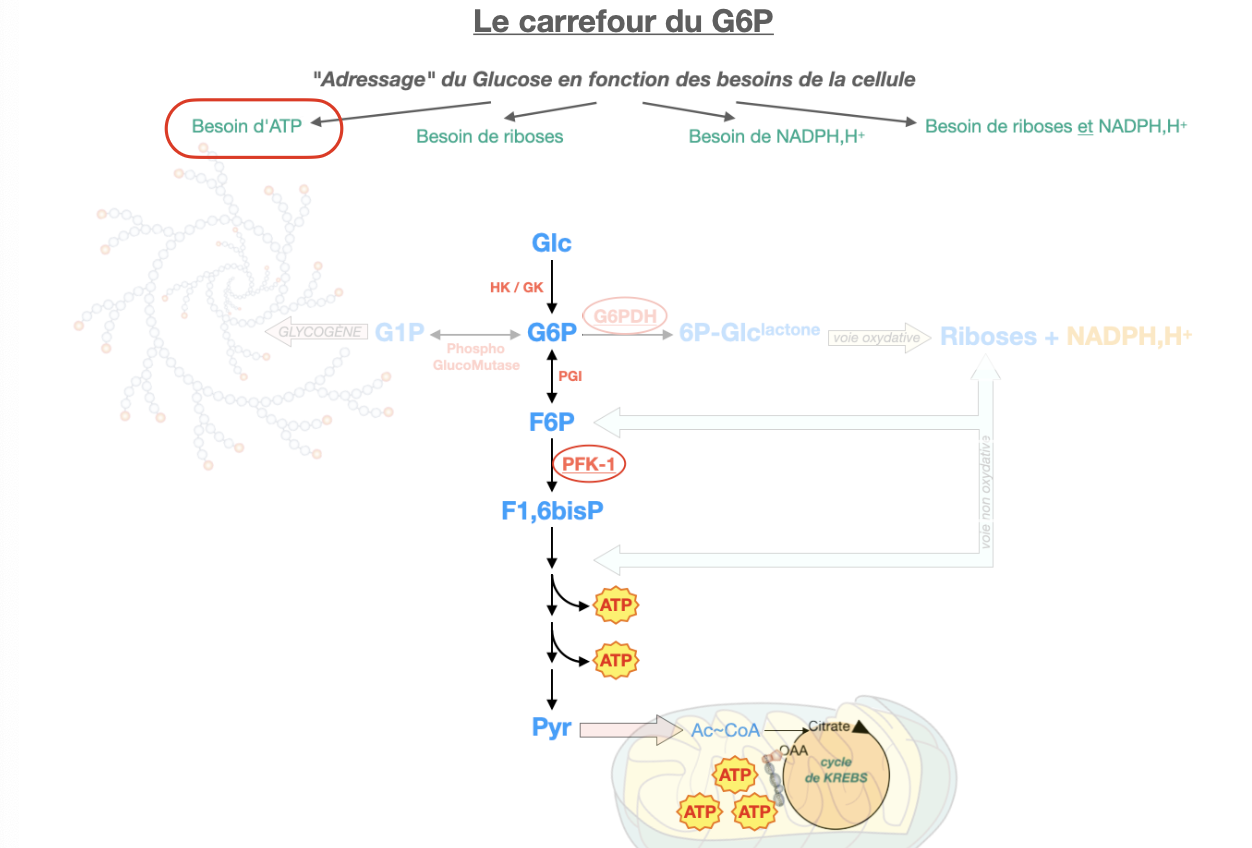
Q1. Qu’est-ce que le carrefour G6P (entrées/sorties majeures et enzymes-porte) ?
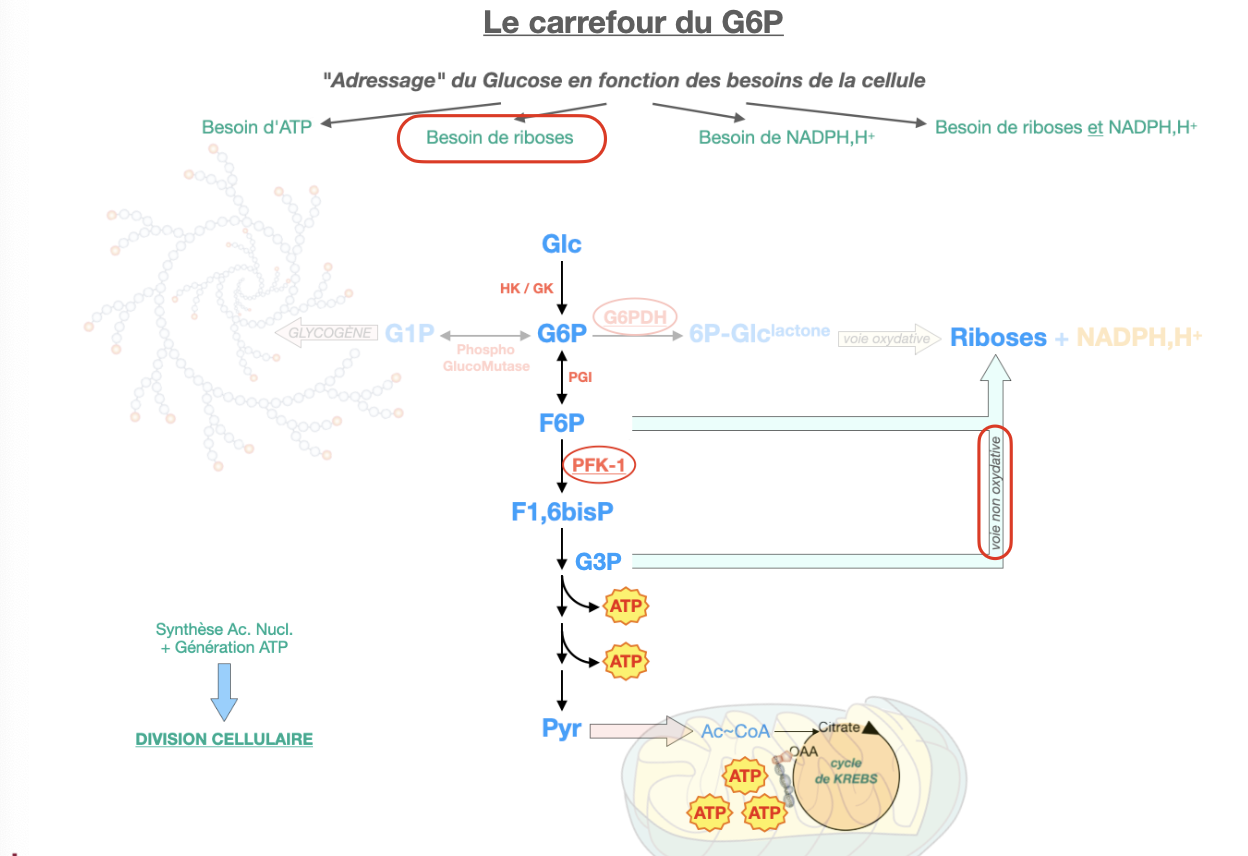
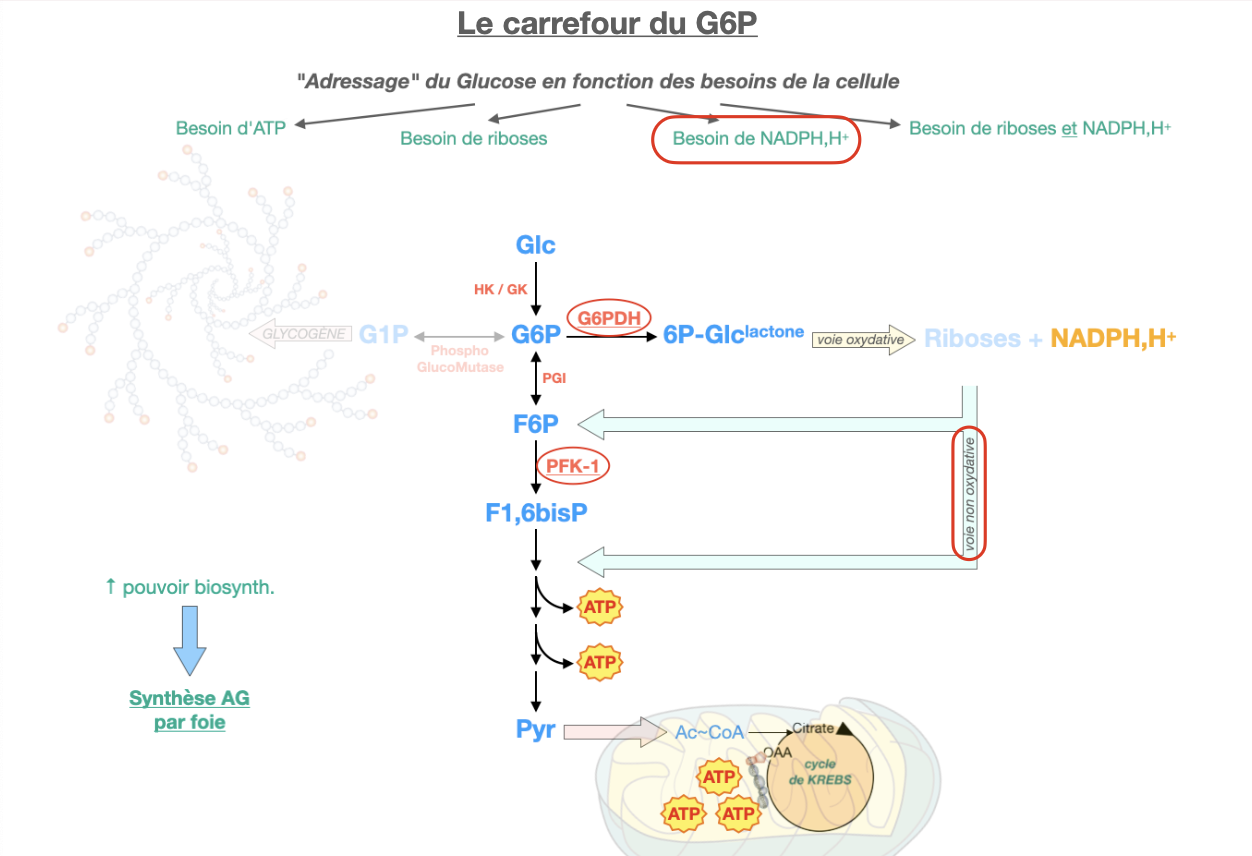
Q2. Comment le G6P est-il adressé selon le besoin : (a) excès de glucose, (b) besoin de riboses, (c) besoin de NADPH, (d) besoin de riboses + NADPH, (e) besoin d’ATP ?
Q3. Régulations clés qui orientent le flux (hormonales et allostériques : PFK-1, G6PDH, glycogène) ?
Q4. Spécificités tissulaires : foie vs muscle vs globule rouge / neutrophile ?
Q5. De G6P à UDP-glucose : étapes, enzymes et coût pour la glycogénogenèse ?
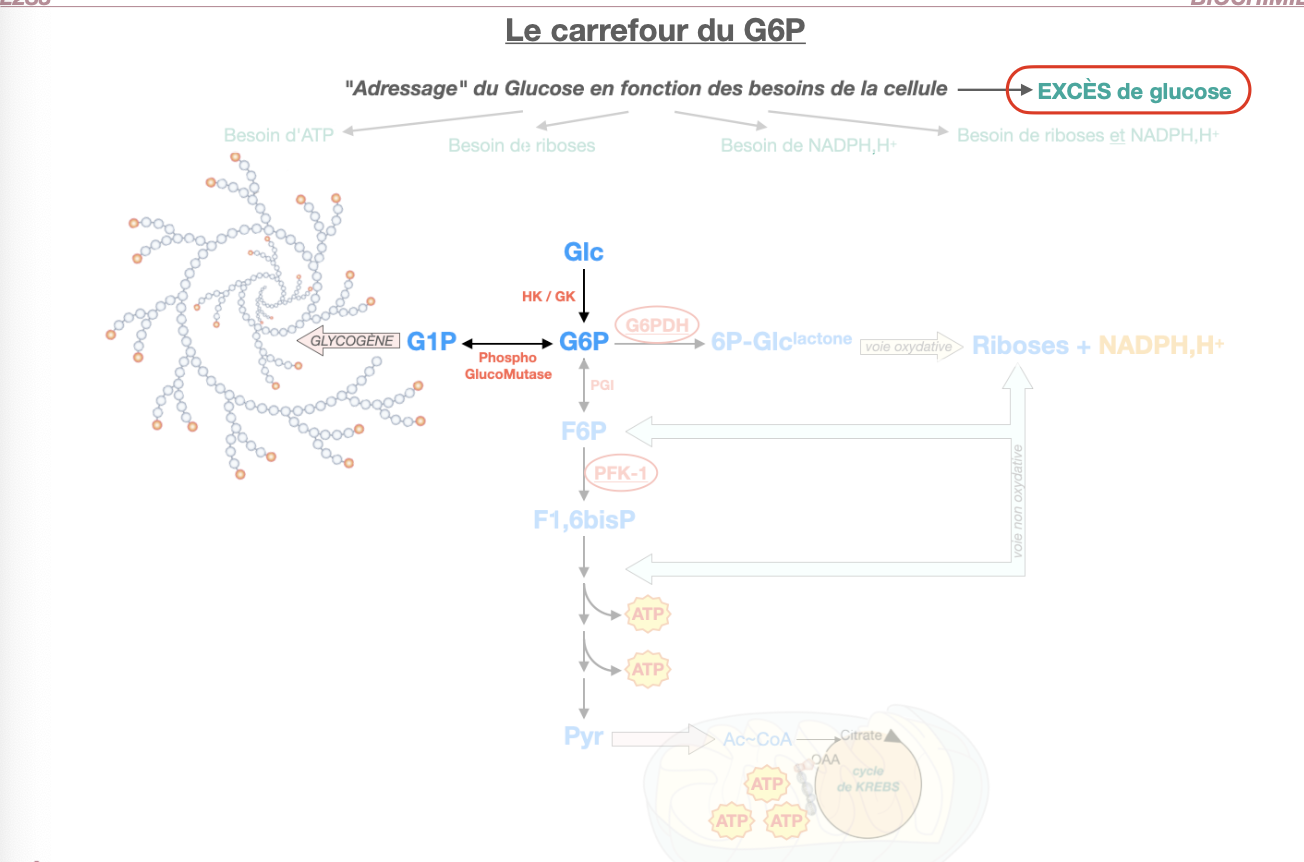
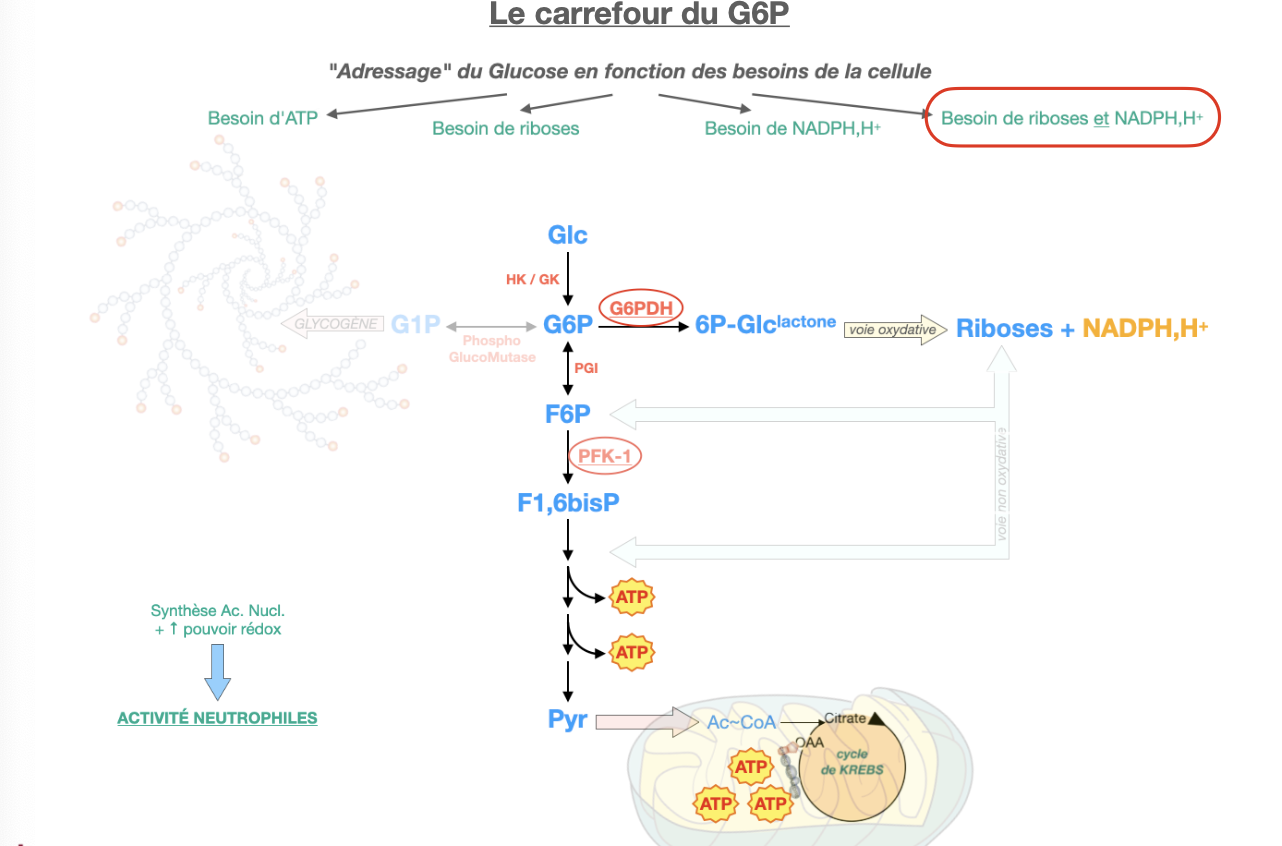
R1. Nœud cytosolique reliant : glycogène ⇄ G1P (phosphoglucomutase), glycolyse (PGI : G6P→F6P, puis PFK-1), voie des pentoses (G6PDH = porte oxydative), export hépatique (G6Pase). Entrée principale : HK/GK (Glc→G6P).
R2.
(a) Excès de glucose → glycogène (G6P→G1P→UDP-Glc→synthase) ± PPP.
(b) Riboses seuls → passer par glycolyse → non-oxydative PPP (F6P/G3P→R5P).
(c) NADPH seul → PPP oxydative (G6PDH), retour des sucres C5/C7 vers glycolyse.
(d) Riboses + NADPH → PPP oxydative complète (donne R5P + NADPH).
(e) ATP → glycolyse → pyruvate → mitochondrie (TCA/OxPhos).
R3.
PFK-1 : ↑ par AMP/ADP, ↓ par ATP/citrate (foie : F-2,6-BP l’active).
G6PDH : inhibée par NADPH, activée quand NADP⁺↑.
Glycogène : insuline/PP1 → synthase active, phosphorylase inactive ; glucagon/adrénaline/PKA font l’inverse. G6P active allostériquement la synthase ; AMP active la phosphorylase musculaire.
R4.
Foie : GK (Km↑), G6Pase+ ⇒ stockage, PPP ou export glycémique.
Muscle : HK I/II (Km↓, inhibée par G6P), pas de G6Pase ⇒ ATP via glycolyse.
GR : pas de mitochondries → PPP indispensable pour NADPH (glutathion).
Neutrophiles : NADPH pour burst oxydatif.
R5. G6P —(phosphoglucomutase)→ G1P —(UDP-glucose pyrophosphorylase)→ UDP-Glc + PPi (hydrolysé) → substrat de la glycogène-synthase. Coût : 1 UTP/glucose incorporé (≈ 1 ATP)
Le glycogène
🔹 A — Réactivité des amides
Q1. Pourquoi une amide (liaison peptidique) est-elle peu réactive en substitution acyle ? Qu’impliquent les pKa sur le nucléofuge et la catalyse acide ?
🔹 B — Hydrolyse acide des peptides
Q2. Quelles conditions et produits pour l’hydrolyse totale d’un peptide ?
Q3. Donner le schéma mécanistique minimal de l’hydrolyse acide d’une amide.
🔹 C — Synthèse peptidique : problèmes & solutions
Q4. Deux problèmes clés de la synthèse directe et leurs solutions ?
Q5. Pourquoi protéger certaines chaînes latérales et quels critères pour un bon protecteur ?
🔹 D — Stratégie pratique
Q6. En 4 mots-étapes, résumer la stratégie standard de synthèse peptidique.
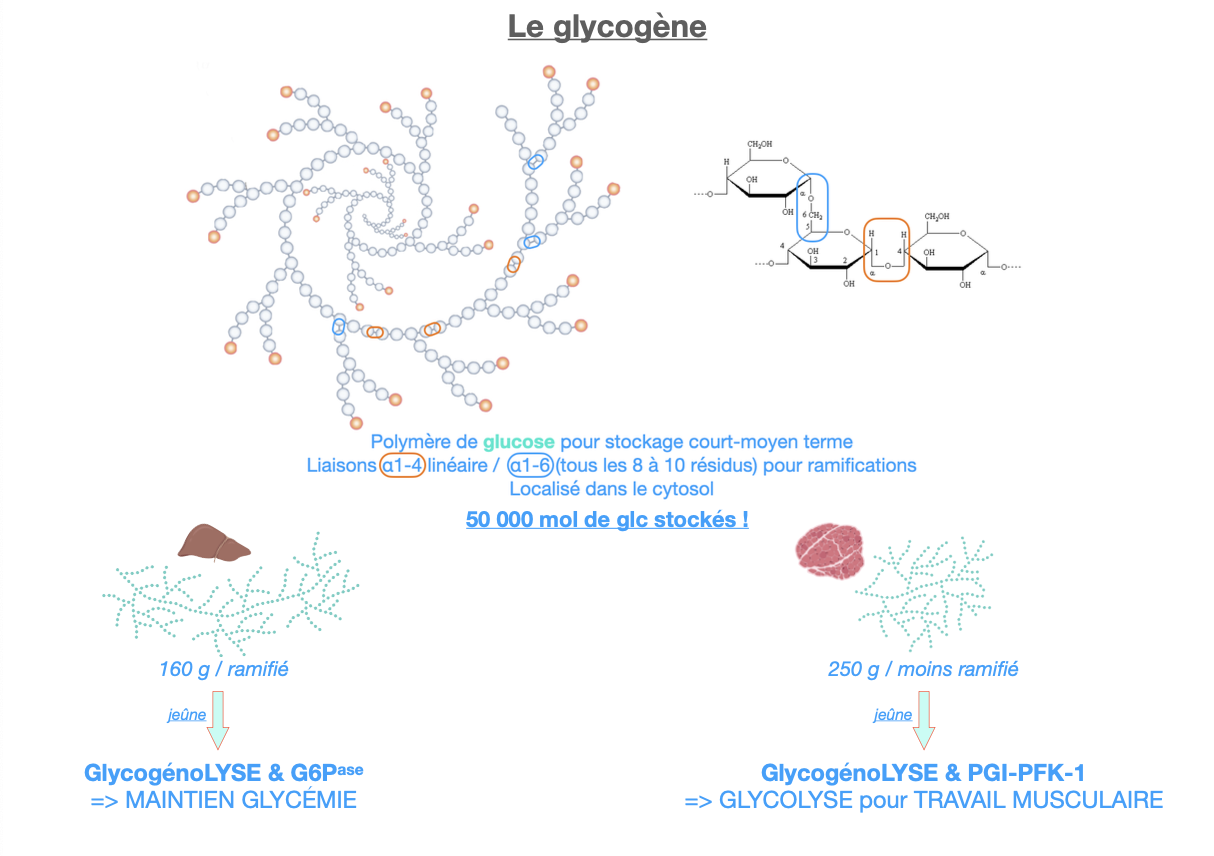
R1. Polymère de glucose cytosolique : liaisons α1→4 (chaînes) et α1→6 (branches tous les ~8–10 résidus).
R2. Foie ~160 g (très ramifié) ; muscle ~250 g (un peu moins ramifié).
R3.
Foie (jeûne) : glycogénolyse + G6Pase ⇒ glucose sanguin.
Muscle (effort) : glycogénolyse + PGI → PFK-1 ⇒ glycolyse/ATP (pas de G6Pase).
R4. Glycogénogenèse : amorçage par glycogénine → UDP-glucose (UTP) → glycogène-synthase (α1→4) → enzyme de branchement (α1→6). Coût : 1 UTP par glucose ajouté.
R5. Glycogénolyse : phosphorylase (α1→4 ⇒ G1P), enzyme débranchante (transférase + α-1,6-glucosidase). G1P → G6P (phosphoglucomutase) ; foie : G6Pase → glucose ; muscle : G6P → glycolyse.
R6. Insuline (PP1) : déphosphoryle ⇒ active synthase, inhibe phosphorylase.
Glucagon/adrénaline (cAMP-PKA) : phosphoryle ⇒ active phosphorylase, inhibe synthase.
Allostérie : G6P active synthase ; AMP active phosphorylase musculaire, ATP/G6P la freinent ; glucose inhibe phosphorylase hépatique.
Le carrefour du G6P
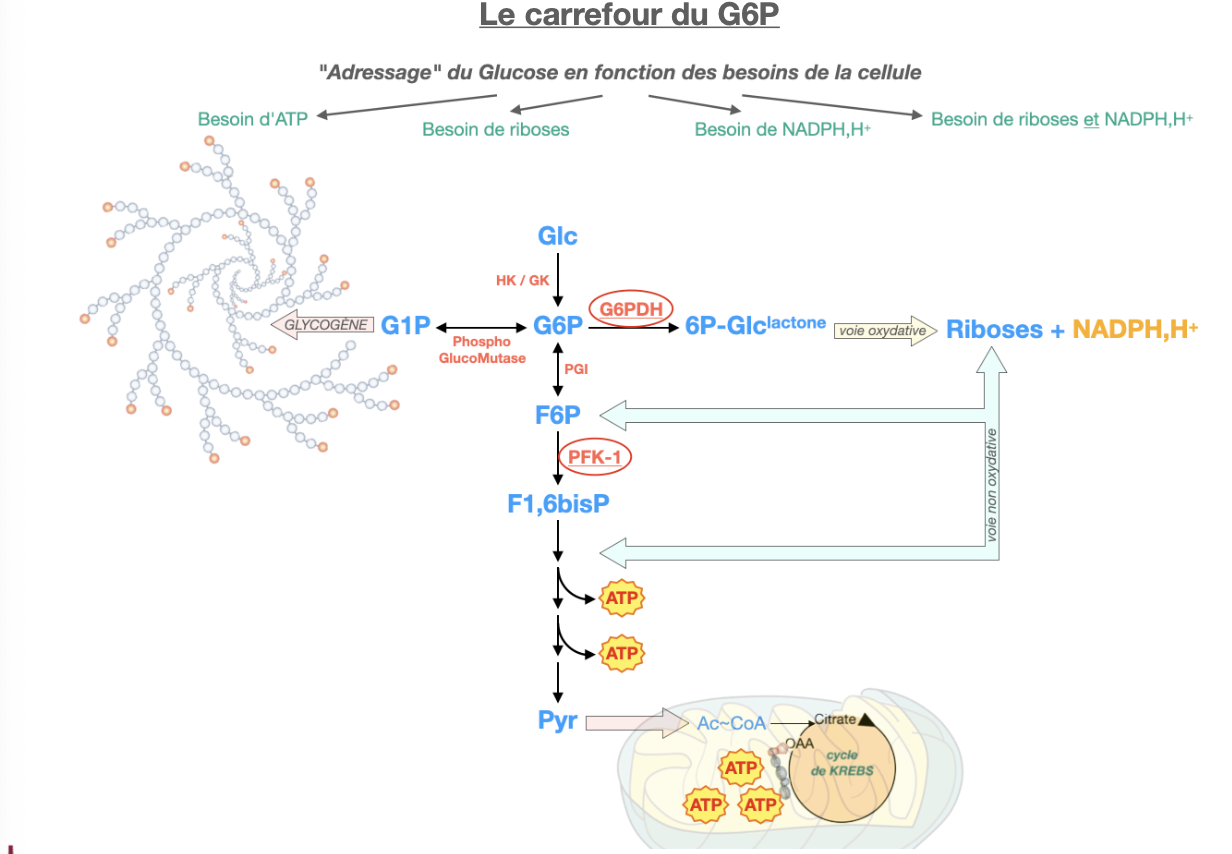
🔹 A — Destins du G6P
Q1. Citer les grands destins métaboliques du G6P et l’enzyme-porte pour chacun.
🔹 B — Départ de la glycogénogenèse
Q2. Quelles sont les étapes et enzymes de G6P → UDP-glucose ? Quel coût énergétique ?
🔹 C — Spécificités tissulaires / régulation
Q3. Différences foie vs muscle (entrée du glucose, sortie du glucose, choix d’orientation du flux) et principaux contrôles ?
🔹 D — Intérêt physiologique
Q4. Pourquoi le G6P est-il un carrefour central et que risque-t-on si la G6PD est déficiente ?
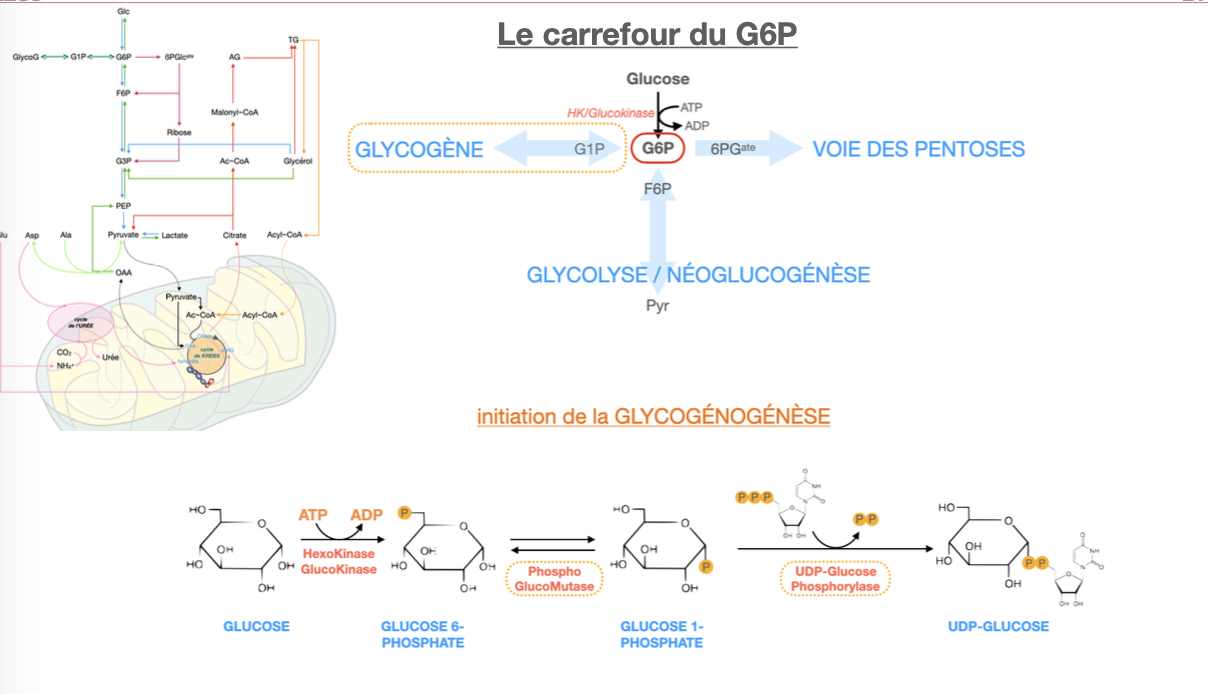
R1.
Glycogène ⇄ G1P (phosphoglucomutase).
Voie des pentoses : G6PD = « gate » (G6P → 6-phosphoglucono-δ-lactone).
Glycolyse : PGI (G6P → F6P) puis PFK-1.
Néoglucogenèse/Export hépatique : G6Pase (foie/RS) → glucose sanguin.
R2. G6P —(phosphoglucomutase)→ G1P —(UDP-glucose pyrophosphorylase)→ UDP-glucose + PPi ; PPi hydrolysé tire la réaction. Coût : 1 UTP par glucose incorporé (équiv. 1 ATP).
R3.
Foie : glucokinase (HK IV) à Km élevé (capte quand glycémie ↑) ; G6Pase présente (peut relarguer du glucose). Orientation flexible vers glycogène, PPP ou export.
Muscle : hexokinase I/II (Km faible, inhibée par G6P) ; pas de G6Pase → flux prioritaire vers glycolyse/ATP.
Contrôles : hormones (insuline favorise synthase/glycogène ; glucagon/adrénaline via PKA favorisent phosphorylase), allostérie (G6P active synthase ; AMP active phosphorylase musculaire ; ATP/G6P l’inhibent).
R4. Le G6P connecte stockage (glycogène), énergie rapide (glycolyse), pouvoir réducteur/biosynthèse (NADPH & ribose via PPP) et maintien glycémie (G6Pase hépatique). Déficit G6PD → ↓NADPH, stress oxydant érythrocytaire → hémolyse (ictère/crises hémolytiques).
La glycogénogenèse
Q1. Définition, où/quand a lieu la glycogénogenèse ?
Q2. Voie d’activation du glucose et enzymes clés jusqu’à UDP-glucose ?
Q3. Initiation : rôle de la glycogénine et du premier amorçage ?
Q4. Élongation et enzyme branchante : réactions, fréquence et intérêt des α1→6 ?
Q5. Coût énergétique par résidu incorporé et régénération du nucléotide sucre ?
Q6. Régulation (foie vs muscle) : hormonal + allostérique de la glycogène-synthase ?
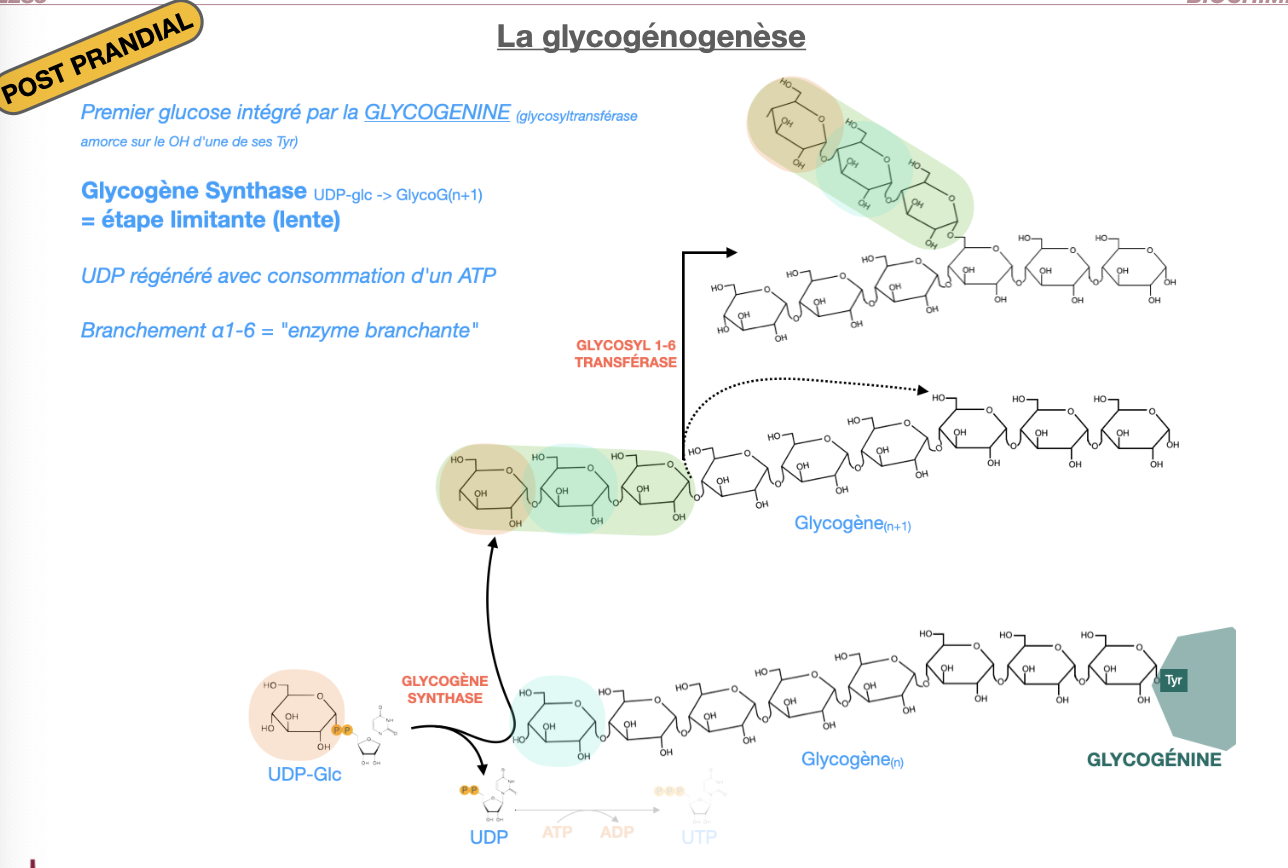
R1. Synthèse de glycogène à partir de glucose dans le cytosol, surtout post-prandial ; très active dans foie (stockage glycémie) et muscle (réserve locale d’ATP).
R2. Glc —(HK/GK)→ G6P —(phosphoglucomutase)→ G1P —(UDP-glucose pyrophosphorylase)→ UDP-Glc + PPi (hydrolysé).
R3. Glycogénine (Tyr-OH) s’auto-glucosyle (≈ 8 résidus α1→4) : amorce sur laquelle la glycogène-synthase peut travailler.
R4. Glycogène-synthase ajoute des glucosyls (UDP-Glc) en α1→4 aux extrémités non réductrices. Enzyme branchante (amylo-(1,4→1,6)-transglycosylase) transfère un segment (~6–7 résidus) pour créer une liaison α1→6 toutes 8–10 unités ⇒ ↑ solubilité, ↑ extrémités ⇒ synthèse/dégradation rapides.
R5. 1 UTP consommé par glucose incorporé (via UDP-Glc) ; UDP est régénéré en UTP par nucléoside-diphosphate kinase : ATP + UDP → ADP + UTP (≈ coût 1 ATP).
R6.
Hormonal : insuline/PP1 → déphosphoryle ⇒ glycogène-synthase active ; glucagon/adrénaline/PKA → phosphoryle ⇒ inactive (foie > muscle). Insuline via Akt inhibe GSK3 (↓ phosphorylation inhibitrice).
Allostérique : G6P active la synthase (même forme b) ; Ca²⁺/AMP orientent le muscle vers glycogénolyse (indirectement freinent la synthèse).
La physiologie du glycogène
🔹 A — Bilan & enzymes
Q1. Quel est le bilan net énergétique et les enzymes clés de la glycogénogenèse à partir de G6P ?
Q2. Quelle est l’étape limitante de la glycogénogenèse et comment démarre l’amorçage ?
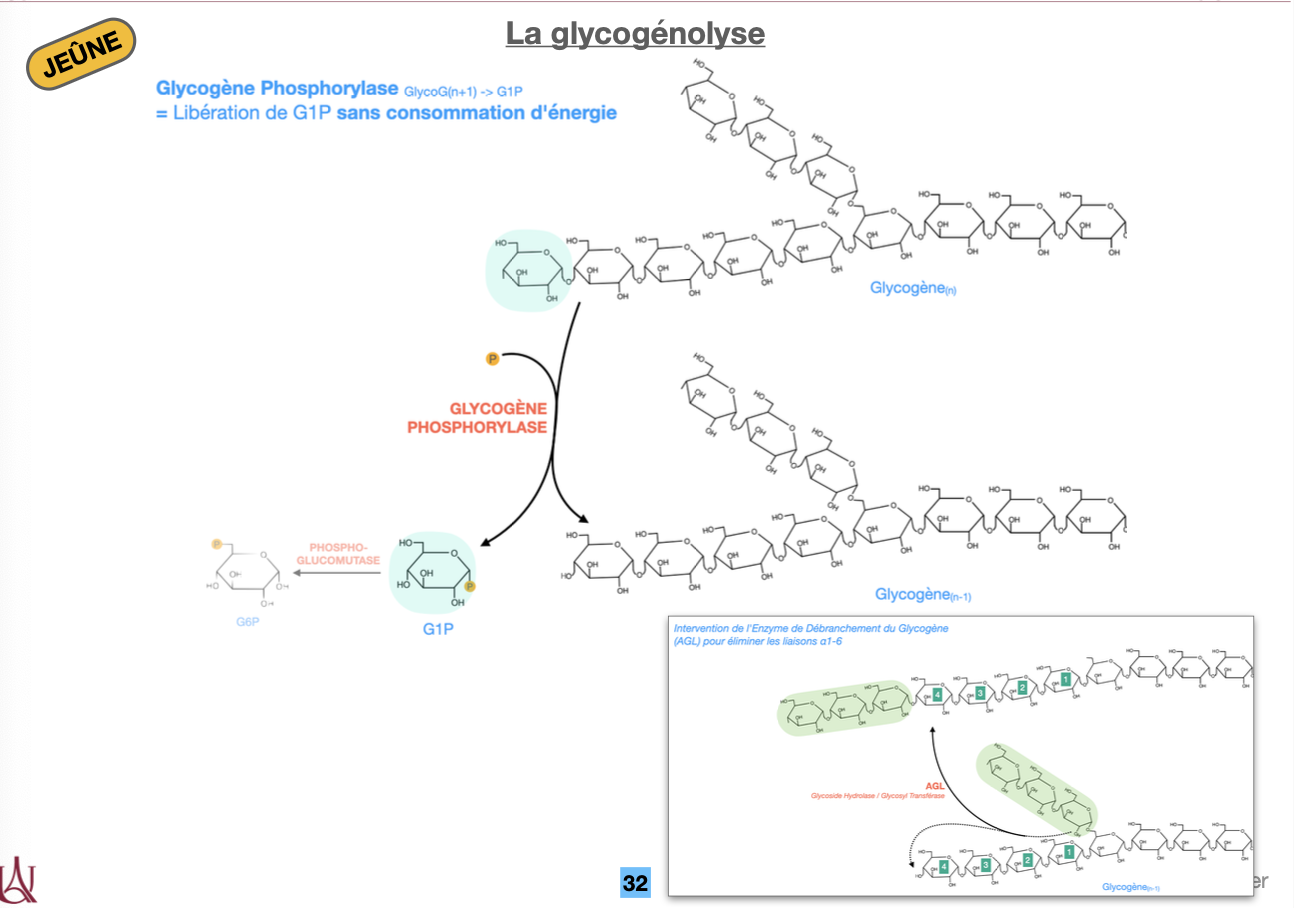
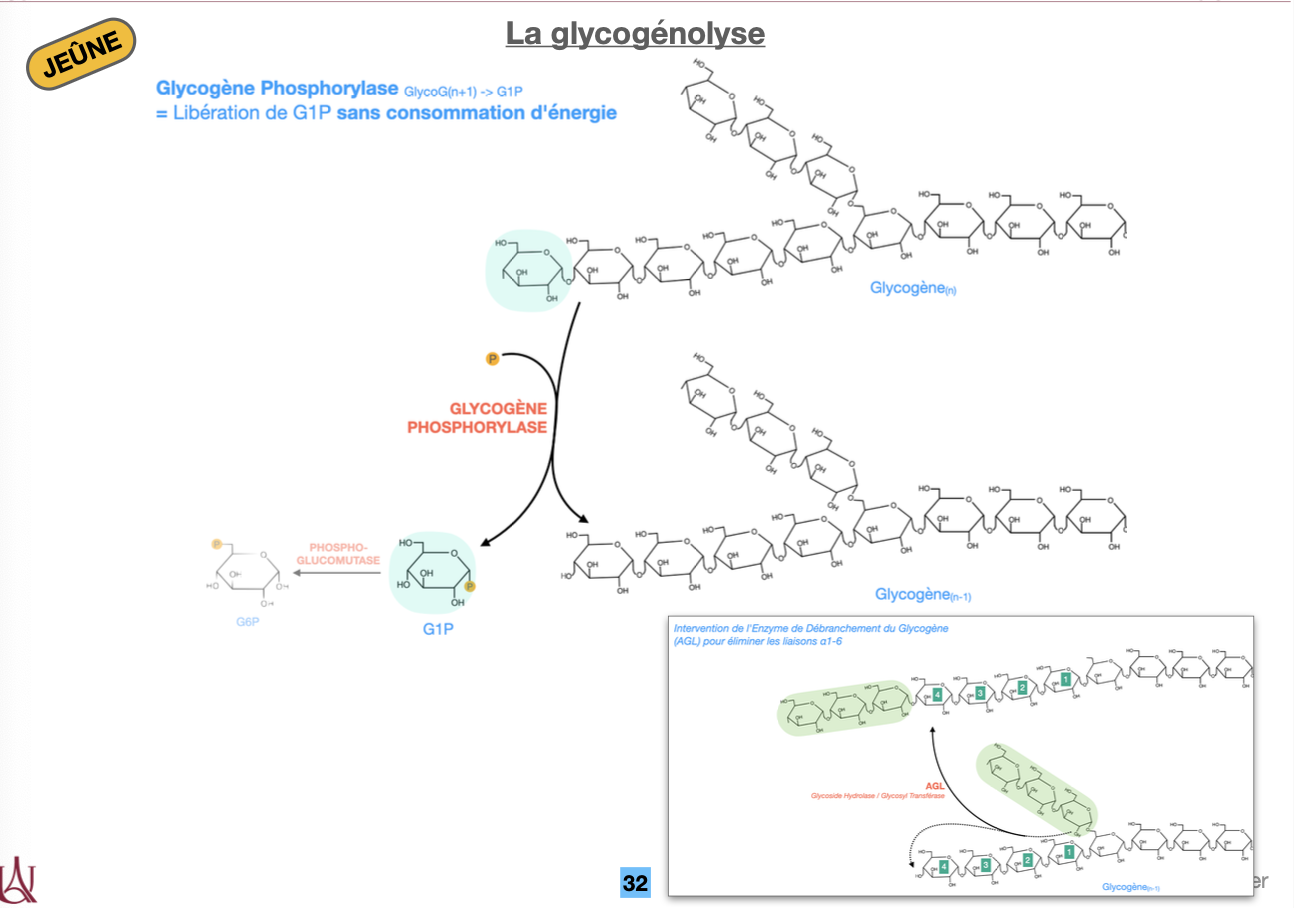
🔹 B — Dégradation
Q3. Quelles enzymes réalisent la glycogénolyse et quels produits sont libérés (α1→4 vs α1→6) ?
Q4. Pourquoi dit-on que la glycogénolyse ne consomme pas d’ATP et quel est le gain ATP en glycolyse musculaire ?
🔹 C — Intégration physiologique
Q5. Que fait le foie en post-prandial vs jeûne ? et le muscle à l’effort ?
Q6. Contrôle hormonal majeur (insuline vs glucagon/adrénaline) sur synthase et phosphorylase ?
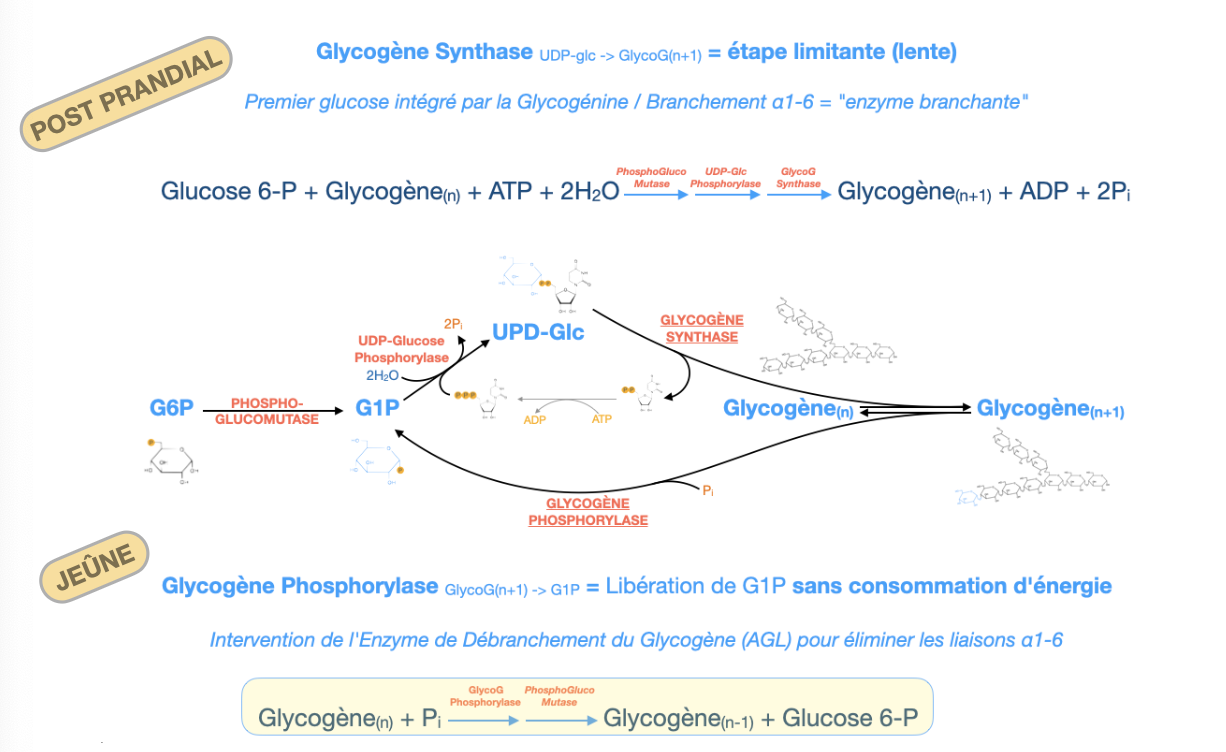
R1. G6P → G1P (phosphoglucomutase) → UDP-Glc (UDP-glucose pyrophosphorylase) → allongement α1→4 (glycogène-synthase) → branches α1→6 (enzyme branchante). Coût net : ~1 ATP/glucose incorporé (via UTP régénéré par ATP).
R2. Étape limitante : glycogène-synthase. Amorçage par glycogénine (auto-glucosylation sur Tyr, ~8 résidus α1→4).
R3. Glycogène phosphorylase enlève les α1→4 → G1P. Près d’une branche : enzyme débranchante (AGL) = transférase + α-1,6-glucosidase → libère un glucose libre au point α1→6.
R4. La phosphorylase fait une phosphorolyse (Pi) ⇒ G1P sans ATP. Dans le muscle, le glucose issu du glycogène entre en G6P sans hexokinase ⇒ glycolyse anaérobie : +3 ATP/glucose (vs +2 depuis glucose libre).
R5. Foie :
Post-prandial → glycogénogenèse (stockage).
Jeûne → glycogénolyse + G6Pase → glucose sanguin.
Muscle : glycogénolyse → G6P → glycolyse pour ATP local (pas de G6Pase).
R6. Insuline/PP1 : déphosphoryle → synthase active, phosphorylase inactive.
Glucagon/adrénaline/PKA : phosphoryle → phosphorylase active, synthase inactive.
Allostérie : G6P ↑ synthase ; AMP ↑ phosphorylase musculaire, ATP/G6P l’inhibent ; glucose inhibe la phosphorylase hépatique.
La régulation du métabolisme du glycogène
Q1. Quelle est la logique hormonale (glucagon/adrénaline vs insuline) et quelles kinases/phosphatases pilotent glycogénolyse vs glycogénogenèse ?
Q2. Quelles sont les formes actives des deux enzymes clés (glycogène phosphorylase et glycogène-synthase) et leur état de phosphorylation ?
Q3. Allostérie musculaire à l’effort vs au repos : rôles de AMP, ATP, G6P, Ca²⁺ ?
Q4. Particularités hépatiques : rôle du glucose et des hormones sur la glycogénolyse ?
Q5. Intégration physiologique : que se passe-t-il post-prandial vs jeûne/effort ?
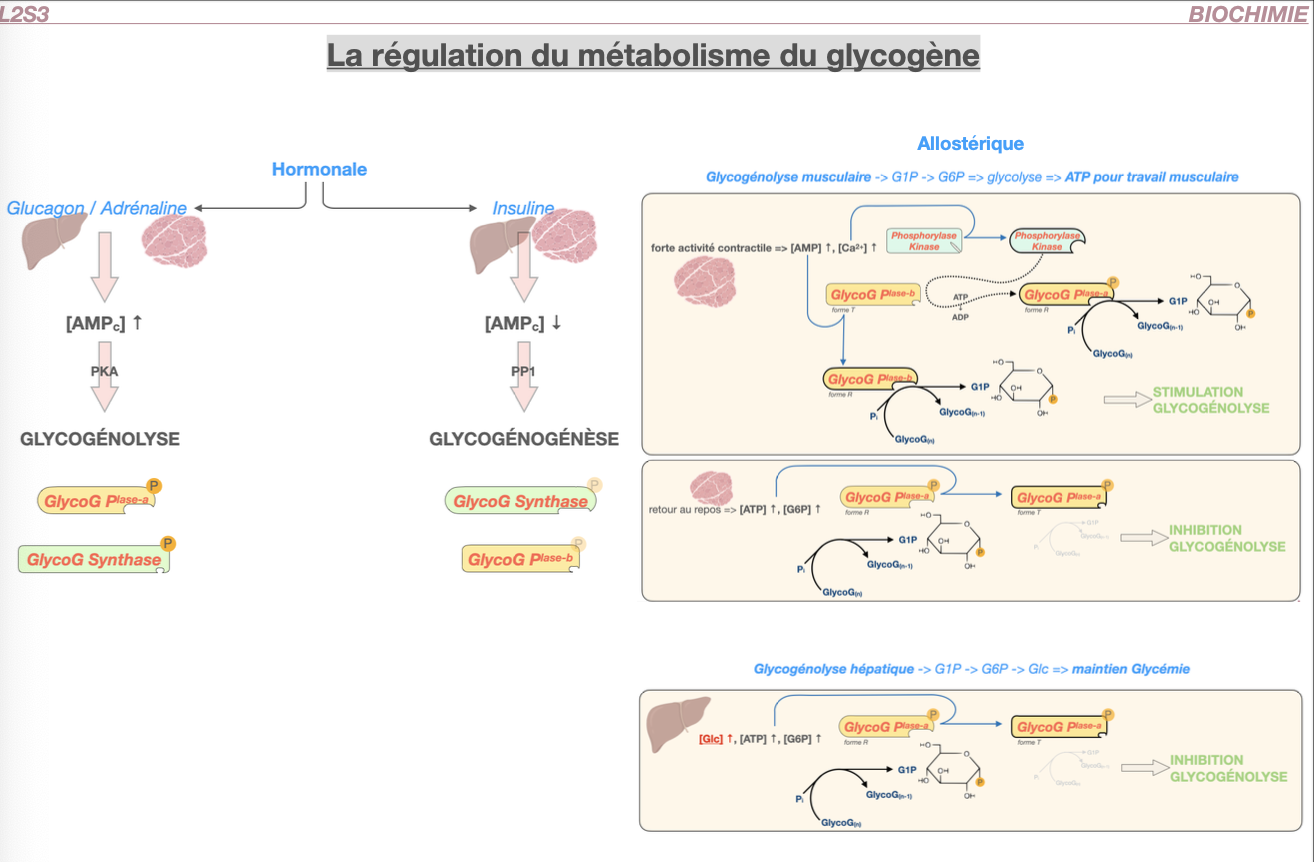
R1.
Glucagon/Adrénaline → cAMP → PKA → Phosphorylase kinase (PhK) ⇒ active la glycogénolyse et phosphoryle/inhibe la glycogène-synthase.
Insuline → PP1 (et Akt ↓GSK3) ⇒ déphosphoryle : active la glycogène-synthase, inhibe la phosphorylase.
R2.
Phosphorylase a (P, phosphorylée) = active ; phosphorylase b (déP) = moins active.
Synthase a (déP) = active ; synthase b (P, phosphorylée) = inactive.
(PKA/PhK poussent vers a pour phosphorylase et b pour synthase ; PP1 fait l’inverse.)
R3.
Muscle – effort : AMP↑ et Ca²⁺-calmoduline activent PhK → phosphorylase a ; AMP active allostériquement la phosphorylase b.
Repos : ATP/G6P inhibent la phosphorylase ; G6P active allostériquement la synthase.
R4.
Foie : glucagon (± adrénaline) via PKA → glycogénolyse.
Glucose élevé se fixe sur phosphorylase a hépatique → la rend sensible à PP1 → inactivation de la phosphorylase et relance de la synthèse.
R5.
Post-prandial (insuline) : glycogénogenèse (synthase a), glycogénolyse freinée.
Jeûne/effort (glucagon au foie, adrénaline muscle/foie) : glycogénolyse (phosphorylase a), synthèse freinée ; au muscle, le G6P va à la glycolyse/ATP