Chimie bloc 3
1/162
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
163 Terms
La tendance à l’énergie minimale
Les atomes forment des liaisons pour accéder à un niveau d'énergie inférieur, entraînant une libération d'énergie.
Liaison ionique
Transfert d'électrons d'un atome à un autre, entre un métal qui perd des électrons et un non-métal qui en gagne.
Déterminer les températures de fusion et d’ébullition
Il faut déterminer le nombre et la force des liaison intermoléculaire
Force de dispersion
Force dipôle dipôle (électronégatif et géométrie)
Liaisons hydrogène
Si ils ont le même nombre de force, il faut chercher leur intensité
Dispersion: augmente avec la taille
Dipôle: différence d’électronégatif
Hydrogène F> O > N
Quelle force il faut briser pour changer d’état
Les forcé intermoléculaire
Quelle force il faut briser pour séparer deux électrons
Les liaisons covalente = ionique > métallique
Comment déterminer la force d’une liaison covalente
Ordre de liaison : triple > double > simple
Taille des atomes : plus les atomes sont petits → meilleure recouvrement → liaison plus forte
Différence d’électronégativité modérée : un bon partage d’électrons renforce la liaison
Déterminer la force d’une Liaison métallique
Nombre d’électrons délocalisés : plus il y en a, plus la liaison est forte
Taille des atomes : plus l’atome est petit → les noyaux sont plus proches → attraction plus forte
Structure du métal : les métaux de transition (comme Fe, Ni, Cr) ont souvent des liaisons métalliques plus fortes
Déterminer la force d’une liaison ionique
Charge ionique élevée : plus les ions sont chargés (Mg²⁺ vs Na⁺), plus l’attraction est forte.
Rayon ionique petit : plus les ions sont petits, plus ils peuvent se rapprocher → force accrue.
Propriété des alcanes
Plus la chaîne de carbone est long et plus la température d’ébullition augmente.
Quelle sont les force intramoléculaire
Liaison ionique
Liaison covalente
Liaison métallique
Quels sont les forces les plus forte au plus faible
Liaison ionique
Liaison covalente
Liaison métallique
Liaison hydrogène
Dipôle-dipôle
Forces de dispersion (London
Polarité selon les groupe fonctionnel
Tout les groupes sont polaire sauf les alcane
Attraction électrostatique
Force entre ions de charges opposées.
Liaison covalente
Partage d'électrons entre deux atomes, généralement entre deux non-métaux.
Partage d'électrons
Peut être un partage égal ou inégal selon l'électronégativité des atomes.
Liaison métallique
Mise en commun d'électrons entre plusieurs atomes métalliques, permettant la conductivité électrique et la malléabilité.
Liaisons intermoléculaires
Forces d'attraction entre différentes molécules, incluant les forces dipôle-dipôle, les forces de Van der Waals et les liaisons hydrogène.
Propriétés physiques
Influencées par les liaisons intermoléculaires comme les températures de fusion et d'ébullition.
Formation d'une liaison covalente
Deux orbitales se rapprochent pour former une liaison entre deux électrons de valence non appariés.
Forces attractives
Forces entre électrons et noyaux lors de la formation d'une liaison covalente.
Forces répulsives
Forces entre noyaux et entre électrons eux-mêmes lors de la formation d'une liaison covalente.
Diagramme d'énergie
Représentation de la diminution de l'énergie potentielle par rapport a la distance entre les noyaux lors de la formation d'une liaison covalente.
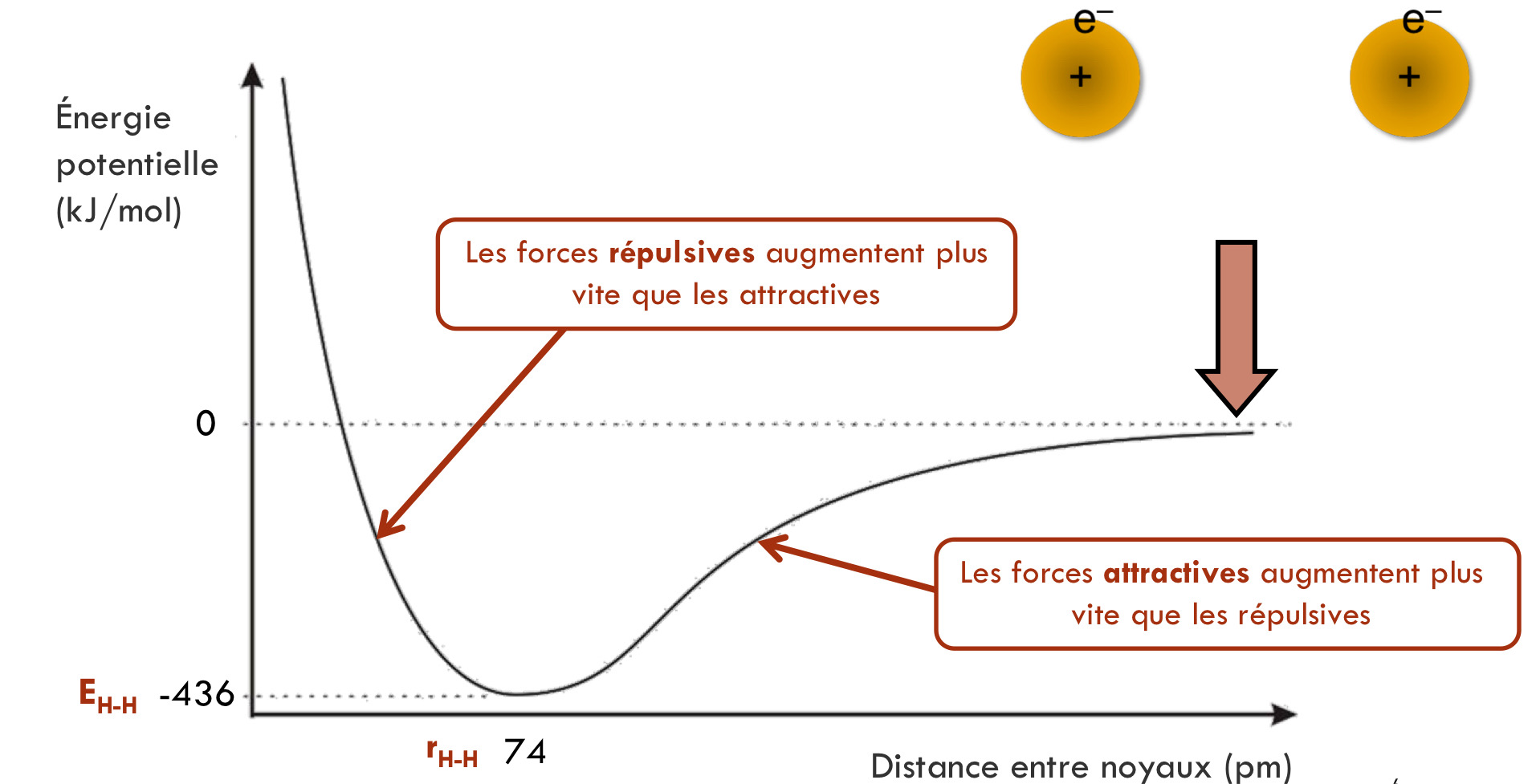
Énergie potentielle
Stabilisation sous forme moléculaire, influencée par la distance entre les atomes.
Longueur de la liaison
Distance à laquelle les forces de répulsion et d'attraction sont égales.
Énergie de la liaison
Énergie dégagée lors de la formation d'une liaison.
Modèle de Lewis
Proposition d'un modèle de liaison où deux atomes mettent des électrons en commun pour obtenir une couche externe pleine.
Théorie de la liaison de valence (LV)
Théorie découlant de la mécanique quantique concernant les liaisons entre atomes.
Théorie des orbitales moléculaires (OM)
Théorie découlant de la mécanique quantique concernant la distribution des électrons dans les molécules.
Objectif du diagramme de Lewis
Objectif : Agencer les atomes afin de mettre en évidence la mise en commun d’électrons (liaisons).
Représentation de chaque atome à l’aide de symboles des e- de valence.
Permet de prédire l’arrangement spatial des molécules.
Étapes pour déterminer la structure de Lewis
1) Déterminer l'atome central, 2) Établir le squelette, 3) Identifier l'état de valence, 4) Représenter les électrons, 5) Unir les atomes, 6) Vérifier la règle de l'octet, 7) Vérifier la configuration électronique.
État de valence
Correspond au nombre de liaisons covalentes qu'un atome peut former.
Doublet liant
Doublet d'électrons qui participe à une liaison.
Doublet non liant
Doublet d'électrons qui ne participe pas à la liaison.
État de valence excité
État où un atome redistribue ses électrons de valence pour permettre le plus grand nombre de liaisons.
Promotion électronique
Processus par lequel un atome obtient de l'énergie pour redistribuer ses électrons de valence.
Orbitale 3
La première qui peut atteindre le niveau d et donc distribuer plus d'électrons.
Gaz nobles
Atomes qui ne font jamais de liaisons à l'état fondamental.
Règle de l'octet
Tendance qu'ont certains atomes à s'entourer de 8 électrons (incluant doublets libres et doublets liants).
Certains atomes respectent toujours la règles de l’octet
Si, C, N, O Et F
Octet incomplet
Certain atome ne possède pas le nombre d'électrons nécessaire pour former la règle, le bore et le berylium en sont un exemple.
Octet étendu
Quand les électrons sont promus dans une orbitale d, l'atome peut être entouré d'un nombre plus élevé d'électrons.
Anion
Espèce chimique ayant un surplus d'électron(s). Pour un anion polyatomique, les e- en surplus sont ajoutés à l'atome le plus électronégatif. ()-
Cation
Espèce chimique ayant un déficit d'électron(s). Pour un cation polyatomique, les e- sont enlevés à l'atome le moins électronégatif. ()+
Géométrie moléculaire
La géométrie d'une molécule influence les propriétés physiques, chimiques, la polarité et l'activité biologique.
Théorie de répulsion des paires d'électrons de valence (RPEV)
Permet de connaître la disposition tridimensionnelle de la molécule basée sur la géométrie de répulsion.
Géométrie de répulsion
Molécule dont l'atome ne contient aucun doublet libre. Linéaire, triangulaire plane, tétraédrique, base triangulaire, octaédrique

Formule générale des molécules
ABx, où x est le nombre d'atomes de l'élément B, avec 5 possibilités : AB2, AB3, AB4, AB5 et AB6.
Géométrie triangulaire plane
Géométrie d'une molécule avec la formule AB3, SP2 Et 120 degré.
Géométrie tétraédrique
Géométrie d'une molécule avec la formule AB4, SP# et 109,5 degré.
Géométrie linéaire
Géométrie d'une molécule avec la formule AB2, SP1 et 180 degré.
Géométrie bipyramidale à base triangulaire
Géométrie d'une molécule avec la formule AB5, SP3d et 120 et 90 degrés.
Géométrie octaédrique
Géométrie d'une molécule avec la formule AB6,SP3d2 et 90 degré .
Géométrie moléculaire
Quand un atome contient des doublets libres
AB2E
Angulaire, < 120°
AB3E2
Angulaire, < 109,5°
AB3E
Pyramide à base triangulaire,< 109,5° Et < 107°
AB5E
Pyramide à base carrée, 90°
AB4E
À bascule, < 90°< 120°
AB3E2
En T, <90°
AB3E3
Linéaire, 180°
AB4E2
Plane carée, <90°
RPEV
Répulsion des Paquets d’Électrons de Valence
Modèle RPEV
La géométrie autour d'un atome dépend du nombre de « paquets » d'électrons de valence qui l'entourent.
Distance des paquets
Les « paquets » d’électrons adoptent des positions aussi éloignées que possible les uns des autres, afin de minimiser les répulsions (théorie De Gillespie).
Étapes d’applications
1. Écrire la structure de Lewis. Case quantique, excité, diagrame en regroupant les électrons
2. Calculer le nombre de paquets d’électrons (liants et non-liants) autour de l’atome central et déterminer la géométrie de répulsion.
- Une liaison double ou triple compte pour un seul paquet.
- Les doublets libres prennent plus de place que les doublets liants !
3. Déterminer la géométrie moléculaire en considérant seulement la disposition des atomes (doublets liants).
- Déterminer les angles des liaisons
- Déterminer la polarité de la molécule
Angle de liaison
Position des 3 noyaux impliqués dans deux liaisons (deux doublets liants issus d'un même atome).Les doublets non liants occupent plus d’espace. Ils ont tendance à comprimer les angles de liaisons.
Polarité
Fait qu'une molécule ou une liaison ait une répartition inégale des charges électriques.
Liaison non-polaire
Impliquant généralement 2 atomes identiques, avec une différence d'électronégativité nulle.
Liaison polaire
Présente lorsque les 2 atomes impliqués ont des électronégativités différentes.
Delta
Symbole de la charge partielle. Peut être aussi montrer sous une flèche
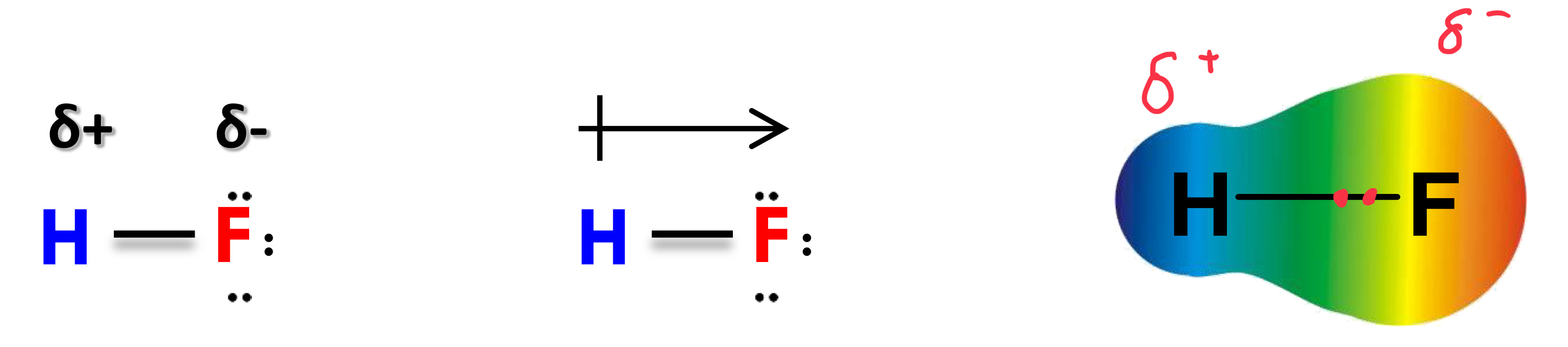
Molecule polaire
Une molécule est polaire si elle possède un moment dipolaire non nul.
Moment dipolaire (µ)
Somme des moments dipolaires vectoriels des liaisons qui constituent une molécule.
Dépendance du moment dipolaire
Le moment dipolaire d'une molécule dépend de la polarité des liaisons et de la géométrie de la molécule.
Formule du moment dipolaire
µ = Q x d
Doublets non-liants et polarité
Une molécule qui a des doublets non-liants sera généralement polaire et vice-versa.
Liaison covalente
Une liaison covalente résulte du recouvrement des orbitales atomiques (OA), entre deux atomes, contenant deux électrons célibataires et de spin opposé.
Densité électronique
La densité électronique est donc à son maximum dans la région de recouvrement axiale entre les noyaux (liaison σ).
Liaison sigma
La liaison sigma est une liaison covalente résultant du recouvrement des orbitales atomiques (OA), entre deux atomes.
Recouvrement
Le recouvrement, c'est quand deux orbitales atomiques de deux atomes se croisent ou se superposent pour former une liaison chimique.
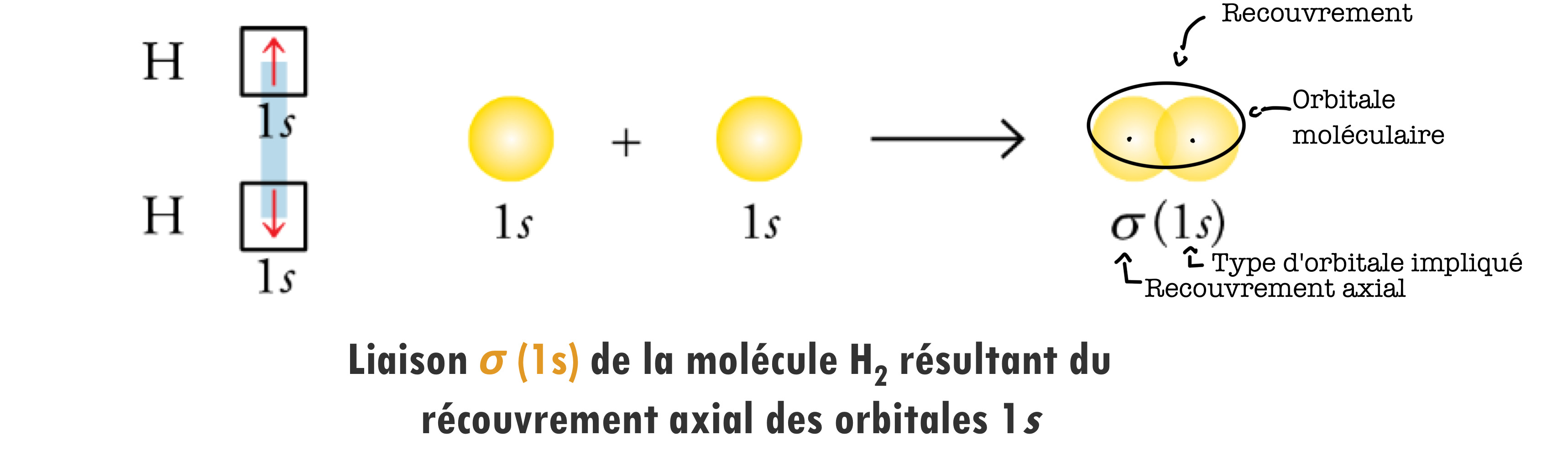
Forme d'une liaison σ
La forme d'une liaison σ dépend des orbitales atomiques dont elle provient.
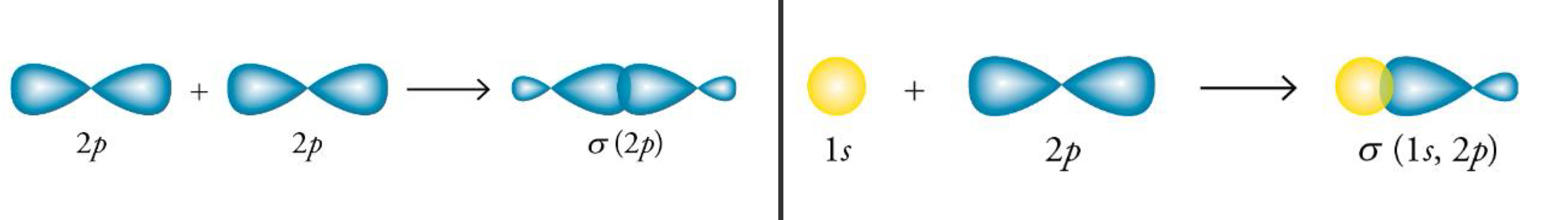
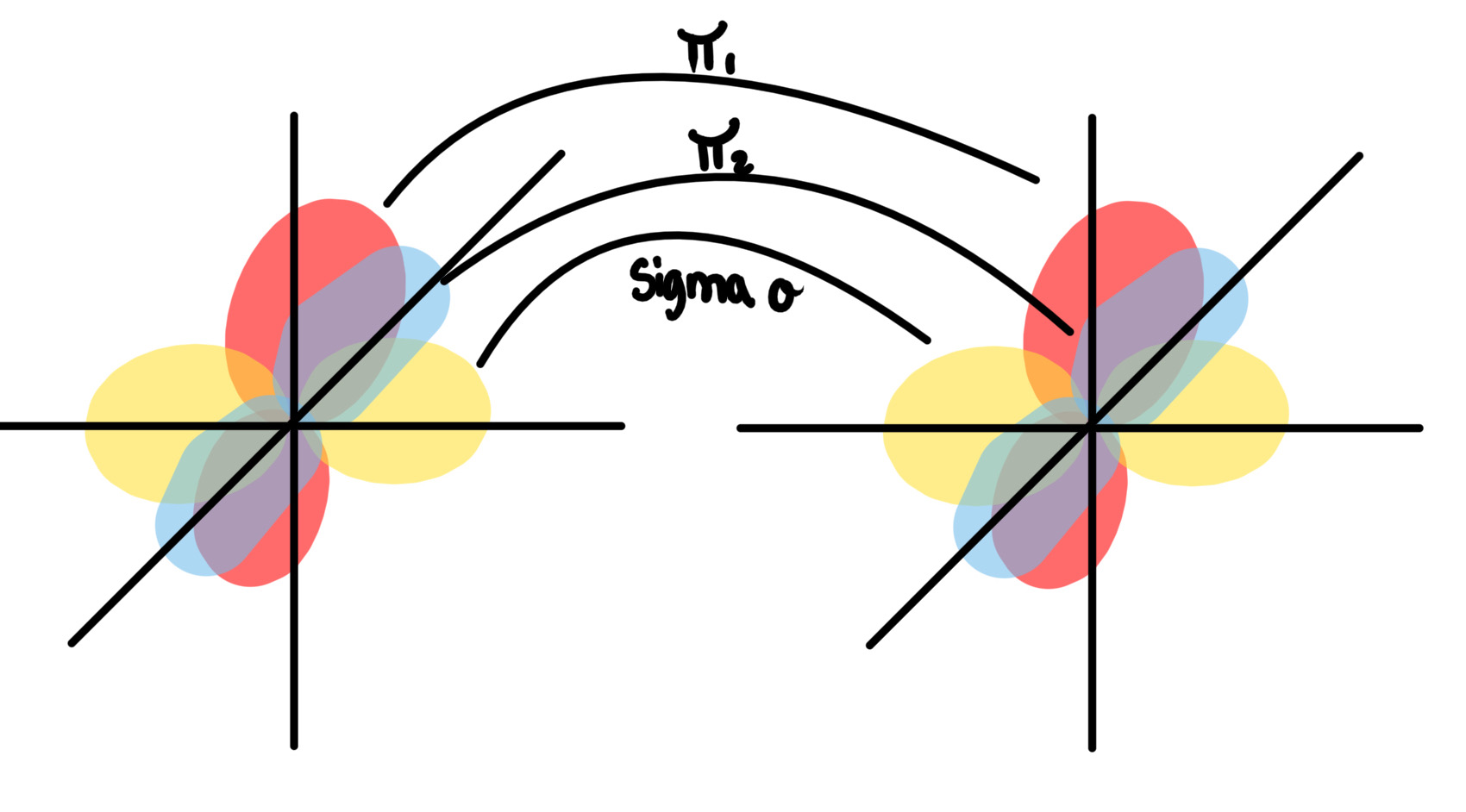
Liaison pi
La liaison pi est générée lorsque le recouvrement latéral des orbitales se produit.
Liaison pi 2 et 3
1) la premiere orbitale qui se touchent vont generer une liaison sigma (axial)
2) pi 1, quand sigma est impossible, recouvrement latérale
3) la dernière liaison: Recouvrement latérale
Les deux liaison pi sont facile à briser
Formation des liaisons
Ce sont les électrons de valence célibataires qui sont responsables de la formation des liaisons covalentes.
Électrons dans une liaison
Une liaison comprend toujours 2 électrons ou plus.
Ordre de formation des liaisons
La première liaison à se former sera une liaison sigma, car il s'agit de la meilleure place disponible.
Liaison de coordinence
Liaison covalente dont le doublet d'électrons qui assure la liaison provient du même atome.
Propriétés de la liaison de coordinence
Nécessite un atome porteur d'un doublet d'électrons libre et un autre atome ayant une orbitale vide. Demande une grande quantité d’énergie.
Molécules organiques
Les molécules organiques sont composées de carbone, d'hydrogène, d'oxygène et d'azote.
Alcanes
Ils sont des composés organiques sans fonction, contenant seulement du carbone et de l'hydrogène. Il ne contiennent que des liaison simples.
Formule des alcanes
CnH2n+2, où n représente le nombre d'atomes de carbone.
Nom des Arcanes
Ils sont nommées selon le nombre d’atome de carbones qu’ils contiennent , suivis de la terminaison « -ane »
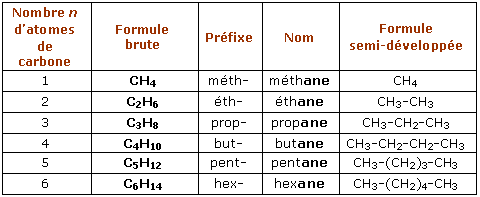
Alcane avec 1 atome de carbone
Méthane
Alcane avec 2 atome de carbone
Éthane
Alcane avec 3 atome de carbone
Propane
Alcane avec 4 atome de carbone
Butane
Alcane avec 5 atome de carbone
Pentane
Alcane avec 6 atome de carbone
Hexane
Une formule semi-développée
Elle donne l’ordre d’enchaînement des atomes à respecter (H sur le C qui précède).
Groupement fonctionnel
Un groupement fonctionnel est une caractéristique structurale qui confère une réactivité au composé.
Alcool
R-OH