anions : réactions d'identification
1/16
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
17 Terms
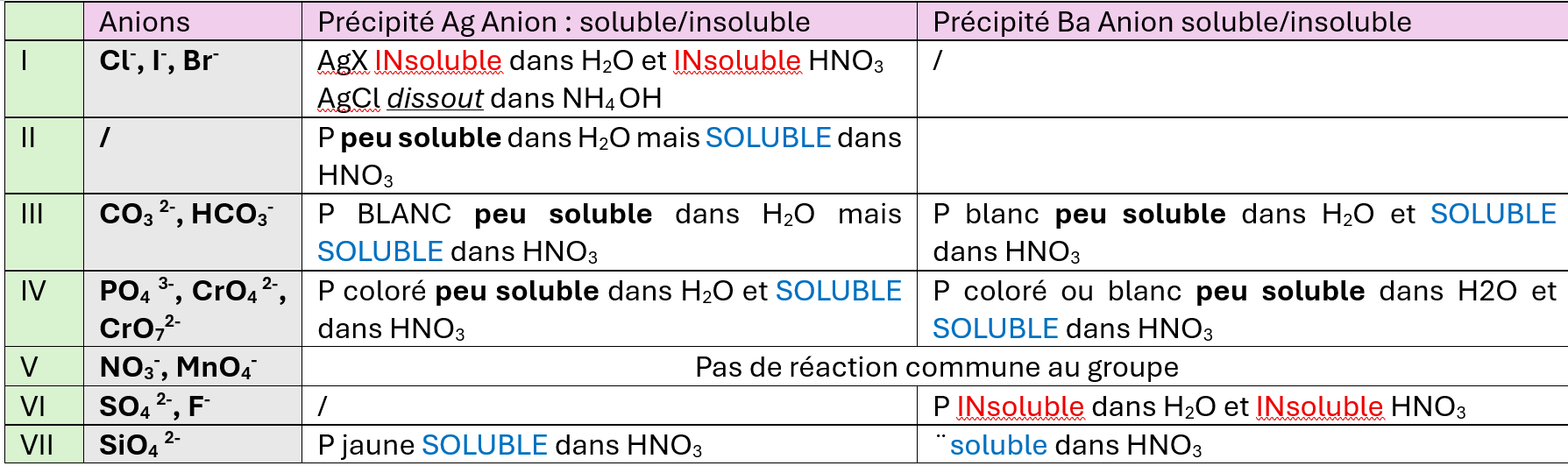
réaction de groupe des anions

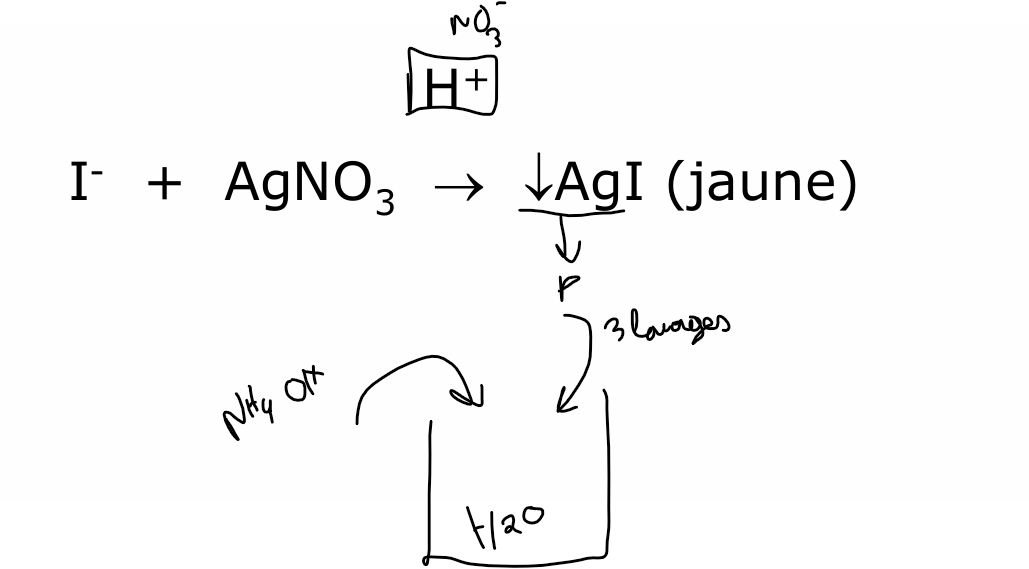
iode
le précipité reste stable et ne se dissout pas malgré NH4 OH ajout
A l’abri de la lumière car AgNO3 peut faire photo réaction —> Ag 0

iode
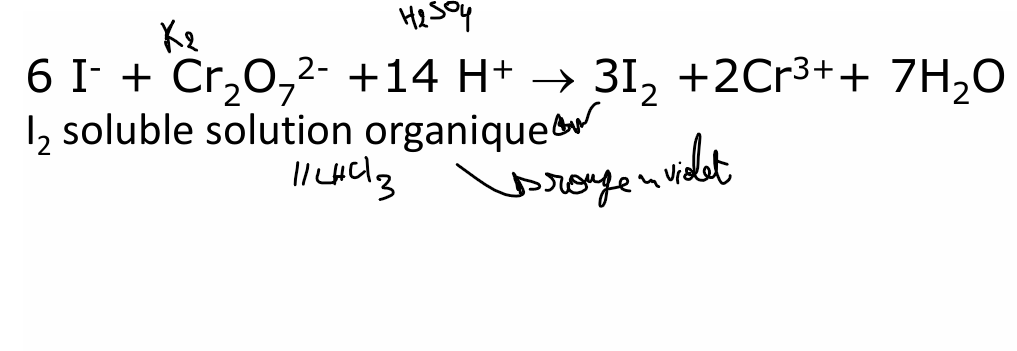

brome


brome
bien sécher les bords du tube pour éviter que la fuchsine ne réagisse avec autre chose que le Br2 in situ volatile formé
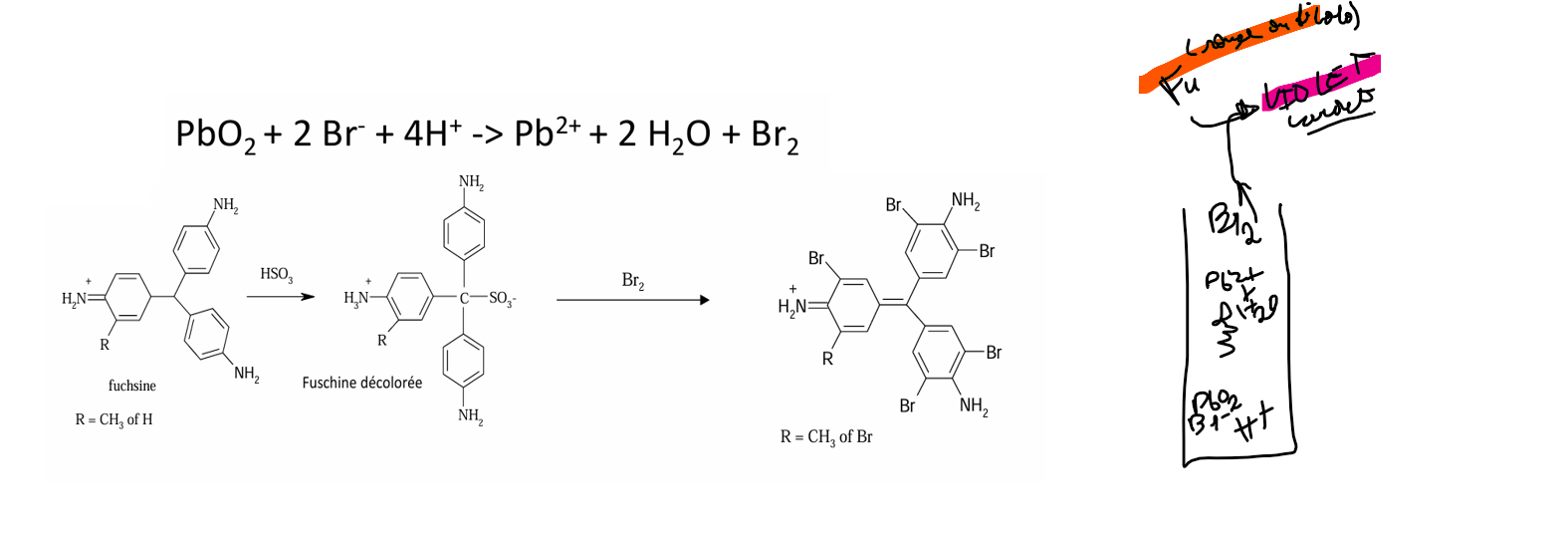

chlore
A l’abri de la lumière car AgNO3 peut faire photo réaction —> Ag 0
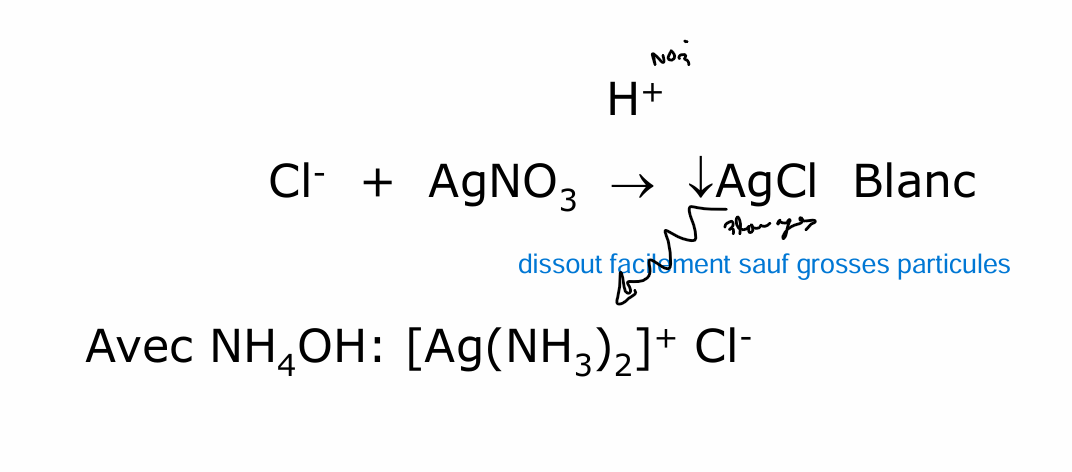

chlore
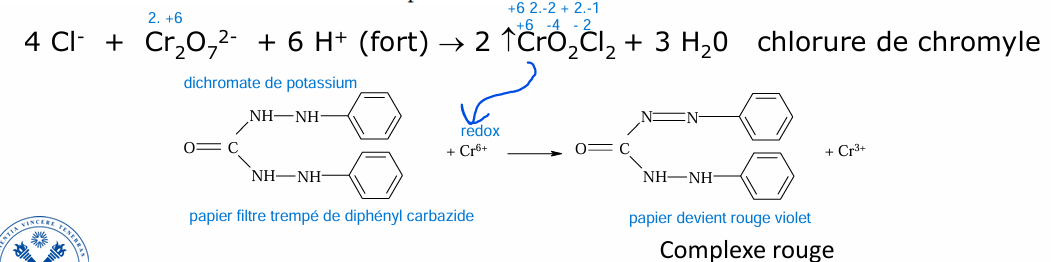
le papier de ne doit pas toucher la solution car le Cr2O7 2- est aussi Cr étage oxydation +6 (réactif) : sauf qu’on veut vérifier la présence de Cl- et ce par l’intermédiaire de formation de chlorure de chromyle qui réagit avec le diphényl carbazide

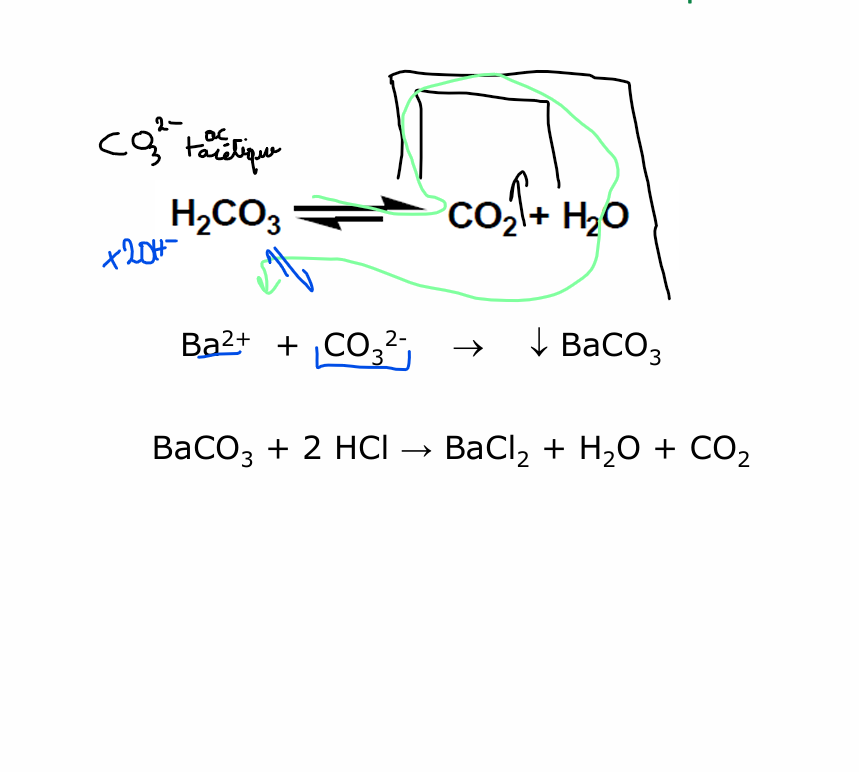
carbonate
On forme à partir de CO3 2- + ac acétique du CO2 volatile
CO2 est resolubilisé en H2CO3.
Par la présence de OH- —> équilibre (principe le chatelier) vers la formation de base carbonate —> précipité blanc
précipité resolubilisé par HCl

phosphate (orthophosphate)
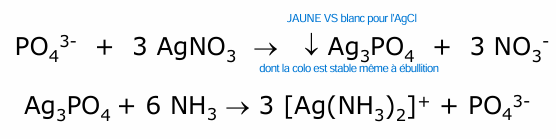

phosphate (orthophosphate)

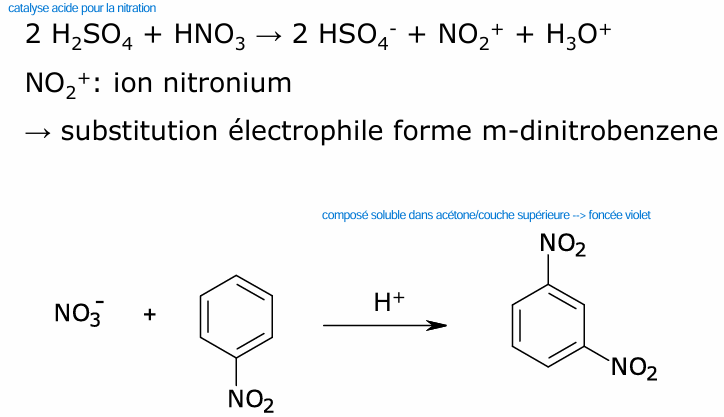
nitrate

sulfates
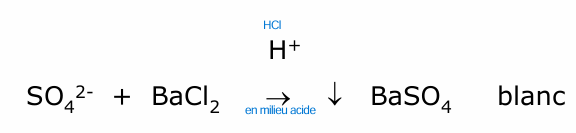

sulfate (a = BaSO4)
Si iodates : IO3- + 5 I- + 6 H+ → 3 I2 + 3 H2O et on aurait reformé du I2 (coloré)


fluorure de sodium (et non fluor spécifiquement)
dès que le résidu de fluorures a réagi avec un Fe3+ → FeF6 3- , l’équilibre va vers dissociation du précipité (vers Ks et >< 1/Ks) pour aller vers la formation du complexe (K compl)
==> K compl > 1/Ks
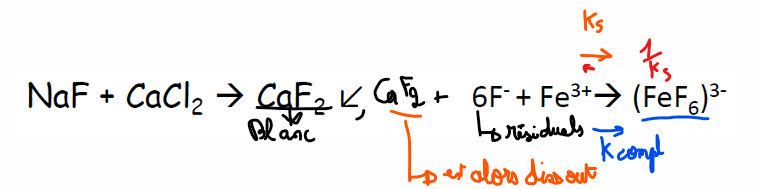

fluorure de sodium (et non fluor spécifiquement)
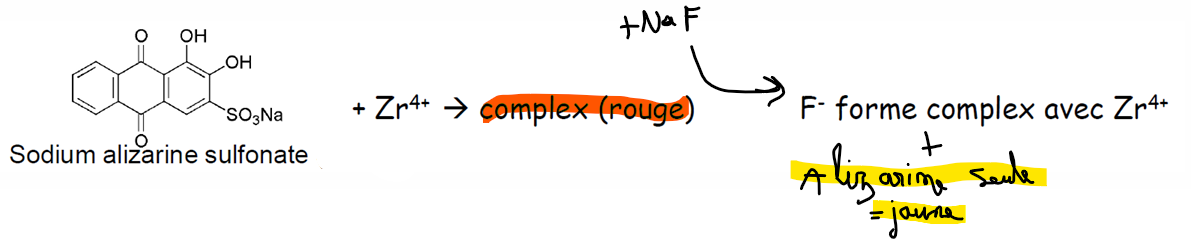

fluore (fluorures)
essai limite au fluorure
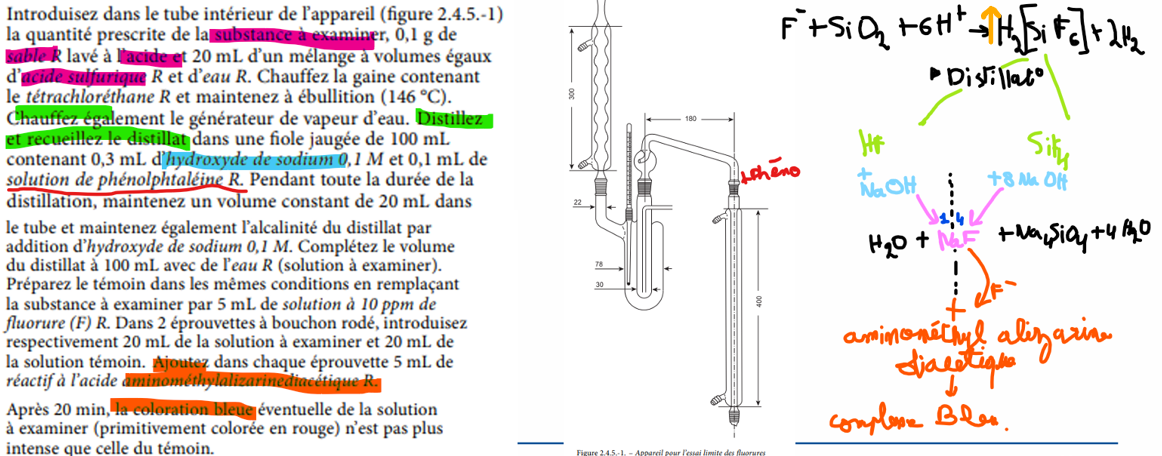

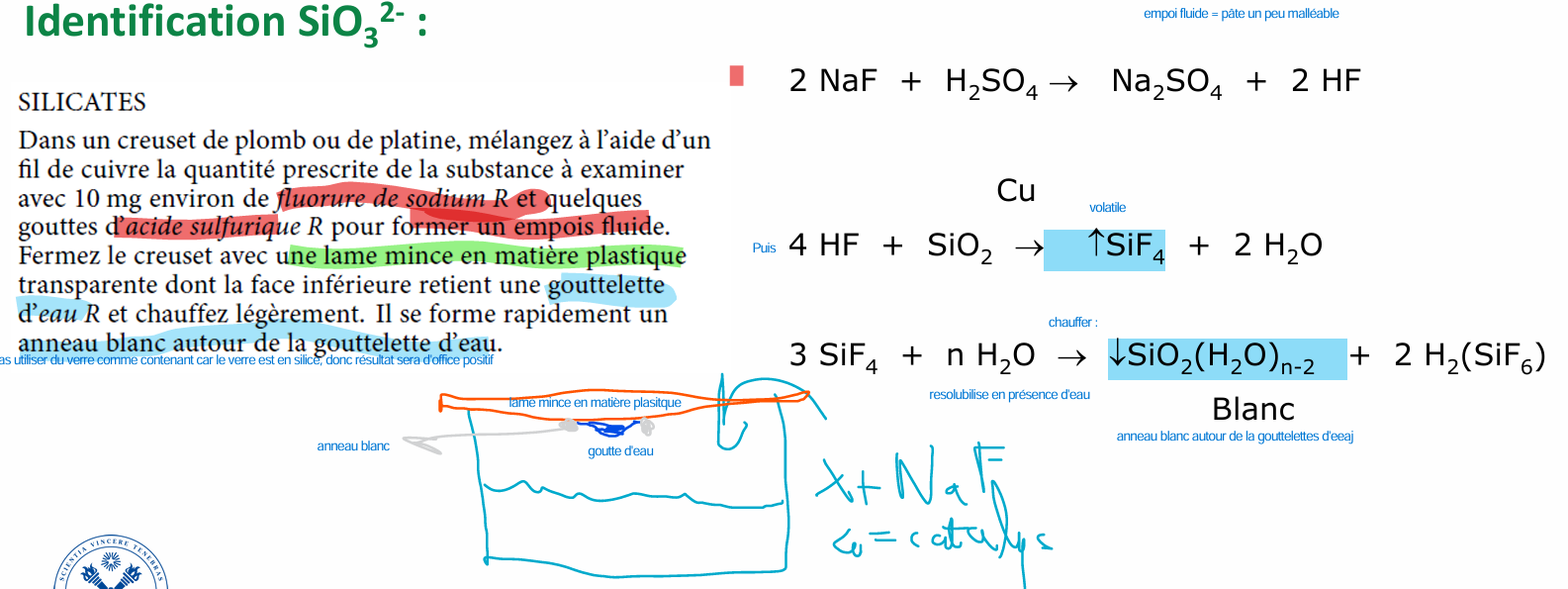
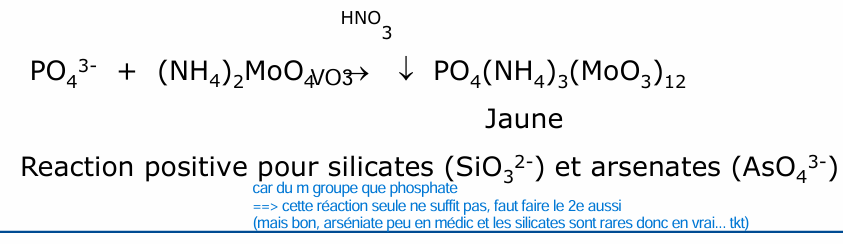
silicates