Chemie thema 3 hs 1 (4de)
1/7
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
8 Terms
Relatieve atoommassa
Ar
☆ De verhouding tussen de absolute massa m (de werkelijke massa van een atoom uitgedrukt in kg) en de atomaire massa-eenheid u = 1,66 × 10-24g (wordt vaker gebruikt omdat de massa zo klein is)
Formule: Ar = m/u
Kan je aflezen op het PSE
Relatieve molecuulmassa
Mr
☆ De verhouding tussen de absolute massa m van een molecuul en de atomaire massa-eenheid u.
Formule: Mr = m/u
Kan ook bepaald worden door de relatieve atoommassa’s op te tellen van de elementen waaruit de molecule is opgebouwd
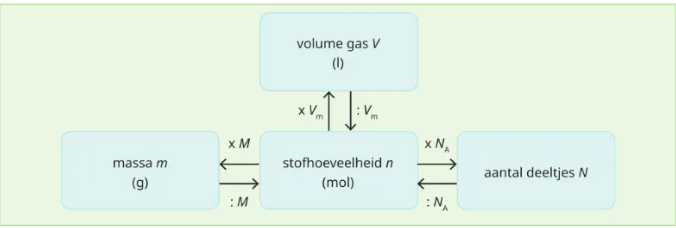
Stofhoeveelheid
n
☆ Een groot aantal deeltjes
☆ Maat voor hoeveelheid stof in mol.
n = N/NA
n = m/M
n = V/Vm
Mol
☆ De eenheid van de grootheid stofhoeveelheid (n)
1 mol = 6,02 × 1023 deeltjes
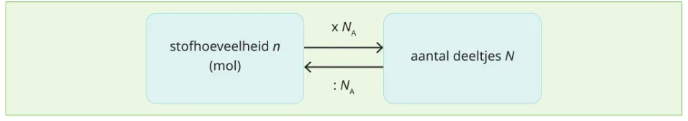
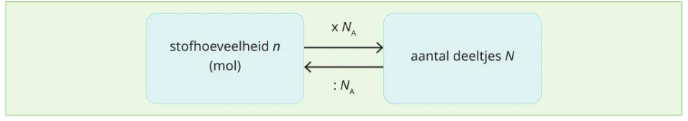
Aantal deeltjes
N
☆ Het werkelijke aantal atomen/moleculen.
n =N/NA
De constante van Avogadro
NA
☆ Geeft weer hoeveel deeltjes zich bevinden in 1 mol en is 6,02 x 10²³ deeltjes/mol
☆ Laat toe om het verband te berekenen tussen een stofhoeveelheid (n) en het aantal deeltjes (N)
n =N/NA
Molaire massa
M
☆ de massa van 1 mol deeltjes uitgedrukt in gram
☆ is gelijk aan de relatieve atoommassa/molecuulmassa van een stof uitgedrukt in gram per mol
hieruit kan de formule worden afgeleid die het verband weergeeft tussen de massa en het aantal mol van een stof: n = m/M

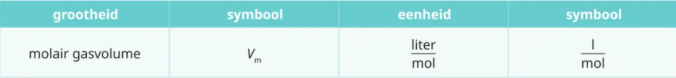
Molair gasvolume
Vm
☆ het volume van 1 mol gas bij normomstandigheden (273 k,; 1013 hPa)
☆Vm = 22,4 l / mol
hieruit kan de formule worden afgeleid die het verband weergeeft tussen de stofhoeveelheid (n) en het volume (V) van een een gas (n.o.)
n = V/Vm