Chemia sesja wykład 1, 9 październik
1/25
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
26 Terms
wymień liczby kwantowe (4) sranie
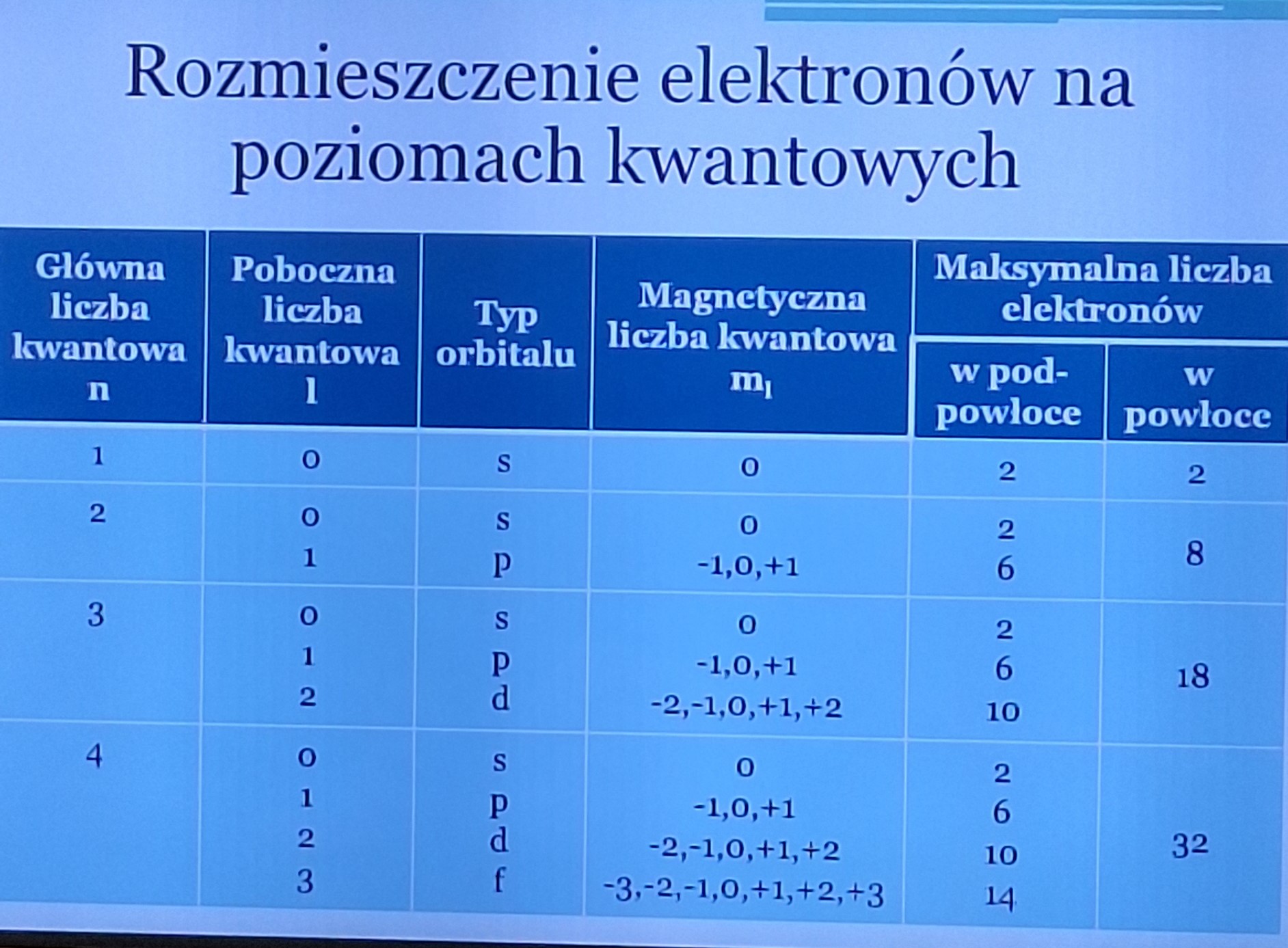
główna (n), poboczna (l), magnetyczna (m), magnetyczna-spinowa (ms),
podaj znaczenie (4) i wartości głównej liczby kwantowej, ile na każdej powłoce może być elektronów
n=1,2,3 K,L,M,N,O (2,8,18,32,50 elektronów walencyjnych mogą mieć), określa poziom energetyczny, ilość powłok, wielkość orbitalu, odległość od jądra.
podaj znaczenia (2) i wartości pobocznej liczby kwantowej
l=0,1,2,3 s,p,d,f określa kształt orbitalu, określa dokładniej poziom energetyczny, w jaki sposób elektron porusza się wokół jądra,
podaj znaczenie (2) i wartości liczby magnetycznej - spinowej
wartości +1/2 i -1/2, określa spin elektronu, umożliwia rozróżnienie elektronu o tych samych liczbach kwantowych m,l n (+ w prawo i - w lewo się kręci) (muszą być antyrównoległe)
podaj znaczenie (2) i wartości magnetycznej liczby kwantowej
-l<=m<=l (ile kratek ma s,p,d,f, 1,3,5,7) określa nieznaczne zmiany energetyczne elektronu, określa położenie orbitalu w przestrzeni (ile różnych form ułożenia w przestrzeni ma)
podaj jak wygląda budowa atomu?
jądro po środku powłok na których są podpowłoki o typach orbitali, s,p,d,f
co to są izotopy
są to atomy tego samego pierwiastka mające identyczną liczbę protonów w jądrze, taki sam ładunek jądra, taką samą liczbę atomową ale RÓŻNĄ LICZBĘ NEUTRONÓW W JĄDRZE, więc liczba masowa A się różni.
co nam mówi liczba masowa?
o sumie protonów i neutronów w jądrze
co nam mówi liczb atomowa
o ilość protonów i elektronów
co to proton elektron i neutron
cząsteczki elementarne o różnych ładunkach (dodatni neutralny i ujemny) równoważą siły w atomie i decydują o właściwościach atomu.
co mówi nam konfiguracja elektronowa?
mówi nam o sposobie rozmieszczenia elektronów w atomie, symboliczne przedstawienie orbitali atomowych
co mówi zakaz Pauliego?
w atomie nie mogą występować elektrony nie różniące się ani jedną liczbą kwantową (ich magnetyczna liczba spinowa zawsze musi się różnić i muszą być antyrównoległe w kratkach)
co mówi reguła Hunda
dopóki to możliwe to na każdy orbital ma przypadać jeden elektron niesparowany a potem uzupełniane są one o antyrównoległych spinach.
co mówi zasada rozbudowy powłok?
kolejne orbitale są zajmowane w porządku wzrastającej energii (piramidkowy sposób)
o czym mówi numer grupy? ile mamy grup
o ilości elektronów walencyjnych (na ostatniej powłoce), 18
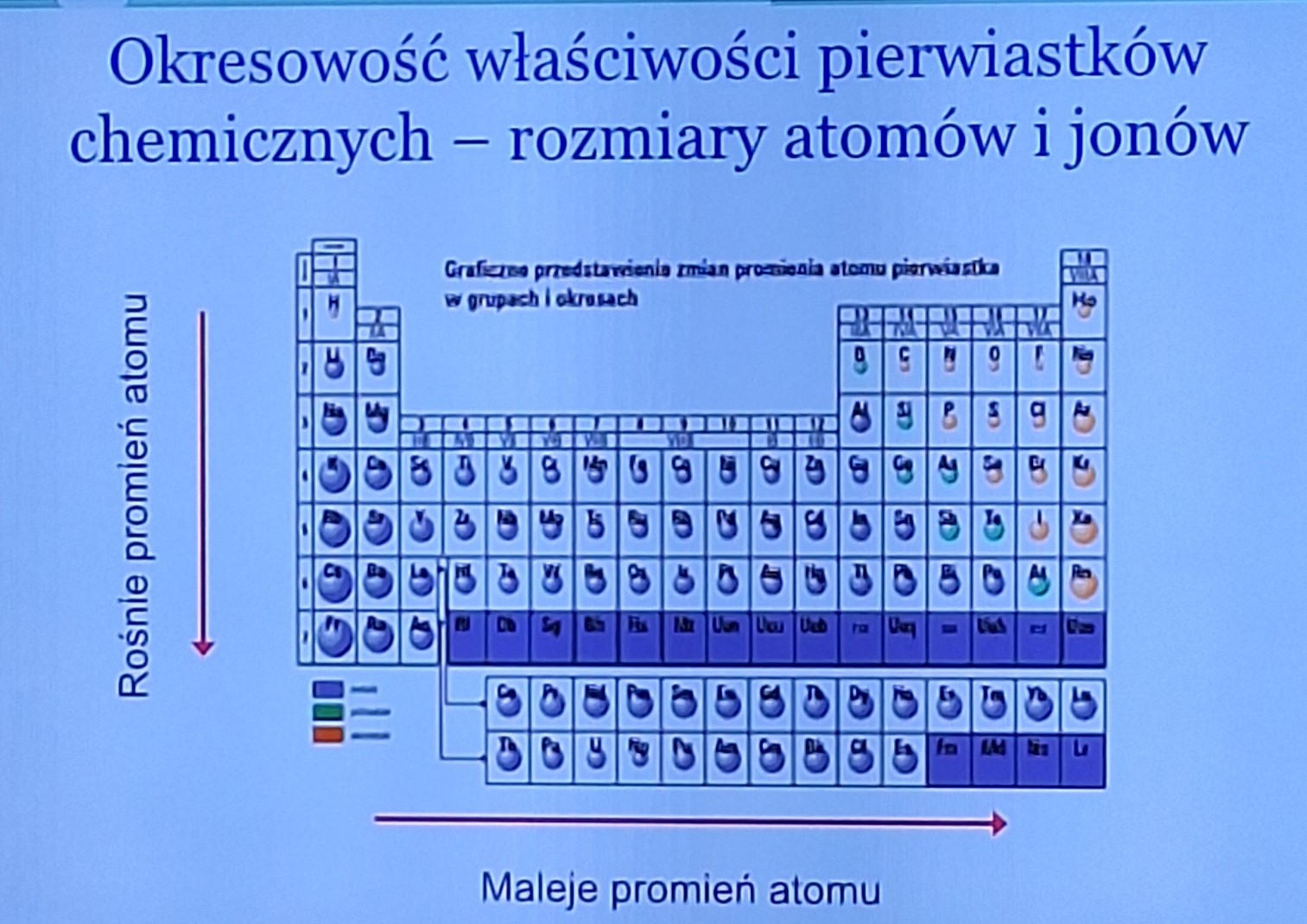
co określa rozmiary atomów i jonów?
promień zewnętrzny powłoki elektronowej
jak na układzie wygląda spadek i wzrost promieni atomów
w dół rośnie w prawo maleje
co to energia jonizacji?
energia potrzebna do oderwania elektronu z ostatniej powłoki
dlaczego układ OKRESOWY?
bo właściwości pierwiastków pokazują się okresowo
jaka jest 18 grupa?
niereaktywna chemicznie, stan równowagi, oktet
co nam mówi okres grupy? i ile mamy okresów?
numer okresu podaje nam numer powłoki walencyjnej 7 mamy
co to powinowactwo elektronowe i jak rośnie i maleje na układzie okresowym?
jest to energia uwalniana w momencie przyjęcia elektronu przez atom, (powinowactwo elektronu do atomu) w dół maleje w prawo rośnie

co to elektroujemność i jak wygląda na układzie?
zdolność przyciąganie elektronu przez dany atom w wiązaniu chemicznym
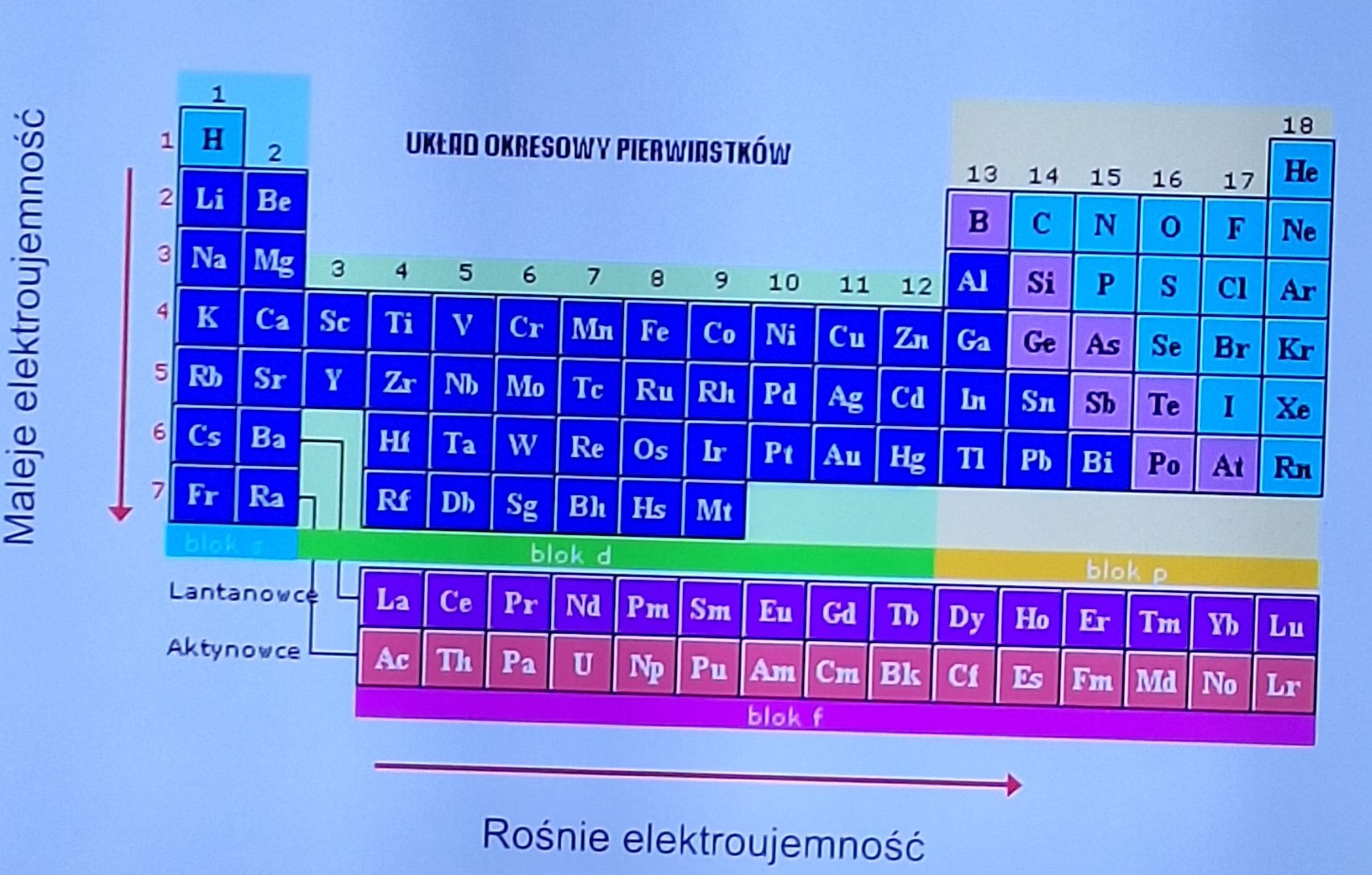
co to pierwiastki elektroujemne i elektrododatnie?
elektroujemne silnie przyciągają elektrony stając się anionami, elektrododatnie chętnie oddają elektrony stając się kationami
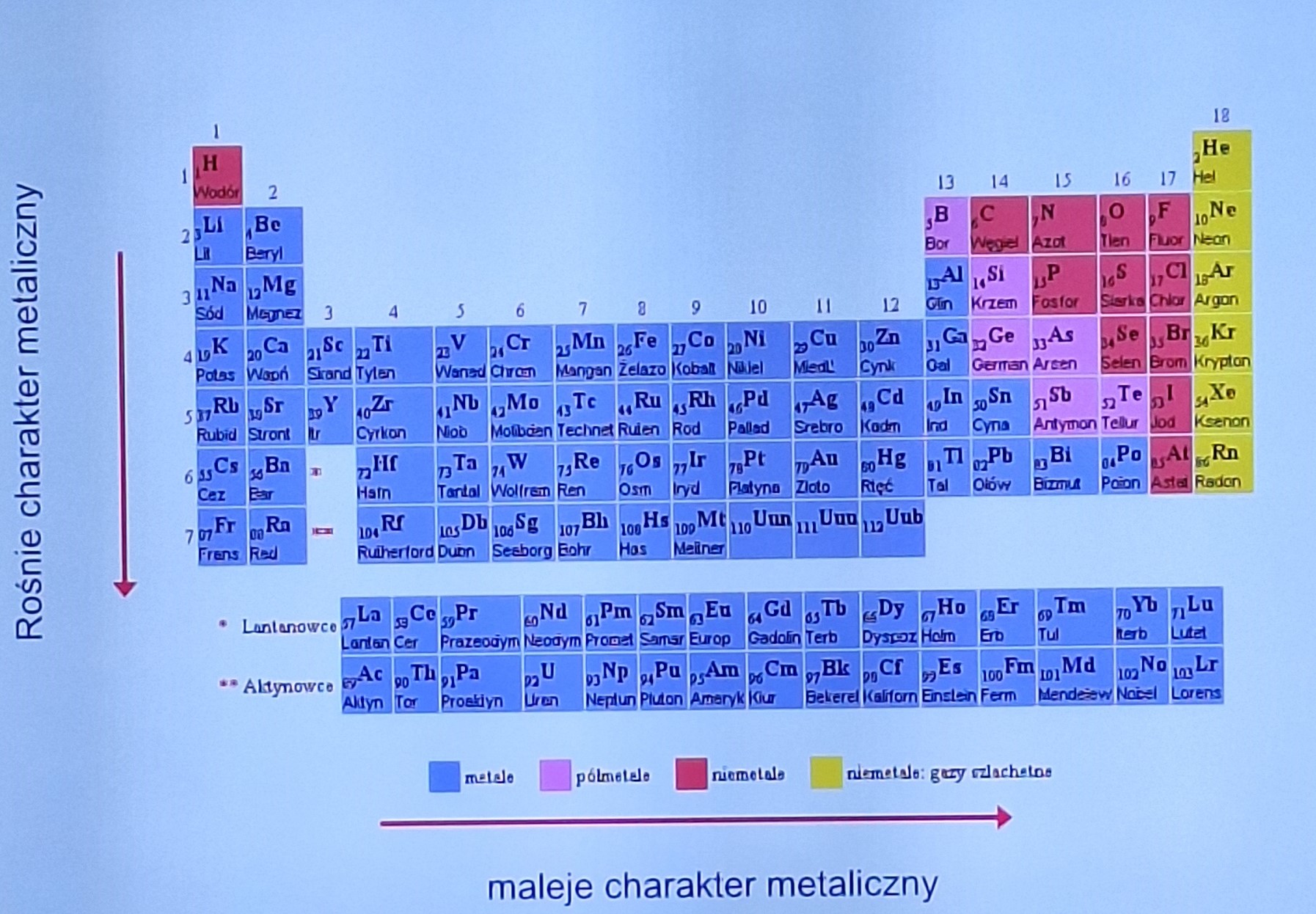
rozkład metali, niemetali, półmetali i gazów w układzie
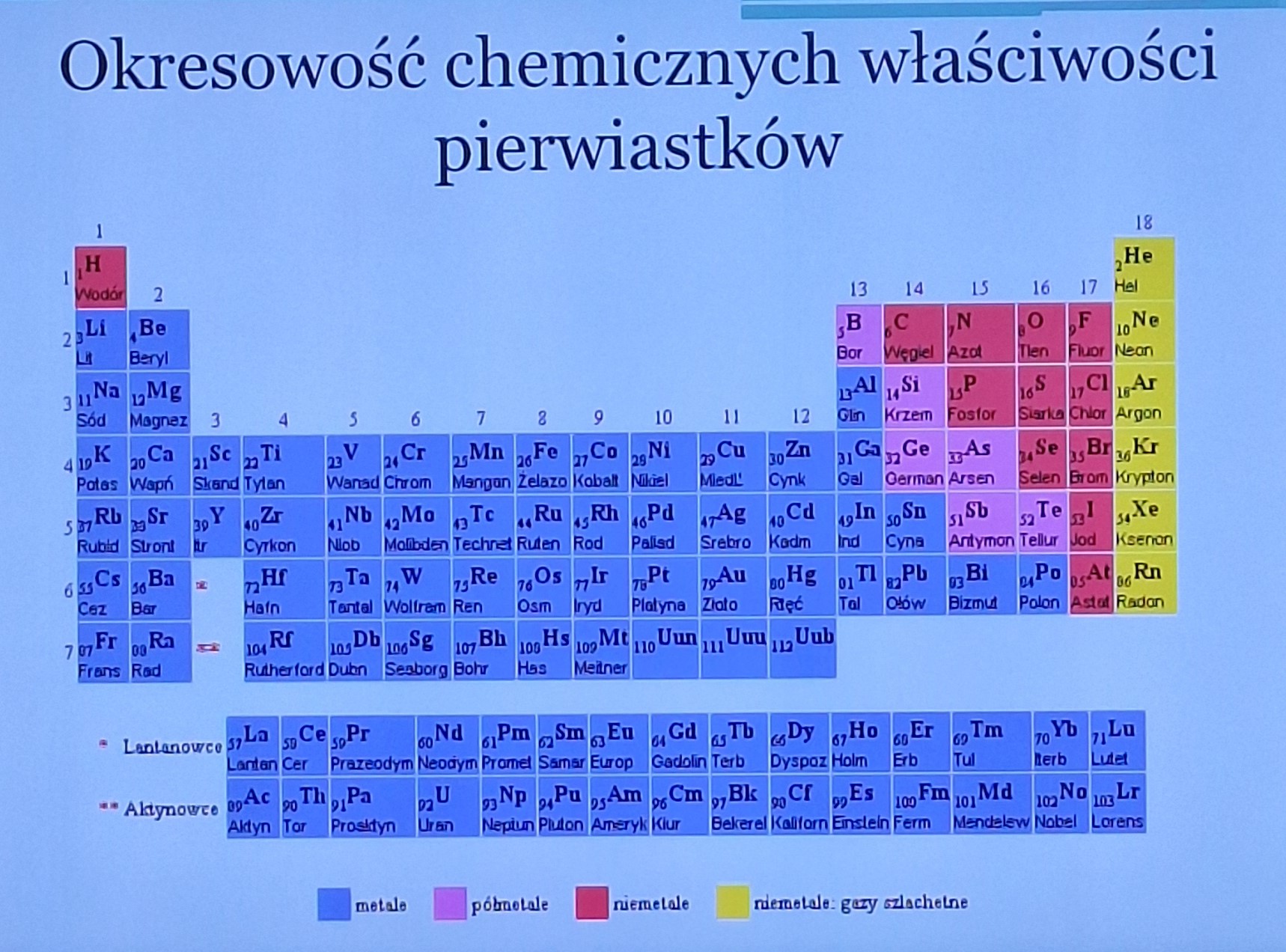
jak maleje i rośnie charakter metaliczny w układzie i co to charakter metaliczny?
to cecha atomów określająca ich zdolność do zachowywania się jak metale, np. przewodnictwo cieplne i elektryczne, połysk metaliczny i kowalność w dół rośnie maleje w prawo