patologia vascolare: ischemia
1/21
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
22 Terms
Ischemia
• Definizione: L'ischemia è la riduzione della perfusione dei tessuti dovuta all'ostruzione di un vaso, tale da non soddisfare le necessità metaboliche locali. Comporta ridotto apporto di nutrienti/ossigeno e accumulo di cataboliti tossici.
• Concetto Relativo: L'ischemia dipende dal fabbisogno metabolico del tessuto (in quiete o attivo). Una perfusione ridotta può essere fisiologica in stati di quiete, ma diventa patologica (ischemia) se la richiesta metabolica aumenta.
• Significato Clinico: Il termine indica una ridotta perfusione che funge da "campanello d'allarme" prima che si verifichi un danno irreversibile (infarto/necrosi).
• Conseguenze:
• Mancanza di Ossigeno e Nutrienti (necessari al catabolismo).
• Accumulo di cataboliti (tossici per la cellula per mancata depurazione).
Ipossia classificazione
CLASSIFICAZIONE DELLE IPOSSIE (4 Tipi)
Si basa sui meccanismi patogenetici:
1. IPOSSIA IPOSSICA
• Definizione: Insufficiente ossigenazione tissutale per ridotta ossigenazione del sangue circolante.
• Cause:
• Malattie polmonari (BPCO, Tubercolosi).
• Cardiopatie cianogene (aumento Hb non ossigenata > 5g/dL, es. pervietà forame ovale).
• Diminuita pressione parziale O_2 nell'aria (es. altitudine).
• Avvelenamento da CO.
• Esempio Altitudine: A livello del mare la pO_2 arteriosa è 150mmHg (ottima riserva). Sull'Everest la pressione atmosferica è 45mmHg e la pO_2 è circa il 20% di tale valore; ciò causa svenimenti nonostante i meccanismi di adattamento.
2. IPOSSIA ANEMICA
• Definizione: Insufficiente ossigenazione per diminuita concentrazione di emoglobina o eritrociti.
• Meccanismo: Problema del trasportatore. L'ossigeno è poco solubile nei liquidi (a differenza dell'azoto), quindi necessita assolutamente dell'emoglobina.
3. IPOSSIA ISTOTOSSICA
• Definizione: Incapacità della cellula di utilizzare l'ossigeno per inibizione dei sistemi respiratori cellulari (es. avvelenamento da cianuro, alcolismo cronico). L'ossigeno c'è, ma mancano gli strumenti per usarlo.
4. IPOSSIA ISCHEMICA
• Definizione: Ipossia causata da un deficit circolatorio (fenomeno ischemico).
• Tipologie:
• Localizzata: Ostruzione in un punto preciso.
• Generalizzata: Shock (ridotta perfusione di tutti i tessuti).
Ischemia vs ipossia
• Differenza: Il quadro ipossico riguarda solo la riduzione della tensione parziale di ossigeno (danno più "semplice"). L'ischemia è un danno più "complesso" che include l'ipossia ma aggiunge il mancato apporto nutritizio e il mancato smaltimento rifiuti.
Fattori che influenzano il danno ischemico
L'intensità e la gravità dipendono da:
• Fattori favorenti: Età, sesso, nutrizione, stato endocrino, ambiente, caratteristiche metaboliche/anatomiche.
• Grado di ostruzione: Limitazione del lume (es. 20-80%).
• Velocità di insorgenza:
• Lenta: Permette adattamento (ipertrofia, atrofia, quiescenza).
• Brusca: Non permette adattamento, porta a danno.
Il danno dipende dal settore vascolare (arterioso, venoso, microcircolo) e dalle caratteristiche del tessuto.
Caratteristiche Metaboliche del Tessuto
• Tessuti quiescenti (es. cute): Tollerano bene la riduzione di perfusione.
• Tessuti attivi (es. cuore, SNC): Mal tollerano i cambiamenti, necessitano apporto continuo.
Caratteristiche Anatomiche dei Vasi
• Circolazione Terminale (es. Retina): Irrorata da un unico vaso. Ostruzione = danno grave.
• Circolazione Anastomotica (es. Anse Intestinali): Ampio ricircolo. L'ostruzione di un vaso è spesso compensata dagli altri (eccetto in casi venosi specifici).
• Circolazione Funzionalmente Terminale (es. Cuore): Nonostante le anastomosi, il fabbisogno è talmente alto che funzionano come terminali.
• Zona di penombra cardiaca: La parte interna del cuore è nutrita per diffusione dalle cavità, l'esterna dalle coronarie. La porzione centrale della parete ("penombra") è la più a rischio ipossia, specialmente se il muscolo si ipertrofizza (ispessisce).
Localizzazione dei quadri ischemici
SETTORE ARTERIOSO
Include trombosi, aterosclerosi, tromboembolia e spasmi.
• Spasmo Arterioso: Contrazione della parete muscolare che riduce il lume. È un meccanismo patogenetico importante nei pazienti giovani (spesso legato a ipereccitabilità o uso di sostanze vasocostrittrici/adrenalina).
• Infarto miocardico nei giovani: Spesso dovuto a spasmi (il vaso si chiude temporaneamente) piuttosto che a degenerazione aterosclerotica.
• Sintomi: Dolore toracico. L'uso di vasodilatatori risolve lo spasmo e fa scomparire il dolore.
SETTORE VENOSO
L'occlusione venosa può dare ischemia (impedimento del deflusso).
• Esempi nelle anse intestinali:
• Ernia addominale: I vasi venosi vengono strangolati dalle masse muscolari.
• Invaginazione: Ripiegamento dell'ansa su se stessa che costringe i vasi.
• Volvolo: L'ansa gira su se stessa costringendo il vaso venoso.
• Meccanismo: L'ostruzione venosa causa ipertensione locale -> fuoriuscita liquidi (edema) -> aumento pressione interstiziale -> chiusura microcircolo e settore arterioso.
MICROCIRCOLO
Ostruzioni causate da: trombi di fibrina (CID), compressione (piaghe), aggregati di globuli rossi, leucociti (leucemia), emboli, iperviscosità.
Concetto di Iperviscosità
La viscosità è inversamente proporzionale al flusso. Se aumenta, il flusso rallenta.
1. Da Eritrocitosi: Aumento globuli rossi (ematocrito alto). Nonostante il maggior trasporto di O_2, il flusso crolla.
2. Leucemie: Aumento esorbitante di globuli bianchi (es. mieloidi croniche, da 4-10k a 80-90k). I leucociti hanno il nucleo e sono incomprimibili -> aumento massivo viscosità -> ostruzione e ischemie periferiche.
3. Sindromi Metaboliche: Resistenza insulinica, dislipidemia (siero lattrescente per troppi lipidi) aumentano la viscosità.
4. Proteine: Gammopatie monoclonali (es. plasmacellule che producono troppe immunoglobuline).
Trombosi cos’è e come si forma?
È l'ostruzione di un vaso per attivazione anomala del sistema emostatico.
• Fisiologia vs Patologia: La coagulazione serve a fermare il sanguinamento (coagulo = positivo). Quando si attiva senza danno vascolare o in modo eccessivo, forma un trombo (patologico).
Genesi (Triade di Virchow)
Tre elementi cooperano:
1. Danno Endoteliale: Il fulcro principale.
2. Flusso Anomalo.
3. Ipercoagulabilità.
Si aggiungono le variazioni degli elementi del sangue (viscosità).
Funzioni delle cellule endoteliali
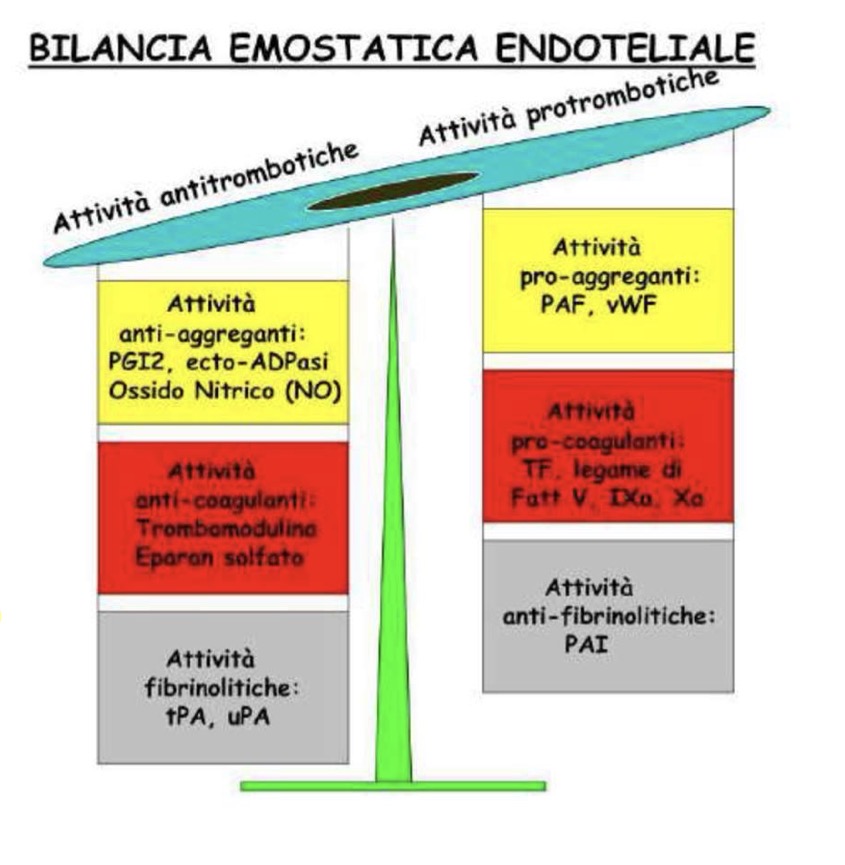
In condizioni fisiologiche, l'endotelio è anti-trombotico:
• Attività Antiaggregante/Anticoagulante: Produce Prostaciclina, Ossido Nitrico (NO), ADPasi (inibiscono l’aggregazione piastrinica), Trombomodulina (attiva Proteina C), Eparan-solfati.
• Attività Fibrinolitica: tPA, uPA.
• Lo Shift: Se l'endotelio soffre (danno locale, flusso lento, ipossia), cambia fenotipo diventando PRO-AGGREGANTEe PRO-COAGULANTE.
Prodotti Endoteliali nello stato patologico:
• Fattore di von Willebrand (adesione piastrinica).
• PAF (infiammazione).
• Fattore Tissutale (primo fattore via estrinseca).
• Recettori per Fattori V e IX (essenziali per la coagulazione).
• PAI (inibitore della fibrinolisi).
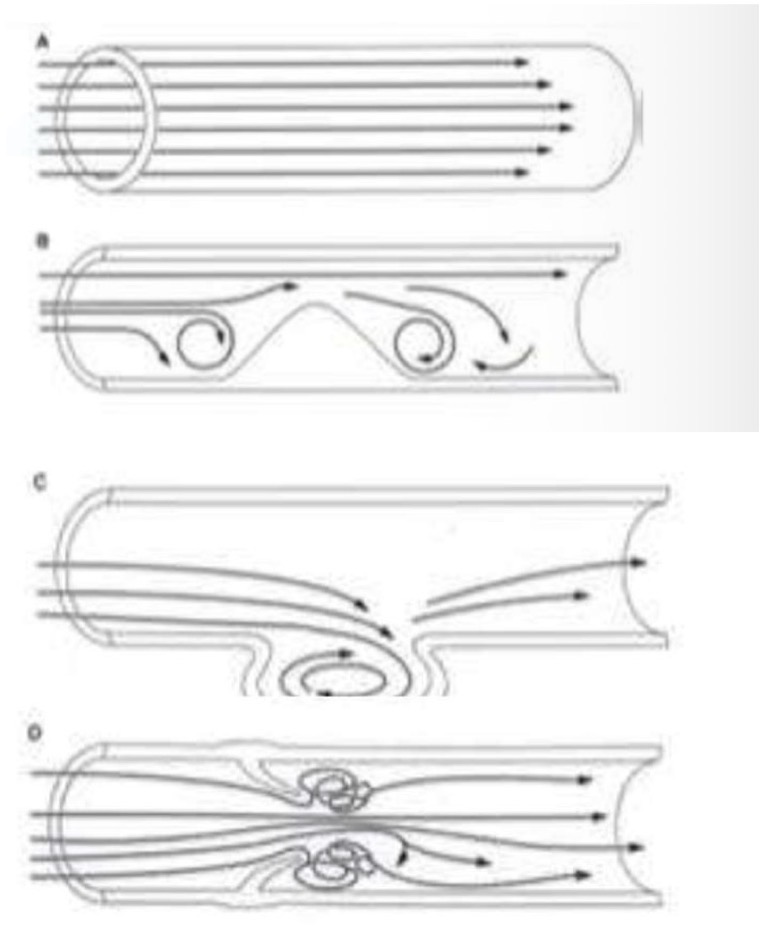
Concetto di flusso e danno endoteliale
• Flusso Laminare: Fisiologico (Quadro A).
• Flusso Vorticoso/Turbolento:
• Si crea in caso di ostruzione (Quadro B), ipertensione, o biforcazioni.
• Il vortice danneggia l'endotelio, riduce l'apporto di ossigeno e può rimuovere le cellule endoteliali stesse.
• Biforcazioni: La somma dei calibri dei vasi figli è maggiore del vaso origine -> la velocità si riduce -> formazione di vortici -> danno endoteliale (comune sede di placche/trombi).
• Sacca aneurismatica (quadro C)
• Valvole Venose: A livello delle tasche valvolari il flusso ristagna e crea vortici (Quadro D), sede tipica di inizio dei trombi venosi.
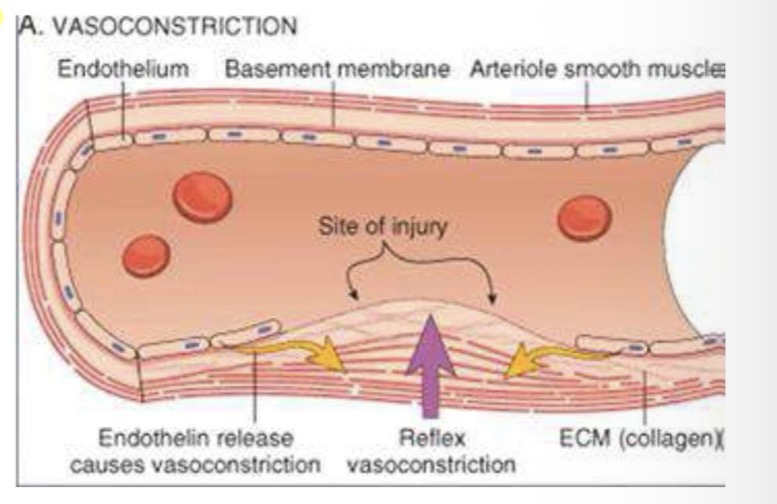
Meccanismi di formazione del trombo
• Inizio: Causato da danno del vaso (emodinamico, biologico, autoimmune).
• Bersaglio: Cellule endoteliali. La vasocostrizione o la perdita di endotelio espone il tessuto sottoendoteliale (collagene), innescando il processo.
Dopo il danno vascolare (o l'attivazione inappropriata), il sistema emostatico si attiva seguendo tappe precise che coinvolgono piastrine e coagulazione.
1. Attivazione delle Piastrine
Le piastrine aderiscono alla zona dove le cellule endoteliali sono scomparse.
• Adesione: Necessita di recettori specifici per legarsi a fattore di von Willebrand (prodotto dall'endotelio), collageno e fibrinogeno.
• Cambiamento di forma e Aggregazione: Le piastrine cambiano forma e si aggregano tra loro con l'aiuto del fibrinogeno.
• Rilascio di Fattori: Rilasciano ADP e trombossano per richiamare altre piastrine e potenziare l'aggregazione (feedback positivo). Nota: In condizioni normali, l'endotelio produce ADPasi per distruggere l'ADP e impedire l'aggregazione.
• Stabilizzazione: Le piastrine formano "spine" tra loro e l'aggregato diventa sempre più stabile.
Ruolo del Fibrinogeno:
Funge da "colla" o sostegno. Le piastrine esprimono recettori che lo riconoscono.
• Analogia con la VES: Come nell'infiammazione il fibrinogeno fa impilare i globuli rossi riducendo le cariche negative, qui permette l'aggregazione piastrinica.
• Il fibrinogeno è anche un fattore della coagulazione, creando un legame stretto tra componente piastrinica e cascata coagulativa.
2. Attivazione della Coagulazione
Le piastrine attivate offrono una superficie fosfolipidica per l'attivazione dei fattori.
• Shift Endoteliale: Le cellule endoteliali vicine al danno non vanno in necrosi ma cambiano funzione: da anti-emostasi passano a pro-emostasi, producendo il Fattore Tissutale.
Il Fattore Tissutale (pro-coagulante) è il primo elemento della via estrinseca, fondamentale per lo "start" della coagulazione.
• Formazione del Tappo: Si ha attivazione di Protrombina -> Trombina -> Fibrina. La fibrina forma una rete che stabilizza il tappo emostatico primario (inizialmente instabile) impedendo che venga portato via dal flusso.
• Doppia Velocità (Iniziazione e Amplificazione): La via estrinseca porta velocemente alla formazione di Trombina.
• La Trombina trasforma il fibrinogeno in fibrina.
• Attiva i fattori di accelerazione (V e VIII).
• Amplificazione (Via Intrinseca): L'attivazione innesca anche il Fattore IX (via intrinseca), che amplifica ulteriormente il sistema portando a una massiccia produzione di fibrina tramite l'attivazione del Fattore X.
• Fattori Vitamina K dipendenti: Importanti per la terapia e comprensione delle emorragie. Sono i fattori II, VII, IX e X.
Crescita del Trombo:
Il trombo cresce rapidamente all'interno del lume. Non è costituito solo da elementi emostatici, ma intrappola neutrofili e globuli rossi nella massa fibrinica.
• Conseguenza: La riduzione del lume riduce il flusso. Se il tessuto a valle richiede molto sangue (es. Cuore, SN), questa variazione diventa patologica e porta a morte tissutale.
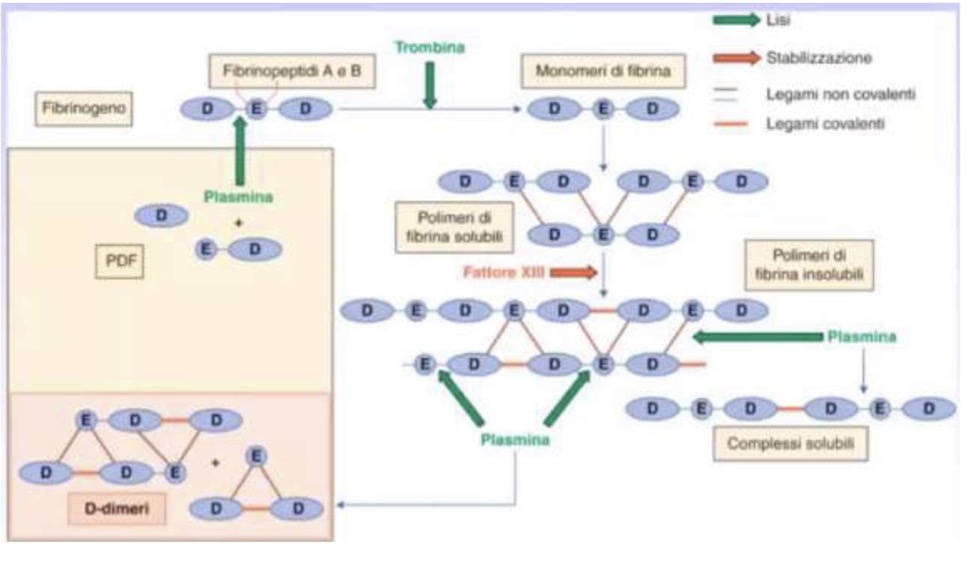
Sistema fibrinolitico
È il sistema di controllo che mira a ristabilire la pervietà del vaso degradando la fibrina.
• Plasminogeno -> Plasmina: Attivato da attivatori tissutali (tPA) o urochinasici (uPA).
• Funzione della Plasmina: Degrada la fibrina (lisi del trombo).
• Regolazione: Le cellule endoteliali producono attivatori della fibrinolisi per mantenere la pervietà, ma in condizioni pro-trombotiche producono inibitori (PAI).
Aspetti Diagnostici e Patologici del Sistema Fibrinolitico
• Attivazione: Il plasminogeno è attivato anche da fattori della coagulazione (XII, XI, callicreina).
• Inibizione: La plasmina è immediatamente controllata dalla alpha2-antiplasmina (proteina della fase acuta prodotta dal fegato).
• Azione della Plasmina: Oltre alla fibrina, degrada anche Fibrinogeno, Fattore V e Fattore VIII.
• La carenza di Fattore VIII causa emofilia A (emorragie spontanee).
• La degradazione eccessiva di questi fattori è tipica della CID (Coagulazione Intravascolare Disseminata), dove coesistono trombosi ed emorragia.
D-DIMERI:
Quando la plasmina taglia la fibrina insolubile (stabilizzata dal Fattore XIII con legami covalenti), si formano i D-Dimeri.
• Sono complessi di dimeri strettamente associati.
• Importanza clinica: Indicano che c'è stata formazione e successiva lisi di un trombo. Fondamentali nel monitoraggio di pazienti Covid-19 per valutare l'evoluzione trombo-emorragica.
Sistema infiammatorio e trombotico
Esiste una stretta associazione tra immunità innata e trombosi.
• Immunotrombosi: Teoria secondo cui la trombosi può essere un meccanismo di difesa fisiologico per intrappolare patogeni.
• Meccanismo:
• Collaborazione tra cellule infiammatorie (monociti, granulociti) ed elementi del trombo.
• Trapping (NETs): I granulociti rilasciano materiale istonico legato al DNA formando una rete che intrappola microrganismi ed enzimi (mieloperossidasi, elastasi).
• La fibrina coadiuva questo intrappolamento per evitare la diffusione dei patogeni (sepsi).
• Microvescicole: I monociti producono microvescicole contenenti Fattore Tissutale, facilitando la trombosi (visibile anche in sindromi paraneoplastiche).
Ruolo del Fattore XII:
Utile all'attivazione della via intrinseca e della bradichinina (pro-infiammatorio). Carenze di Fattore XII non causano emorragie, ma paradossalmente possono portare a tromboembolia.
Se il sistema infiammazione-coagulazione non è controllato, si rischiano trombi microvascolari diffusi.
Evoluzione finale delle trombosi
Il destino di un trombo può seguire 4 vie:
1. RISOLUZIONE: Prevale l'attività fibrinolitica, il trombo viene eliminato.
2. EMBOLIZZAZIONE: Una parte si stacca e blocca la circolazione in un altro distretto.
3. RIORGANIZZAZIONE E INCORPORAZIONE: Risposta infiammatoria cronica. Le cellule endoteliali ricoprono il trombo (ri-endotelizzazione) integrandolo nella parete vasale. Simile alla guarigione delle ferite, il trombo diventa un'area ricca di cellule che stimolano la crescita endoteliale sopra di esso.
4. RICANALIZZAZIONE: Adattamento del tessuto tramite neoangiogenesi. Si creano nuovi canali di passaggio del sangue attraverso il trombo stesso, ristabilendo parzialmente il flusso.
Embolie
Definizione: L'embolismo è il passaggio nel sistema vascolare di materiale immiscibile (trombi, gas, lipidi, ecc.) capace di insediarsi in vasi di calibro minore, ostruendoli. È un evento a insorgenza repentina che causa un danno ischemico acuto.
Tipologie di Embolia:
• Tromboembolia (90% dei casi): Deriva dalla frammentazione di un trombo.
• Polmonare: Origina spesso dalle vene profonde degli arti inferiori (TVP) a seguito di immobilità o fratture. Il trombo si distacca, passa al cuore destro e occlude il circolo polmonare. Poiché il polmone ha una doppia irrorazione (arterie polmonari e bronchiali), l'infarto polmonare avviene solo se l'embolo è abbastanza grande o se il circolo bronchiale non compensa.
• Embolo a Sella: Embolo massivo che si blocca alla biforcazione dell'arteria polmonare, ostruendo entrambi i polmoni (evento critico/fatale).
• Paradossa: Passaggio di un embolo venoso nel circolo arterioso tramite la pervietà del forame ovale.
• Sistemica: Origina nel cuore sinistro (aorta, grossi tronchi). Cause: danni endoteliali, stasi da fibrillazione atriale (il cuore non si contrae bene, si formano trombi che poi si distaccano). Spesso colpisce le carotidi (embolie cerebrali).
• Embolia da ulcerazione di ateroma: Nelle placche aterosclerotiche (ricche di colesterolo nella tonaca intima), la rottura della placca endoteliale espone sostanze pro-coagulanti (collagene), innescando trombosi e occlusione del lume.
• Embolia Lipidica: Presenza di particelle di grasso in circolo. Cause: fratture di ossa lunghe (liberazione di midollo), liposuzione, ustioni, steatosi epatica o pancreatica.
• Embolia Gassosa: Bolle di gas (aria o azoto). Cause: traumi toracici, ferite al collo, malattia da decompressione (nei sub che risalgono troppo velocemente, l'azoto disciolto torna gassoso formando bolle che occludono i vasi). Terapia: camera iperbarica.
• Embolia da Liquido Amniotico: Ingresso di liquido amniotico (ricco di cellule fetali e detriti) nel circolo materno. Contiene fattori pro-trombotici che innescano la CID.
Coagulazione intravascolare disseminata (CID) cos’è e come si innesca?
Definizione: Sindrome caratterizzata da attivazione incontrollata del sistema emostatico (trombi diffusi) seguita dal consumo dei fattori della coagulazione, portando a manifestazioni emorragiche.
Meccanismi di Innesco :
Si ha una massiva generazione di trombina che supera i sistemi di controllo inibitori.
1. Via Estrinseca:
Questa via parte principalmente quando c'è un danno ai tessuti o una sofferenza cellulare che rilascia fattori tissutali nel sangue. Le cause principali sono:
• Tessuti traumatizzati (es. sindrome da schiacciamento): liberano cellule danneggiate.
• Danno endoteliale da ipossia o citochine infiammatorie la cellula endoteliale "cambia fenotipo" (si modifica) e inizia a produrre fattori che favoriscono i trombi (espressione di fattore tissutale).
• Tessuti ricchi di fattore tissutale (placenta, cellule tumorali, macrofagi attivati e liquidi amniotici).
2. Via Intrinseca:
Questa via si attiva per danni diretti all'interno del vaso o per la presenza di sostanze estranee nel sangue:
• Esposizione membrane basali (danni endoteliali).
• Frammenti di emazie, endotossine, aumento lipoproteine.
Le due vie cooperano portando a una coagulazione incontrollata.
Meccanismi patogenetici nella CID
• Fase Trombotica: Eccesso di trombina converte fibrinogeno in fibrina, intrappolando piastrine. Si formano microtrombi ovunque (ostruzione vasale diffusa).
• Fase di Consumo: L'attivazione massiva consuma fibrinogeno, Fattore V, VIII e piastrine. Il fegato e il midollo non riescono a rigenerarli in tempo.
• Anemia Emolitica Microangiopatica: I tralci di fibrina nei capillari agiscono come una rete che "taglia" i globuli rossi di passaggio (schistociti), causandone la distruzione precoce (emolisi) e riducendoli a forme sferiche rigide rimosse dalla milza.
Evoluzione: Ischemia e Fibrinolisi
• Danno Ischemico: I microtrombi causano ipossia tissutale.
• Attivazione Fibrinolitica: Il corpo tenta di sciogliere i trombi attivando la plasmina. La plasmina però degrada non solo la fibrina, ma anche il fibrinogeno e i fattori V e VIII, aggravando la coagulopatia da consumo (fattori di coagulazione consumati, ciò porta ad emorragia).
• Quadro Clinico: Trombosi + Anemia Emolitica + Emorragia (per mancanza di fattori).
Terapia Fondamentale: Paradossalmente, pur essendoci emorragia, si deve somministrare un anticoagulante (per bloccare il trigger trombotico iniziale) e trasfondere fattori/piastrine per ripristinare le scorte.
Diagnosi di CID e parametri emostatici in CID acuta e cronica
Diagnosi: Monitoraggio dei D-dimeri (prodotti di degradazione della fibrina). Nella fase acuta sono altissimi mentre fibrinogeno e piastrine crollano. Quando la terapia funziona, i D-dimeri scendono e le piastrine risalgono.
Parametri Emostatici
• Piastrine: Ridotte (trombocitopenia).
• PTe PTT: Allungati quindi il sangue impiega più tempo a coagulare (fattori consumati). N.B.:
PT (Tempo di Protrombina): È il parametro che indaga fondamentalmente la via estrinseca della coagulazione.
PTT (Tempo di Protrombina Parziale attivato): È il parametro che indaga fondamentalmente la via intrinseca della coagulazione.
• Fibrinogeno: Ridotto.
• D-dimeri e FDP: Positivi/Aumentati.
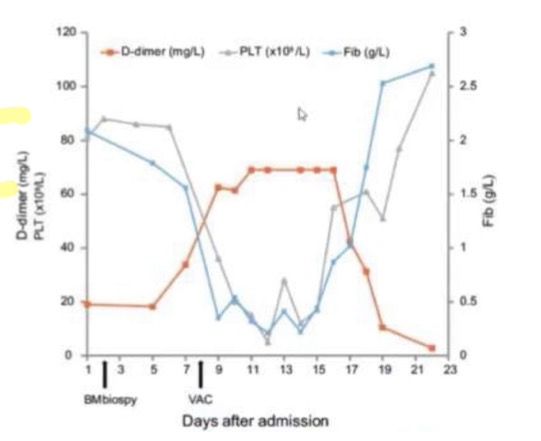
Condizioni associate a CID
• Sepsi (Gram +/-): innesco processo infiammatorio.
• Neoplasie: Carcinomi (pancreas, polmone), Leucemia Promielocitica Acuta.
• Complicanze Ostetriche: Embolia liquido amniotico, ritenzione feto morto, eclampsia.
• Danno Tissutale Esteso: Ustioni, chirurgia, traumi.
• Emolisi Acuta Intravascolare: Trasfusioni incompatibili.
Danno ischemico da compressione e altre cause
Piaghe da Decubito:
Danno ischemico della microcircolazione dovuto alla compressione prolungata (paziente immobile) tra struttura ossea e materasso (sacro, coccige, talloni). Causa morte del tessuto, ulcerazione e rischio infezione. Bisogna muovere il paziente e sostituire il materasso con uno antidecubito.
Aggregati di Globuli Rossi:
Esempio della Falcemia: mutazione puntiforme (Valina al posto di Acido Glutammico) altera l'emoglobina. In carenza di ossigeno, il globulo rosso diventa falciforme, rigido e si aggrega ad altri, ostruendo i vasi e causando ischemia.
Effetti dell’ischemia
Il danno dipende da intensità, durata e tipo di tessuto.
1. Danno Reversibile:
• Rigonfiamento Torbido: Carenza di energia (ATP) -> blocco pompa Na/K -> il Sodio entra nella cellula portando con sé acqua. La cellula si gonfia.
• Steatosi (Degenerazione grassa): Accumulo di lipidi (trigliceridi) nel citoplasma di cellule non adipose (es. epatociti). Avviene perché l'epatocita, senza energia, non riesce a formare le lipoproteine (VLDL) per smistare i grassi, che quindi si accumulano in gocce.
2. Danno Irreversibile / Avanzato:
• Degenerazione Vacuolare: Fase avanzata del rigonfiamento, l'acqua entra anche nei mitocondri danneggiandoli.
• Atrofia: Adattamento in cui la cellula riduce volume e organelli per sopravvivere con meno nutrienti.
• Apoptosi: Morte programmata (può avvenire nell'atrofia).
• Infarto (Necrosi): Se l'ischemia supera la capacità di adattamento, la cellula muore. Esempio classico: occlusione coronarica e infarto del miocardio.
Istologia dell’infarto miocardico
Quadro Angiografico e Compensatorio
Nelle rappresentazioni angiografiche di un cuore infartuato, si nota spesso una grossa ostruzione coronarica (un "salto" nel vaso). Rispetto a un cuore normale, si osserva un enorme aumento delle comunicazioni tra le coronarie: questo è un tentativo (tardivo) di compenso per aggirare le restrizioni aterosclerotiche diffuse.
Caratteristiche della Necrosi Coagulativa
L'istologia dell'infarto miocardico mostra tipicamente una necrosi coagulativa, caratteristica del danno ischemico.
• Aspetto delle cellule: Le miocellule morte mantengono parzialmente la loro architettura ("fantasmi cellulari"). Si osservano ancora i fasci e le file delle cellule, ma mancano i nuclei.
• Colore: Il tessuto appare intensamente eosinofilo (più rosso) a causa della coagulazione delle proteine citoplasmatiche.
• Fasci Ondulati: I fasci necrotici appaiono ondulati. Questo fenomeno accade perché le fibre morte sono ancora fisicamente connesse ai fasci di tessuto vitale adiacente; quando la parte sana si contrae, "stira" e distende passivamente i fasci morti, creando l'ondulazione.
• Infiammazione ed Essudato: Tra i fasci morti si accumula una quantità enorme di materiale liquido (edema) e cellulare (granulociti neutrofili), segno dell'innesco del processo infiammatorio acuto.
Evoluzione e guarigione
Il processo di riparazione segue una cronologia precisa guidata dalla risposta infiammatoria.
1. Fase Infiammatoria Iniziale (3-4 giorni): La zona necrotica è invasa dai granulociti neutrofili che iniziano a "pulire" l'area.
2. Fase dei Macrofagi: Ai granulociti subentrano gli istiociti e i macrofagi. Queste sono grosse cellule con nuclei importanti che rimuovono attivamente i detriti cellulari e le fibre morte.
3. Angiogenesi e Tessuto di Granulazione: Si forma il tessuto di granulazione, caratterizzato dalla neo-formazione di piccoli vasi sanguigni (vasellini dilatati). Istologicamente si riconoscono perché sono stipati di globuli rossi al loro interno. Questa fase è fondamentale per portare nutrienti per la riparazione.
4. Cicatrizzazione (Fibrosi): I miofibroblasti producono fibre di collagene (colorate in blu nelle immagini istologiche) che sostituiscono progressivamente la zona necrotica.
• Il risultato finale è una cicatrice: un tessuto fibroso che garantisce integrità strutturale ma non ha capacità contrattile né di conduzione dello stimolo elettrico (o in misura molto alterata).
Danno da riperfusione
Il Concetto di Riperfusione
La riperfusione è il ritorno del flusso sanguigno (e quindi dell'ossigeno) in un'area ischemizzata, sia per meccanismi spontanei che terapeutici (es. angioplastica).
• Importanza: Senza riperfusione, la lesione ischemica è estesa (circa 70% del tessuto a rischio muore). Con una riperfusione tempestiva, si può salvare una buona parte del muscolo (ne rimane oltre il 40%).
• Il Paradosso: Sebbene necessaria, la riperfusione stessa può innescare meccanismi che danneggiano ulteriormente il tessuto (Danno da Riperfusione).
Meccanismi del Danno Ischemico (fase pre-riperfusione)
Durante l'ischemia, la carenza di ossigeno innesca una cascata di eventi:
• Metabolismo Anaerobio: La cellula usa il glicosidi in anaerobiosi producendo acido lattico. Il pH intracellulare scende, attivando enzimi lisosomiali che degradano la cellula dall'interno.
• Blocco delle Pompe Ioniche (Carenza di ATP):
• Pompa Na/K: Smette di funzionare. Il Sodio (Na+) entra nella cellula portando con sé acqua (rigonfiamento cellulare), mentre il Potassio (K+) esce (rischio iperkalemia).
• Pompe del Calcio: Smettono di funzionare. Il Calcio si accumula nel citoplasma (rilasciato anche dagli organelli danneggiati).
• Attivazione Enzimatica: L'eccesso di Calcio attiva enzimi distruttivi come ATPasi, fosfolipasi, proteasi ed endonucleasi.
Meccanismi del Danno da Riperfusione (fase post-riperfusione)
Quando l'ossigeno torna, trova un ambiente cellulare alterato, scatenando la formazione di Radicali Liberi dell'Ossigeno (ROS).
1. Conversione della Xantino Deidrogenasi in Xantino Ossidasi:
• Normalmente, l'enzima Xantino Deidrogenasi degrada le purine (catabolismo ATP) producendo acido urico.
• Durante l'ischemia, la proteolisi modifica questo enzima trasformandolo in Xantino Ossidasi.
• All'arrivo dell'ossigeno (riperfusione), la Xantino Ossidasi usa l'ossigeno per produrre acqua ossigenata e anione superossido (ROS) invece che semplice acido urico.
2. Attivazione Infiammatoria:
• Il danno cellulare richiama granulociti neutrofili. Questi possiedono l'enzima NADPH ossidasi che produce ulteriori enormi quantità di ROS come arma di difesa (burst respiratorio), aggravando il danno tissutale ("fuoco amico").
• Anche il metabolismo dell'acido arachidonico (via cicloossigenasi/lipossigenasi) e la produzione di Ossido Nitrico (NO) in presenza di ossigeno contribuiscono alla formazione di radicali (es. nitriti).
3. Circolo Vizioso: I ROS danneggiano membrane e mitocondri, facendo fuoriuscire altro materiale che stimola ulteriormente l'infiammazione e la trombosi. Linfociti Th17 sono particolarmente attivi nel richiamare neutrofili, mantenendo il processo lesivo.
La riperfusione è quindi un'arma a doppio taglio: salva il tessuto dall'anossia ma scatena uno stress ossidativo violento che deve essere gestito.