CM3: Neurophysiologie - Propriétés du neurone
1/23
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
24 Terms
SYSTÈME NERVEUX — Organisation cellulaire Questions
Comment est-ce que les neurones communiquent ?
Quels sont les différents types de morphologies des neurones ? Quelle est la caractéristique de leur morphologie ?
Qu’est-ce que le degré de complexité de l’arborisation dendritique ? de convergence ? de divergence ?


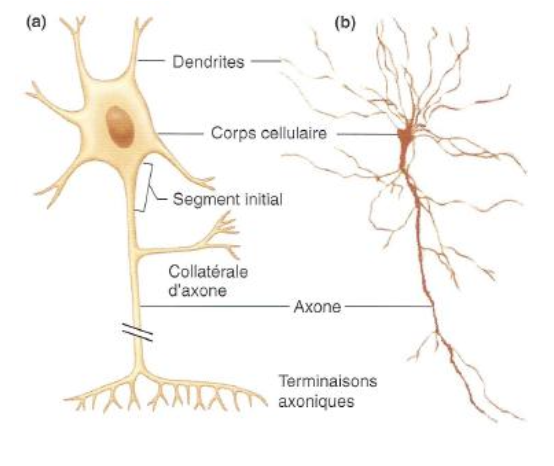
1. Comment est-ce que les neurones communiquent ?
Les neurones communiquent grâce à leur membrane excitable, capable de générer et de propager des signaux électriques (potentiels d’action). Ces signaux voyagent le long de l’axone jusqu’aux terminaisons axoniques, où la communication se fait par libération de neurotransmetteurs dans la fente synaptique.
Pourquoi ? Cela permet de transmettre rapidement et efficacement l’information nerveuse.
Comment ? Le potentiel d’action naît au segment initial de l’axone, se propage le long de la membrane grâce aux canaux ioniques, puis déclenche l’exocytose de neurotransmetteurs aux terminaisons synaptiques.
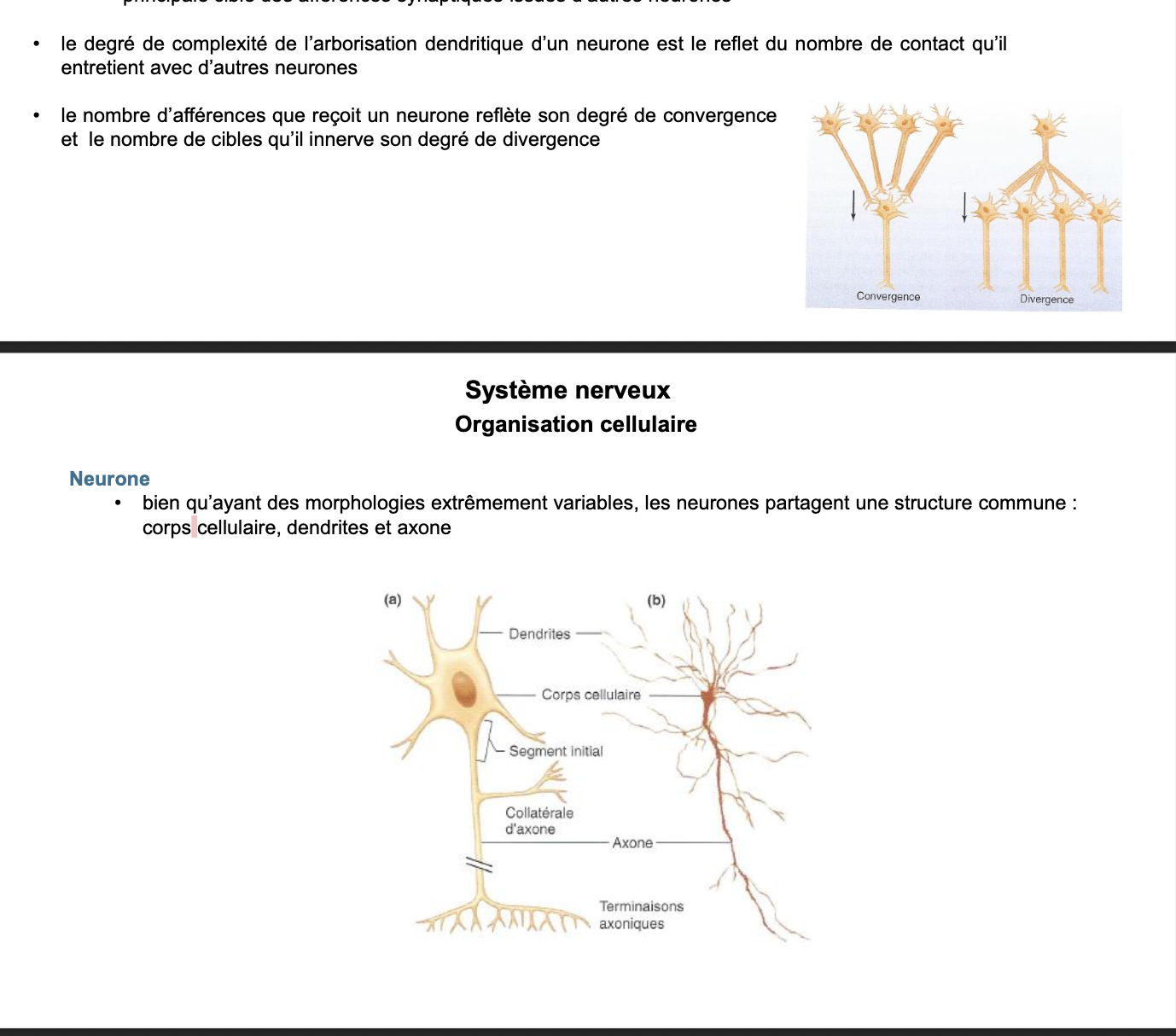
2. Quels sont les différents types de morphologies des neurones ? Quelle est la caractéristique de leur morphologie ?
Il existe plusieurs morphologies principales de neurones, toutes adaptées à leur fonction :
Multipolaires : plusieurs dendrites + un axone → typiques du système nerveux central, favorisent l’intégration de multiples signaux.
Bipolaires : une dendrite + un axone → présents dans les organes sensoriels (ex. rétine, épithélium olfactif).
Pseudo-unipolaires : un prolongement unique qui se divise en deux branches (une vers la périphérie, une vers le SNC) → typiques des ganglions sensitifs.
Unipolaires : un seul prolongement → fréquents chez certains invertébrés.
👉 Leur caractéristique essentielle est la variabilité extrême de leur morphologie, mais toutes conservent une structure commune : corps cellulaire, dendrites et axone. Cette diversité reflète la spécialisation des neurones dans la réception, l’intégration et la transmission des informations.
Organisation cellulaire — Interneurones Question
Qu’est-ce qu’un interneurone ?
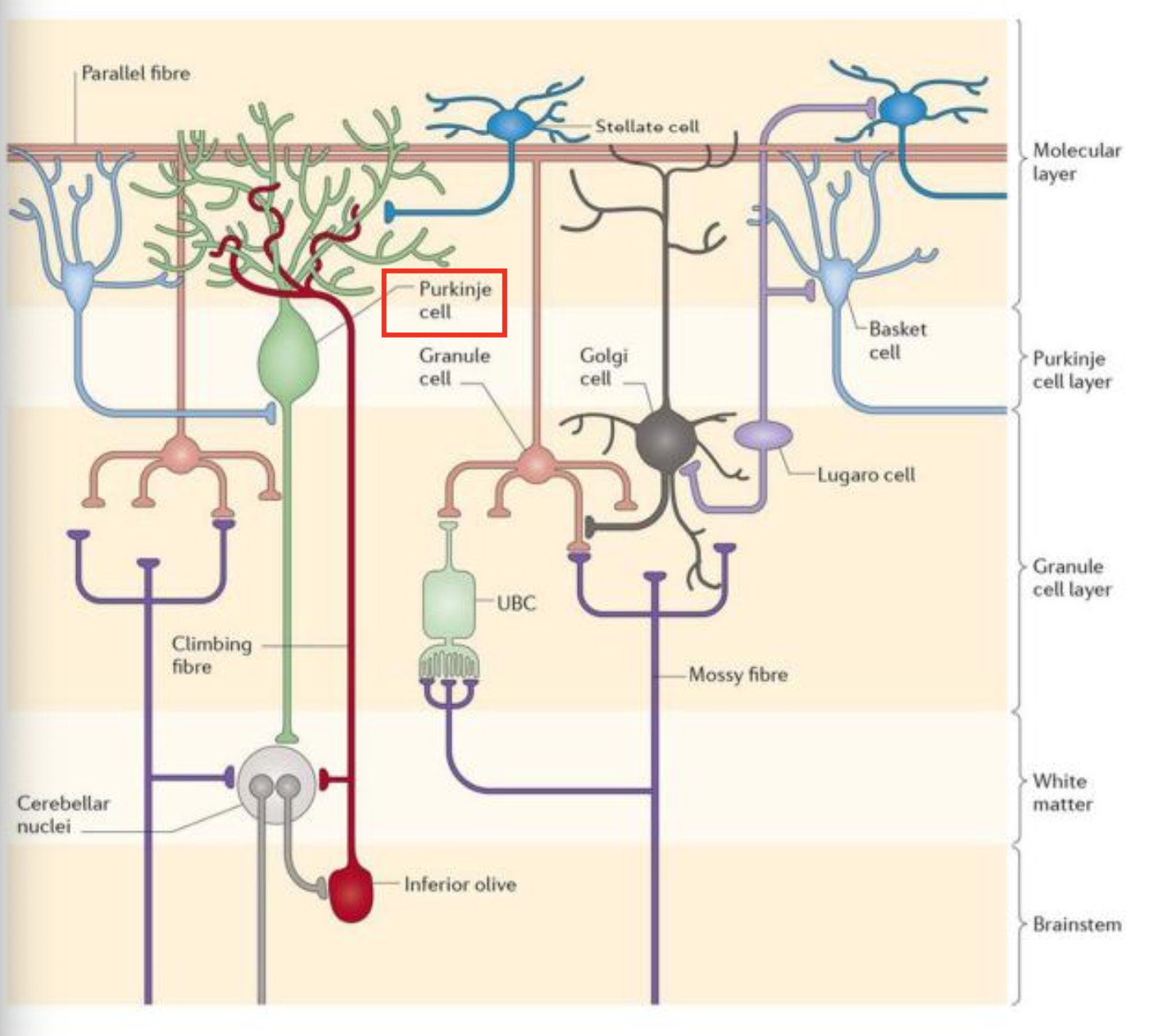
Quoi ? Ce sont des neurones spécialisés dans la modulation des circuits neuronaux internes, souvent inhibiteurs (via le GABA) mais parfois excitateurs (via le glutamate).
Où ? On les retrouve dans de nombreuses régions, notamment le cortex cérébelleux (comme les cellules de Golgi, stellate, basket et Lugaro) et le cortex cérébral.
Comment ? Ils agissent en régulant l’activité des neurones de projection (ex. cellules de Purkinje dans le cervelet), souvent par des synapses inhibitrices.
Pourquoi ? Leur rôle est essentiel pour contrôler la synchronisation, l’équilibre excitation/inhibition et la précision du traitement de l’information.
👉 Exemple de l’image :
Stellate cells (cellules étoilées) : interneurones GABAergiques inhibiteurs localisés dans la couche moléculaire du cortex cérébelleux.
Ils établissent des synapses inhibitrices sur les dendrites des cellules de Purkinje, modulant leur activité excitatrice en provenance des fibres parallèles.
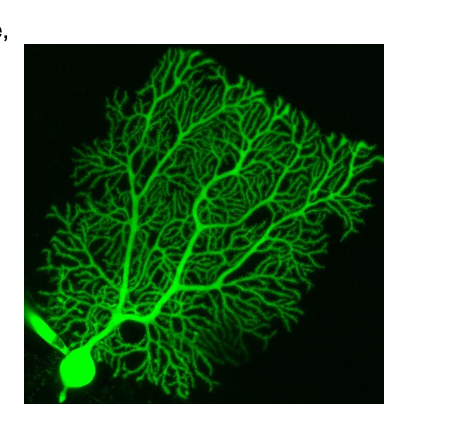

coloré a la fluorescein
Organisation cellulaire Neurone
Cheminement de l’information?
Organisation cellulaire — Neurone Cheminement de l’information
Initiation du potentiel d’action (PA)
Le PA prend naissance au segment initial de l’axone, zone riche en canaux sodiques voltage-dépendants.
Pourquoi ici ? Car c’est le point le plus sensible à la sommation des potentiels excitateurs et inhibiteurs reçus par les dendrites et le soma.
Propagation le long de l’axone
Le message électrique se propage sous forme de potentiel d’action auto-régénéré.
Deux cas :
Axones myélinisés : conduction saltatoire (le PA « saute » de nœud de Ranvier en nœud de Ranvier).
Axones non myélinisés : conduction continue, plus lente.
Arrivée aux terminaisons axoniques
Le PA atteint les terminaisons synaptiques, déclenchant l’ouverture de canaux calciques voltage-dépendants.
L’entrée de Ca²⁺ provoque l’exocytose des vésicules synaptiques contenant des neurotransmetteurs.
Transmission synaptique
Les neurotransmetteurs sont libérés dans la fente synaptique.
Ils se fixent sur les récepteurs post-synaptiques (ionotropes ou métabotropes).
Cela génère soit un potentiel excitateur post-synaptique (PPSE), soit un potentiel inhibiteur post-synaptique (PPSI), modifiant la probabilité de déclenchement d’un nouveau PA dans le neurone cible.
Classes de neurones
1. Quelles sont les trois grandes classes de neurones et leur rôle respectif ?
2. Quel est le ratio entre neurones afférents, efférents et interneurones dans le SNC ?
1. Quelles sont les trois grandes classes de neurones et leur rôle respectif ?
Les neurones se classent en trois catégories principales :
Neurones afférents (sensoriels) : conduisent l’information de la périphérie (récepteurs sensoriels de la peau, des organes sensoriels, viscères) vers le système nerveux central (SNC).
Neurones efférents (moteurs) : transportent les commandes du SNC vers la périphérie (muscles, glandes, organes effecteurs).
Interneurones : restent confinés dans le SNC et relient les neurones entre eux, permettant l’intégration, la modulation et le traitement complexe de l’information.
2. Ratio fonctionnel
2. Quel est le ratio entre neurones afférents, efférents et interneurones dans le SNC ?
Pour 1 neurone afférent entrant dans le SNC, on trouve en moyenne :
10 neurones efférents,
200 000 interneurones.
👉 Ce ratio reflète l’importance des interneurones dans l’intégration, la régulation et la complexité des réseaux neuronaux, beaucoup plus que la simple transmission entrée-sortie.
Organisation cellulaire — Neurone : Transport axonique 1. Généralités
1. Qu’est-ce que le système de transport axonique et de quoi dépend-il ?
2. Types de transport
2. Qu’est-ce que le transport axonique antérograde et quels sont ses exemples ?
3. Qu’est-ce que le transport axonique rétrograde et quels sont ses exemples ?
1. Généralités
1. Qu’est-ce que le système de transport axonique et de quoi dépend-il ?
Le système de transport axonique est un mécanisme intracellulaire permettant d’acheminer des molécules, des organites et des vésicules le long de l’axone.
Quoi ? C’est un système bidirectionnel de transport.
Comment ? Il s’effectue grâce à des protéines motrices (kinésines et dynéines) qui se déplacent le long des microtubules.
Énergie ? Ce mécanisme nécessite de l’ATP, indispensable à l’activité des moteurs moléculaires.
2. Types de transport
2. Qu’est-ce que le transport axonique antérograde et quels sont ses exemples ?
Définition : transport qui se fait du corps cellulaire (soma) vers la terminaison axonale.
Protéine motrice : principalement les kinésines.
Exemples : acheminement de vésicules contenant des neurotransmetteurs, enzymes, protéines membranaires nécessaires à la communication synaptique.
3. Qu’est-ce que le transport axonique rétrograde et quels sont ses exemples ?
Définition : transport qui se fait de la terminaison axonale vers le corps cellulaire.
Protéine motrice : principalement les dynéines.
Exemples : recyclage des vésicules et organites usés, transport de facteurs trophiques captés à la synapse, mais aussi voie d’entrée de certaines toxines et virus (ex. toxine botulinique, toxine tétanique, virus de l’herpès et de la rage).
Système nerveux — Signalisation nerveuse (Rappel) 1. Bases électriques
1. Qu’est-ce qu’un courant électrique ?
2. Qu’est-ce qu’un potentiel ?
3. Qu’est-ce que le principe d’électroneutralité ?
1. Bases électriques
1. Qu’est-ce qu’un courant électrique ?
Un courant électrique correspond à un déplacement de charges électriques.
Dans les métaux : déplacement d’électrons.
Dans les milieux biologiques : déplacement d’ions (Na⁺, K⁺, Cl⁻, Ca²⁺, etc.) à travers la membrane cellulaire grâce à des canaux ioniques, pompes et transporteurs.
👉 Dans le neurone, le courant électrique est donc produit par le flux ionique transmembranaire.
2. Qu’est-ce qu’un potentiel ?
Un potentiel est une différence de répartition des charges électriques entre deux compartiments séparés par une membrane.
Quoi ? C’est la différence de potentiel électrique (en volts ou millivolts) entre l’intérieur et l’extérieur de la cellule.
Comment ? Elle est créée par des gradients de concentration d’ions (ex. Na⁺, K⁺, Cl⁻, Ca²⁺) et par la perméabilité sélective de la membrane plasmique.
👉 Exemple : dans le neurone, au repos, l’intérieur est chargé négativement par rapport à l’extérieur, ce qui crée le potentiel de repos (≈ -70 mV chez le mammifère).
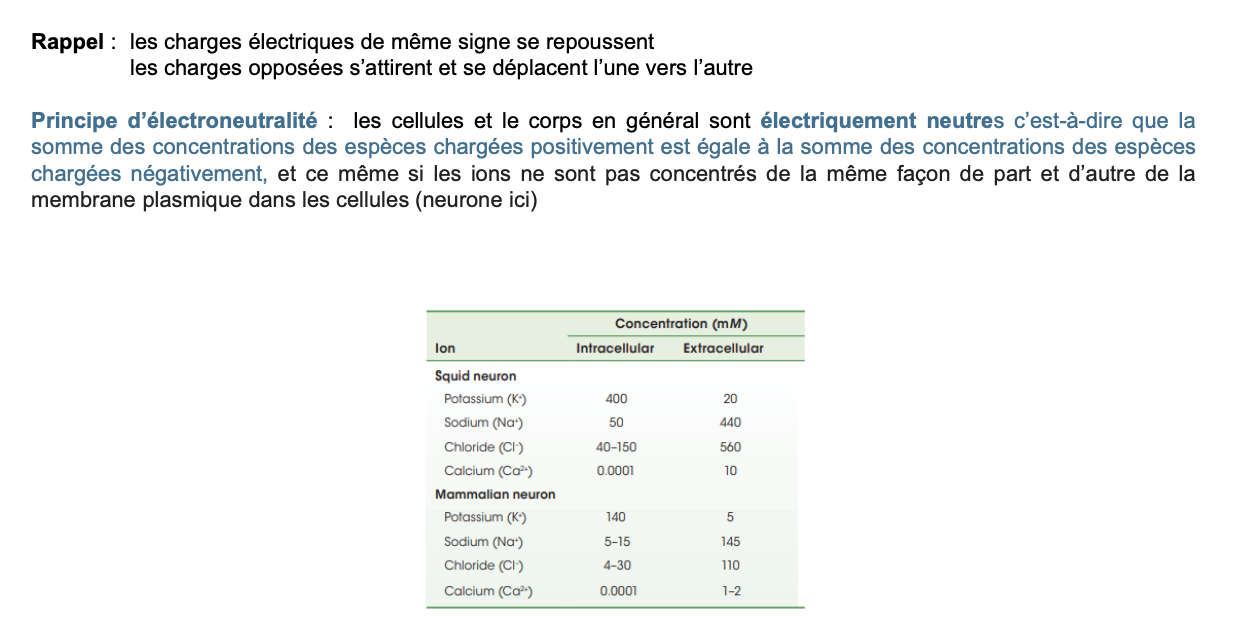
3. Qu’est-ce que le principe d’électroneutralité ?
Le principe d’électroneutralité stipule que :
La somme des charges positives = la somme des charges négatives dans un compartiment.
Cela signifie que, globalement, les cellules et le corps sont électriquement neutres.
Même si les concentrations d’ions diffèrent entre les milieux intra- et extracellulaire (ex. beaucoup de K⁺ à l’intérieur, beaucoup de Na⁺ et Cl⁻ à l’extérieur), chaque compartiment garde une neutralité électrique : la charge totale positive est compensée par une charge totale négative.
👉 Exemple : dans le neurone, malgré un gradient marqué de Na⁺ et de K⁺ de part et d’autre de la membrane, chaque compartiment (intra et extracellulaire) est électriquement neutre dans son ensemble.
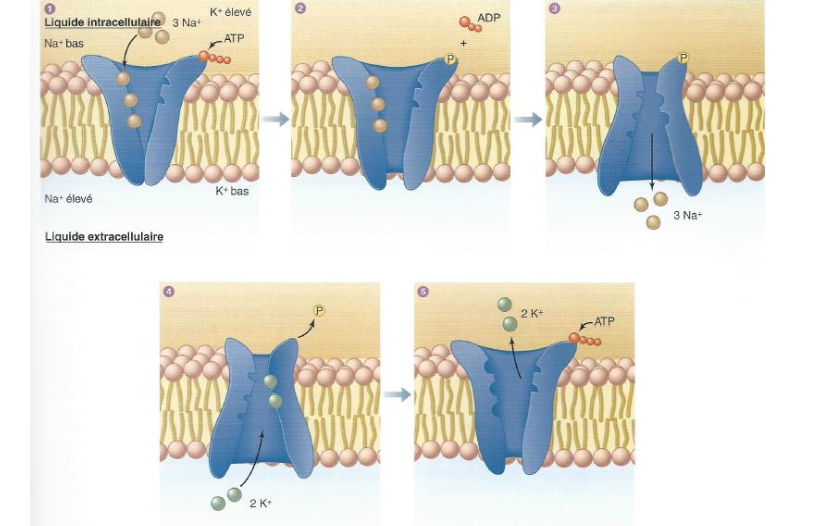
🔹 Protéines membranaires — Pompe Na⁺/K⁺ ATPase 1. Généralités
1. Où se trouve la pompe Na⁺/K⁺ ATPase et quel est son rôle général ?
2. Quel est le type de transport réalisé par la pompe Na⁺/K⁺ ATPase et quelle est sa source d’énergie ?
2. Mécanisme de fonctionnement
3. Quelles sont les étapes de fonctionnement de la pompe Na⁺/K⁺ ATPase concernant les ions Na⁺ ?
4. Quelles sont les étapes de fonctionnement de la pompe Na⁺/K⁺ ATPase concernant les ions K⁺ ?
3. Importance physiologique
5. Pourquoi la pompe Na⁺/K⁺ ATPase est-elle essentielle pour le neurone ?


1. Généralités
1. Où se trouve la pompe Na⁺/K⁺ ATPase et quel est son rôle général ?
Elle est présente sur la membrane plasmique des neurones (et de nombreuses autres cellules).
Elle permet de maintenir les gradients ioniques fondamentaux en expulsant le Na⁺ vers l’extérieur et en faisant entrer le K⁺ à l’intérieur, indispensables pour le potentiel de repos et la propagation des potentiels d’action.
2. Quel est le type de transport réalisé par la pompe Na⁺/K⁺ ATPase et quelle est sa source d’énergie ?
C’est un transport actif primaire, car il agit contre les gradients de concentration des ions.
Sa source d’énergie est l’ATP, hydrolysé par l’activité ATPasique intrinsèque de la pompe.
2. Mécanisme de fonctionnement
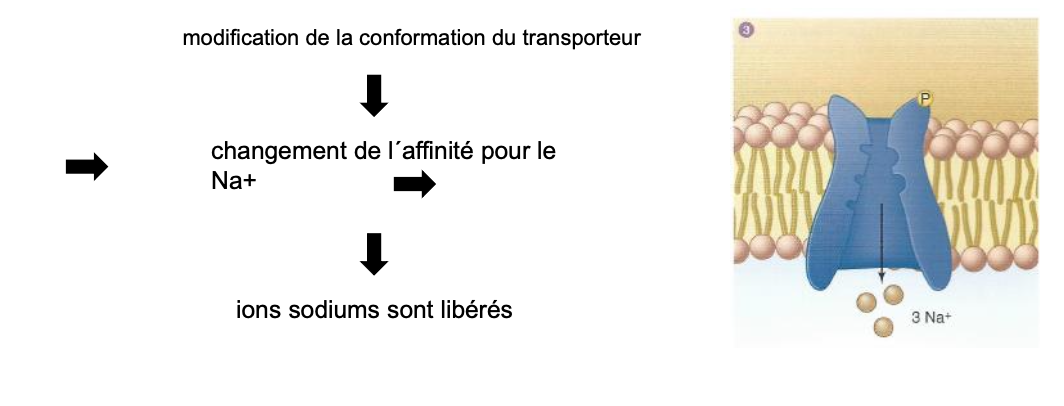
3. Quelles sont les étapes de fonctionnement de la pompe Na⁺/K⁺ ATPase concernant les ions Na⁺ ?
Fixation de 3 ions Na⁺ intracellulaires sur la pompe.
Hydrolyse de l’ATP → phosphorylation de la pompe et libération d’ADP.
Changement de conformation du transporteur → baisse de l’affinité pour le Na⁺.
Libération des 3 Na⁺ vers le milieu extracellulaire.
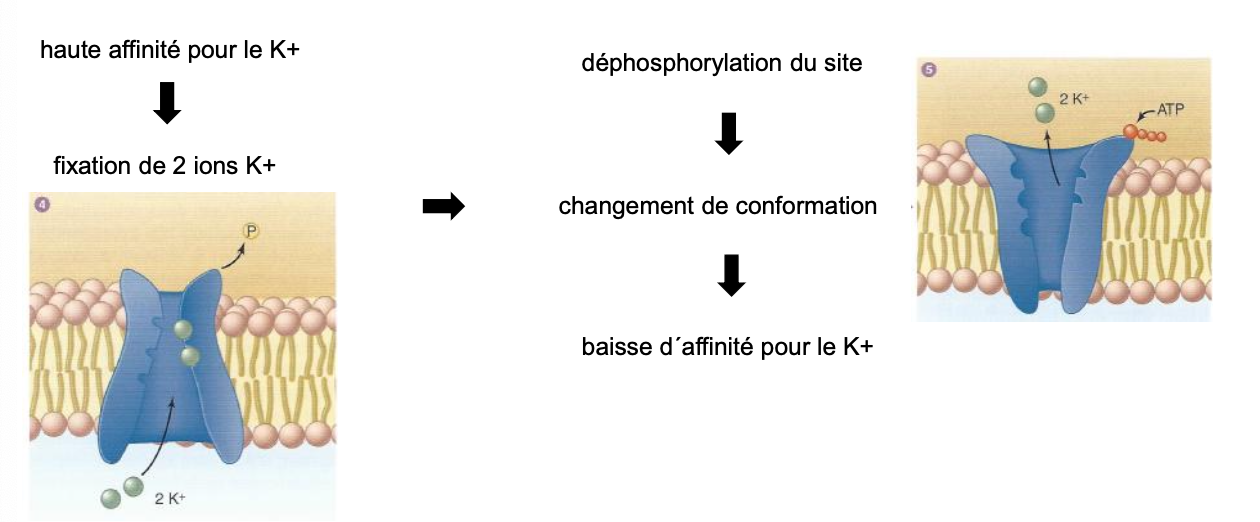
4. Quelles sont les étapes de fonctionnement de la pompe Na⁺/K⁺ ATPase concernant les ions K⁺ ?
La nouvelle conformation de la pompe a une haute affinité pour le K⁺.
Fixation de 2 ions K⁺ extracellulaires.
Déphosphorylation de la pompe → retour à la conformation initiale.
Baisse de l’affinité pour le K⁺ → libération des 2 K⁺ dans le cytoplasme.
3. Importance physiologique
5. Pourquoi la pompe Na⁺/K⁺ ATPase est-elle essentielle pour le neurone ?
Elle maintient le potentiel de repos en préservant les gradients ioniques Na⁺ et K⁺.
Elle assure la disponibilité des ions nécessaires à la génération et à la propagation des potentiels d’action.
Elle joue un rôle majeur dans l’homéostasie cellulaire et le contrôle du volume cellulaire.
👉 Son activité est très coûteuse en énergie : elle représente à elle seule 20 à 40 % de la consommation d’ATP du cerveau.
Schématise le fonctionnement de la pompe Na/K ATPase.
Protéines membranaires — Différence de potentiel 1. Mise en place de la différence de potentiel
1. Quelles sont les deux protéines membranaires qui permettent de mettre en place une différence de potentiel ?
2. Canaux de fuite
2. Qu’est-ce qu’un canal de fuite et lequel est majoritaire dans les neurones ?
3. Quelle loi physique décrit le fonctionnement des canaux de fuite ?
4. Comment fonctionne le canal de fuite potassique et quel est son rôle dans le potentiel de repos membranaire ?

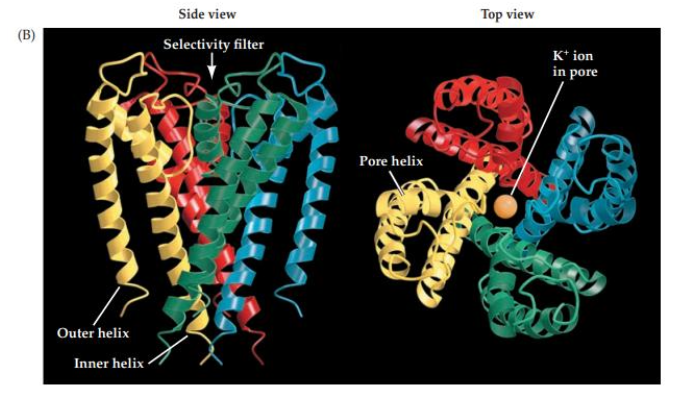

1. Mise en place de la différence de potentiel
1. Quelles sont les deux protéines membranaires qui permettent de mettre en place une différence de potentiel ?
La pompe Na⁺/K⁺ ATPase : assure une différence de concentration ionique en expulsant 3 Na⁺ vers l’extérieur et en important 2 K⁺ à l’intérieur, contre leur gradient de concentration, grâce à l’hydrolyse de l’ATP.
Les canaux de fuite : permettent une perméabilité sélective de la membrane à certains ions, générant ainsi une différence de potentiel électrique.
2. Canaux de fuite
2. Qu’est-ce qu’un canal de fuite et lequel est majoritaire dans les neurones ?
Un canal de fuite est un canal ionique ouvert en permanence, laissant passer passivement un type d’ion spécifique selon son gradient de concentration et de charge.
Dans les neurones, les canaux de fuite potassiques (K⁺) sont les plus nombreux et donc les plus déterminants pour le potentiel de repos.
3. Quelle loi physique décrit le fonctionnement des canaux de fuite ?
Le fonctionnement des canaux de fuite obéit à la loi de Fick : les ions diffusent du compartiment le plus concentré vers le moins concentré.
Cela correspond à un mouvement passif, sans consommation d’énergie.
4. Comment fonctionne le canal de fuite potassique et quel est son rôle dans le potentiel de repos membranaire ?
Le canal de fuite potassique laisse sortir les ions K⁺ (plus concentrés dans le cytoplasme que dans le milieu extracellulaire).
Ce flux de K⁺ sortants crée une charge négative relative à l’intérieur de la cellule, car les anions intracellulaires (protéines, phosphates) restent piégés.
Ce déséquilibre aboutit à l’établissement d’un potentiel de repos de la membrane (environ -70 mV chez le neurone).
👉 Ainsi, l’action conjointe de la pompe Na⁺/K⁺ ATPase et des canaux de fuite potassiques établit et stabilise la polarisation électrique de la membrane neuronale.
4. Équation de Nernst
7. Quelle est la formule générale de l’équation de Nernst et que signifient ses paramètres ?
8. Quelle est sa version simplifiée utilisée en physiologie ?
9. Que donne l’application de cette équation au potassium ?
10. Quelles sont les limites de l’équation de Nernst dans l’étude des membranes biologiques ?




👉 L’équation de Nernst ne prend pas en compte :
la présence de plusieurs ions qui peuvent traverser simultanément la membrane,
la perméabilité relative de la membrane vis-à-vis de chaque ion (variable et non binaire).
C’est pour cela qu’on utilise l’équation de Goldman comme extension.
2. Structure mathématique de l’équation
3. Quelle est la forme de l’équation de Goldman pour les principaux ions ?
4. Que représente le coefficient PPP dans cette équation ?

🔹 Potentiel ionique de repos des cellules nerveuses 1. Mise en place des gradients ioniques
1. Quelle différence de concentration ionique existe au repos entre le milieu intracellulaire et extracellulaire ?
2. Quel mécanisme permet de maintenir cette différence ?
2. Différence de potentiel de repos
3. Quelle différence de potentiel (ddp) se met en place au repos ?
4. Quelle est la valeur typique du potentiel de repos d’un neurone ?
3. Rôle des canaux ioniques
5. Quels canaux ioniques expliquent principalement la mise en place du potentiel de repos ?
6. Quel est le rôle des autres ions (Na⁺, Cl⁻) au repos ?
4. Conditions indispensables au potentiel d’action
7. Quels événements sont indispensables pour qu’un potentiel d’action puisse avoir lieu ?
8. Quel rôle joue la variation de perméabilité membranaire dans la genèse du potentiel d’action ?


👉 Au repos, il existe un gradient ionique de part et d’autre de la membrane plasmique :
Forte concentration de Na⁺ à l’extérieur et faible à l’intérieur.
Forte concentration de K⁺ à l’intérieur et faible à l’extérieur.
Cl⁻ et Ca²⁺ ont aussi des gradients mais leur rôle est secondaire.
Ce gradient est maintenu par la pompe Na⁺/K⁺ ATPase, qui expulse 3 Na⁺ hors de la cellule pour 2 K⁺ rentrant, consommant de l’ATP.
2. Différence de potentiel de repos
3. Quelle différence de potentiel (ddp) se met en place au repos ?
4. Quelle est la valeur typique du potentiel de repos d’un neurone ?
👉 La ddp de repos est comprise entre –40 mV et –90 mV selon les types cellulaires.
Dans un neurone, le potentiel de repos est en moyenne d’environ –70 mV.
3. Rôle des canaux ioniques
5. Quels canaux ioniques expliquent principalement la mise en place du potentiel de repos ?
6. Quel est le rôle des autres ions (Na⁺, Cl⁻) au repos ?
👉 La ddp de repos est principalement due à la présence de canaux de fuite perméables au potassium.
Ainsi, le K⁺ a tendance à diffuser vers l’extérieur suivant son gradient, créant une charge négative à l’intérieur de la cellule.
👉 Les autres ions (Na⁺ et Cl⁻) jouent un rôle mineur au repos, mais ils deviennent essentiels lors des changements rapides de potentiel (PA).
4. Conditions indispensables au potentiel d’action
7. Quels événements sont indispensables pour qu’un potentiel d’action puisse avoir lieu ?
8. Quel rôle joue la variation de perméabilité membranaire dans la genèse du potentiel d’action ?
👉 Deux conditions sont indispensables :
Un gradient de concentration élevé de K⁺ intracellulaire (et de Na⁺ extracellulaire) maintenu par la pompe Na⁺/K⁺.
Une fuite de K⁺ au repos qui établit la ddp négative.
👉 Le potentiel d’action repose sur le changement transitoire de perméabilité membranaire aux ions Na⁺ et K⁺ :
Ouverture rapide des canaux Na⁺ → dépolarisation.
Ouverture retardée des canaux K⁺ → repolarisation.
Qu’est ce qu’une hyperpolarisation? une depolarisation? lequel est inhibiteur?

Dépolarisation
Quoi ? → C’est une diminution de la différence de potentiel transmembranaire : l’intérieur de la cellule devient moins négatif (par ex. de –70 mV à –50 mV).
Comment ? → Cela se produit généralement par entrée de Na⁺ ou de Ca²⁺, rendant le potentiel plus proche de 0 ou même positif.
Pourquoi ? → La dépolarisation rapproche le neurone du seuil d’excitation et favorise la génération d’un potentiel d’action.
👉 Effet : excitateur.
🔹 Hyperpolarisation
Quoi ? → C’est une augmentation de la différence de potentiel transmembranaire : l’intérieur de la cellule devient plus négatif (par ex. de –70 mV à –90 mV).
Comment ? → Cela survient en général par sortie de K⁺ ou entrée de Cl⁻.
Pourquoi ? → L’hyperpolarisation éloigne le neurone du seuil d’excitation et rend plus difficile la génération d’un potentiel d’action.
👉 Effet : inhibiteur.
🔹 POTENTIEL D’ACTION ET CONDUCTANCE MEMBRANAIRE Questions
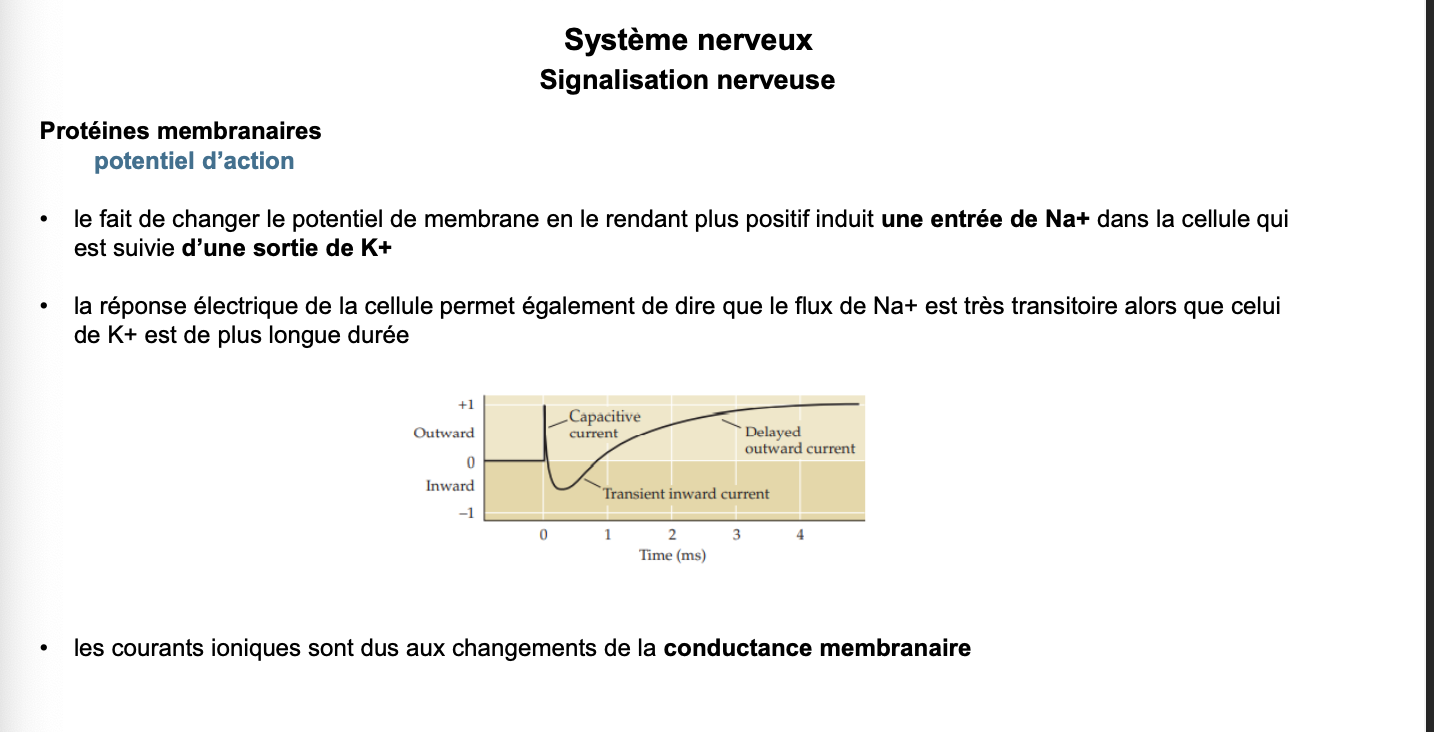
Qu’est-ce que la conductance ? Que se passe-t-il si cette conductance est élevée ?
Quelle est la loi associée à la conductance ionique ?
Les canaux ont-ils tous la même conductance ?
Que représentent gNa⁺ et gK⁺ ? Comment varient-ils ? Lequel ne s’inactive pas ?

1. Qu’est-ce que la conductance ? Que se passe-t-il si cette conductance est élevée ?
La conductance membranaire (g) est l’inverse de la résistance membranaire. Elle reflète la perméabilité de la membrane aux ions, c’est-à-dire la facilité avec laquelle un ion traverse la membrane par ses canaux.
Plus la conductance est élevée, plus la membrane est perméable à l’ion considéré → le flux ionique est donc facilité.
2. Quelle est la loi associée à la conductance ionique ?
Hodgkin et Huxley ont montré que le courant ionique obéit à la loi d’Ohm appliquée à la membrane :
Iion=gion⋅(Vm−Eion)
Avec :
Iion = courant ionique,
gion = conductance membranaire pour l’ion,
Vm = potentiel de membrane,
Eion = potentiel d’équilibre de l’ion.
3. Les canaux ont-ils tous la même conductance ?
Non, chaque type de canal ionique a sa conductance spécifique.
Par exemple, les canaux Na⁺ et K⁺ voltage-dépendants n’ont pas les mêmes vitesses d’ouverture/fermeture, ni la même amplitude de conductance.
Cela explique les différences dans la cinétique des flux ioniques lors d’un potentiel d’action.
4. Que représentent gNa⁺ et gK⁺ ? Comment varient-ils ? Lequel ne s’inactive pas ?
gNa⁺ : conductance de la membrane au sodium.
Elle augmente très rapidement lors de la dépolarisation (ouverture des canaux Na⁺).
Elle diminue rapidement grâce au mécanisme d’inactivation spécifique aux canaux sodiques.
gK⁺ : conductance de la membrane au potassium.
Elle augmente plus lentement (ouverture retardée des canaux K⁺).
Elle ne s’inactive pas : les canaux K⁺ restent ouverts tant que le potentiel de membrane le permet, ce qui assure la repolarisation et l’hyperpolarisation.
🔹 Patch-clamp et canaux voltage-dépendants 1. Principe général
1. Qu’a permis la mise au point de la technique du patch-clamp dans les années 1970 ?
2. Quelles étaient les limites des enregistrements avant cette technique ?
2. Différentes configurations
3. Quelles sont les principales configurations du patch-clamp et que permettent-elles d’étudier ?
3. Apports scientifiques
4. Quels types de canaux ont pu être caractérisés grâce au patch-clamp ?
5. Quelles informations fonctionnelles a-t-il permis de découvrir ?
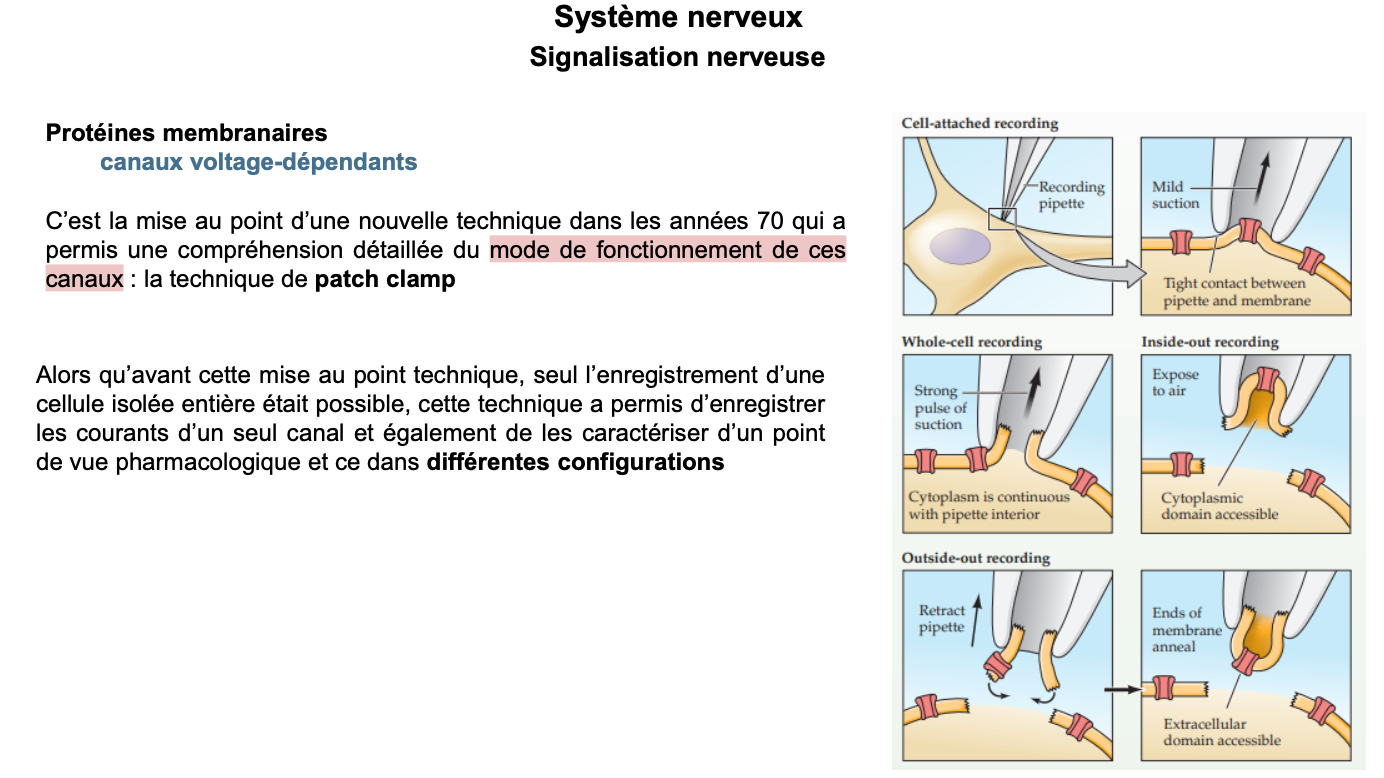


1. Principe général
1. Qu’a permis la mise au point de la technique du patch-clamp dans les années 1970 ?
2. Quelles étaient les limites des enregistrements avant cette technique ?
👉 Le patch-clamp, mis au point dans les années 70, a permis une compréhension fine du mode de fonctionnement des canaux voltage-dépendants.
Avant cette technique, on ne pouvait enregistrer que l’activité d’une cellule entière, sans distinction des canaux unitaires.
👉 Grâce au patch-clamp, on a pu :
mesurer les courants ioniques d’un seul canal,
caractériser leur sélectivité ionique (Na⁺, K⁺, Cl⁻, Ca²⁺),
analyser leur régulation pharmacologique (action de toxines, médicaments),
étudier leur comportement dans différentes configurations expérimentales.
2. Différentes configurations
3. Quelles sont les principales configurations du patch-clamp et que permettent-elles d’étudier ?
👉 Les principales configurations sont :
Cell-attached : pipette scellée à la membrane → enregistrement d’un canal unique sans perturber le cytoplasme.
Whole-cell recording : forte aspiration → continuité entre cytoplasme et pipette → mesure des potentiels et courants de la cellule entière, possibilité d’injecter des substances dans la cellule.
Inside-out : on retire la pipette → face intracellulaire exposée → permet d’étudier l’effet de molécules intracellulaires sur les canaux.
Outside-out : membrane se referme → face extracellulaire exposée → permet d’étudier l’action de neurotransmetteurs ou médicaments extracellulaires.
3. Apports scientifiques
4. Quels types de canaux ont pu être caractérisés grâce au patch-clamp ?
5. Quelles informations fonctionnelles a-t-il permis de découvrir ?
👉 Grâce au patch-clamp, on a caractérisé les canaux :
sodiques (Na⁺),
potassiques (K⁺),
mais aussi calciques (Ca²⁺) et chlorures (Cl⁻).
👉 Cela a permis de comprendre :
leur sélectivité ionique,
leur voltage-dépendance (probabilité d’ouverture selon le potentiel),
leur rôle dans la génération du potentiel d’action et la signalisation neuronale.
🔹 CANAUX VOLTAGE-DÉPENDANTS : FONCTIONNEMENT ET ÉTATS Questions
Combien d’états fonctionnels possèdent les canaux sodiques et potassiques voltage-dépendants ?
Quel est le rôle spécifique du mécanisme d’inactivation des canaux sodiques ?
Pourquoi dit-on que les canaux voltage-dépendants sont sensibles au potentiel de membrane ?
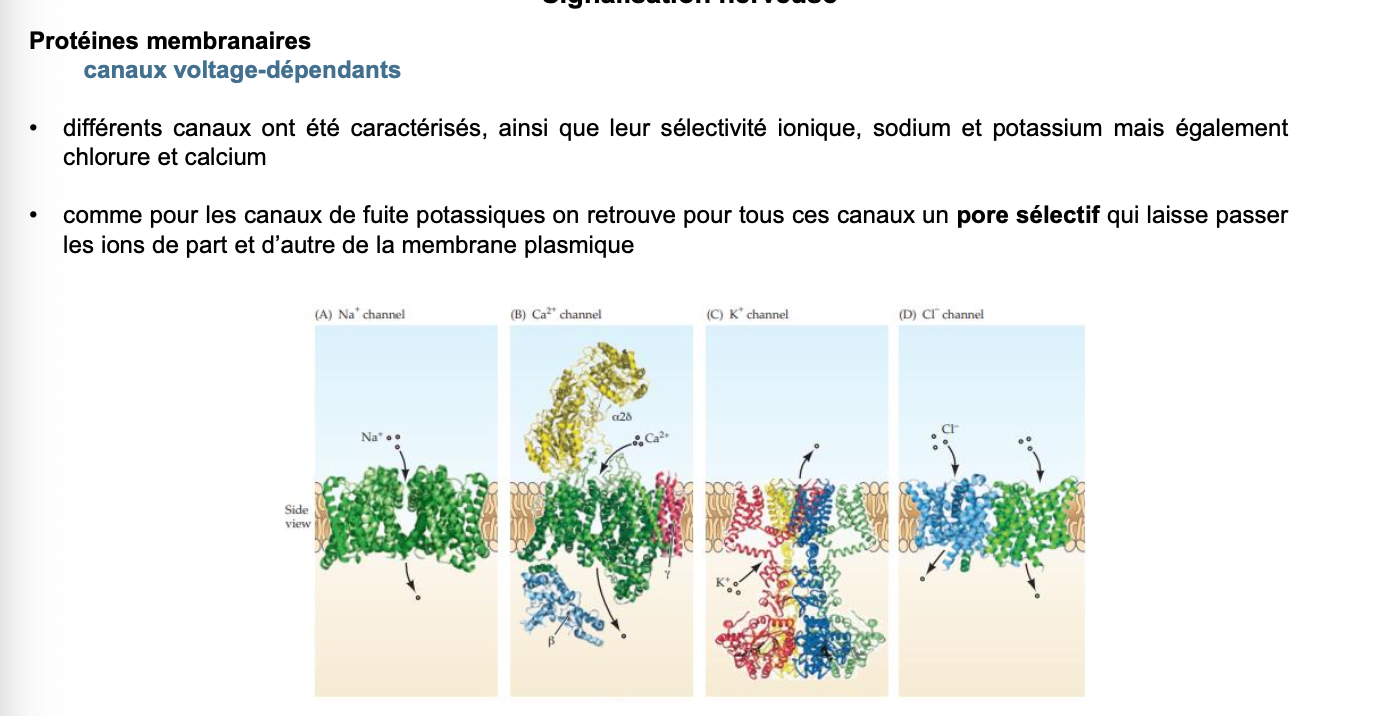
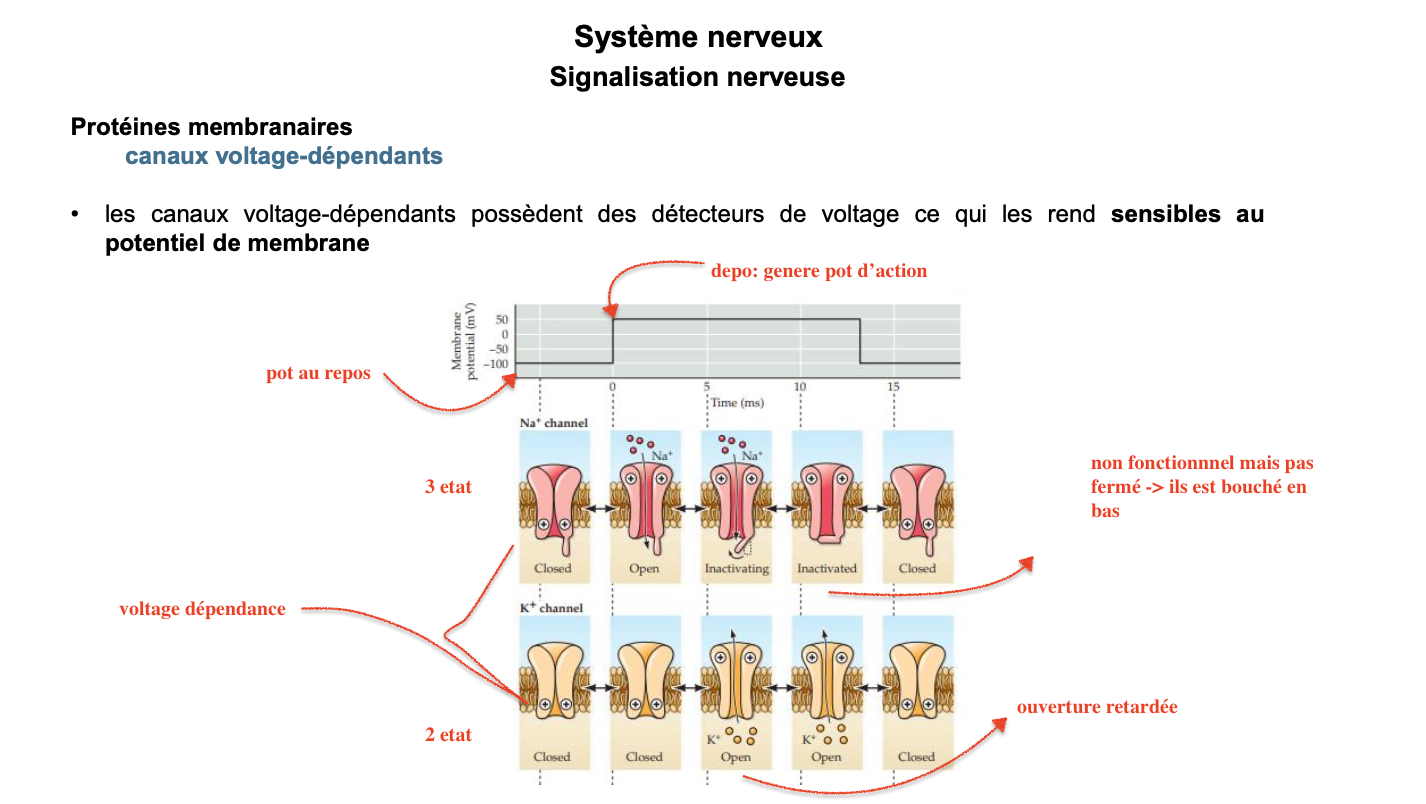
1. Combien d’états fonctionnels possèdent les canaux sodiques et potassiques voltage-dépendants ?
Les canaux sodiques (Na⁺) possèdent 3 états :
Fermé (Closed) : état au potentiel de repos (≈ -70 mV), aucun ion Na⁺ ne passe.
Ouvert (Open) : activation rapide lors de la dépolarisation (entrée massive de Na⁺).
Inactivé (Inactivated) : le canal devient non fonctionnel malgré un potentiel positif, grâce à un « bouchon » intracellulaire qui bloque le pore.
Les canaux potassiques (K⁺) possèdent 2 états principaux :
Fermé (Closed) : aucun passage d’ions K⁺.
Ouvert (Open) : ouverture retardée par rapport aux Na⁺, ce qui entraîne une sortie de K⁺ et permet la repolarisation de la membrane.
2. Quel est le rôle spécifique du mécanisme d’inactivation des canaux sodiques ?
L’inactivation des canaux Na⁺ intervient très rapidement après leur ouverture.
Elle bloque le canal même si la membrane reste dépolarisée, interrompant l’entrée continue de Na⁺.
Ce mécanisme :
Permet la fin de la phase de dépolarisation.
Rend possible la période réfractaire absolue, empêchant la génération immédiate d’un nouveau potentiel d’action.
Garantit la propagation unidirectionnelle du signal nerveux.
3. Pourquoi dit-on que les canaux voltage-dépendants sont sensibles au potentiel de membrane ?
Parce qu’ils possèdent des capteurs de voltage (domaines chargés) qui détectent les variations du potentiel transmembranaire.
Lorsque le potentiel atteint un seuil (≈ -55 mV), ces capteurs déclenchent un changement de conformation :
Activation → ouverture des canaux Na⁺.
Ouverture retardée des canaux K⁺.
Inactivation des canaux Na⁺ après quelques millisecondes.
Cette sensibilité est à la base de la genèse du potentiel d’action.
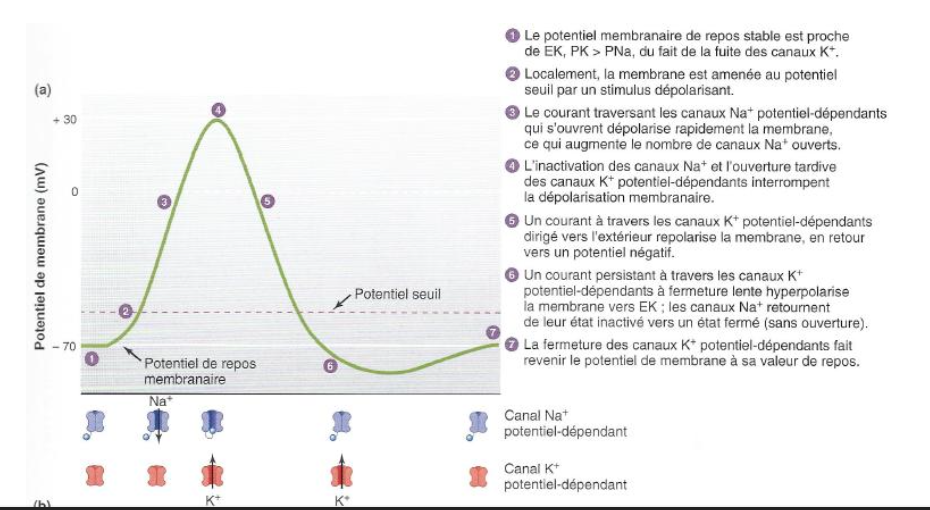
POTENTIEL D’ACTION : PÉRIODE RÉFRACTAIRE Questions
Qu’est-ce que la période réfractaire ?
Quand a lieu la période réfractaire absolue ?
Quand a lieu la période réfractaire relative ?
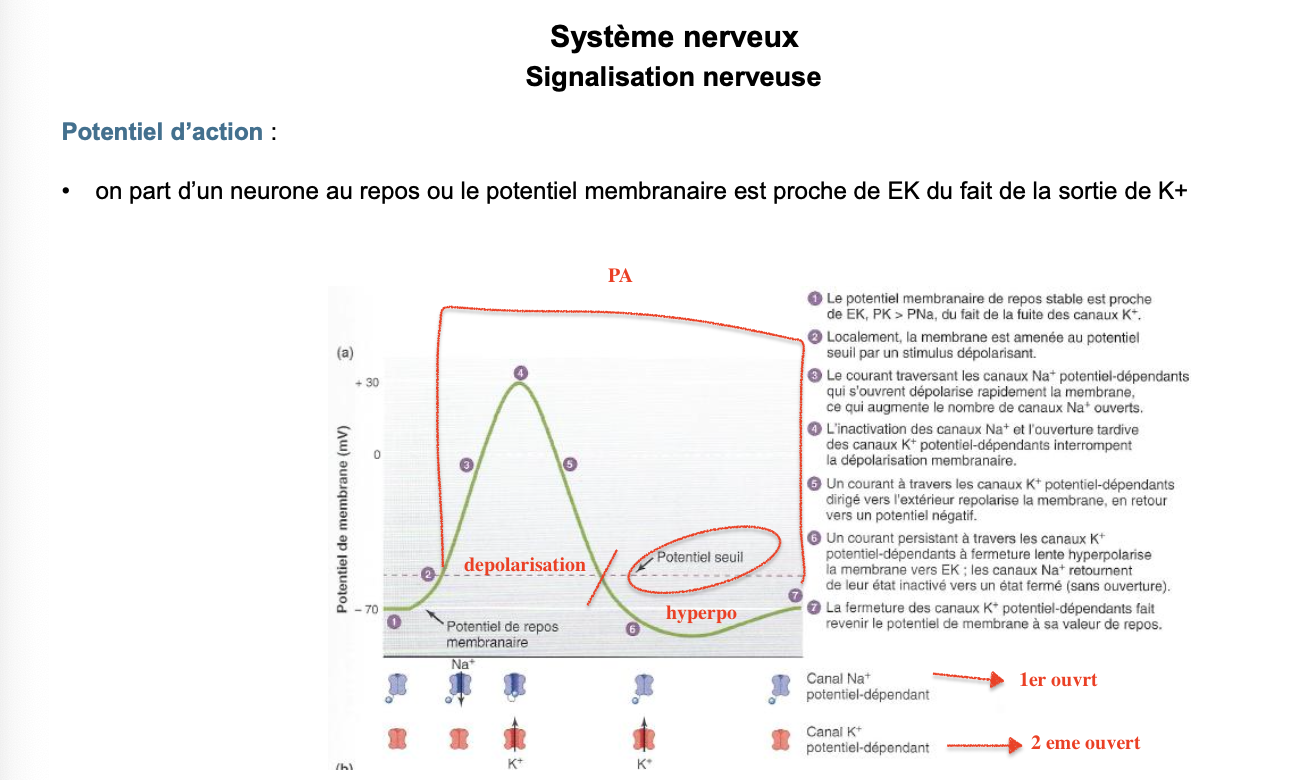
1. Qu’est-ce que la période réfractaire ?
La période réfractaire correspond au laps de temps suivant un potentiel d’action (PA) pendant lequel le neurone ne peut pas ou difficilement déclencher un nouveau PA.
Elle est due :
à l’inactivation transitoire des canaux Na⁺ voltage-dépendants,
et à l’activation prolongée des canaux K⁺ voltage-dépendants.
2. Quand a lieu la période réfractaire absolue ?
Elle survient pendant la dépolarisation et la repolarisation initiale du PA.
Elle correspond au moment où tous les canaux Na⁺ sont inactivés (bloqués par leur bouchon intracellulaire).
Dans cette phase, aucun nouveau PA ne peut être déclenché, même avec un stimulus très fort.
3. Quand a lieu la période réfractaire relative ?
Elle survient pendant l’hyperpolarisation.
Les canaux Na⁺ commencent à revenir à l’état fermable/activable, mais beaucoup de canaux K⁺ sont encore ouverts.
Un nouveau PA peut être déclenché, mais uniquement avec un stimulus plus fort que d’habitude (car la membrane est plus négative que le potentiel de repos).
im occ
🔹 Potentiel d’action — Loi du tout ou rien
1. Qu’est-ce que la loi du tout ou rien ?
2. Y a-t-il une amplitude maximale du PA ?
3. À quoi servent les stimuli qui ne génèrent pas de PA ?
🔹 Conduction saltatoire
4. Qu’est-ce que la conduction saltatoire ?
5. Où se trouvent les canaux sodiques et potassiques voltage-dépendants dans un axone myélinisé ?
6. Comment le PA est-il régénéré dans un axone myélinisé ?
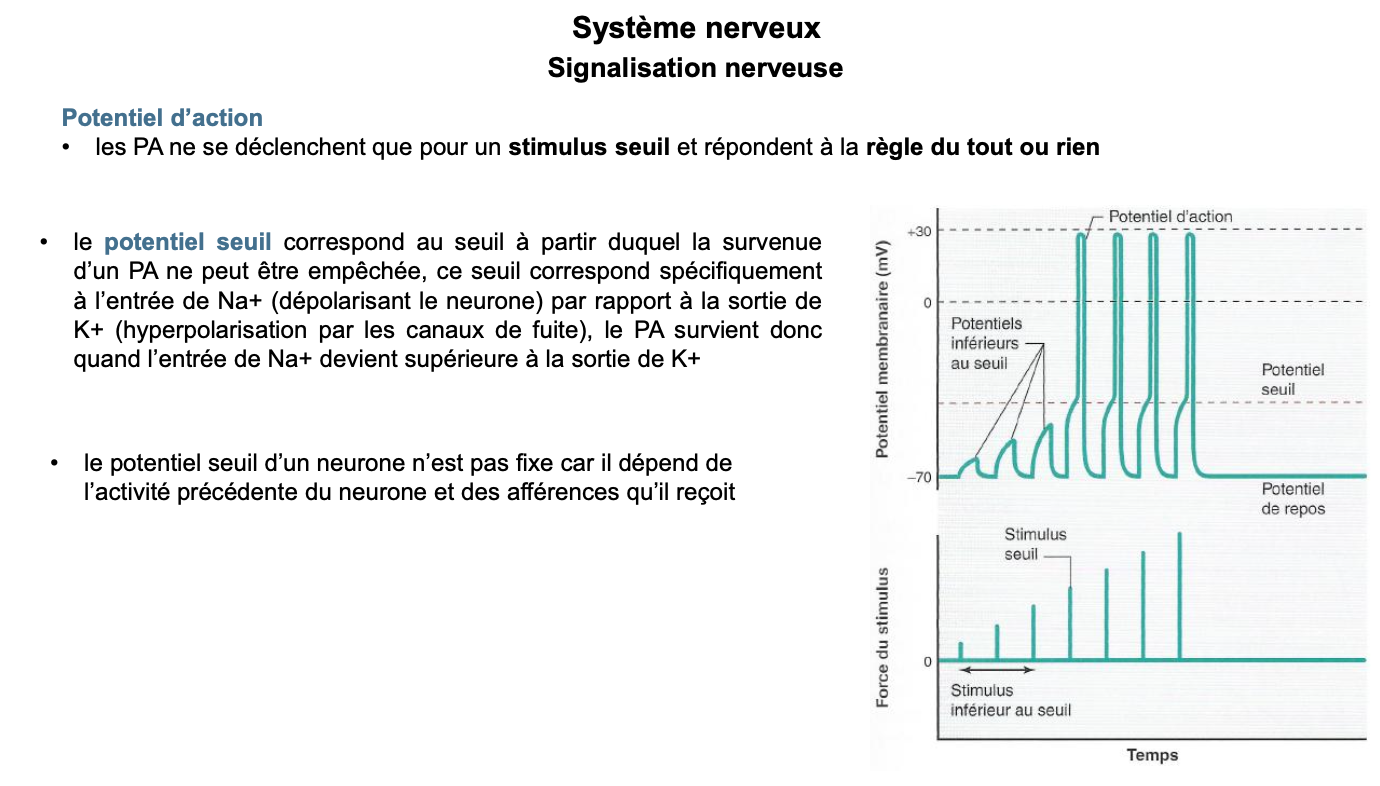
La loi du tout ou rien signifie qu’un potentiel d’action ne se déclenche que si le stimulus atteint un potentiel seuil. En dessous du seuil, aucun PA n’est généré ; au-dessus, un PA complet est produit.
Oui, le PA possède une amplitude maximale fixe, indépendante de l’intensité du stimulus supraseuil. L’information est codée en fréquence, pas en amplitude.
Les stimuli infraseuils provoquent des potentiels gradués locaux (dépolarisations faibles) qui ne déclenchent pas de PA mais peuvent s’additionner (sommation temporelle ou spatiale) pour atteindre le seuil et initier un PA.
Réponses :
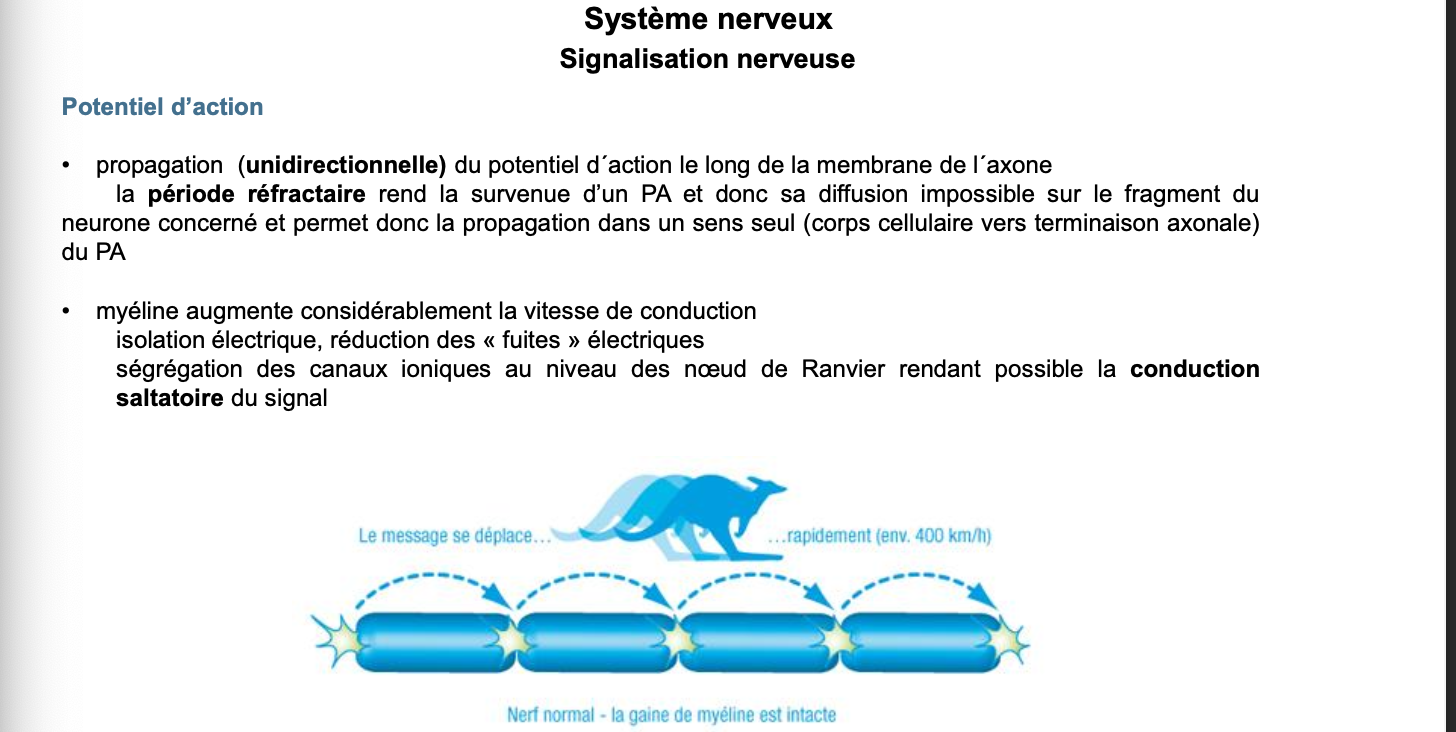
4. La conduction saltatoire est un mode de propagation du PA dans les axones myélinisés où le signal “saute” d’un nœud de Ranvier à l’autre. La myéline agit comme un isolant électrique, réduisant les fuites ioniques et augmentant considérablement la vitesse de conduction.
5. Les canaux sodiques et potassiques voltage-dépendants sont regroupés uniquement aux nœuds de Ranvier, les zones non myélinisées de l’axone.
6. À chaque nœud de Ranvier, le PA est régénéré par l’ouverture séquentielle des canaux Na⁺ voltage-dépendants. Le signal ne s’affaiblit pas mais “saute” de nœud en nœud, ce qui assure une transmission rapide et efficace.
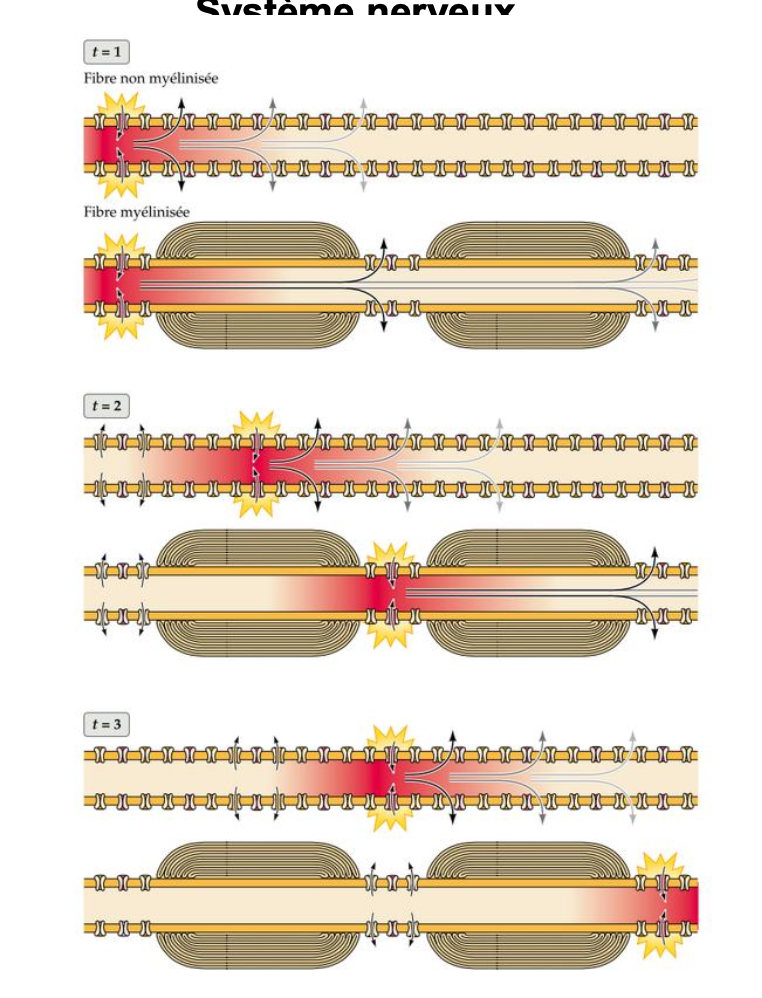
que montre cette image
L’image compare la propagation du potentiel d’action dans un axone non myélinisé (haut) et un axone myélinisé (bas), en montrant la différence de vitesse et de localisation de la dépolarisation.
Dans une fibre non myélinisée, le potentiel d’action se propage de façon continue le long de l’axone : chaque segment de membrane doit s’ouvrir successivement aux ions Na⁺ et K⁺, ce qui est lent et énergétiquement coûteux.
Dans une fibre myélinisée, la conduction est saltatoire : le potentiel d’action “saute” d’un nœud de Ranvier au suivant, car seuls ces nœuds possèdent une forte densité de canaux Na⁺/K⁺ voltage-dépendants. Les segments myélinisés servent d’isolant et empêchent les fuites ioniques.
La myéline joue trois rôles principaux :
Isolation électrique → empêche les fuites de courant ionique.
Augmentation de la vitesse de conduction → le PA est transmis beaucoup plus rapidement (jusqu’à 400 km/h).
Économie d’énergie → seuls les nœuds nécessitent un échange ionique actif.
Les zones fluorescentes indiquent les sites actifs de dépolarisation (entrée massive de Na⁺ suivie de sortie de K⁺). Dans la fibre non myélinisée, elles s’étendent sur toute la longueur de l’axone, tandis que dans la fibre myélinisée elles sont localisées uniquement aux nœuds de Ranvier.
🔹 Propagation du message nerveux : potentiels d’action
1. Comment se propage le potentiel d’action le long de l’axone ?
2. Quel est le rôle de la myéline dans la propagation du message nerveux ?
3. Quelles sont les deux principales fonctions de la myéline pour augmenter la conduction ?
4. Où sont localisés les canaux ioniques voltage-dépendants dans un axone myélinisé ?
5. Quelle est la différence de vitesse de conduction entre fibres non myélinisées et fibres myélinisées ?
6. Donne un exemple de différence fonctionnelle entre conduction lente et rapide.

Réponses :
Le potentiel d’action se propage le long de la membrane de l’axone par l’ouverture séquentielle des canaux Na⁺ et K⁺ voltage-dépendants. Dans les fibres myélinisées, cette propagation est saltatoire, sautant de nœud de Ranvier en nœud de Ranvier.
La myéline augmente considérablement la vitesse de conduction en agissant comme un isolant électrique qui limite les pertes de courant et concentre les échanges ioniques aux nœuds de Ranvier.
Deux fonctions essentielles :
Isolation électrique → réduit les « fuites » de charges.
Segregation des canaux ioniques → concentrés uniquement aux nœuds de Ranvier, ce qui permet la conduction saltatoire.
Les canaux Na⁺ et K⁺ voltage-dépendants sont regroupés exclusivement au niveau des nœuds de Ranvier, zones dépourvues de myéline.
Fibres non myélinisées : ~0,5 m/s.
Fibres myélinisées : jusqu’à ~150 m/s.
Exemple :
Fibres lentes non myélinisées → conduction de la douleur.
Fibres rapides myélinisées → contraction musculaire rapide.