Human fys; Plasma membrane, membran potential, graded and action potential
1/64
Earn XP
Description and Tags
Kapitel 3, 4.2 og 4.3
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
65 Terms
Hvad er glycocalyx, og hvad er dens funktion?
Glycocalyx er et sukkerlag af glycoproteiner og glycolipider på ydersiden af membranen, der bruges til celle-genkendelse og "self"-signalering.
Kanalproteiner
Danner vandfyldte porer gennem membranen.
Tillader passage af små, vandopløselige stoffer uden kontakt med lipidlaget.
Meget selektive (fx kun Na⁺ i natriumkanaler).
Leak channels: altid åbne.
Gated channels: åbner/lukker som respons på stimuli (fx spænding, kemiske signaler).
Defekter i kanaler kan give sygdomme (fx Ca²⁺-kanalblokkere ved forhøjet blodtryk).
Carrier-proteiner (transportproteiner)
Binder specifikke stoffer og flytter dem over membranen.
Vigtige for transport af fx glukose, aminosyrer og jod.
Hver celletype har unikke transportører.
Docking-proteiner
De guider vesikler til membranen og muliggør exocytose.
Cystisk fibrose
Skyldes en genetisk defekt i chlorid (Cl⁻)-kanalen i plasmamembranen, kaldet CFTR (Cystic Fibrosis Transmembrane Conductance Regulator).
Defekt CFTR-protein sidder fast i ER og når ikke membranen.
Uden CFTR bliver membranen impermeabel for Cl⁻, hvilket forstyrrer ion- og væskebalance i luftvejene og bugspytkirtlen.
Symptomer og problemer
Lunger:
Tykt, klistret slim gør det svært at trække vejret og giver bakterier gode vækstbetingelser → hyppige infektioner.
Luftvejene kan ikke optage Na⁺ og Cl⁻ ordentligt → salt og væske ubalance → slim bliver endnu tykkere.
Bakterien Pseudomonas aeruginosa trives → kroniske infektioner.
Bugspytkirtel:
Kanaler blokeres af slim → enzymer når ikke frem til tarmen → nedsat næringsoptag og væksthæmning.
Væske samler sig → væv nedbrydes og bliver fibrotisk.
Hvad er funktionen af cell adhesion molecules (CAMs)?
De binder celler til hinanden eller til extracellulære strukturer og deltager i signalering, immunrespons og sårheling.
Specialiserede funktioner af membranproteiner
Kanalproteiner: Danner vandfyldte porer til ioner.
Carrier-proteiner: Binder og flytter specifikke stoffer.
Receptorer: Binder signalstoffer og aktiverer cellulære responser.
CAMs: Binder celler sammen og formidler signaler.
Docking-proteiner: Hjælper vesikler med at fusionere med membranen.
Enzymer og identitetsmarkører: Fx glycoproteiner til "self"-genkendelse.
Hvad er ECM, og hvad er dens funktion?
Extracellular matrix:
ECM er et netværk af proteinfibre i en gel, som holder celler sammen og muliggør stofudveksling mellem blod og væv.
ECM består hovedsageligt af tre typer proteinfibre:
Collagen
Giver trækstyrke (modstår udstrækning).
Mest udbredte protein i kroppen.
C-vitaminmangel → defekt collagen → fx skørbug (tandkød bløder).
Elastin
Giver elasticitet: kan strækkes og genfinde form (fx i lunger og hud).
Fibronectin
Holder celler fast i ECM.
Mangel på fibronectin → set i nogle kræfttyper → celler slipper og spreder sig.
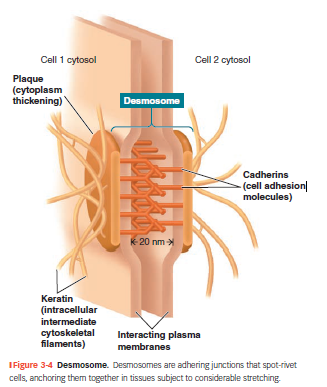
Desmosomer
“Velcro”-lignende punktsammenkoblinger mellem celler.
Består af:
Plaques på indersiden af membranen.
Cadheriner, som forbinder plaques på tværs af naboceller.
Keratinfilamenter → forankrer desmosomet til cytoskelettet.
Findes i væv med mekanisk stress (hud, hjerte, livmoder).
Danner et netværk, som øger trækstyrken og hindrer cellerne i at rive sig løs.
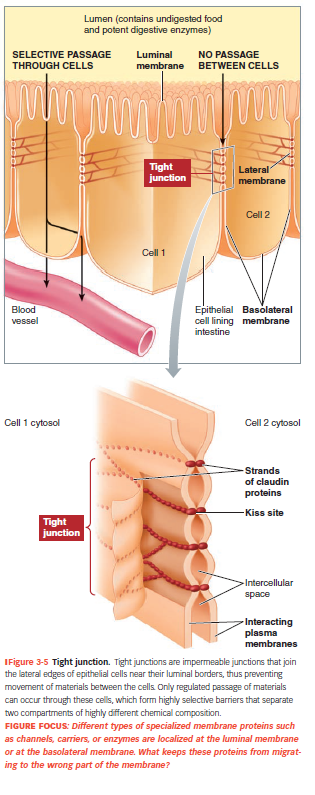
Tight junctions
Forsegler kontakt mellem celler i epitellag → ingen væske eller molekyler kan passere mellem cellerne.
Proteinet claudin danner disse “kyssezoner”.
Findes fx i tarmepitel, hvor de forhindrer læk mellem lumen og blod.
Transport sker gennem cellerne, ikke mellem dem.
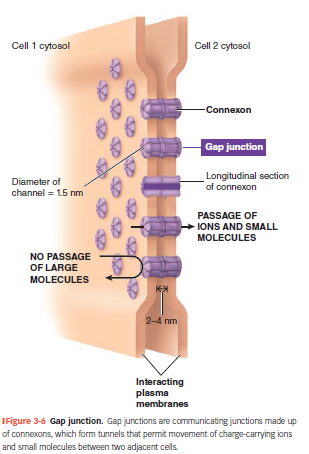
Gap junctions
Danner små kanaler mellem celler, lavet af proteinet connexon (6 connexiner).
Tillader direkte passage af ioner og små molekyler (fx glukose, aminosyrer, signalstoffer).
Forbindelsen går cytosol-til-cytosol, uden at passere ECF.
Ingen store molekyler kan passere.
Funktioner
Vigtig i væv, hvor hurtig og koordineret kommunikation er nødvendig:
Hjertemuskulatur → synkron kontraktion.
Glat muskulatur → elektriske signaler spredes hurtigt.
Også vigtig i ikke-muskulære væv:
Fx næringsstof-overførsel til ægceller i ovarier.
Muliggør direkte celle-til-celle signalering.
Hvad kan passere membranen uden hjælp (unassisted transport)?
Små, lipidopløselige stoffer:
Fx O₂, CO₂, fedtsyrer → kan diffundere frit gennem membranen.
Små, uladede vandopløselige molekyler:
Fx H₂O kan til en vis grad diffundere.
Større eller ladede stoffer (fx glukose, Na⁺, K⁺) kan ikke krydse uden hjælp.
Aktiv vs passiv transport
Passiv transport:
Kræver ingen energi.
Bevægelse sker ned ad en gradient (fx diffusion).
Aktiv transport:
Kræver ATP.
Stoffet bevæges mod dets gradient.
Unassisted transport = passiv diffusion
Kræver ikke energi eller transportproteiner.
Bevægelsen sker som følge af to kræfter:
Koncentrationsgradient (kemisk gradient)
Elektrisk gradient
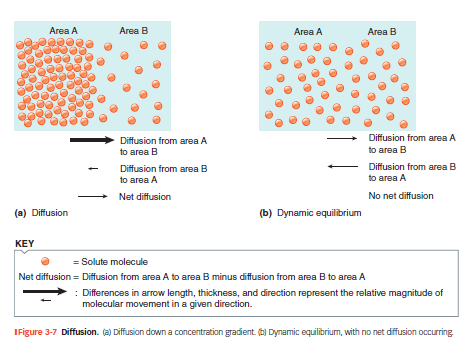
Diffusion langs en koncentrationsgradient
Molekyler bevæger sig spontant fra område med høj koncentration → lav koncentration.
Bevægelsen skyldes tilfældige kollisioner og varmebevægelse.
Når koncentration udlignes på begge sider → dynamisk ligevægt (molekyler bevæger sig stadig, men netto-flow = 0).
Simple diffusion
Handler om, hvordan molekyler spontant bevæger sig i alle retninger pga. varmebevægelse.
Dette sker hele tiden — molekyler kolliderer og spreder sig ud jævnt over tid.
Bevægelsen sker tilfældigt, og kræver ingen energi.
Net diffusion
Er det samlede resultat af simple diffusion i en situation med koncentrationsforskel.
Molekyler bevæger sig stadig i begge retninger, men flere går fra høj til lav koncentration → der er en netto-bevægelse.
Net diffusion fortsætter indtil koncentrationerne udlignes (dynamisk ligevægt).
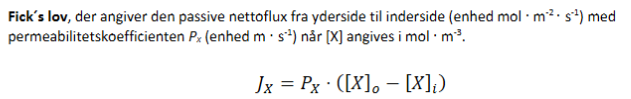
ick’s lov for net diffusion
Hvad du kan bruge den til:
Beregne hvor hurtigt et stof diffunderer passivt ind i cellen (positiv Jₓ) eller ud af cellen (negativ Jₓ).
Vise at fluxen afhænger af:
Hvor stor koncentrationsforskellen er.
Hvor permeabel membranen er for det pågældende stof.
Hvornår gælder den?
Kun for passiv diffusion (altså: ingen energiforbrug, ned ad gradient).
Forudsætter at der ikke er nogen elektrisk gradient – kun koncentrationsforskel.
Hvad bestemmer Pₓ (permeabilitet)?
Hvor nemt stoffet passerer membranen, afhænger af:
Lipidopløselighed (jo højere → højere Pₓ)
Størrelse/molekylevægt (jo større → lavere Pₓ)
Tilstedeværelse af kanaler (for vandopløselige/ladede stoffer)
Hvad betyder fortegnet?
Jx>0 → nettoflux ind i cellen
Jx<0 → nettoflux ud af cellen
Hvad bestemmer Pₓ (permeabilitetskoefficienten)
↑ Lipid solubility → ↑ net diffusion
↑ Molecular weight → ↓ net diffusion
Lipidopløselighed (β)
→ Jo bedre stoffet opløses i membranens fedtlag, jo lettere diffunderer det.
→ Mere lipidopløseligt = højere PₓMolekylevægt (MW)
→ Større/tungere molekyler bevæger sig langsommere.
→ Høj molekylevægt = lavere Pₓ
Elektrisk gradient
Ioner påvirkes ikke kun af koncentration, men også af ladning.
Positivt ladede ioner (kationer) tiltrækkes af negativt ladede områder, og Negativt ladede ioner (anioner) tiltrækkes af positivt ladede områder.
Hvis der er forskel i ladning over membranen, skabes en elektrisk gradient.
Når både koncentrations- og elektrisk gradient virker samtidig på en ion, kaldes det en elektrokemisk gradient.
Elektrokemisk gradient.
Når både koncentrations- og elektrisk gradient virker samtidig på en ion.
Både en elektrisk- og en koncentrationsgradient kan påvirke en given ion på samme tid. Netto effekten af disse gradienter kaldes en elektrokemisk gradient.
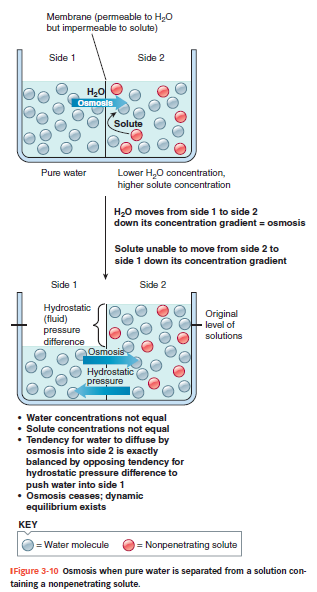
Osmose = vandets diffusion
Vand kan diffundere gennem membranen, selvom det er polært, fordi det er meget småt.
Mange celler har aquaporiner = vandkanaler → gør membranen mere vandpermeabel.
Osmose = vand bevæger sig fra område med lav solutkoncentration → høj solutkoncentration (altså høj → lav vandkoncentration).
Den drivende kraft er koncentrationsgradienten for vand, ikke tiltrækning fra solutterne.
Vigtig pointer
Hvis membranen er kun permeabel for vand, men ikke for solut, vil kun vand flytte sig → volumenændring.
Dette skaber hydrostatisk tryk, som modarbejder yderligere vandbevægelse.
Osmose fortsætter indtil tryk og koncentrationsforskel er i balance.
Osmostisk tryk og hydrostatisk tryk
Når vand bevæger sig gennem en membran (kun permeabel for vand), vil det:
Flytte sig mod høj solutkoncentration (lav vandkoncentration).
Dette skaber en volumenforskel → tryk opbygges. (hvis membranen ikke kan flytte sig eller give sig
Hydrostatisk tryk (væsketryk) modvirker fortsat osmose.
Osmose stopper, når det osmotiske tryk er i ligevægt med det hydrostatiske tryk.
Osmotisk tryk og osmolaritet
Osmotisk tryk afhænger af antal partikler (ikke typen).
Måles i osmolaritet = antal osmotisk aktive partikler per liter (osmol/L).
Fx: 1 mol glukose = 1 osmol
1 mol NaCl → 1 mol Na⁺ + 1 mol Cl⁻ = 2 osmol
Kroppens normale osmolaritet ≈ 300 mOsm/L
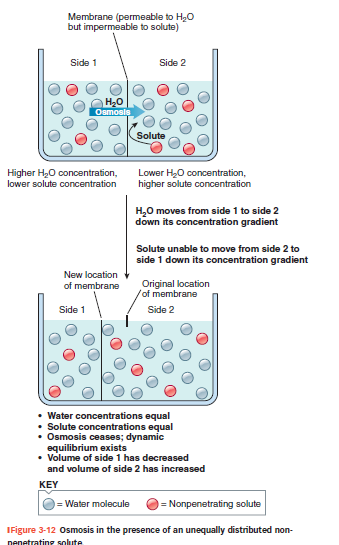
Figur 3-12: Nonpenetrerende solut
Membran er kun permeabel for vand, ikke for solut.
Vand bevæger sig mod den side med høj solutkoncentration (side 2).
Solut bliver på sin side → der opstår volumenændring:
Side 2 → volumen stiger
Side 1 → volumen falder
Osmose fortsætter indtil vandkoncentrationen er ens på begge sider → dynamisk ligevægt, men forskellig volumen.
Den normale osmolaritet for kropsvæsken
Den normale osmolaritet for kropsvæsken er 300 mOsm/L.
Stoffer, der frit kan diffundere gennem membranen bidrager ikke på en ændring af osmolaritet, dermed heller ikke volumen. Cellevolumen bestemmes kun af det impermeable stof.
Tonicitet af en opløsning
Den effekt opløsningen har på cellens volumen.
Isotonisk opløsning (300 mOsm/L): En opløsning med samme koncentration af ikke penetrerende substanser som celler i kroppen har. Cellevolumen forbliver konstant.
Opløsningen har samme osmolaritet som ICF.
→ Ingen netto vandbevægelse → ingen volumenændring.
Hypotonisk opløsning (mindre end <300 mOsm/L): En opløsning med mindre koncentration (fortyndet) af ikke-penetrerende stoffer end celler i kroppen. Cellerne svulmer op og lyserer evt.
Lavere koncentration af nonpenetrerende solutter end ICF.
→ Vand diffunderer ind i cellen → cellen svulmer (og kan sprænges = lysering).
Hypertonisk opløsning (mere end >300 mOsm/L): En opløsning med en højere koncentration (opkoncentreret) af ikke-penetrerende stoffer end celler i kroppen. Cellerne skrumper.
Højere koncentration af nonpenetrerende solutter end ICF.
→ Vand diffunderer ud af cellen → cellen skrumper.
Transport gennem cellemembranen
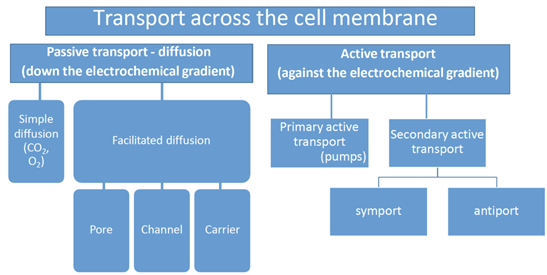
Hvornår bruges assisted transport?
Bruges til stoffer, der ikke kan diffundere frit, fx:
Store molekyler
Vandopløselige stoffer
Ladede ioner
Eksempler: glukose, aminosyrer, proteiner
Carrier-mediated transport
Et transportprotein skifter form og flytter molekylet over membranen.
Molekylet binder → proteinet ændrer form → slipper molekylet af på den anden side.
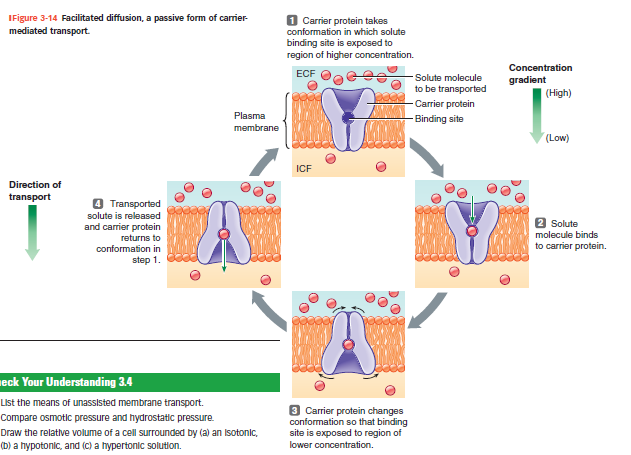
Faciliteret diffusion er passiv (ingen ATP).
Aktiv transport bruger ATP og kan gå mod gradient.
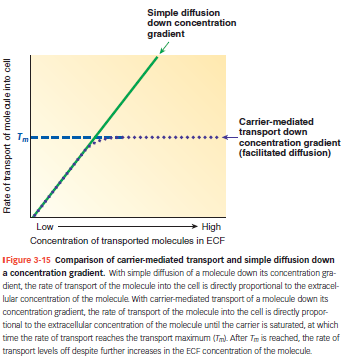
Simpel diffusion: Lineært forhold → mere stof = mere transport.
Carrier-mediated: Øges først, men flader ud ved Tₘ (max kapacitet).
Faciliteret diffusion – hvordan det fungerer
Transportproteinet (carrier) har bindingssteder, der skiftevis vender mod ECF og ICF.
Molekylet binder → carrier ændrer form → molekylet frigives på modsatte side.
Bevægelsen sker ned ad koncentrationsgradienten (passiv), men adgangen er begrænset af:
Antal bindinger
Transporthastighed → mættes ved høje koncentrationer
Active transport = carrier-mediated transport med energiforbrug
Stoffet flyttes mod sin koncentrationsgradient (”op ad bakke”).
To former:
Primær aktiv transport – bruger direkte ATP.
Sekundær aktiv transport – bruger energien fra en eksisterende iongradient (typisk Na⁺) skabt af primær aktiv transport.
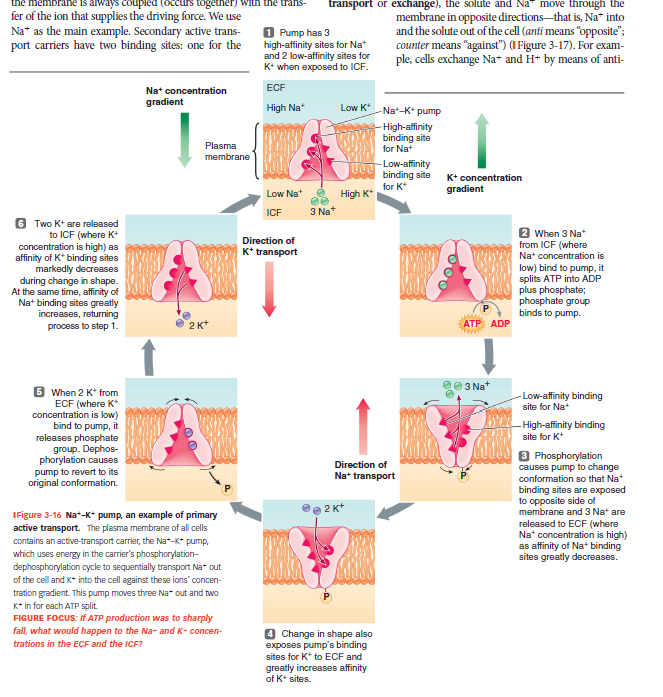
Primær aktiv transport: Na⁺–K⁺ pumpen (natrium-kalium-pumpen)
Pumper 3 Na⁺ ud og 2 K⁺ ind i cellen pr. ATP.
Mekanisme:
3 Na⁺ binder → ATP spaltes → carrier phosphoryleres.
Ændret form → Na⁺ frigives ud.
2 K⁺ binder → dephosphorylering → K⁺ frigives ind.
Opretholder hvilemembranpotentiale, cellevolumen og driver sekundær transport.
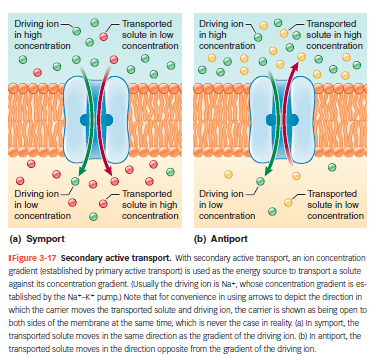
Sekundær aktiv transport
Bruger Na⁺-gradienten som energikilde.
To typer:
Symport: begge stoffer i samme retning (fx Na⁺ og glukose ind).
Antiport: stoffer i hver sin retning (fx Na⁺ ind, H⁺ ud).
Eksempel: SGLT i tarm og nyre – bringer glukose ind sammen med Na⁺.
Vesikulær transport
Bruges til store partikler, som ikke kan komme gennem membranen via kanaler eller carriers.
Transporten kræver energi (ATP) → aktiv transport.
Stoffet er pakket i en membranomsluttet vesikel, der enten fusionerer med eller afsnøres fra membranen.
Balance mellem endo- og exocytose
Cellens overfladeareal reguleres via balancen mellem de to processer.
Ved høj aktivitet kan membranen gendannes op til 30× i timen via exocytose + endocytose.
Vesikulær transport: Endocytose - materiale ind i cellen
Pinocytose: uspecifik væskeoptag
Receptor-medieret endocytose: selektiv optag af specifikke molekyler (fx LDL, jern)
Fagocytose: optag af store partikler (fx bakterier)
→ Vesiklen kan enten:
Smelte sammen med lysosomer (nedbrydning), eller
Transporteres videre til modsatte side (transcytose)
Vesikulær transport: Exocytose - materiale ud af cellen
Vesiklen fusionerer med membranen og frigiver sit indhold til ECF.
Bruges til:
Sekretion af proteiner, enzymer og signalstoffer
Tilføjelse af membranproteiner eller lipider
Membranpotentiale
Spændingsforskel over cellemembranen
Skyldes en ulig fordeling af elektriske ladninger (ioner) på tværs af membranen.
Positivt ladede ioner (kationer) og negativt ladede ioner (anioner) samles på hver sin side → skaber elektrisk spænding.
En cellemembran med spændingsforskel siges at være elektrisk polariseret.
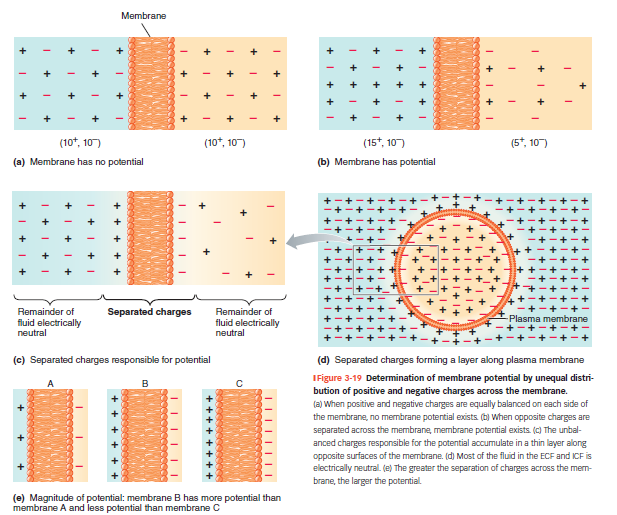
Hvilke ioner bestemmer membranpotentialet?
Det er især:
K⁺: høj koncentration inde i cellen
Na⁺: høj koncentration udenfor cellen
A⁻ (store intracellulære anioner): findes kun inde i cellen
Na⁺/K⁺-pumpen skaber og vedligeholder denne forskel.
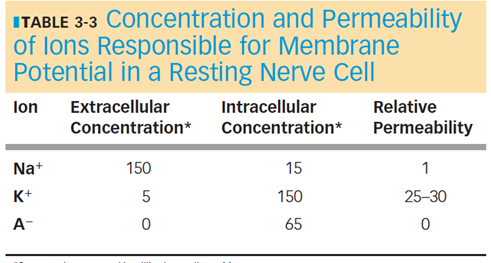
Hvilemembranpotentialet
Hvilemembranpotentialet påvirkes af både Na+ og K+, men da permeabiliteten for K+ er højest, så har denne størst indflydelse.
Tilstedeværelsen af store negativt ladede ICF proteiner er også vigtige. De er betegnet A-.
Hverken Na+ eller K+ er i ligevægt.
Na+-K+ pumpens effekt på membranpotentialet
Både natrium og kalium er kationer. Da det er ulige transport af kationerne separeres ladninger over membranen (3 Na+ ud og 2 K+ ind). Ydersiden bliver relativt mere positiv, mens indersiden bliver relativ mere negativ, da flere kationer transporteres ud end ind.
Men denne transport er kun nok til at genere et lille membranpotentiale på 1 mV til 3 mV.
hvordan ligevægtspotentialet for K⁺ (Eₖ) opstår
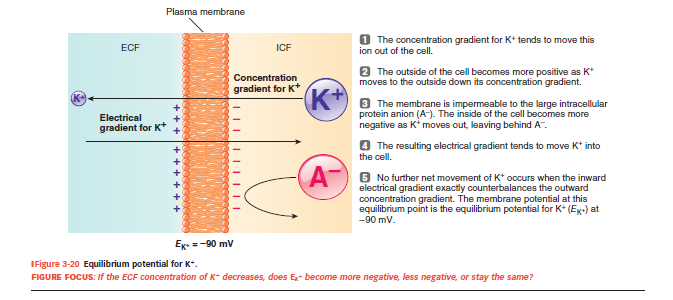
Ligevægtspotentiale (Eₓ)
Det spændingsniveau hvor elektrisk kraft og koncentrationsgradient for en ion præcis balancerer hinanden.
På dette punkt er der ingen netto bevægelse af ionen
Hvad er Eₖ og Eₙₐ for en typisk celle, og hvad betyder de?
Eₖ = –90 mV → holder K⁺ inde.
Eₙₐ = +60 mV → holder Na⁺ ude.
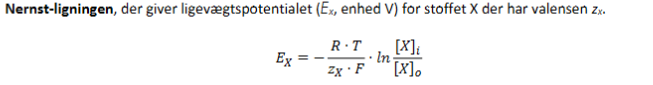
Nernst-ligningen
Forklaring af symboler:
Ex: Ligevægtspotentiale for ion X (i volt, V)
R: Gaskonstant
T: Temperatur i Kelvin
zX: Valens (ladningstal) for ion X (fx +1 for K⁺ og Na⁺)
F: Faradays konstant
[X]i: Koncentration af X inde i cellen
[X]o: Koncentration af X ude i cellen
→ Dette udtryk fortæller dig, ved hvilket membranpotentiale der ikke vil være netto bevægelse af ion X, fordi den elektriske og kemiske kraft præcist balancerer hinanden.
Kan kun bruges til at bestemme potentialet generet fra én specifik ion.
Se formlen til højre.
Jo større koncentrationsgradienten for en ion er, desto større er ionens ligevægtspotentiale.
Bruges til at forstå, hvilken retning en ion vil bevæge sig, hvis membranpotentialet ≠ Eₓ.
![<p><strong>Forklaring af symboler:</strong></p><ul><li><p class="">E<sub>x</sub>: Ligevægtspotentiale for ion X (i volt, V)</p></li><li><p class="">R: Gaskonstant</p></li><li><p class="">T: Temperatur i Kelvin</p></li><li><p class="">z<sub>X</sub>: Valens (ladningstal) for ion X (fx +1 for K⁺ og Na⁺)</p></li><li><p class="">F: Faradays konstant</p></li><li><p class="">[X]i: Koncentration af X <strong>inde</strong> i cellen</p></li><li><p class="">[X]o: Koncentration af X <strong>ude</strong> i cellen</p></li></ul><p class="">→ Dette udtryk fortæller dig, <strong>ved hvilket membranpotentiale</strong> der <strong>ikke vil være netto bevægelse</strong> af ion X, fordi den elektriske og kemiske kraft præcist balancerer hinanden.</p><p class=""></p><p class=""><span style="font-family: "Times New Roman", serif">Kan kun bruges til at bestemme potentialet generet fra én specifik ion.</span></p><p class="MsoNormal"><span style="font-family: "Times New Roman", serif">Se formlen til højre.</span><span> </span></p><p class="MsoNormal"><span style="font-family: "Times New Roman", serif"> </span></p><p><span style="font-family: "Times New Roman", serif">Jo større koncentrationsgradienten for en ion er, desto større er ionens ligevægtspotentiale.</span></p><p class="">Bruges til at forstå, hvilken retning en ion <strong>vil bevæge sig</strong>, hvis membranpotentialet ≠ Eₓ.</p><p class=""></p><p class=""></p>](https://knowt-user-attachments.s3.amazonaws.com/eeec504c-4629-4de5-89ba-1a91fa9a39ac.png)
Hvilemembranpotentialet (Vm)
Opstår, fordi:
K⁺ diffunderer ud af cellen → indersiden bliver negativ.
Na⁺ diffunderer lidt ind → modvirker delvist K⁺’s effekt.
A⁻ (store anioner) kan ikke forlade cellen og forbliver negativt ladet.
Typisk værdi: ~ –70 mV
K⁺ har størst effekt, fordi membranen er 25–30× mere permeabel for K⁺ end for Na⁺.
Resultatet bliver, at Vm ligger tættere på Eₖ (–90 mV) end på Eₙₐ (+60 mV).
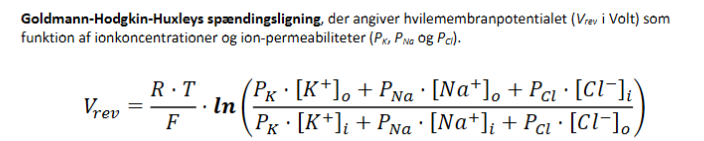
Goldmann-Hodgkin-Huxleys spændingsligning
Vrev: Hvilemembranpotentialet (i volt)
R: Gaskonstant
T: Temperatur (i Kelvin)
F: Faradays konstant
PX: Permeabilitet for ionen X
[X]o, [X]i: Koncentration af X udenfor og indenfor cellen
Cl- kan ignoreres, fordi den ikke direkte bidrager til potentialet.
Hvornår bruges GHK fremfor Nernst?
Nernst-ligningen | GHK-ligningen |
|---|---|
Én ion ad gangen | Flere ioner samtidig |
Bruges til Eₓ (ligevægt) | Bruges til Vm (hvilepotentiale) |
Ingen permeabilitet indgår | Tager højde for permeabilitet (Pₓ) |
Steady-state
Hvilemembranpotentialet er ikke ligevægt, men “steady state”
Ved hvile er en celles membranpotentiale typisk omkring –70 mV. Det betyder, at indersiden af cellen er negativ i forhold til ydersiden. Men dette potentiale er ikke en elektrisk ligevægt for hverken K⁺ eller Na⁺. For eksempel har K⁺ et ligevægtspotentiale (Eₖ) omkring –90 mV, hvilket betyder, at K⁺ stadig vil bevæge sig ud af cellen, fordi membranen er mindre negativ end Eₖ. På samme måde har Na⁺ et ligevægtspotentiale på omkring +60 mV, så Na⁺ vil bevæge sig ind i cellen.
Begge disse ioner lækker derfor passivt – K⁺ ud og Na⁺ ind – gennem åbne leak-kanaler. Hvis dette stod alene, ville koncentrationerne ændre sig over tid, og membranpotentialet ville ikke forblive stabilt.
Men det gør det – og det skyldes Na⁺–K⁺-pumpen. Denne pumpe bruger energi (ATP) til at transportere 3 Na⁺ ud og 2 K⁺ ind i cellen. På den måde gendanner den hele tiden den oprindelige fordeling af ioner og holder membranpotentialet stabilt.
Derfor siger man, at hvilemembranpotentialet befinder sig i en steady state, ikke en ligevægt: der foregår konstant ionbevægelse, men input og output er i balance. Det kræver energi at opretholde, i modsætning til en ligevægt, som er passiv.
Huskeregel for bevægelse af ioner
Hvis en kation har et mere negativt Ex end Vm, så vil den ud af cellen.
Hvis en kation har et mere positivt Ex end Vm, så vil den ind i cellen.
Hvis en anion har et mere negativt Ex end Vm, så vil den ind i cellen
Hvis en anion har et mere positivt Ex end Vm, så vil den ud af cellen.
Hvad er et graded potential
En lokal ændring i membranpotentialet (fx fra –70 mV til –60 mV).
Udløses af et triggerevent, fx åbning af Na⁺-kanaler.
Jo stærkere trigger, jo større ændring (→ graded = gradueret).
Varer kun så længe kanalerne er åbne.
Hvad er et aktionspotentiale?
Et hurtigt og stort skift i membranpotentiale (typisk fra –70 mV til +30 mV).
Den reverserer midlertidigt spændingen → indersiden bliver positiv ift. ydersiden.
Sker kun i excitable celler (fx neuroner og muskler).
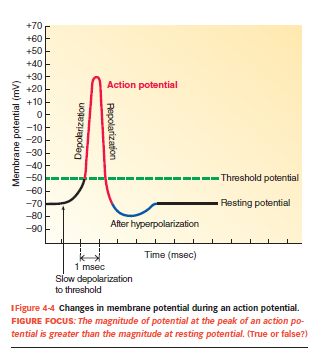
Hvad udløser aktionspotentialer?
En graded potential når tærskelværdien (typisk –55 mV).
Når dette punkt nås → eksplosiv åbning af spændingsstyrede Na⁺-kanaler → depolarisering.
Hvordan forløber aktionspotentialet sig
Hvile: Vm = –70 mV, membranen er mest permeabel for K⁺
Tærskel nås (~–55 mV) → spændingsstyrede Na⁺-kanaler åbner
Depolarisering: Na⁺ strømmer ind → Vm stiger → peaker ved +30 til +40 mV
Repolarisering: Na⁺-kanaler inaktiveres, og K⁺-kanaler åbner → K⁺ ud
Hyperpolarisering: K⁺-kanaler lukker langsomt → Vm falder til –80 mV
Tilbage til hvile: Na⁺–K⁺-pumpen gendanner ionfordeling og Vm
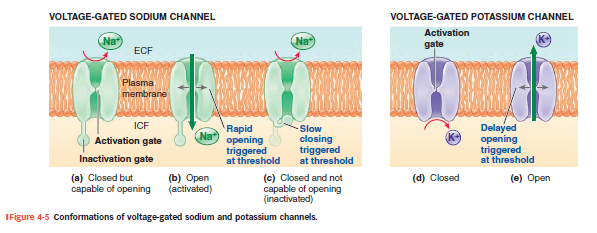
Spændingsafhængige Na+ og K+ kanaler
Spændingsstyrede Na⁺-kanaler har 3 tilstande:
(a) Lukket, men klar til at åbne (ved hvile)
(b) Åben (ved tærskel – depolarisering)
(c) Inaktiveret (kort efter peak)
Spændingsstyrede K⁺-kanaler har 2 tilstande:
(d) Lukket (ved hvile)
(e) Åben (forsinket åbning under repolarisering)

Hvile (–70 mV)
→ Alle spændingsstyrede Na⁺- og K⁺-kanaler er lukkede, men klar til at åbne.Tærskel nås (~–55 mV)
→ Na⁺-kanalers aktiveringsgate åbner, og P_Na⁺ stiger kraftigt.Depolarisering (op til +30 mV)
→ Na⁺ strømmer ind → membranen bliver positiv → Na⁺-kanaler går mod inaktivering.Peak (+30 mV)
→ Na⁺-kanalers inaktiveringsgate lukker, K⁺-kanaler åbner → P_K⁺ stiger.Repolarisering
→ K⁺ strømmer ud → Vm falder tilbage mod hvile.Hyperpolarisering (~–80 mV)
→ K⁺-kanaler lukker langsomt, så lidt ekstra K⁺ slipper ud → Vm falder under –70 mV.Tilbage til hvile
→ Na⁺-kanaler resettes, K⁺-kanaler lukker → membranen stabiliseres igen ved –70 mV.
Na⁺–K⁺-pumpens rolle efter aktionspotentiale
Under et AP:
Na⁺ strømmer ind under depolarisering
K⁺ strømmer ud under repolarisering
Efterfølgende ændres ionfordelingen en smule
Na⁺–K⁺-pumpen gendanner langsomt den oprindelige koncentrationsforskel.
Denne genopretning tager lang tid, men et AP kræver kun små ionmængder, så cellen kan lave mange AP’er uden at "løbe tør".
Neuronets opbygning og funktionelle zoner
Input zone
→ Dendritter og cellekrop
→ Modtager signalerTrigger zone
→ Axon hillock
→ Starter aktionspotentialer, hvis tærskel nåsConducting zone
→ Axon
→ Leder AP uden tab (nondekrementelt), selv over lange afstandeOutput zone
→ Axon terminal
→ Frigiver neurotransmittere til næste celle
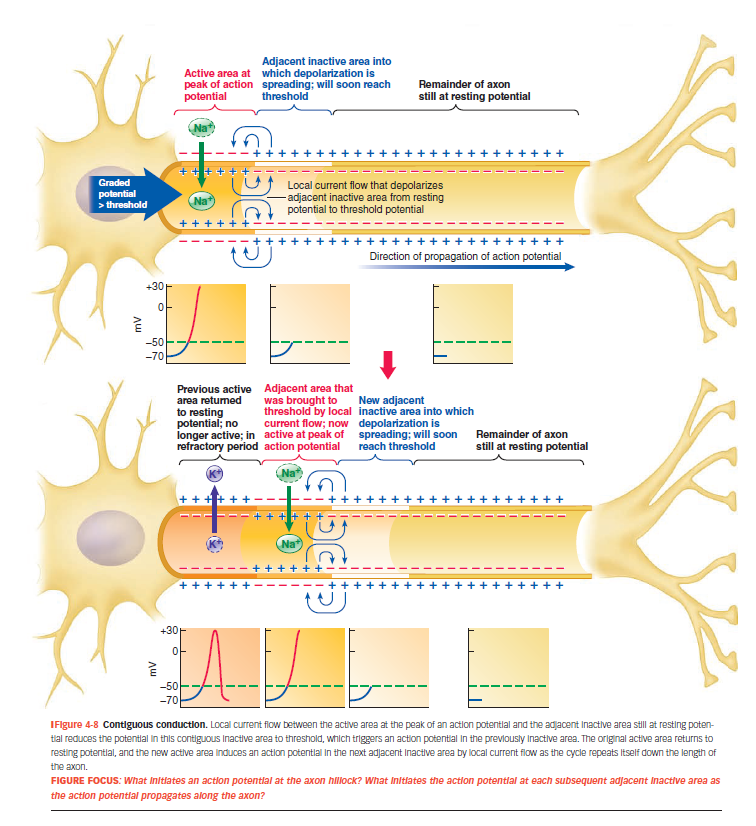
Forklar figuren
Graded potential > tærskel
Et lokalt depolariserende signal (graded potential) når tærskelværdien i axon hillock.
Det starter et aktionspotentiale.
Na⁺ strømmer ind (aktivt område)
Spændingsstyrede Na⁺-kanaler åbner → Na⁺ strømmer ind → dette sted bliver mere positivt = aktivt område.
Lokal strøm flyder til naboområder
Positive ladninger bevæger sig til nabo-områder, som stadig er i hvile.
Dette kaldes local current flow.
Naboområde depolariseres → ny AP starter
Når det næste område når tærskel, åbner dets Na⁺-kanaler.
→ Et nyt AP starter dér.
Det tidligere aktive område begynder at repolarisere (K⁺ strømmer ud).
Processen gentager sig
Det nye aktive område bliver positivt → depolariserer det næste → osv.
Som en bølge, hvor hver del af membranen fyrer et AP ét ad gangen.
Refraktær periode forhindrer tilbageslag
Tidligere områder er ufølsomme for ny stimulering → sikrer, at AP kun bevæger sig fremad.
Refraktærperioden
Forhindrer at aktionspotentialet går baglæns
Begrænser frekvensen af hvor ofte et neuron kan fyre
Sikrer at AP’er ikke overlapper (ingen “piggybacking”)
Typer af refraktærperiode:
Absolut refraktærperiode
Ingen nyt AP muligt, uanset hvor stærkt stimulus er
Skyldes at Na⁺-kanaler er inaktiverede og endnu ikke nulstillet
Varer fra tærskel → næsten tilbage til hvilende Vm
Relativ refraktærperiode
Nyt AP kan ske, men kræver stærkere stimulus end normalt
Skyldes at nogle Na⁺-kanaler stadig ikke er klar, og K⁺-kanaler stadig er åbne → membranen er hyperpolariseret
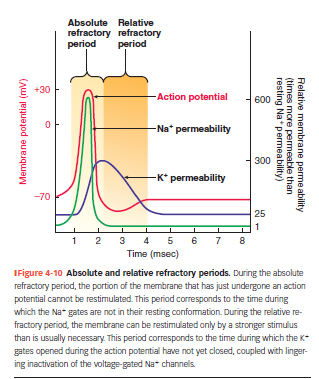
Rød kurve: membranpotentiale under AP
Grøn kurve: Na⁺-permeabilitet (↑ under depolarisering)
Lilla kurve: K⁺-permeabilitet (↑ under repolarisering)
Farvede felter:
Orange = absolut refraktærperiode
Gul = relativ refraktærperiode
Aktionspotentialer er alt-eller-intet
Når tærskel nås → maksimalt aktionspotentiale dannes, samme størrelse hver gang
Et stærkere stimulus skaber ikke større AP, kun flere AP’er per sekund
Svagere stimuli (under tærskel) = ingen AP
Ledningshastighed afhænger af:
. Myelinisering
Myelin = fedtholdigt lag der isolerer axonet → AP "springer" fra node til node (saltatorisk ledning)
Øger hastighed op til 50× ift. ikke-myeliniserede fibre
Axonets diameter
Større diameter → lavere elektrisk modstand → hurtigere ledning
Hvad er saltatorisk ledning?
En hurtig form for AP-ledning, hvor signalet "hopper" fra node til node i myeliniserede axoner.
Hvor sker aktionspotentialer i myeliniserede fibre?
Kun i Ranvierske indsnøringer, hvor ionkanaler findes.