Chimie générale - Architecture moléculaire (copy)
1/71
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
72 Terms
Formule moléculaire =
Formule brute
Formule brute ( = formule moléculaire):
Indique le nombre de chaque espèce d’atomes dans la molécule (C…H…O…N…)
Donne peu d’info sur la molécule → n’indique pas l’enchaînement des atomes
Généralement: plusieurs composés ont la même formule brute
Permet de determiner le nombre d’insaturations/cycle (Ni)
Formule pour déterminer le nombre d’instaurations (ou de cycle) Ni:

Atomes d’halogène
Éléments chimiques constituant le sous-groupe VII b de la classification périodique,:
le fluor (F), le chlore (Cl), le brome (Br), l' iode (I) et l' astate(At)
Avantages/inconvenients formules développées planes:
AVANTAGES:
Représentation schématique qui permet de préciser l’ordre d’enchaînement des atomes
Fait apparaître le nombre de liaisons covalentes qui relient les atomes
Facile (il faut seulement connaître la valence des atomes concernés)
1 liaison = 1 traît
INCONVENIENTS:
Ne fournie pas une représentation de la géométrie de la molécule —> géométrie est nécessaire lors de l’étude de la réactivité chimique, et pour mettre en évidence les 2 types de stéréoisomères
N’est pas pratique (trop longue et encombrante) —> on préfère les formules simplifiées
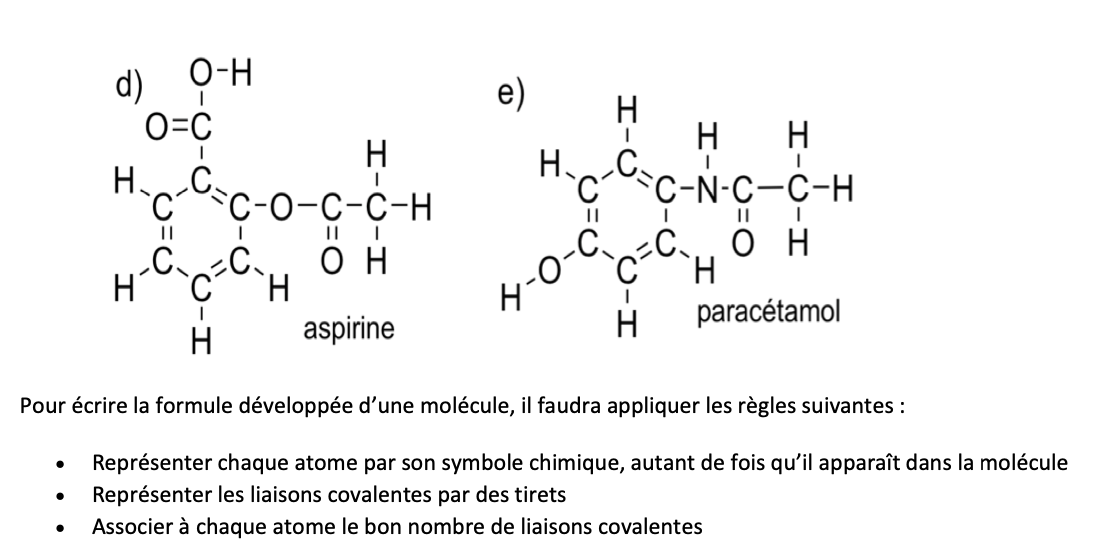
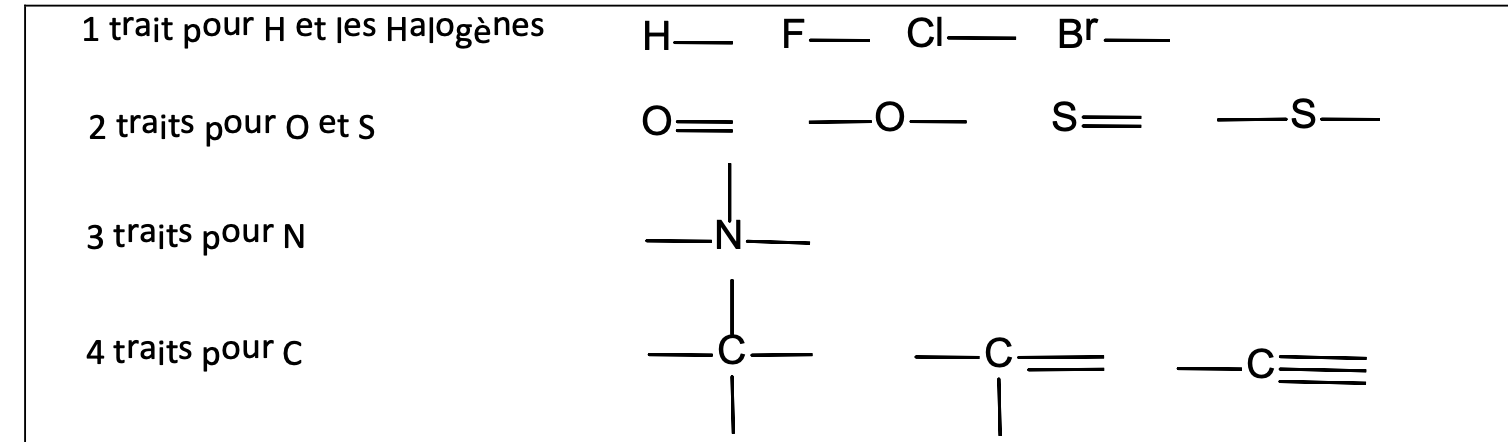
Liaisons les + fréquemment rencontrés en chim organique: H, Halogènes, O, S, N, C
Modes/types d’écriture simplifiée:
Formule combinée = semi-développée
Formule condensée
Formule topologique = forme de bâton
Forme combinée =
Formule semi-développée
Forme topologique =
Forme de bâton
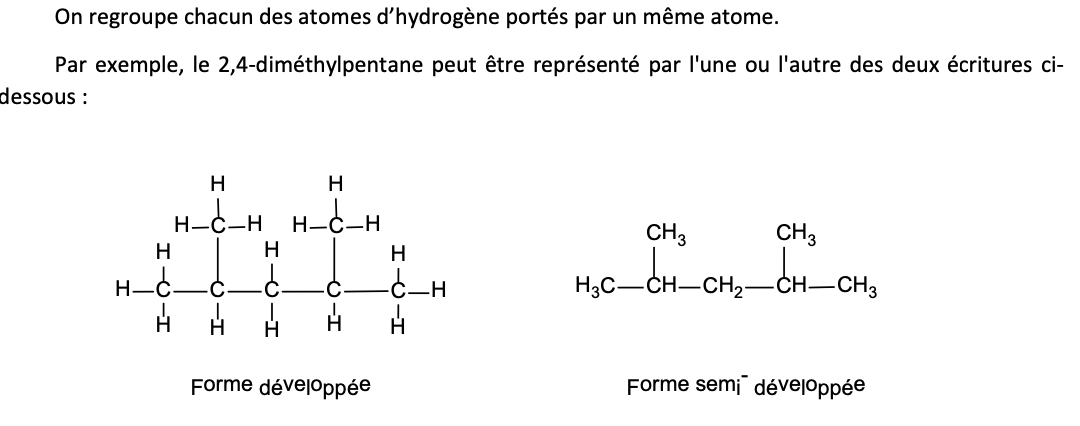
Principes formule combinée ( = semi-développée)
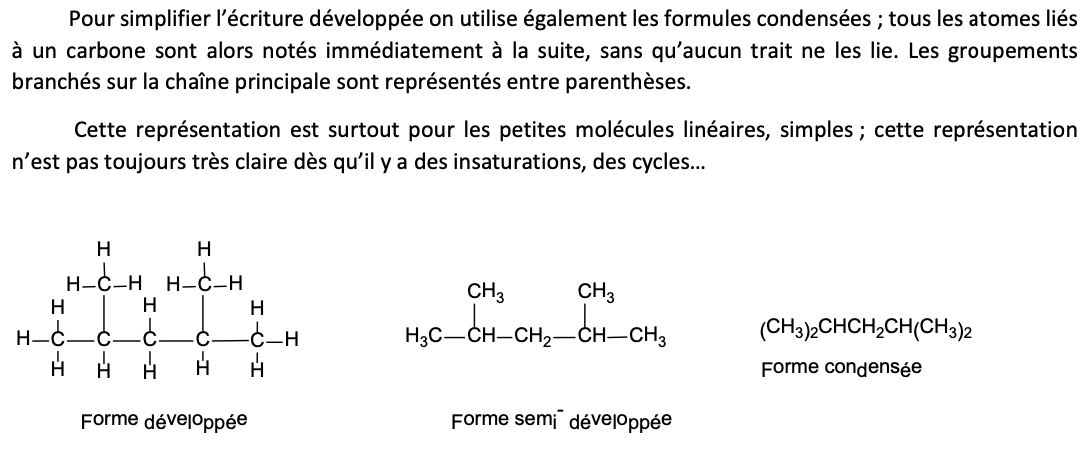
Principes formule condensée
Généralement utilisée pour les petites molécules linéaires, simples
Principes formule topologique ( = forme bâton)
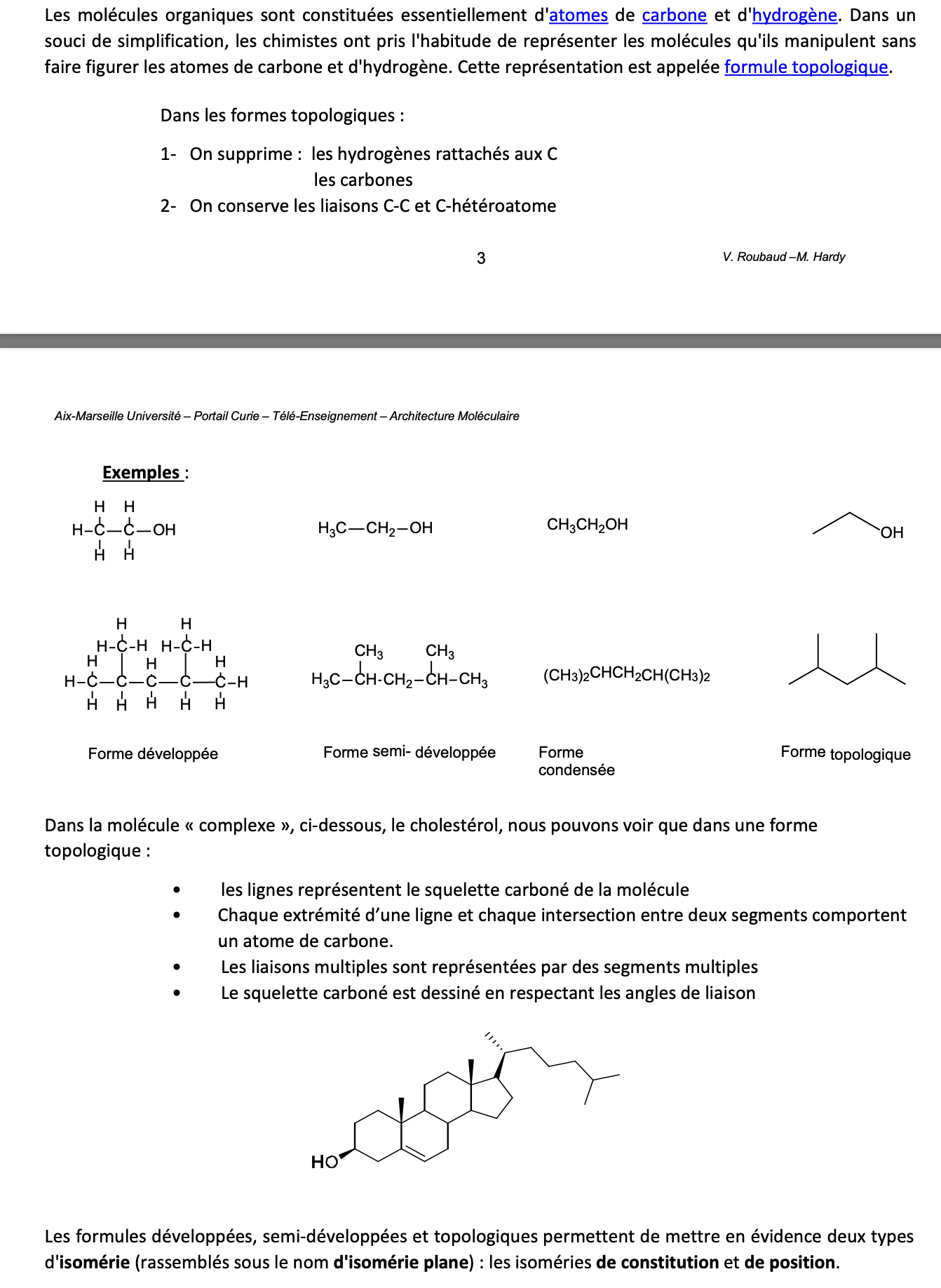
Isomères:
Composés qui ont la même formule brute / moléculaire, mais une structure différente
Il y a deux types:
Isomères structuraux ( = de constitution): formules brutes identiques mais atomes liés de façon différente —> n’ont pas les mêmes propriétés chimiques ni physiques (point d’ébullition, de fusion, indice de réfraction…):
Isomères de squelette ( = de chaîne): diffèrent par leur chaîne carbonnée (squelette)
Isomères de position: même squelette carboné, mais groupements fonctionnels situés à des positions différentes
Isomères de fonction: peuvent posséder (ou pas) la même chaîne carboné, mais des fonctions différentes
Stéréoisomères
Énantiomères: configurations non superposables d’une molécule (molécule chirale), et images l’une de l’autre dans un miroir
Diastéréoisomères: quand molécules sont stéréoisomères mais ne sont pas énantiomères
Diastéréoisomères configurationnels (=diastéréoisomères): espèces uniques, séparables et caractérisables. Il est impossible de les interconvertir l’un dans l’autre sans fournir l’énergie nécessaire à la rupture d’une liaison.
Diastéréoisomères conformationnels (=conformères): diffèrent les uns des autres que par une simple rotation autour d’une liaison simple et ne sont généralement pas séparables.
2 principaux types d’isomères (—> isomérie plane)
Isomères structuraux ( = de constitution): formules brutes identiques mais atomes liés de façon différente, n’ont pas les mêmes propriétés chimiques ni physiques (point d’ébullition, de fusion, indice de réfraction…)
Stéréoisomères ( = de position): formules brutes identiques et atomes liés dans le même ordre, mais disposition différente des atomes et des liaisons dans l’espace
Sont mis en évidence par les formules développées, semi-développées et topologiques
Types d’isomères structuraux ( = de constitution)
Isomères de squelette ( = de chaîne): diffèrent par leur chaîne carbonnée (squelette)
Isomères de position: même squelette carboné, mais groupements fonctionnels situés à des positions différentes
Isomères de fonction: peuvent posséder (ou pas) la même chaîne carboné, mais des fonctions différentes
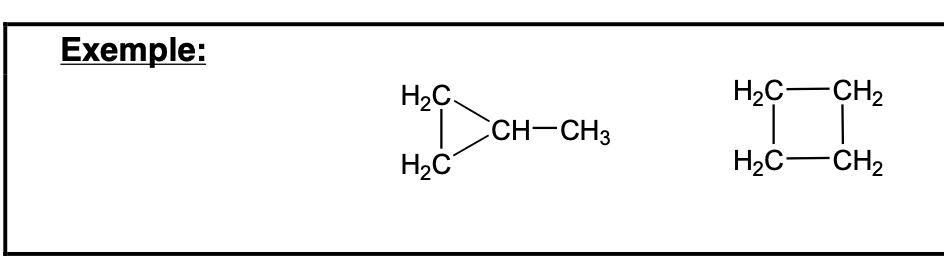
La stéréochimie c’est:
Étude de l’arrangement relatif dans l’espace des atomes d’une molécule
Statique: quand la molécule est fixe dans l’espace et ne subit pas de modifications
Dynamique: quand l’arrangement des atomes de la molécule varie au cours d’une réaction chimique
Types de stéréoisomères
Énantiomères: configurations non superposables d’une molécule (molécule chirale), et images l’une de l’autre dans un miroir
Diastéréoisomères: quand molécules sont stéréoisomères mais ne sont pas énantiomères
Molécule chirale:
Molécule ne possédant ni plan, ni centre de symétrie, a 2 configurations, images dans un miroir, non superposables
Origine la plus fréquente: molécule avec un C asymétrique
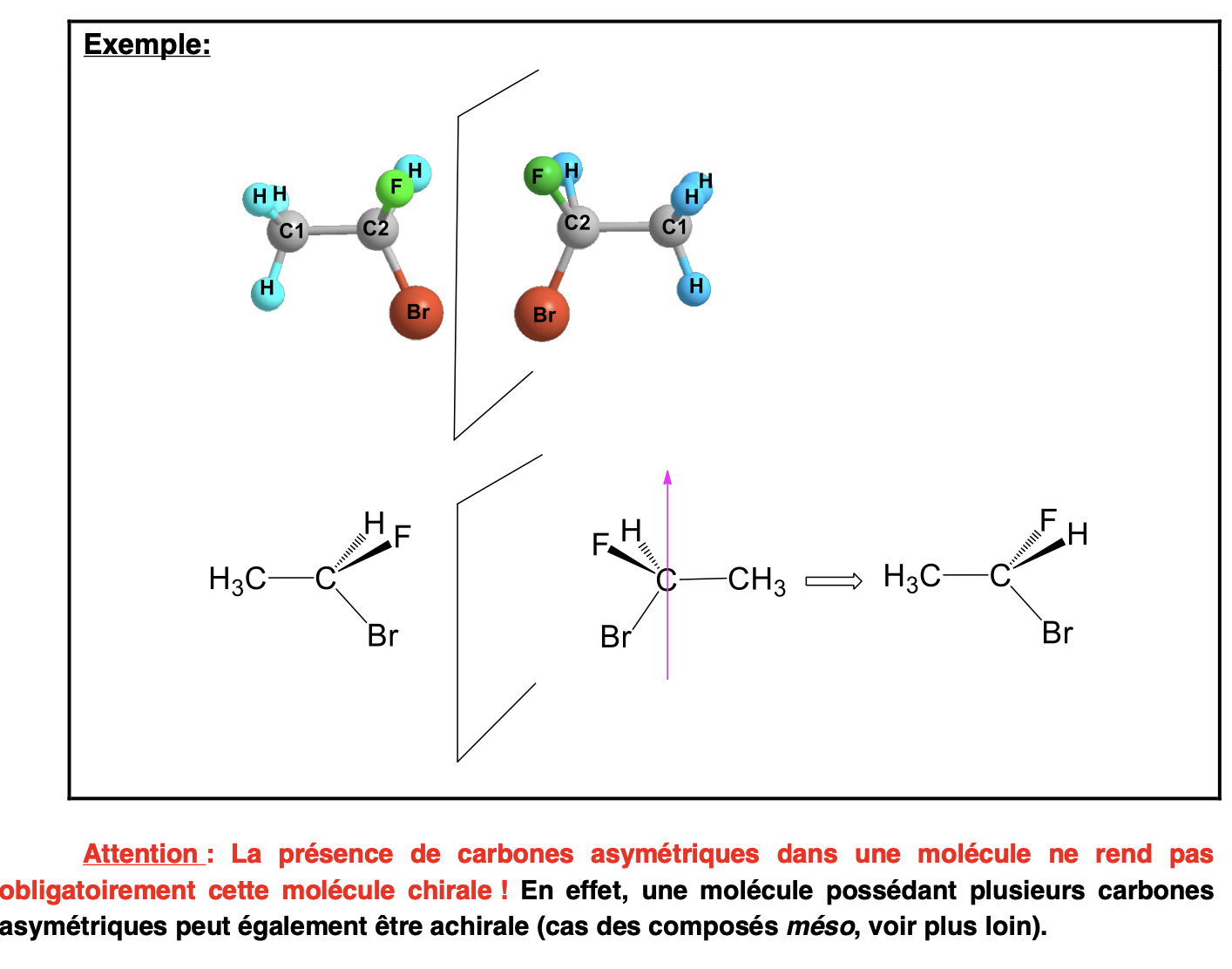
C asymétrique (C*):
C dont les 4 substituants sont différents
Types de diastéréosiomères:
Diastéréoisomères configurationnels (=diastéréoisomères): espèces uniques, séparables et caractérisables. Il est impossible de les interconvertir l’un dans l’autre sans fournir l’énergie nécessaire à la rupture d’une liaison.
Diastéréoisomères conformationnels (=conformères): diffèrent les uns des autres que par une simple rotation autour d’une liaison simple et ne sont généralement pas séparables.
La présence de diastéréoisomères configurationnels (=Diastéréosomères) découle de:
Dans une molécule avec:
C*
nsaturation(s)
1 ou plusieurs cycles
Règles de Cahn, Ingold et Prelog
Permettent d’attribuer un ordre de priorité aux 4 substituants d’un C asymétrique —> pour déterminer la configuration absolue d’un C asymétrique

Configuration absolue d’un C*
R ou S


Diastéréoisomères configurationnels (=Diastéréoisomères) et stéréoisomères quand molécule a 2 C asymétriques
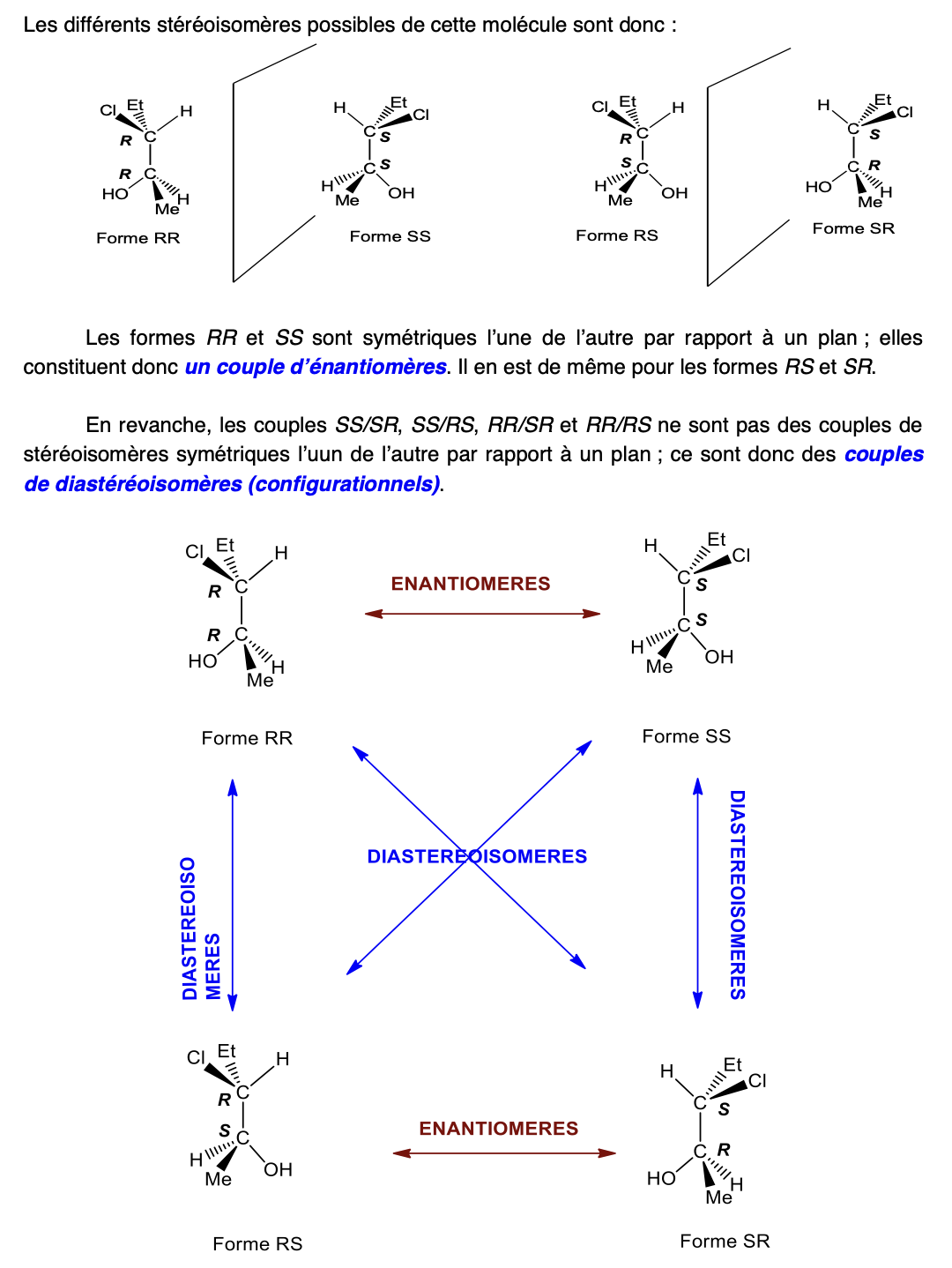
Diastéréoisomères configurationnels (=Diastéréoisomères) et stéréoisomères quand molécule a n C asymétriques (C*)
Même raisonnement que dans le cas de 2 C*

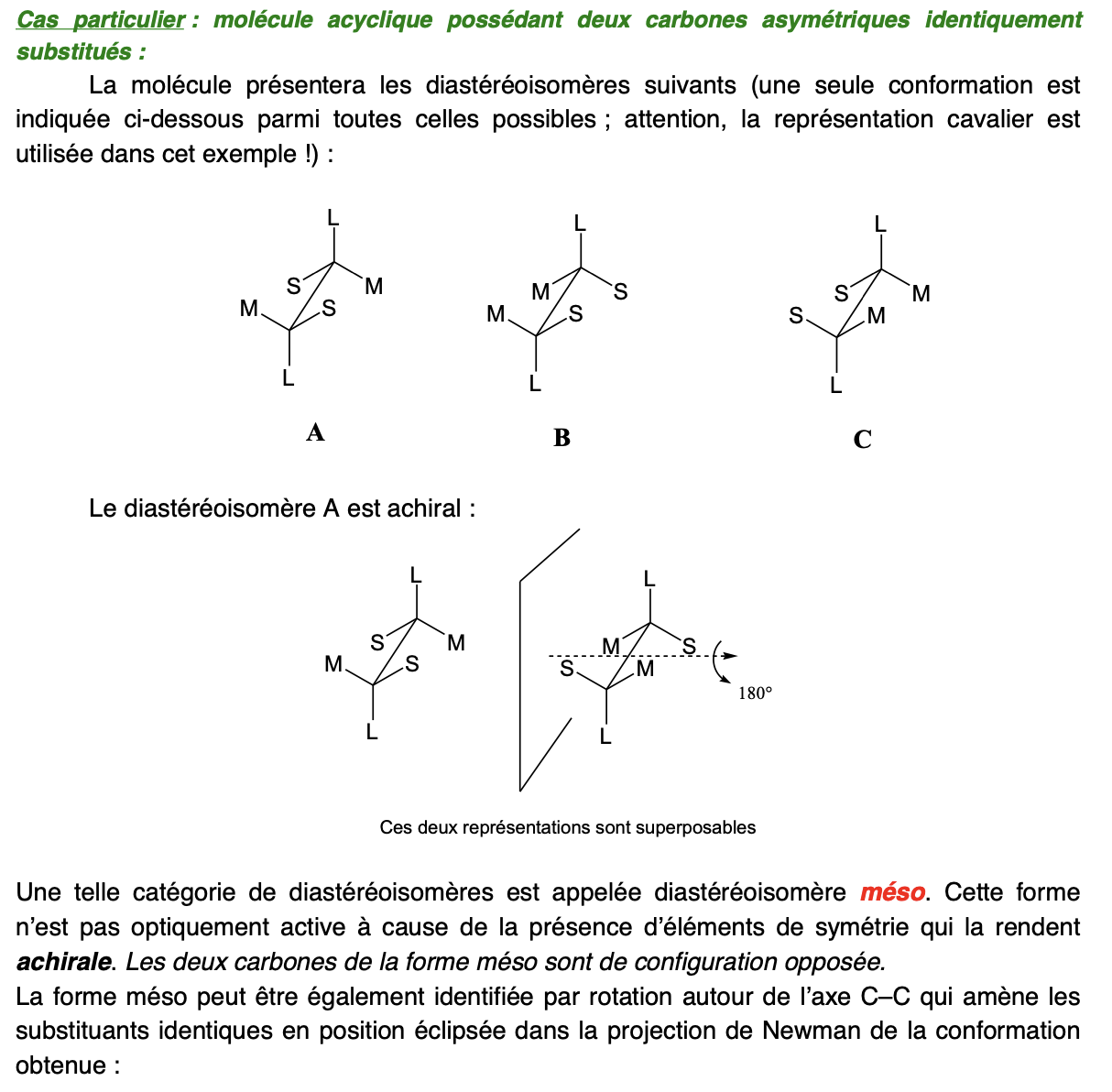
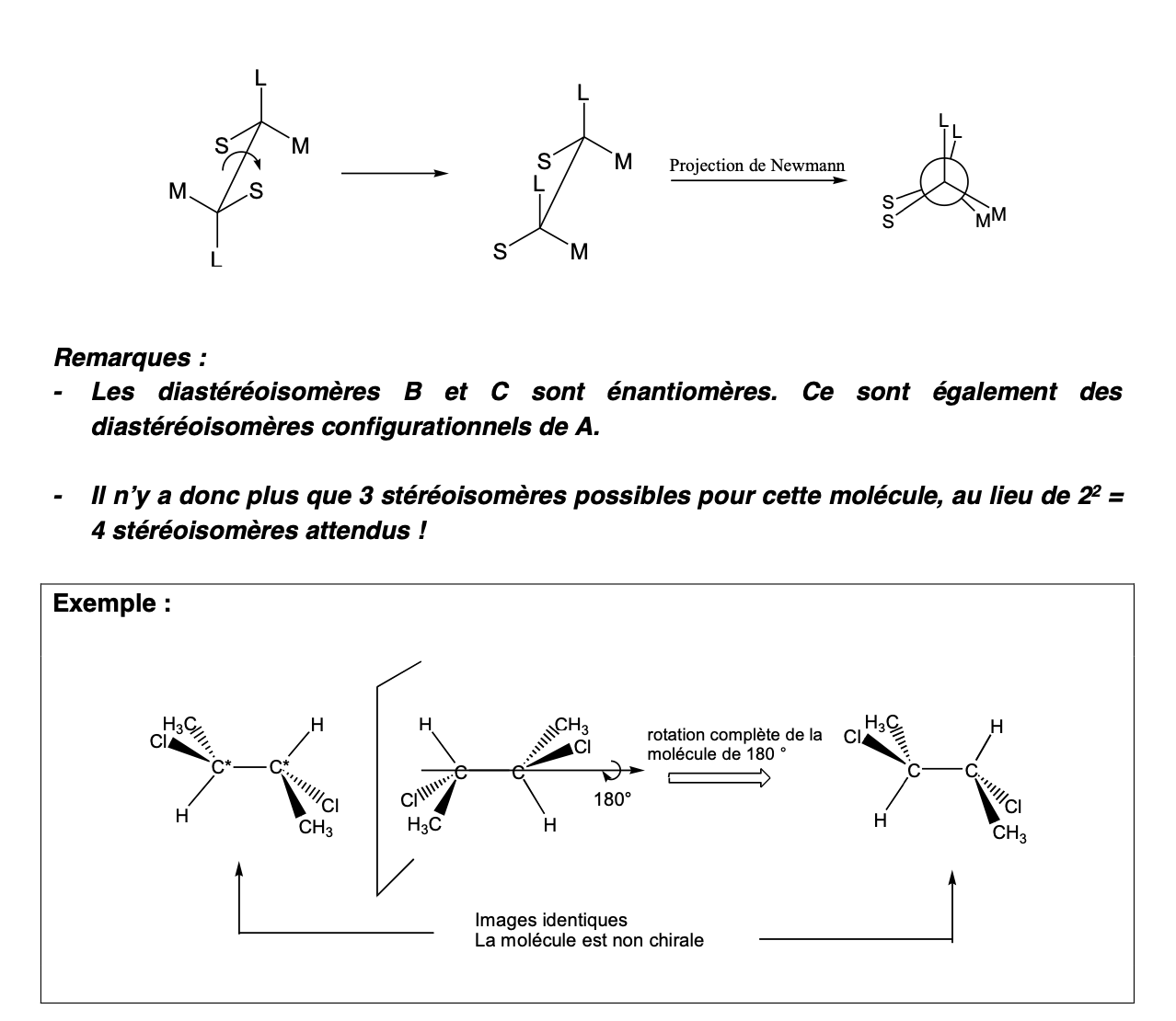
CAS PARTICULIER: diastéréoisomères et stéréoisomères dans molécule acyclique avec 2 C* identiquement substitués
Isomérie (diastéréoisomérie configurationnelle = diastéréoisomérie) Z et E
Avec C=C

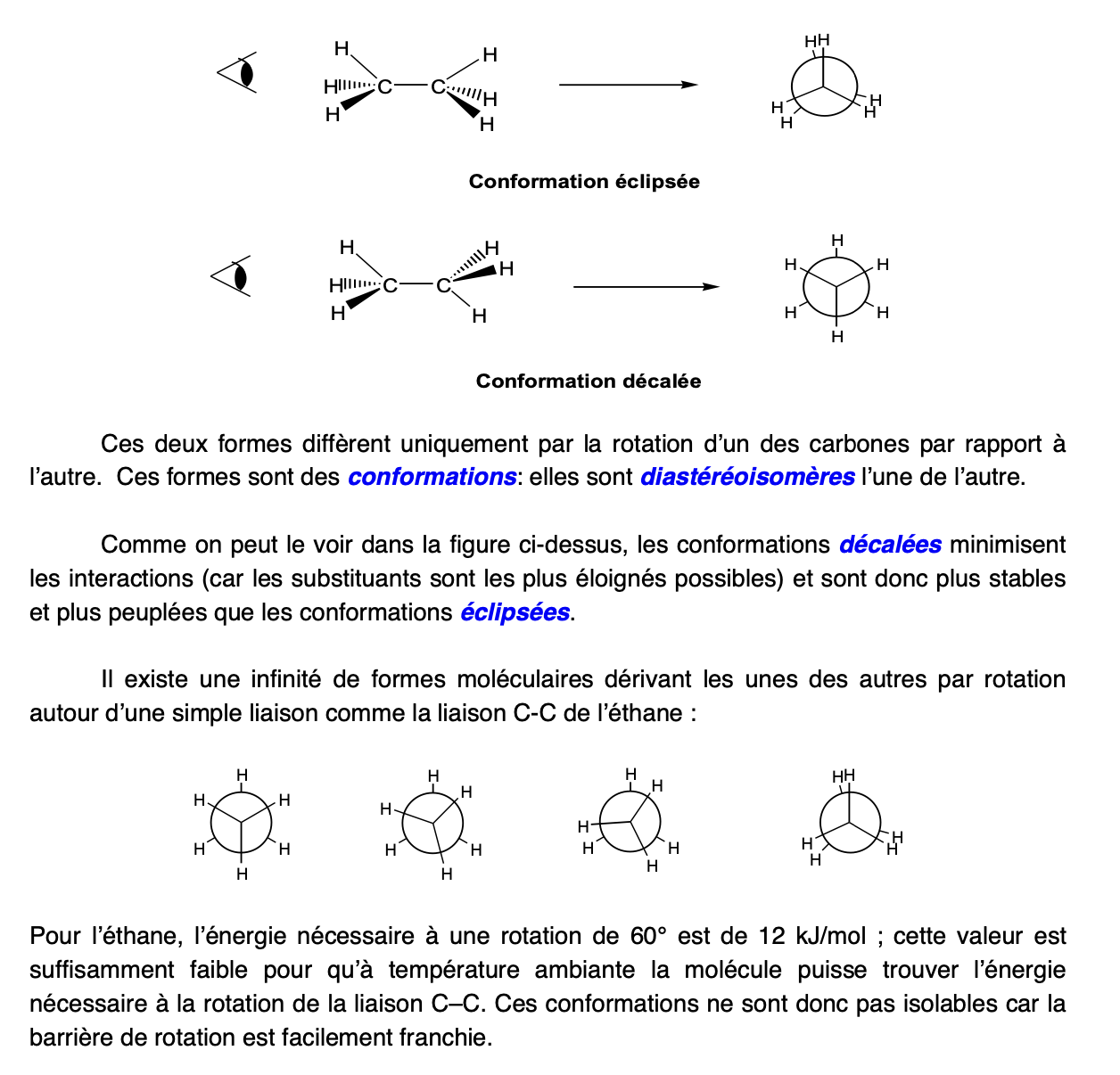
Conformations diastéréoisomères conformationnels, quand il y a 2C (molécules cycliques)
Conformation éclipsée
Conformation décalée: minimise les interactions car substituants sont les plus éloignés possible —> + stables et + peuplées que l’éclipsée
Conformations diastéréoisomères conformationnels, quand il y a + de 2C (molécules cycliques)
S’obtiennent par rotation:
Conformations gauches = énantiomères, sont de même énergie, ce sont des conformations décalées
Conformations anti: les plus stables car groupes les plus “importants” sont les plus éloignées et donc ont les interactions les moins fortes
Conformation syn: apparition d’un éclipse
Conformation éclipsée: énantiomères, forme éclipsée

Tension de cycle:
Le repliement d’une chaine carbonée sur elle-même afin de former un cycle entraine l’apparition d’angles de valence anormaux et donc d’une tension de cycle.

Conformère/forme chaise (Cyclohexane)
Le plus stable
Apparait car les angles C-C-C tendent à se rapprocher de l’angle tétraédrique
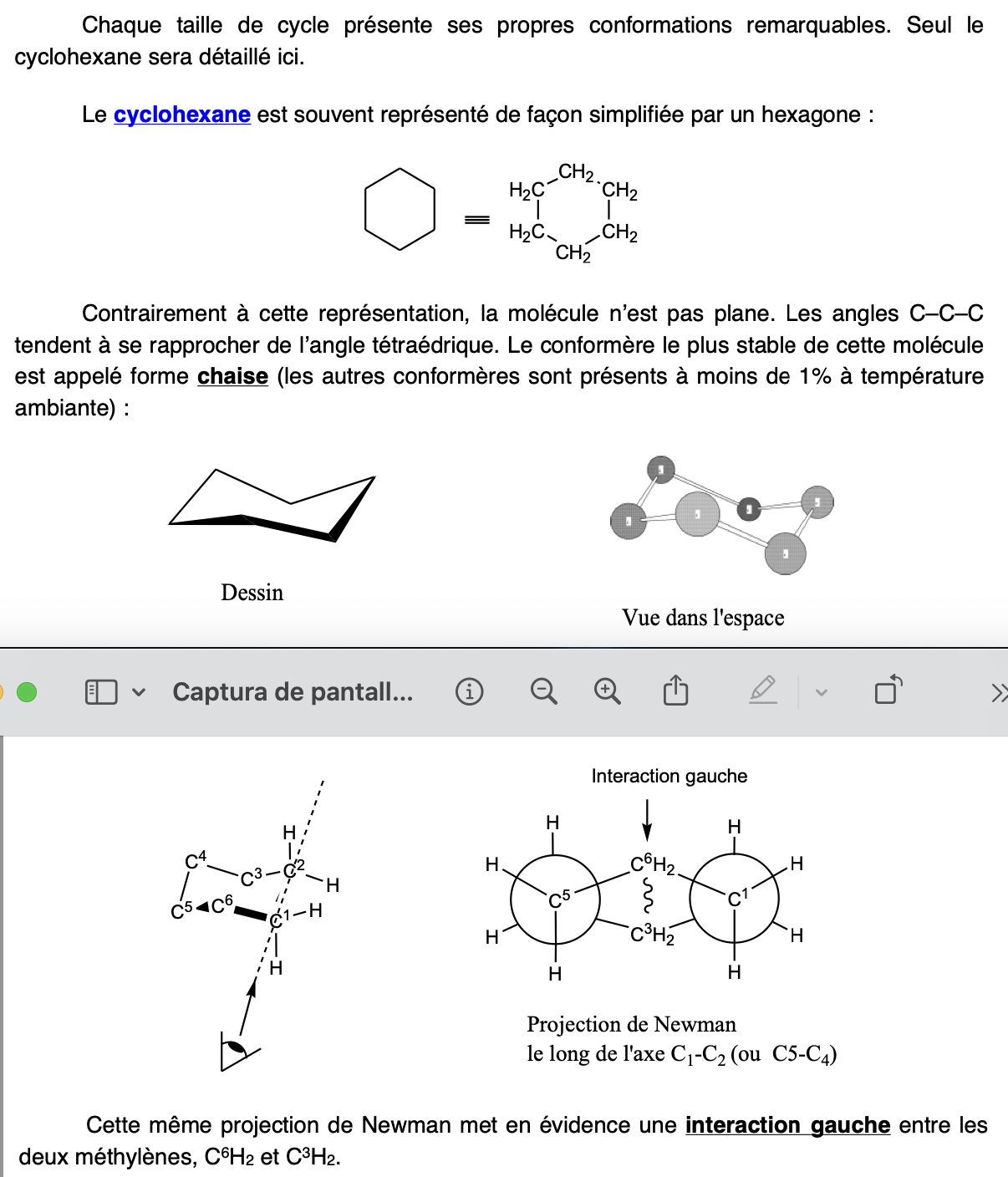
Hydrogènes axiaux VS H équatoriaux
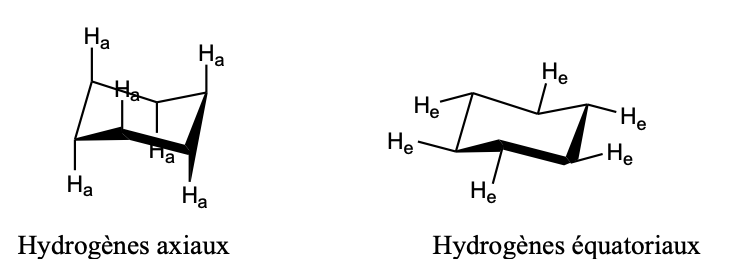
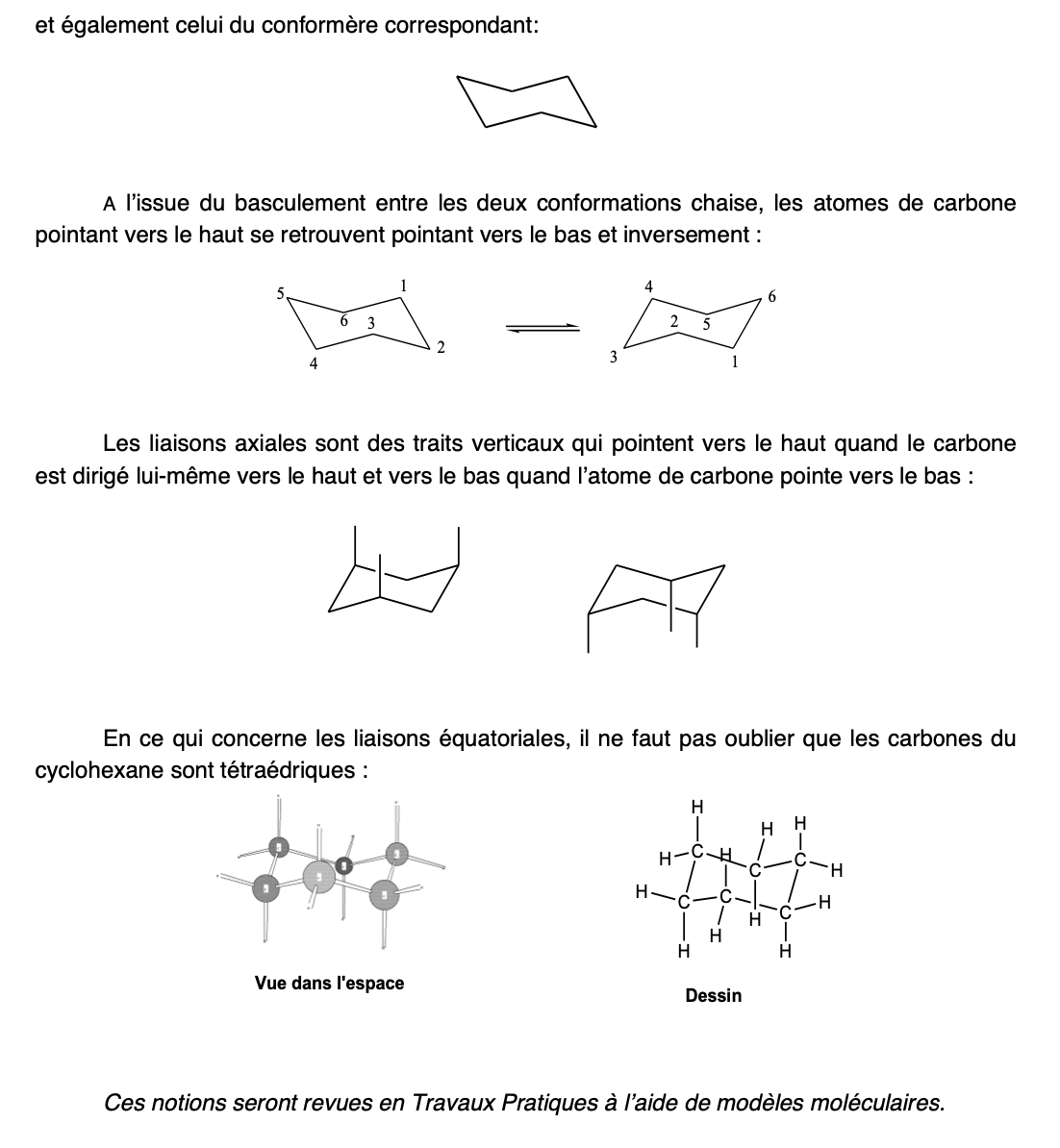
Conformère/forme bâteau (Cyclohexane)
moins stables que la conformation chaise
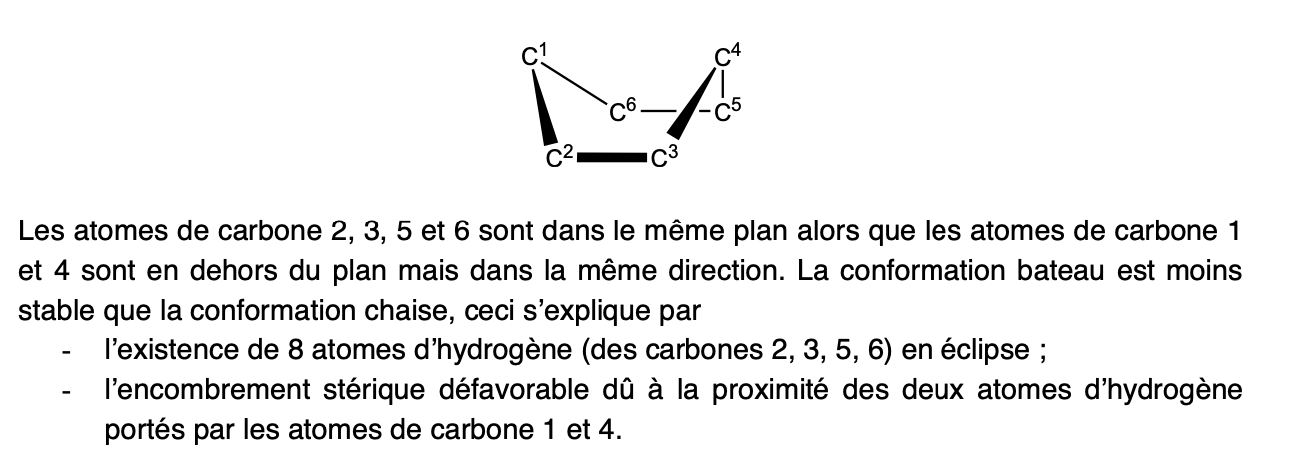
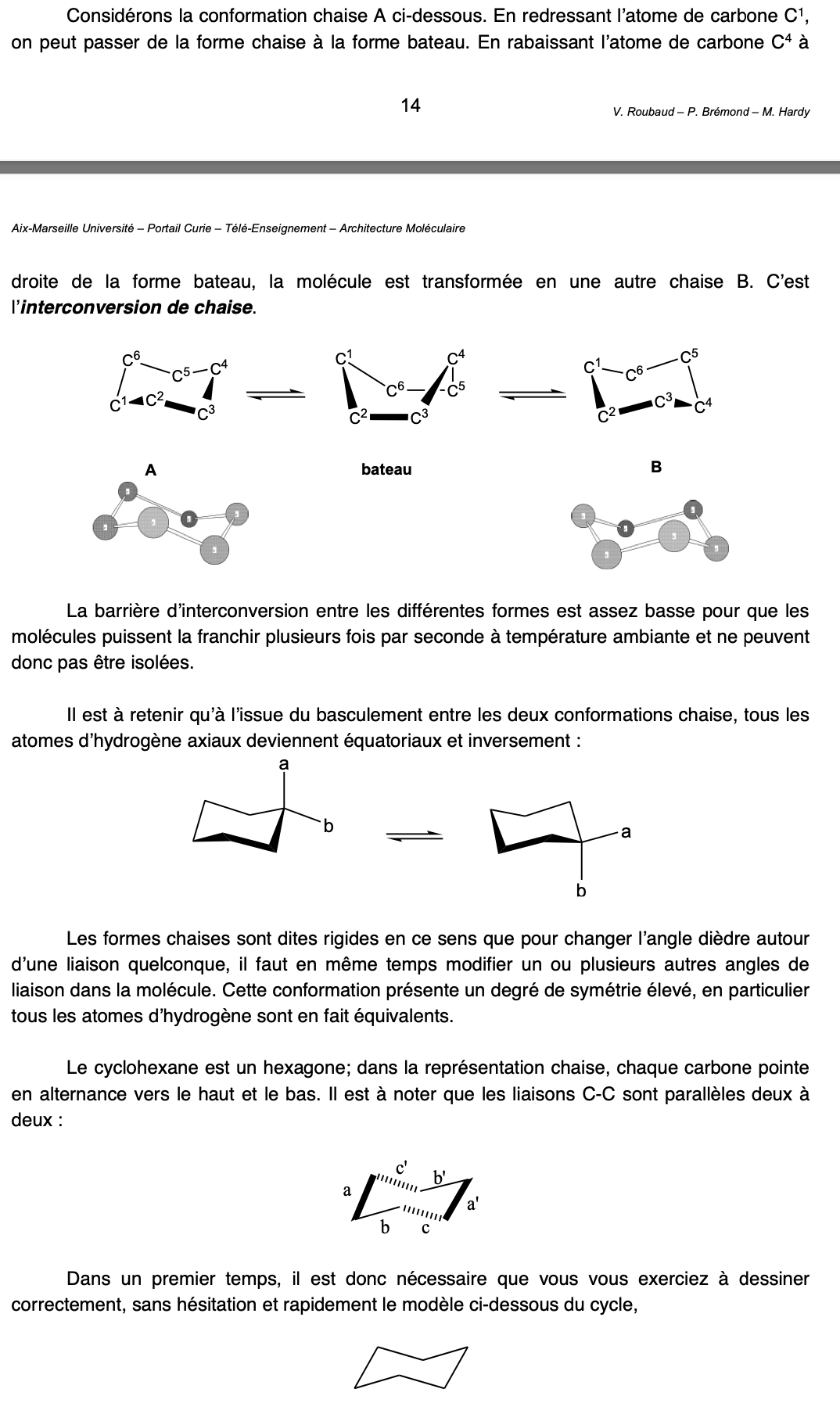
Interconversion de chaise (Cyclohexane)
Chaise —> bâteau —> chaise
Modèle du coin volant ( = CRAM)
Représentation schématique dans l’espace d’un carbone avec 4 liaison simples ( —> 4 substituants)
Angles de liaison:
109º28’: quand les 4 substituants sont identiques ou présentent le même encombrement
>109º28’:(ex: 109º5’): quand substituants trop encombrants ou s’ils sont siège d’une répulsion électrique mutuelle —> équilibre entre tendance des groupements à se placer aussi loin que possible les uns des autres et la déstabilisation qui naît de la déformation angulaire
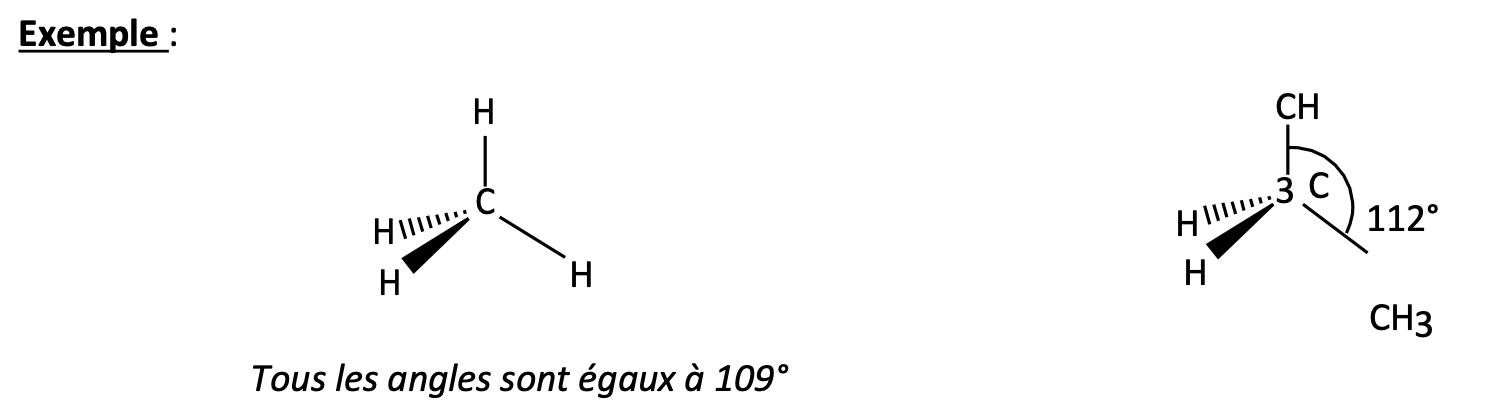
Représentation de cavalier
Utilisée plus rarement
Projections de Newman
Pour molécules avec au moins 1 liaison C -C
Permet de comprendre angle de torsion ( = angle dièdre)

Angle dièdre ( = angle de torsion)
Angle existant entre deux plans
Projection de Fisher:
Se fait sur un plan avec 2 carbones asymétriques
Liaisons horizontales: liaisons en avant du plan
Liaisons verticales: liaisons en arrière du plan
C le plus oxidé: C avec le plus de liaisons C - O

Hydrocarbures:
Composés organiques constitués exclusivement d'atomes de carbone (C) et d'hydrogène (H)
Nomenclature:
Attribution systématique des noms aux composés
Chaque composé doit avoir un nom unique —> communication sans ambiguïté
Système de nomenclature utilisé actuellement
IUPAC (International Union of Pure and Applied Chemistry)
Alcanes:
Hydrocarbures saturés (avec liaisons simples) —> n’ont que des C et des H
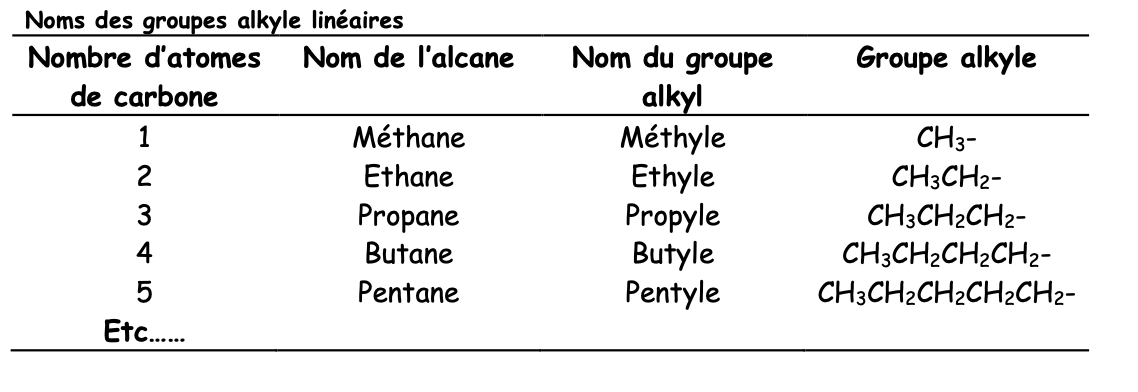
Nom fondamental d’un alcane non ramifié
Combinaison de:
Racine numérique: indique le nombre d’atomes de C de la chaîne
Suffixe: ane
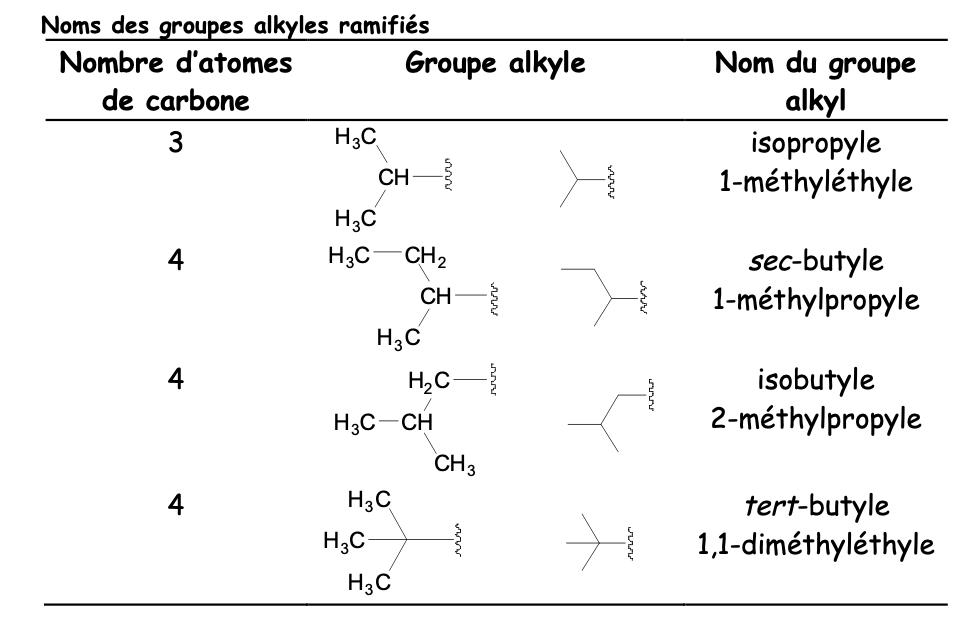
Nom alcanes ramifiés

Nom groupement alklyle (=substituant)
Comme un alcane sauf qu’avec le suffixe yl
Il y a les alkyles linéaires, ramifiés et cycliques
Noms alkyles linéaires
Noms alkyles ramifiés
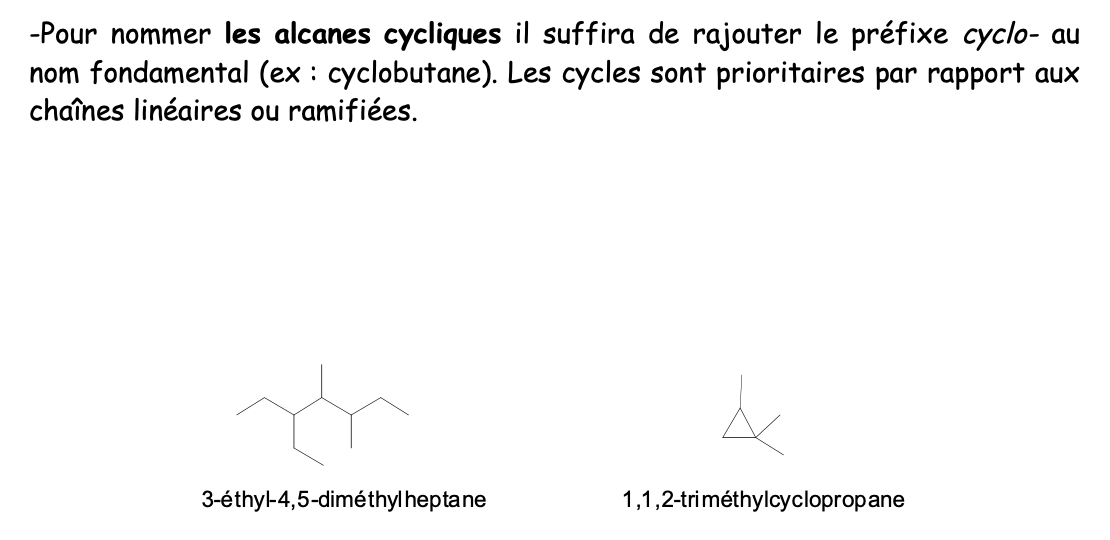
Noms alkyles cycliques
Alcène:
Hydrocarbure insaturé, avec au moins une double liaison (—> groupe fonctionnel)
Nom fondamental alcènes
Racine + suffixe “ène”

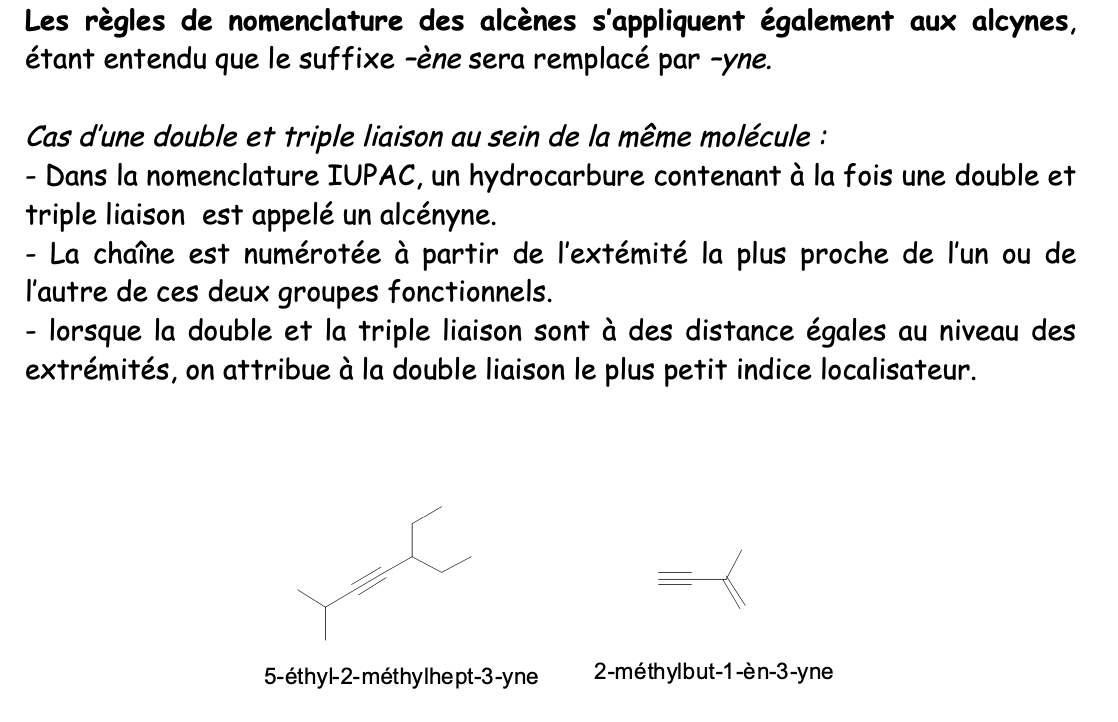
Alcyne:
Hydrocarbure insaturée, avec au moins une triple liaison C,C (—> groupe fonctionnel)
Nom fondamental alcynes
Racine + suffixe “yne”
Nom fondamental composés aromatiques monosubstitués
Il faut rajouter le nom du substituant sous forme de préfixe au mot “benzène”
Nom fondamental composés aromatiques disubstitués

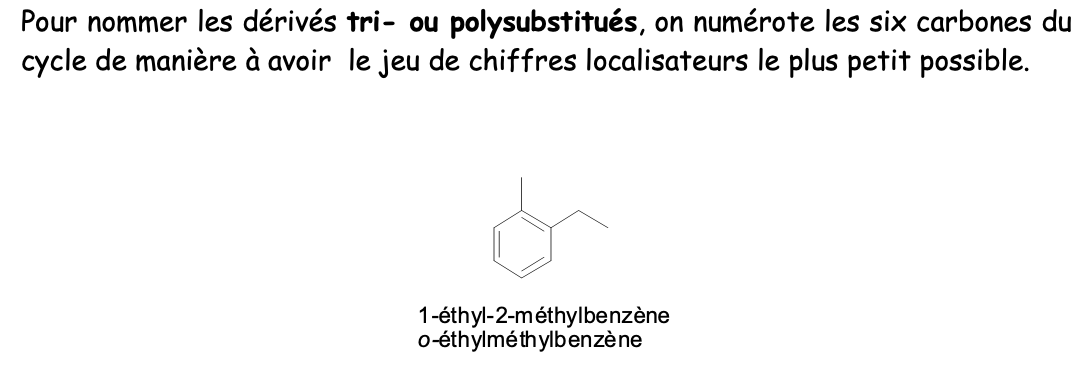
Nom fondamental dérivés tri- ou polysubstitués
Un alcool c’est:
Composé organique avec un groupe fonctionnel hydroxyle (-OH)
—> s’il y a plusieurs OH: c’est un polyalcool
Comment nommer un alcool?

Une cétone c’est:
Composé organique avec un groupe fonctionnel carbonyle (=O)
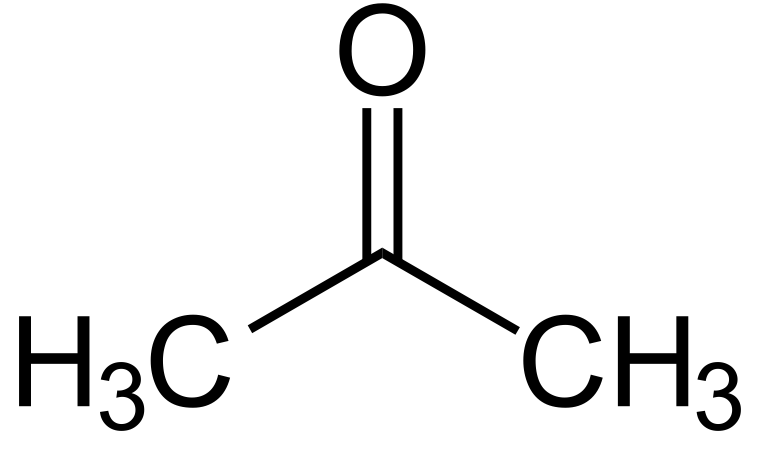
Comment nommer une cétone?

Un aldéhyde c’est:
Composé organique avec un groupe fonctionnel carbonyle (=O) au bout de chaîne
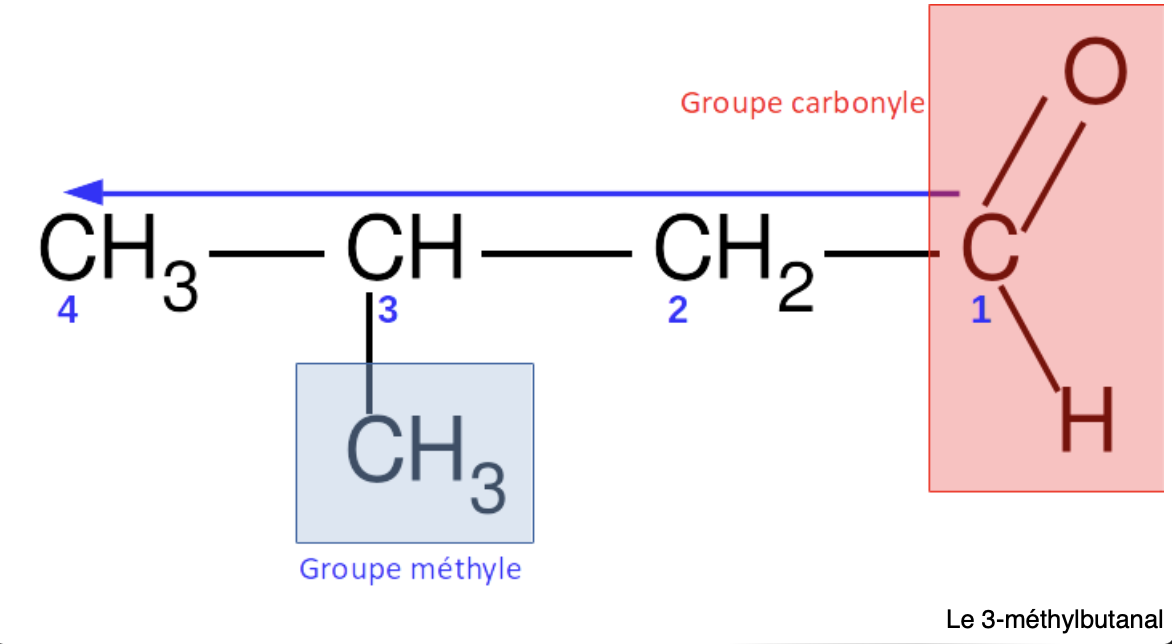
Comment nommer un aldéhydes?

Une amine c’est:
Composé organique avec un groupe amine
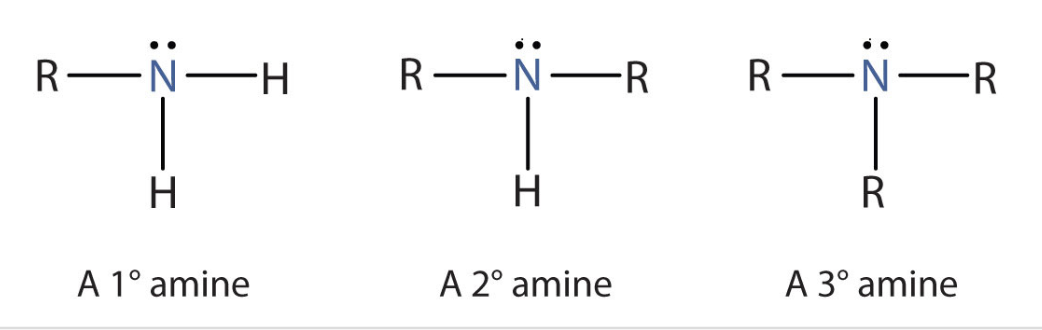
Comment nommer une amine?

Un acide carboxylique c’est:
Composé organique avec un groupe carboxyle (C(O)OH)
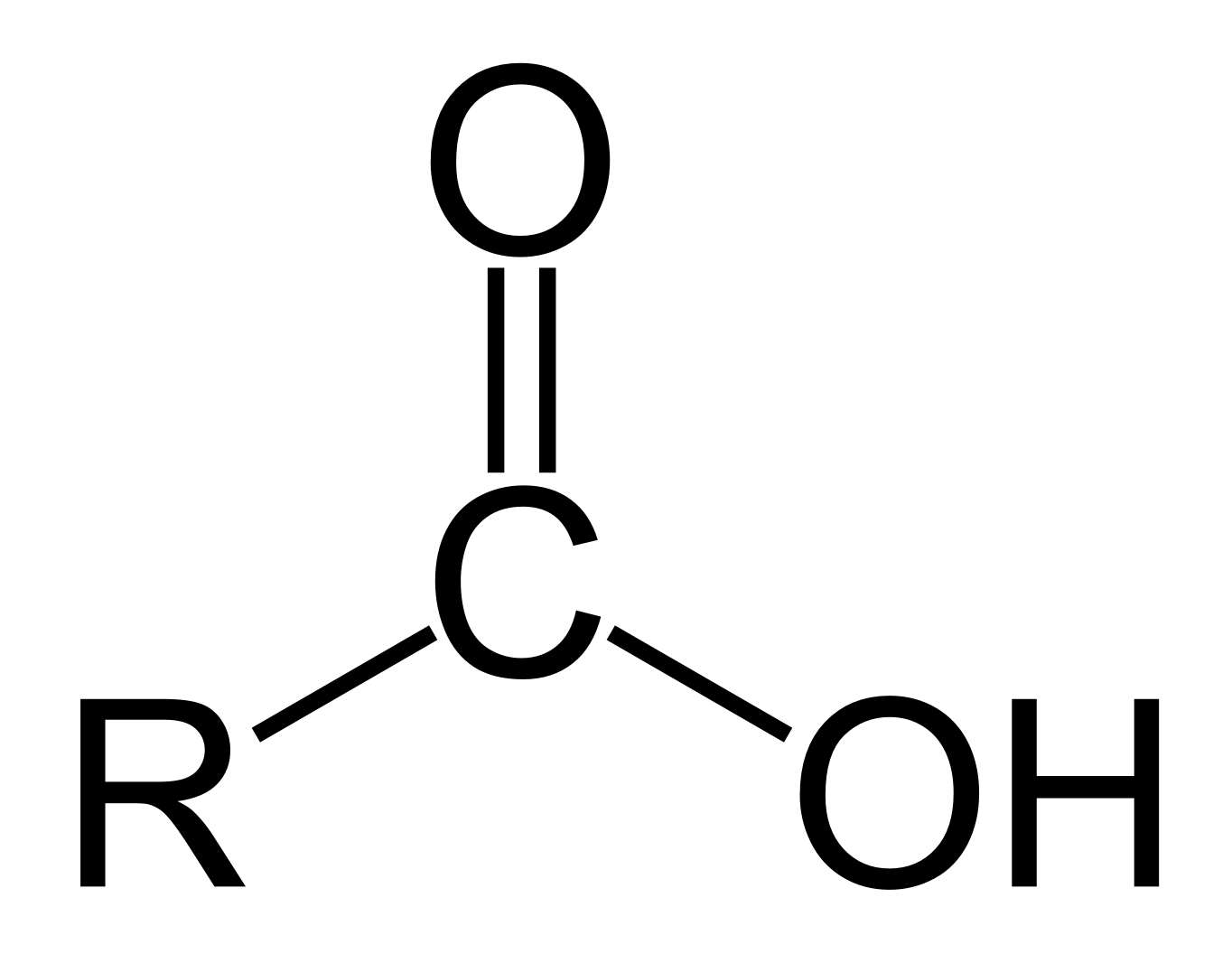
Comment nommer les acides carboxyliques?

Halogénures d’acides
Dérivés d’acides carboxyliques
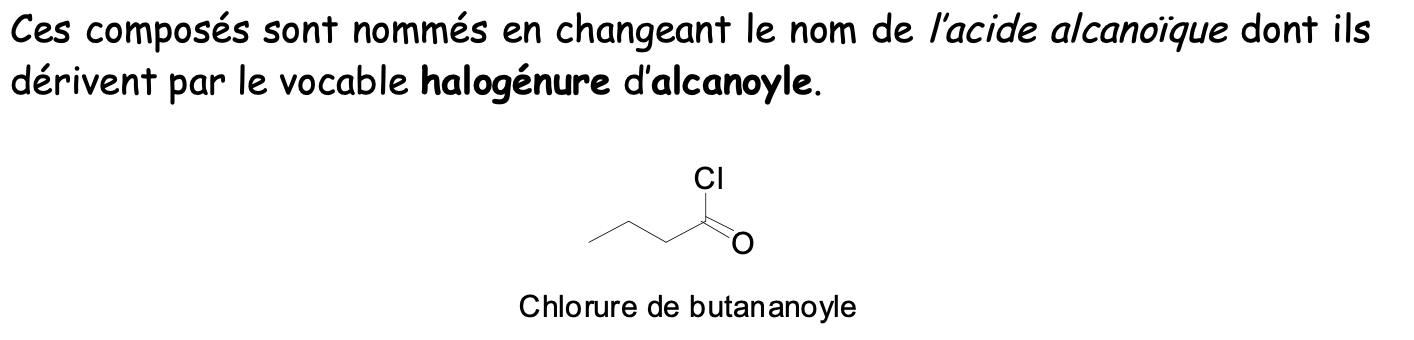
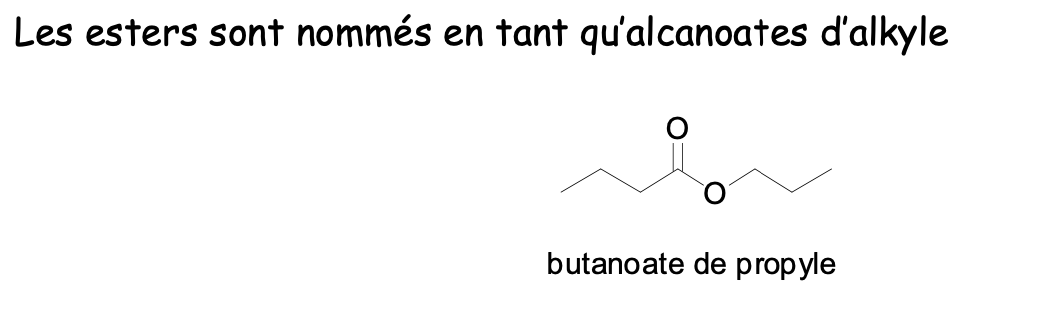
Esters
Dérivés d’acides carboxyliques
Éthers-oxydes

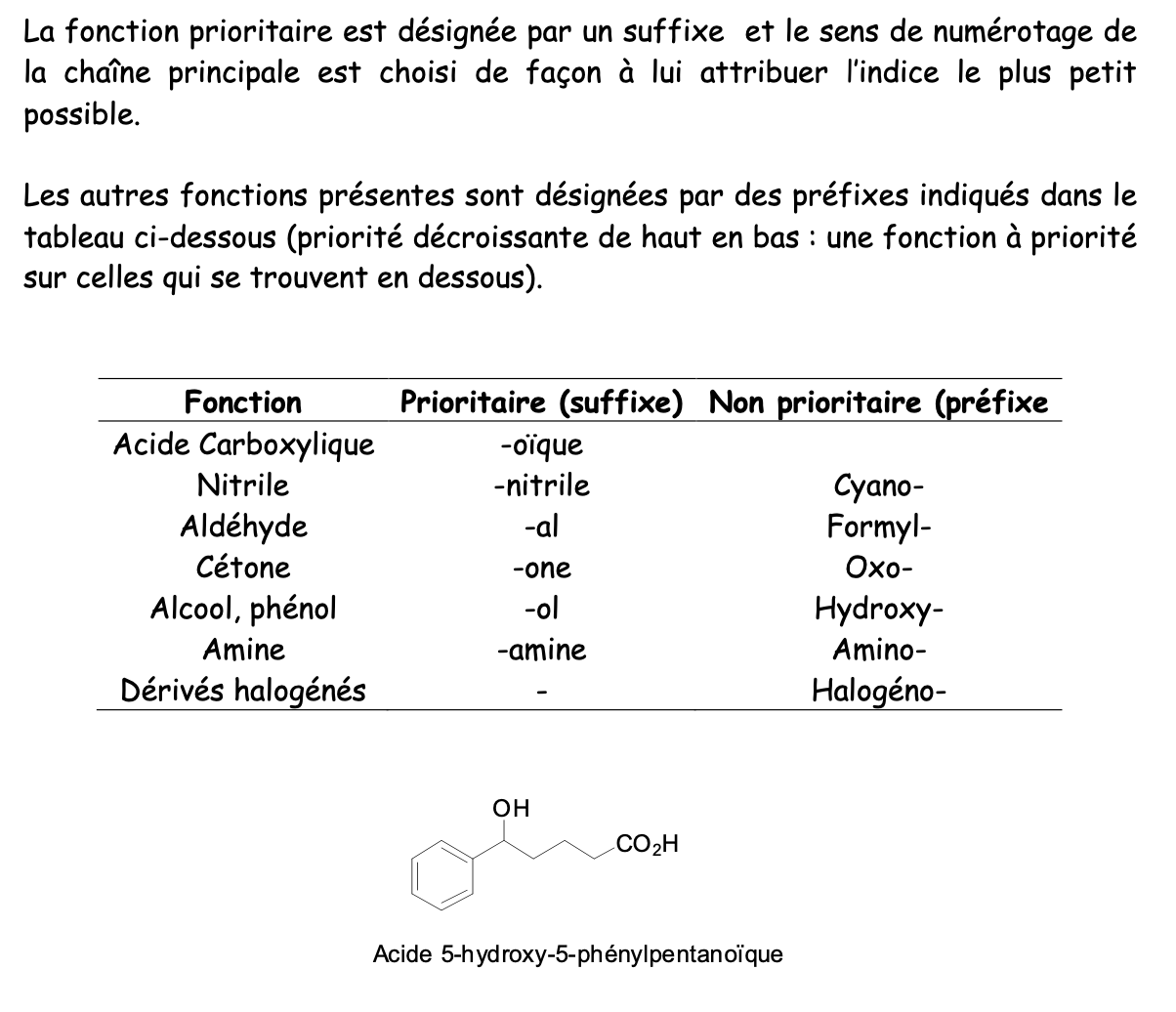
Ordre de priorité lorsqu’il y a de des composés à fonctions mixtes
Rappel hybridation: à l’état fondamental, l’atome de C est:
Tétravalent
