Biologie - Neurobiologie und Enzymen
Neurobiologie und Enzymatik
Enzymaktivität:
Aufbau und Funktion (Prinzip)
- Jedes Enzym hat seine eigene Maximalgeschwindigkeit (Vmax). Da man diese aber schlecht ablesen kann (Asymptote!), ermittelt man, bei welcher Substratkonzentration die halbmaximale Geschwindigkeit (Vmax/2) erreicht ist.
- Das geht mathematisch, indem man die Michaelis-Menten-Gleichung linearisiert, wobei 1/v eine lineare Funktion von 1/s (1/Substratkonzentration) wird.
- Michaelis-Menten-Konstante: gibt die Substratkonzentration, bei der die halbmaximale Reaktionsgeschwindigkeit mit einem bestimmten Enzym erreicht wird.
- Beispielklausur Enzymen: https://www2.klett.de/sixcms/media.php/229/ab045452118_klausur.pdf
- Einfluss von Temperaturen an die Enzymaktivität
- Bei gleichwarmen Organismen, z. B. die Menschen, liegt die Optima der meisten Enzyme bei 37°C.
- RGT-Regel: Bei enzymkatalysierten Reaktionen erhöht sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10°C etwa um das 2fache.
- Denaturierung:
- Änderung der Tertiärstruktur durch Hitze, Säure oder Alkohol.
- Durch Temperatur: hohe Temperaturen zerstören die Sekundär- und Tertiärstruktur der Proteine (Enzyme), d. h. die räumliche Anordnung wird zerstört (Denaturierung) und das Enzym kann nicht mehr funktionieren.
Bei einer Körpertemperatur von ca. 42°C beim Menschen (sehr hohes Fieber) muss man schleunigst Maßnahmen zum Abkühlen ergreifen, weil der Mensch sonst stirbt.
- Durch chemische Veränderung: Schädigung der Enzyme durch bestimmte giftige Stoffe, z.B. Quecksilber und Blei, zerstört die Disulfidbrücken in den Enzymen, da die Schwermetalle mit ihnen stabile Verbindungen eingehen.
Enzyme / Enzymatik - Klausuraufaben [1 von 2] - [Biologie, Oberstufe]
c) Was genau sind Enzymen?
- Enzymendung: ''-ase''
- Namensteil der zu Katalysierenden Reaktion
- Oxidoreduktasen katalysieren Redoxreaktionen,
- Transferasen übertragen funktionelle Gruppen zwischen Substraten,
- Hydrolasen spalten Bindungen unter Einsatz von Wasser,
- Lyasen katalysieren die Spaltung oder Synthese von komplexen Produkten (ohne Einsatz von ATP)
Biokatalysatoren:
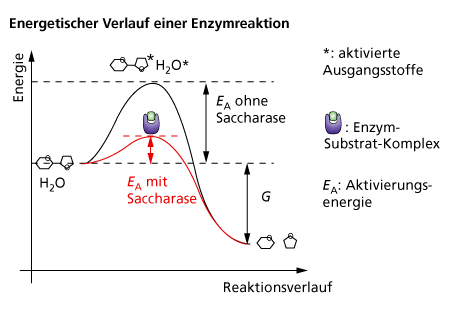
• setzen die Aktivierungsenergie,die erforderlich ist, um eine Reaktion in Gang zu bringen herab und beschleunigen dadurch die Reaktion
• werden bei der Reaktion nicht verbraucht, gehen unverändert aus der Reaktion hervor
• werden bereits in geringen Konzentrationen wirksam
• die meisten Enzyme = reine Proteine, z.B. Urease, Pepsin, Trypsin
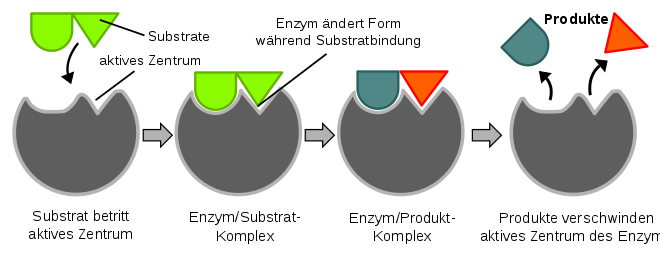
- Enzyme setzen die Aktivierungsenergie herab
- Enzyme haben ein aktives Zentrum
- Enzyme Substrate binden nach dem Schlüssel-Schloss-Prinzip in das Aktive Zentrum
- Enzyme sind Proteine und somit aus AS aufgebaut
- Enzyme sind regulierbar (z.B. durch Neubildung) und beeinflussbar durch Inhibitoren, Aktivatoren, Co-Substrate, CoEnzyme usw)
- Enzyme substratspezifisch
- Enzyme wirkspezifisch
Bsp:
Neuro:
2. Bau und Funktion einer Nervenzelle:
Neuron/Nervenzelle = Zelle, die Informationen (elektro-chemische Signale) empfängt, verarbeitet und/oder an andere Zellen weiterleitet (z.B. Inform. aus den Augen, Ohren, Mund etc.) -> Neurone sind Grundbausteine des Nervensystems. Sie können Erregungen, elektrische Signale, erzeugen, verarbeiten und weiterleiten.
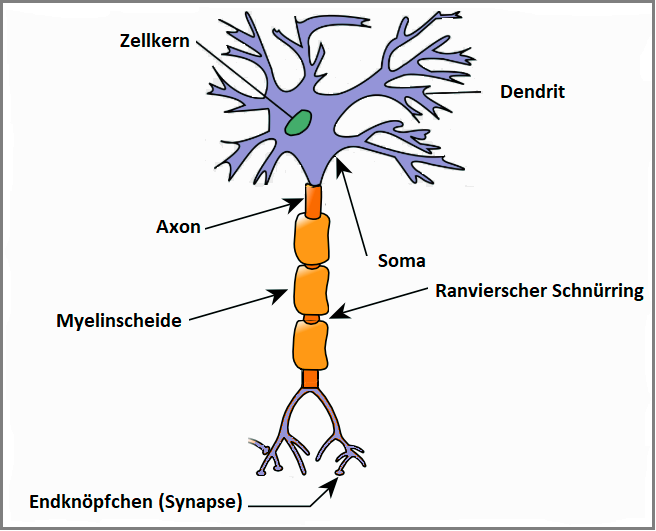
Soma: enthält den Zellkern
Dendriten: der Reizaufnahme dienen.
Axon: leitet Impuls / Aktionspotentiale von Zellen weiter - Dendriten leiten Erregungen zum Zellkörper hin, Axonen leiten Erregungen von ihm weg.
Axonhügel: Dort werden die IPSPs und EPSPs verrechnet und ggf. ein AP generiert.
Synapse Stelle: eine neuronale Verknüpfung, über der eine Nervenzelle in Kontakt zu einer anderen Zelle steht. Synapsen dienen der Übertragung von Erregung, Signalübertragung, Information zu speichern.
Myelinscheide: Isolation des Axons und ermöglicht damit die besonders schnelle saltatorische Erregungsleitung.
Ranvier Schnürring: freiliegende Abschnitt eines Axons zwischen zwei Schwannschen Zellen, die um eine Nervenfaser gewickelt sind. Das AP „springt von Schnürring zu Schnürring -> saltatorische Erregungsleitung.
Endknöpfchen: stellen funktionelle Verbindungen (Synapsen) entweder zu Muskelfasern, Drüsen oder zu anderen Neuronen her.
Gliazellen: stützen und ernähren die Neurone und sorgen für die elektrische Isolation.
Natrium-Kalium-Pumpe: Ohne sie würden sich die Ionenkonzentration langsam ausgleichen und das Membranpotential würde Null gehen.
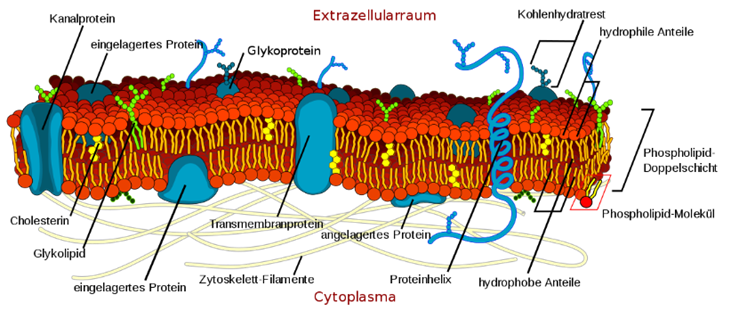
3. Biomembran
Aufbau
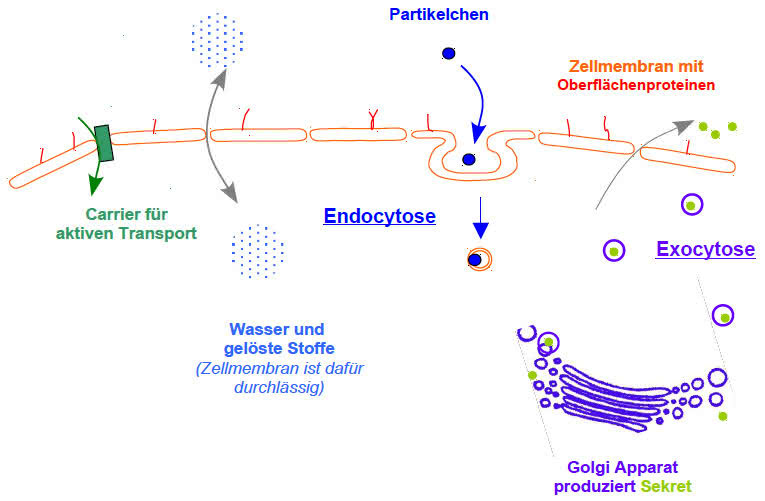
Durchlässigkeit: Der wichtigste Bestandteil einer Biomembran ist ihre Lipiddoppelschicht, die vor allem die Rolle der passiven Trennschicht erfüllt. Sterole wie das Cholesterin gehen eine hydrophobe Wechselwirkung mit den Lipiden ein und verfestigen die ansonsten flexible Biomembran. Darüber hinaus sind auf und innerhalb der Membran Proteine verteilt, welche die aktiven Funktionen der Membran übernehmen. Die Proteine haben nur eine sehr geringe Stützfunktion der Biomembran, da sie durch die Lipidschichten schwimmen. Je nach Funktion der Biomembran unterscheidet sich sowohl die Zusammensetzung an Lipiden als auch an Proteinen deutlich.
Membranpotential, Ruhepotential und Phasen des Aktionspotentials:
Merke: Depolarisation = Erregender Einfluss
Hyperpolarisation = Hemmender Einfluss
- Membranpotential:
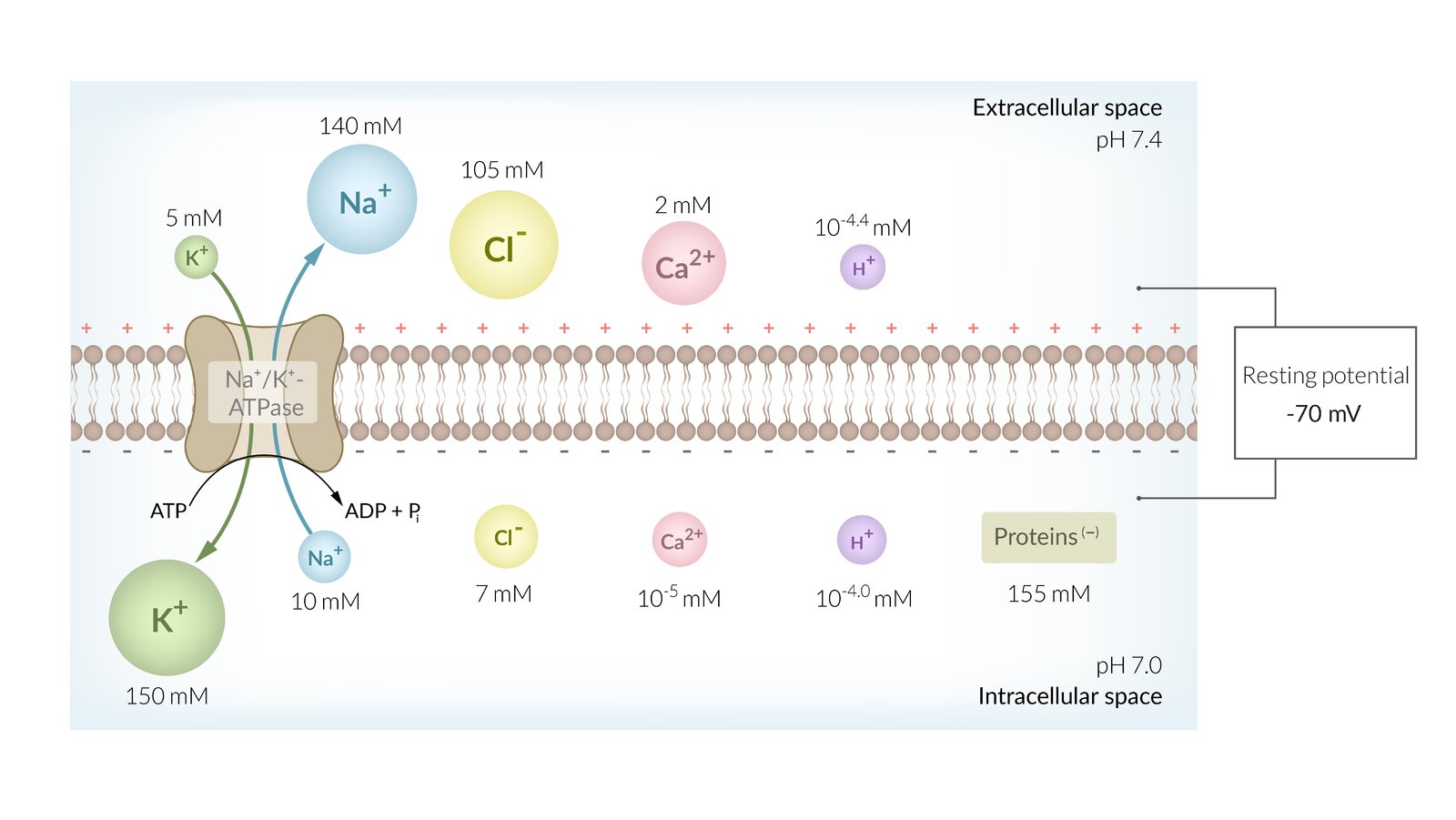
DEFINITION: Das Membranpotential beschreibt die Spannung, die sich zwischen Innen- und Außenseite einer semipermeablen Membran bildet. Zur Herstellung und Aufrechterhaltung der Konzentrationsunterschiede benutzen sie dabei molekulare Pumpen wie die Natrium-Kalium-ATPase, selektive Permeabilität entsteht durch spezifische Ionenkanäle.
FUNKTION: Das Membranpotential nutzen Zellen für Transporte über die Membran; zeitlich veränderliche Membranpotentiale koordinieren die Herzaktion und leiten und integrieren Informationen in Gehirn und Nerven.
II: Ruhepotenzial: wird das Membranpotential von erregbaren Zellen in Ruhe bezeichnet, also bei nicht erregten Nervenzellen oder Muskelzellen..
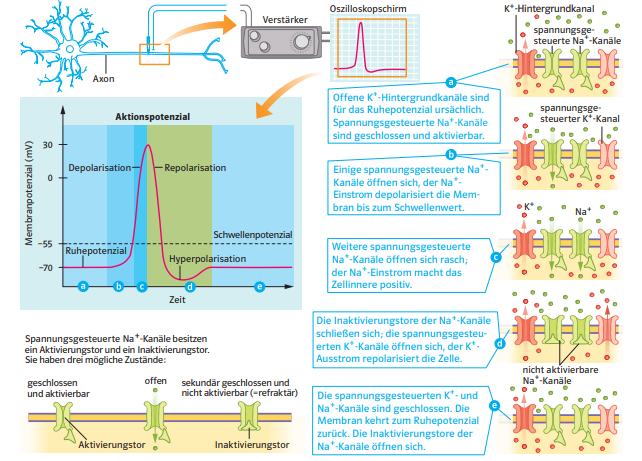
Bevor es mit dem Aktionspotenzial losgeht, befindet sich die Membran normalerweise im Ruhezustand, das Membranpotenzial liegt also bei -70 mV und wird als Ruhepotential bezeichnet. Der Großteil der spannungsgesteuerten Natriumkanäle ist hier geschlossen, ebenso der Großteil der spannungsgesteuerten Kaliumkanäle. Lediglich die Kalium-Sickerkanäle sind geöffnet und sorgen für die Einstellung bzw. Aufrechterhaltung des Ruhepotenzials.
Bei der Ausbildung eines Ruhemembranpotentials wirken mehrere Faktoren zusammen:
- Chemischer Gradient – Teilchen bewegen sich zufällig und tendieren zu gleichmäßiger Verteilung (Brownsche Molekularbewegung).
- Elektrischer Gradient – elektrische Spannungsunterschiede tendieren zu einem Ausgleich.
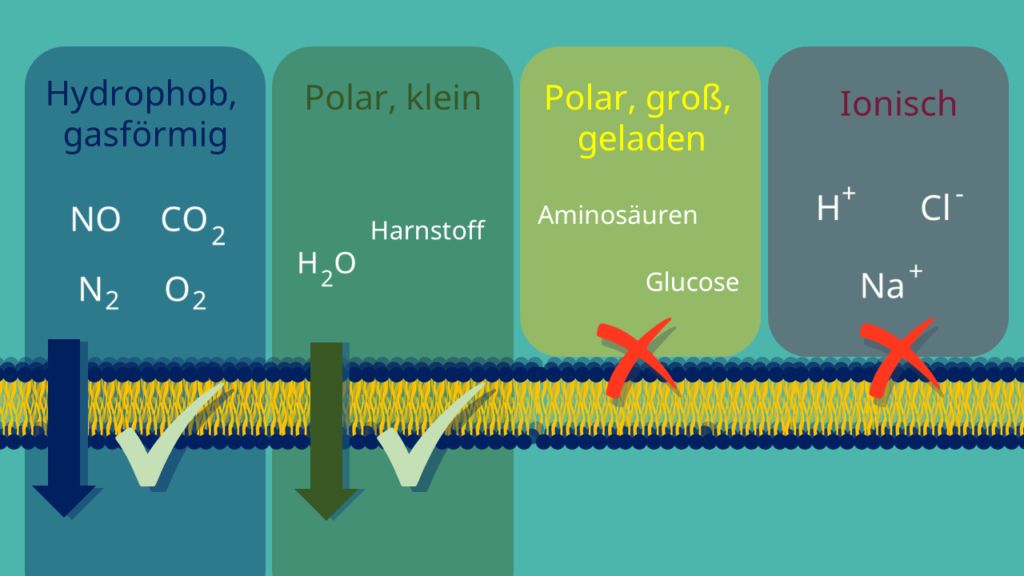
- Selektive Permeabilität – bedingte Durchlässigkeit der Zellmembran in Ruhe aufgrund von Ionenkanälen mit jeweils spezifischer Leitfähigkeit für unterschiedliche Ionen: gut durchlässig vor allem für Kalium-Ionen (K+) und – abhängig vom Zelltyp – für Chlorid-Ionen (Cl−), am Ruhepotential weniger durchlässig für Natrium-Ionen (Na+) und Calcium-Ionen (Ca2+) sowie praktisch undurchlässig für organische Anionen.
- Natrium-Kalium-Ionenpumpe – durch Tätigkeit der Natrium-Kalium-ATPase, einer Ionenpumpe, werden aktiv, unter ATP-Hydrolyse, Natrium-Ionen aus der Zelle heraus- und Kalium-Ionen in die Zelle hineingepumpt.
- Grundlagen des RP
- Brown'sche Molekularbewegung: Teilchen bewegen sich zufällig und streben dabei eine gleichmäßige Verteilung an
- Semipermeable Membran: Durch das Vorhandensein von Ionenkanälen (u.a. einwärtsgleichrichtender K+-Kanal) mit selektiver Transportfähigkeit sind Zellmembranen im Ruhezustand
- Gut durchlässig für K+-Ionen (einige auch für Cl–-Ionen)
- Schlecht durchlässig für Na+-Ionen
- Undurchlässig für anionische Proteine
- Natrium-Kalium-ATPase und Ionenkanäle: Erhalten das RP aktiv aufrecht
- K+ Konzentration: Intrazellulär > extrazellulär
- Na+-Konzentration: Extrazellulär > intrazellulär
III: Aktionspotenzial
Änderung des Membranpotentials über der Zellmembran. Es dient der Reizweiterleitung über Axone an weitere erregbare Zellen (beispielsweise Neuronen).
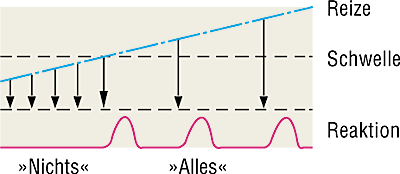
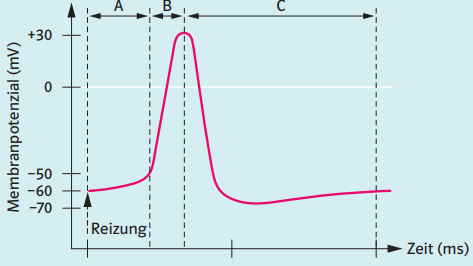
Alles-oder-nichts-Gesetz bezeichnet das Phänomen, dass eine Reaktion auf einen Reiz entweder vollständig oder überhaupt nicht ausgelöst wird. Es gibt also einen Schwellenwert, der überschritten werden muss, um die Reaktion auszulösen.
PHASEN:
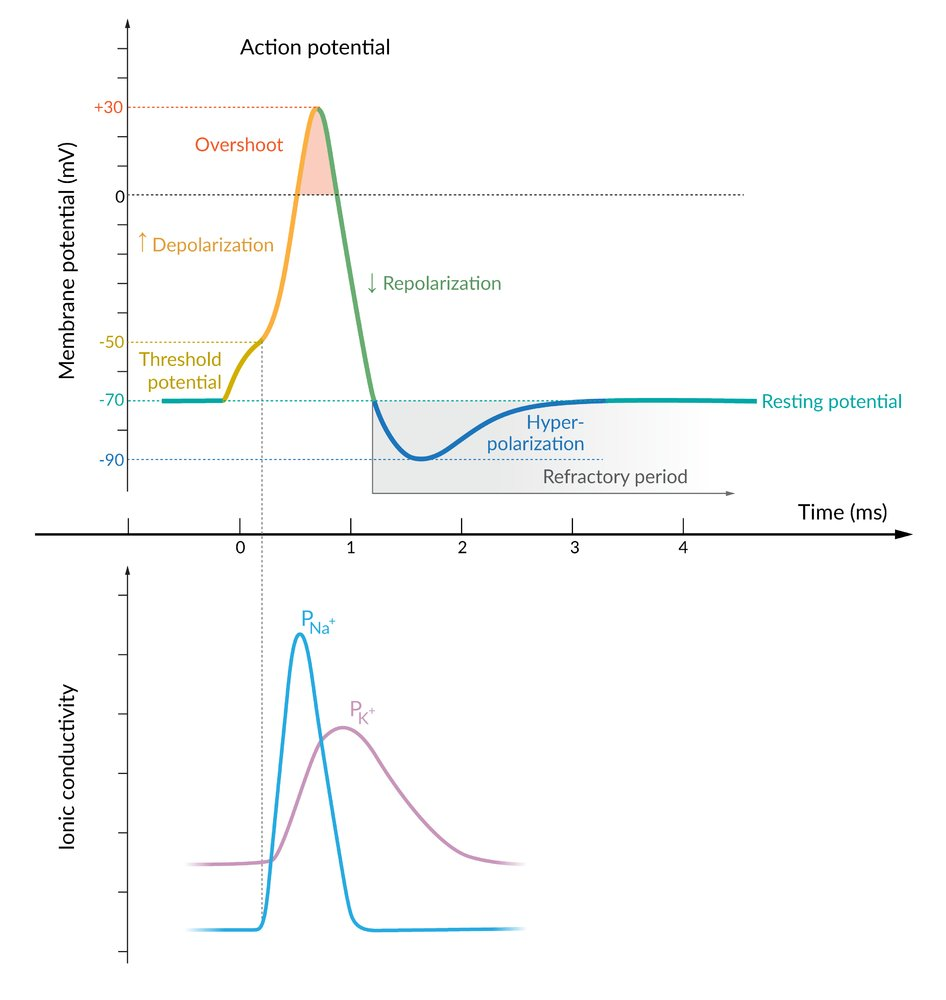
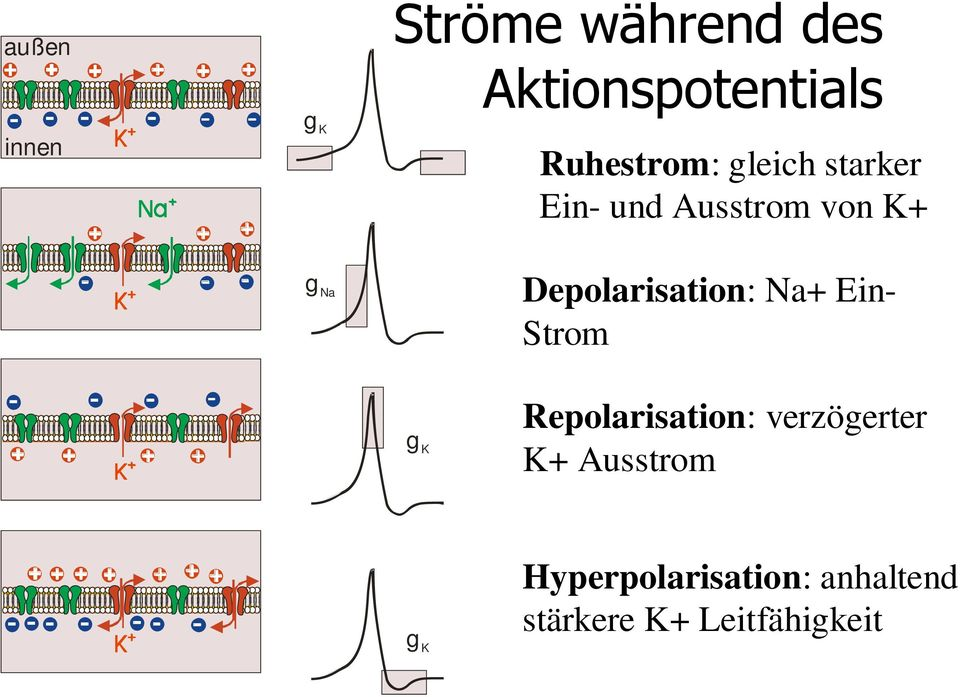
2) Unterschwellige Depolarisierung:
Durch leichte Reize des Neurons kommt es zum Öffnen einiger weniger spannungsgesteuerter Natrium-Kanäle in der Membran des Axons, und ein paar Natrium-Ionen strömen in die Zelle ein. Dadurch wird die Membran leicht depolarisiert.
3) Überschwellige Depolarisierung:
Wird die Zelle stärker gereizt, öffnen sich weitere spannungsgesteuerte Natriumkanäle, so dass noch mehr Natrium-Ionen in das Axon diffundieren. Sobald das Membranpotenzial einen gewissen Schwellenwert überschreitet (bei Säugetierzellen ca. -55 mV [1]), setzt eine positive Rückkopplung ein.
4) Positive Rückkopplung:
Je mehr Na+-Ionen in das Axon eindringen, desto stärker ist die Depolarisierung. Das führt dazu, dass sich mehr spannungsgesteuerte Na+-Kanäle öffnen, was wiederum dazu führt, dass noch mehr Na+-Ionen in das Axon einströmen.
Diese positive Rückkopplung führt zu einer völligen Ladungsumkehr an der axonalen Membran, das Membranpotenzial steigt dabei auf +30 mV
5) Hochpunkt
Das Membranpotenzial hat seinen maximalen positiven Wert von ca. +30 bis +40 mV erreicht. Die genaue Höhe dieses Wertes hängt von mehreren Faktoren ab, zum Beispiel der Konzentration der Na+-Ionen im Außenmedium, der Konzentration der K+-Ionen im Innenraum und so weiter. Die elektrisch gesteuerten Na+-Kanäle sind jetzt alle wieder geschlossen, es können auf diesem Wege keine Na+-Ionen mehr in die Zelle einströmen.
Rein rechnerisch müsste das Membranpotenzial jetzt dem elektrochemischen Gleichgewichtspotenzial von Na+-Ionen entsprechen, das bei ca. +60 mV liegt. Aber es sind ja auch Kalium-Ionen, Chlorid-Ionen und andere Ionen (zum Beispiel Ca2+) im Außenmedium und im Zellplasma gelöst, die einen Einfluss auf das Membranpotenzial haben, daher weicht das Membranpotenzial während des Aktionspotenzials von diesem theoretischen Wert ab.
6) Repolarisation
Die spannungsgesteuerten Na+-Kanäle haben sich vollständig geschlossen, sie sind inaktiviert worden. Es können also keine weiteren Na+-Ionen mehr in das Axon eindringen. Wie diese Inaktivierung genau aussieht, wird auf einer eigenen Seite erklärt.
Neben den spannungsgesteuerten Natrium-Kanälen gibt es auch sehr viele spannungsgesteuerte Kalium-Kanäle in der Membran des Axons. Diese K+-Kanäle beginnen sich nahezu gleichzeitig mit den Na+-Kanälen zu öffnen, das Öffnen dauert aber länger ("langsame Kanäle").
Das Öffnen dieser K+-Kanäle führt dazu, dass K+-Ionen aus dem Zellinnern nach außen strömen. Die K+-Ionen werden durch zwei Triebkräfte nach außen "gestoßen":
- Durch den steilen K+-Konzentrationsgradienten (chemisches Potenzial)
- Durch die positiv geladene Membraninnenseite (elektrisches Potenzial, +30 mV!)
Da mehr K+-Ionen von Innen nach Außen geströmt sind als zuvor Na+-Ionen von Außen nach Innen, ist die Axonmembran auf der Innenseite jetzt sogar noch negativer als im Ruhezustand, es liegt also eine Hyperpolarisation der axonalen Membran vor
Die K+-Kanäle sind immer noch geöffnet, also strömen weitere K+-Ionen nach außen. Allerdings ist es auf der Membraninnenseite jetzt wieder negativ, so dass der K+-Ausstrom langsam gebremst wird.
Allerdings liegt das K+-Gleichgewichtspotenzial bei -90 mV bis -98 mV (bei Säugetierzellen). Da die Natrium-Kanäle in dieser Phase des Aktionspotenzials schon wieder geschlossen sind, leisten die Na+-Ionen keinen Beitrag mehr zum Membranpotenzial, das Membranpotenzial wird also vor allem durch die K+-Ionen bestimmt. Daher nimmt das Membranpotenzial für eine kurze Zeit Werte unterhalb des Ruhepotenzials an, die in der Nähe des K+-Gleichgewichtspotenzials liegen, dieses aber nie ganz erreichen
7)Wiederherstellung des Ruhepotentials
Im Zellplasma befinden sich jetzt viel zu viele Na+-Ionen, während K+-Ionen fehlen. Ein besonderes Protein, nämlich die ATP-getriebene Natrium-Kalium-Pumpe, sorgt jetzt dafür, dass überschüssige Na+-Ionen nach außen gepumpt werden. Gleichzeitig werden K+-Ionen von Außen nach Innen transportiert. Auch zu diesem Thema gibt es für interessierte Schüler eine Vertiefungsseite.
8)Phase 8 bzw. 1
Wenn die ursprünglichen Konzentrationsverhältnisse durch die Natrium-Kalium-Pumpe wiederhergestellt sind, liegt das Membranpotenzial wieder im Bereich des Ruhepotenzials. Jetzt kann auch ein neues Aktionspotenzial entstehen; daher sind wir auch wieder bei Phase 1.
4. Synapsen:
Ablauf eine Aktionspotential:
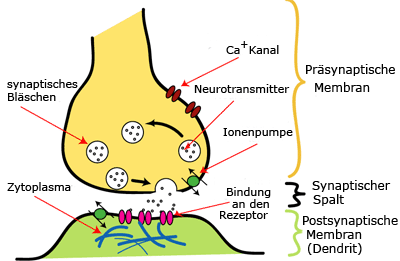
Sobald ein Aktionspotential die Endknöpfchen erreicht, öffnen sich die spannungsabhängigen Ca2+ Ionenkanäle. Es folgt ein starker Einstrom der Ionen in das Endknöpfchen.
Angeregt durch die Ca2+ Ionen Konzentration, wandern die synaptischen Vesikel zur präsynaptischen Membran. Durch Exozytose setzen sie ihre Transmitter in den synaptischen Spalt frei. \n Die Ca2+ Ionen werden derweil wieder aus der Terminale ausgepumpt, um die Ausgangslage wiederherzustellen.
Die freigesetzten Transmitter diffundieren durch den synaptischen Spalt und binden reversibel an den für sie passenden rezeptorabhängigen Ionenkanälen.
Die Bindung bewirkt eine Konformationsänderung und damit eine Öffnung, der rezeptorabhängigen Ionenkanäle.
Durch die geöffneten Ionenkanäle findet ein starker Einstrom an Na+ in die Zelle und ein schwacher Ausstrom K+ aus der Zelle statt. Das führt zu einer Depolarisation der Membran (= Endplattenpotential (EPP) oder postsynaptisches Signal (PSP))
Das EPP breitet sich elektrisch (durch Ionenwanderung) entlang der Membran aus. Erreicht es eine Stelle, die nicht mehr direkt unter der Terminale liegt, und überschreitet dort die Reizschwelle von -60mV, wird ein Muskelaktionspotential ausgelöst. Der Muskel wird kontrahiert.
Der Transmitter (i.d.F. Acetylcholin) löst sich von den Ionenkanälen und wird an der Acetylcholinesterase in Acetat und Cholin abgebaut, um eine sofortige Neubesetzung des Rezeptors zu verhindern.
Die Spaltprodukte werden wieder ins Endknöpfchen aufgenommen und dort neu zu Acetylcholin synthetisiert. Das neugewonnene Acetylcholin wird wiederum in den synaptischen Vesikeln gespeichert. \n Die Synapse ist jetzt voll regeneriert und kann erneut erregt werden!
Also:
Ein Aktionspotential trifft im synaptischen Endknöpfchen ein.
Spannungsabhängige Calciumionenkanäle öffnen sich.
Calciumionen strömen in die Präsynapse ein.
Synaptische Vesikel verschmelzen mit der präsynaptischen Membran.
Die Transmittermoleküle werden in den synaptischen Spalt entleert.
Die Transmittermoleküle diffundieren durch den synaptischen Spalt.
Die Transmittermoleküle binden an den Rezeptoren der postsynaptischen Membran.
Ligandengesteuert öffnen sich Natriumionenkanäle.
Natriumionen strömen in die postsynaptische Zelle ein.
- Es entsteht ein exzitatorisches postsynaptisches Potenzial. (EPSP).
b) Arten von chemisch-interneuronale Synapsen
Es gibt zwei Arten an chemisch-interneuronalen Synapsen.
| Erregende Synapse | Hemmende Synapse |
|---|---|
| Eine erregende Synapse verstärkt die Depolarisation am anbindenden Neuron.Als Transmitter kommen Acetylcholin, Dopamin, Serotonin, u.a. infrage.Die Funktion der Synapse ist analog zu der normalen chemischen Synapse.Die Transmitter öffnen die Ionenkanäle in der postsynaptischen Membran. Darauf folgt die Depolarisation und ein erregendes postsynaptisches Potenzial (EPSP). | Eine hemmende / inhibitorische Synapse vermindert die Depolarisation (= Hyperpolarisation) am anbindenden Neuron.Ein Beispiel für einen Transmitter wäre die Y-Aminobuttersäure.Im Gegensatz zur normalen Synapse werden bei der hemmenden Synapse K+ bzw. Cl- Kanäle geöffnet. Die darauf folgende Hyperpolarisation führt zu einem inhibitorischen postsynaptischen Potenzial (IPSP). |
Die Erregung eines Neurons ergibt sich aus der Summe der verschiedenen Signale, die das Neuron erhält. Also alle EPSPs verrechnet mit allen IPSPs (= Synaptische Integration)
Trotz allem: Nicht jedes Endplattenpotential - egal ob von einer erregenden oder hemmenden Synapse stammend - führt auch zu einer Reizüberschreitung in der postsynaptischen Membran. Oft sind mehrere APo's nötig, um tatsächlich zu einer Muskelkontraktion zu führen oder diese zu unterbinden.
Es gibt zwei Arten von Summation, die an einem Soma auftreten können: die zeitliche und die räumliche Summation.
Zeitliche Summation:
Innerhalb kürzester Zeit laufen APo's am selben Dendrit in das Soma einer Synapse ein.
Räumliche Summation:
An einem Neuron laufen gleichzeitig mehrere APo's von verschiedenen Dendriten in das Soma einer Nervenzelle ein.
Beide Arten von Summationen führen zu graduierten PSPs.
Bei chemischen Synapsen wird der elektrische Reiz an der Präsynapse in ein chemisches Signal umgewandelt, welches an der Postsynapse wiederum ein elektrisches Signal induziert. Es gibt auch elektrische Synapsen, dort gehen Ionenkanäle direkt von der Prä- in die Postsynapse. 20 Ein Neuron kann Reize von hunderten bis tausenden anderen Neuronen erhalten. Die Reize können entweder hemmend oder erregend wirken.
Aufgaben: https://www.klett.de/inhalt/mediafastpath/32/DO013-12-150050OLLoesungenNeuro.pdf
Was ist die Km-Konstante?
Km: Konstante m - Michaelis-Konstante
Beschreibt die Abhangigkeit er Geschwindigkeit, wie schnell eine Enzyme arbeitet.
Enzym + Substanz, Enzymsubstraktkomplex: E + Produkt
Wie erklärt sich der Einfluss des pH - Wertes auf die Enzymaktivität?
Denaturierung des Enzyms: bei zu extremen pH, und wenn das pH zu niedrig ist, gelangen H+ Ionen an die negative Proteine anlagen, und sie verändern ihre Struktur und denaturieren auch.
Ökologie: Enzyme sind so ausgelegt, dass sie bei den Lebensbedingungen verändern, sind sehr wandelbar. Es geht um die Wasserstoffionen. Im Magen: Säure, pH 1, Mund: neutral. Jeder hat sein eigenes pH Optimum. Liegt daran, wie sie gebaut sind.
Beschreibe, warum Enzyme kurz nach dem Temperaturoptimum einen starken Abfall der Reaktionsgeschwindigkeit haben.
Nach dem Temperaturoptimum haben sie einen starken Abfall der Reaktionsgeschwindigkeit, weil am Temperaturoptimum ist die Geschwindigkeit an allerhöchsten - Wenn das überschritten ist, nimm es wieder ab, weil Enzyme aus Proteine gebaut sind: also bei zu höheren Temperaturen sind dieses Proteine zerstört und können nicht mehr arbeiten.
Was versteht man unter Denaturierung des Enzyms?4P
Die korrekte räumliche Struktur von Proteinen ist Voraussetzung für ihre Funktionen. Geht diese Struktur verloren, bezeichnet man das als Denaturierung = Also der Verlust der korrekten räumlichen Struktur eines Proteins. Durch Denaturierung geht auch die Funktion eines Proteins verloren, da diese von der räumlichen Struktur abhängig ist. Die Primärstruktur des Proteins (Aminosäureabfolge) bleibt jedoch erhalten. Die Denaturierung kann reversibel oder irreversibel sein und wird meist durch eine Änderung der äußeren Bedingungen wie bspw. eine Temperatur- oder pH-Wert-Verschiebung verursacht.
Erkläre die RGT - Regel.
Die Aktivität der Enzyme ist sehr stark von ihrer Umgebung abhängig, d.h. die pH-Wert und die Temperatur können bestimmen, wie schnell ein Enzym arbeitet.
Bei Steigende Temperaturen: geht es ziemlich schnell - Dafür gibt es eine Regel:
- 10 Grad Celsius: verdoppelt sich das Reaktionsgeschwindigkeit
Weil Enzyme und Substrate sich schneller im Raum bewegen: größere Wahrscheinlichkeit, dass sie sich treffen Bsp: Tanzen in einer Disko - das passiert aber nur im Temperaturoptimum. Die Geschwindigkeit von Reaktionen wird ganz wesentlich von der Konzentration der Komponenten im Gemisch bestimmt, da die Teilchen ja erst einmal aufeinander treffen müssen, um zu reagieren, und dies ist der zeitintensivste Aspekt der Reaktion.
- Brownsche Molekularbewegung
- 42 Grad Celsius: geht nicht mehr
- 0 C: Wasser friert: keine Bewegung: Grund dafür wir können Essen länger halten, Bsp Fleisch
Was sagt Km über die Affinität des Enzyms zu seinem Substrat aus?
Mithilfe dieser Konstante lassen sich Aussagen darüber treffen, wie hoch die Affinität, also die Bindungsstärke des Enzyms, zu seinem Substrat ist. Das heißt, dass jede Enzyme eine unterschiedliche Leistung haben will.
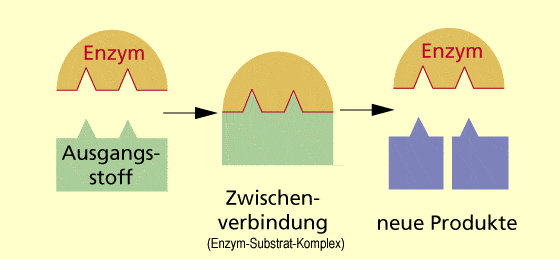
Dieser Enzym-Substrat-Komplex (ES) steht mit den anderen Komponenten des Reaktionsgemischs (dem Enzym (E), dem Substrat (S) und dem Produkt (P)) in einem Fließgleichgewicht . Ein Fließgleichgewicht ist ein Zustand, bei dem ständig Substanzen in gleichem Maße zuströmen wie abfließen. Dies ist eine Konsequenz daraus, dass Zellen offene Systeme sind, die mit ihrer Umgebung im ständigen Austausch stehen.
Also: Produkt = zerlegende Substrat
Enzym + Substanz: Enzymsubstraktkomplex → E + Produkt
Die Umsetzungsgeschwindigkeit hängt vom Substrat ab.
Jede Beziehung hat ihre Konstante: Es gibt Enzyme mit weniger Substraten, mehr und Überschuss.
Erkläre den Zusammenhang mit der Substratkonzentration. 6P
(Warum wird nicht die maximale Umsetzungsgeschwindigkeit, sondern Km angegeben)
Weil die Km gibt es uns einen klaren Wert gibt, ist ein Maß, man muss es nicht in etwas annähern.
Nennen Sie die vier Abschnitte eines Neurons und ordnen Sie ihnen ihre Funktionen zu.
(1) Dendriten: sammeln einkommende erregende und hemmende Informationen und leiten sie elektrotonisch weiter,
(2) Soma: bewerkstelligt Stoffwechsel und Proteinsynthese,
(3) Axon: Axonhügel, erzeugt Aktionspotenziale, Axon leitet Aktionspotenziale fort, (4) Endknöpfchen: Kommunikation mit Zielzellen.
Neurone sind stark differenzierte Zellen mit einer besonderen Struktur. Erstellen Sie eine Liste der Besonderheiten im Vergleich zu einer undifferenzierten Tierzelle und erläutern Sie, inwiefern diese strukturellen Besonderheiten im Zusammenhang mit der Funktion der Neuronen als Empfänger und Verteiler von Informationen stehen.
(1) stark verzweigter Abschnitt der Dendriten: wichtig für Informationsaufnahme von vielen vorgeschalteten Neuronen
(2) langer Abschnitt des Axons: wichtig für Fortleitung über weite Strecken
(3) Verzweigungen im präsynaptischen Abschnitt: wichtig für Informationsweitergabe an bzw. Verschaltung mit vielen weiteren Neuronen
In einem Experiment (O Abb.) messen Sie, ob es zwischen destilliertem Wasser und einer Kaliumcitrat-Lösung zu einer Ungleichverteilung von Ladungen, also zu einer elektrischen Spannung kommt. Die Flüssigkeiten sind durch eine Folie getrennt. Im ersten Experiment verwenden Sie eine Folie, die für alle Ionensorten durchlässig ist. Die im zweiten Experiment verwendete Folie ist hingegen nur für Kalium-Ionen durchlässig. Begründen Sie, ob Sie eine messbare Spannung erwarten, und nennen Sie jeweils die Seite des positiven und des negativen Pols.
Wenn die Folie für beide Ionen durchlässig ist, werden beide Ionensorten entlang ihres Konzentrationsgefälles hindurch diffundieren. Es kommt also zu einer Diffusion von Ionen, aber nicht zu einer Ungleichverteilung der Ladungen, also auch zu keiner messbaren Spannung. Wenn die Folie nur für Kalium-Ionen durchlässig ist, werden nur diese positiv geladenen Ionen entlang ihres Konzentrationsgefälles hindurch diffundieren. Es kommt also zu einer Diffusion von positiven Ionen und somit zu einem Überschuss negativ geladener Citrat-Ionen auf der einen und positiv geladener Kalium-Ionen auf der anderen Seite der Folie. Somit ist eine Spannung messbar.
Nennen Sie die Bedingungen, die erfüllt sein müssen, um eine Bewegung von Ionen durch eine Membran, also einen Ionenstrom, durch a. ein Kanalprotein oder b. eine Ionenpumpe zu erzeugen
a. Kanalprotein: Konzentrationsgefälle und/ oder Ladungsgefälle. Wenn beide in unterschiedliche Richtungen wirken, entscheidet der stärkere Einfluss über die Richtung des Ionenstroms. Das Kanalprotein muss spezifisch für das betreffende Ion sein. b. Ionenpumpe: Bei Vorhandensein von Energieäquivalenten (ATP) können die Ionen auch gegen ein Konzentrations- und/ oder Ladungsgefälle transportiert werden. Die Ionenpumpe muss spezifisch für das betreffende Ion sein.
In Ruhe zeigen Neurone ein Gleichgewichtspotenzial A1 In einem Experiment (O Abb.) werden eine Kaliumcitrat-Lösung und destilliertes Wasser durch eine Folie getrennt. Sie ist nur für Kationen durchlässig. Kaliumcitrat dissoziiert in Wasser in K+-Ionen und negativ geladene Citrat-Ionen. Das Messen der Potenzialdifferenz ergibt einen negativen Wert (Bezugspunkt: Potenzial der äußeren Flüssigkeit ist 0mV). Erklären Sie dieses Ergebnis.
Die Kalium-Ionen diffundieren entlang ihres Konzentrationsgefälles durch die Folie, während die Citrat-Ionen nicht diffundieren. Es kommt also zu einer Diffusion von positiven Ionen und somit zu einem Überschuss negativ geladener Citrat-Ionen innerhalb der Folie und positiv geladener Kalium-Ionen außerhalb der Folie. Somit ist eine Potenzialdifferenz mit negativem Vorzeichen messbar.
A2 In zwei Folgeexperimenten modifizieren Sie das Experiment aus A1. Im ersten Folgeexperiment erhöhen Sie die Ausgangskonzentration an Kaliumcitrat in der inneren Flüssigkeit. Im zweiten Folgeexperiment geben Sie wenig Natriumcitrat in die äußere Flüssigkeit. Geben Sie jeweils an, ob Sie eine Messwertänderung erwarten, und begründen Sie Ihre Erwartung.
Experiment 1: Es diffundieren mehr Kalium-Ionen entlang ihres Konzentrationsgefälles durch die Folie, sodass eine stärkere negative Potentialdifferenz gemessen wird. Experiment 2: Es diffundieren zwar weiter Kalium-Ionen entlang ihres Konzentrationsgefälles nach außen, aber auch Natrium-Ionen entlang ihres Konzentrationsgefälles nach innen (Folie ist durchlässig für Kationen). Da mehr Kaliumcitrat gelöst ist als Natriumcitrat, wird der Kaliumstrom stärker sein. Es ergibt sich also weiterhin eine negative Potentialdifferenz, die aber durch den Strom der Natrium-Ionen schwächer negativer ist als in A1.
In einem Patch-Clamp-Experiment wird ein spannungsgesteuerter Na+- Ionenkanal untersucht. Erläutern Sie, welche Messung Sie erwarten, wenn die Membran von – 70mV kurzzeitig auf – 50mV depolarisiert wird. Vergleichen Sie das mit den Ergebnissen, die Sie für eine kurzzeitige Depolarisation auf – 60mV bzw. – 40mV erwarten würden.
Hintergrund: Wenn das Membranpotenzial kurzfristig von – 70mV um 10 – 15mV positiviert wird, öffnen sich schlagartig alle spannungsgesteuerten Ionenkanäle (Alles-oder-Nichts-Gesetz).
Daher wird sich die Messung des Na+-Stroms (in pA) bei Depolarisation auf – 50mV oder – 40mV nicht unterscheiden. Bei Depolarisation auf – 60mV (unterschwellige Depolarisation) hingegen wird man keinen Na+-Strom messen.
Aktionspotenziale werden selbsttätig entlang des Axons fortgeleitet A1 Beschreiben Sie die verlustfreie Fortleitung eines Aktionspotenzials entlang eines Axons. Prüfen Sie, ob die Begriffe „verlustfrei“ und „Fortleitung“ für diesen Prozess passend gewählt sind.
Verlustfrei: Die Amplitude des ersten Aktionspotenzials, das am Axonhügel erzeugt wird, entspricht genau der Amplitude des Aktionspotenzials, das am Endknöpfchen ankommt. Insofern ist „verlustfrei“ zutreffend. Aber es „kostet“ natürlich etwas, nämlich ATP, das für den Betrieb der Natrium-/ Kalium-Ionenpumpe benötigt wird.
Fortleitung: Genau genommen wird ja nicht ein Aktionspotenzial fortgeleitet, sondern es wird axonabwärts durch Depolarisation immer wieder ein neues Aktionspotential erzeugt.
Als sogenanntes Fugu sind Kugelfische bei Feinschmeckern sehr beliebt. In ihrem inneren Organen und der Haut lagern die Fische das Gift Tetrodotoxin ein. Wird der Fisch nicht fachgerecht zubereitet, gelangt das Gift über die Fischmahlzeit und den Darm ins Blut des Feinschmeckers. Das Gift blockiert beim Menschen die spannungsgesteuerten Na+-Ionenkanäle in Axonmembranen. Kurze Zeit später setzt die Atmung aus. Erklären Sie diesen Sachverhalt
- Blockade der spannungsgesteuerten Na+-Ionenkanäle in der Axonmembran
- keine Entstehung von Aktionspotenzialen
- keine Fortleitung der Aktionspotenziale zur Muskulatur
- keine Muskeltätigkeit
- im Falle der Atemmuskulatur erfolgt Aussetzen der Atmung
Springende Aktionspotenziale beschleunigen die Erregungsleitung erheblich A1 Beschreiben Sie, auf welche Weise bei Wirbeltieren eine Verzehnfachung der Fortleitungsgeschwindigkeit am Axon gegenüber Wirbellosen erreicht wird, ohne dass der Axondurchmesser erhöht wird.
Die Verzehnfachung der Fortleitungsgeschwindigkeit wird durch die saltatorische Erregungsleitung erreicht. Dazu ist die Axonmembran über weite Strecken durch das Vorhandensein der Myelinscheide elektrisch isoliert, d.h. sie weist einen so hohen Membranwiderstand auf, dass an diesen Stellen keine Ionenströme und somit keine Depolarisation und kein Aktionspotenzial möglich sind. Die Ionen fließen statt durch die Membran nur seitwärts zur Membran in Längsrichtung. Am Ranvier-Schnürring ist die Myelinscheide unterbrochen. Diese Stellen sind mit sehr vielen spannungsgesteuerten Natrium-Ionenkanälen besetzt. Die Längsströme von Ionen erzeugen hier nun sehr schnell eine überschwellige Depolarisation und damit ein neues Aktionspotenzial. So „springen“ die Aktionspotenziale von Schnürring zu Schnürring.
a.Stellen Sie den zeitlichen Verlauf eines normalen Aktionspotenzials in einem Diagramm dar. Erläutern Sie, in welchen Phasen des Verlaufs die Na+-Ionen-Kanäle eine besondere Bedeutung haben.
b. Leiten Sie ab, welche Folgen eine Vergiftung mit Batrachotoxin haben wird.
a. A: Öffnung einiger spannungsgesteuerter Na+-Kanäle durch Reizung und Depolarisation bis zum Schwellenwert (ca. – 50 mV)
B: Schlagartige Öffnung aller spannungsgesteuerten Na+-Kanäle
Na+-Einstrom (entlang Konzentrations- und Ladungsgradient) und dadurch starke Depolarisation mit Potenzialumkehr bis ca. + 30mV (Alles-oder-Nichts-Gesetz)
C: Verschluss der spannungsgesteuerten Na+-Kanäle und Öffnung spannungsgesteuerter K+-Kanäle - K+-Ausstrom (entlang Konzentrations- und Ladungsgradient) - Repolarisation bis unter Ruhepotenzial.
b. Da Batrachotoxin die Na+-Inaktivierungstore blockiert, bleiben die Na+-Kanäle im Verlauf eines Aktionspotenzials weiter geöffnet. Damit verbleibt das Membranpotenzial beim Depolarisationswert des Aktionspotenzials. Dies kommt einer Dauererregung gleich. Nachfolgend verschaltete Muskelzellen werden dauernd aktiviert. Es kommt zu Muskelverkrampfungen (z.B. Atemmuskulatur) und folglich zum Tod. Zeit (ms) Reizung A B
Auch bei Pflanzenzellen gibt es Membranpotenziale aufgrund ungleicher Verteilungen von Ionen an der Zellmembran. In manchen Fällen konnte man auch schlagartige Veränderungen dieser Membranpotenziale messen, ähnlich wie bei einem Aktionspotenzial im Tierreich. Man kennt dies z.B. von Armleuchteralgen. Bei mechanischer Reizung ändert sich das Ruhepotential von ca. – 180mV auf + 40mV. Durch diese starke Depolarisation werden vermutlich Stoffwechselprozesse als Antwort auf die mechanische Reizung in Gang gesetzt. Erläutern Sie ausgehend von den Ionenverteilungen in Abb. 3, wie die Depolarisation bei Armleuchteralgen zustande kommen könnte.
Depolarisation bedeutet eine Positivierung des Membranpotenzials, d.h. die Membraninnenseite muss positiver bzw. die Membranaußenseite negativer werden. Eine solche Änderung kann entweder durch Einstrom positiv geladener Ionen (wie bei tierischen Zellen) oder durch Einstrom negativ geladener Ionen erfolgen. Ein Einstrom positiv geladener Ionen müsste jedoch für alle in Abb. 3 gegebenen Beispiele gegen das Konzentrationsgefälle erfolgen und wird daher nicht der Grund für die Depolarisation sein. Ein Ausstrom von Chlorid-Ionen hingegen würde mit dem Ladungs- und mit dem Konzentrationsgefälle erfolgen. Dies erklärt die starke Depolarisation.
Erläutern Sie die Faktoren, die die Leitungsgeschwindigkeit an Axonen beeinflussen. Beachten Sie dabei die jeweilige Körpertemperatur.
Faktor Durchmesser (Schabe vs. Tintenfisch): Je höher der Durchmesser, desto geringer der Längswiderstand bei der Fortleitung der Ausgleichsströme, desto höher die Leitungsgeschwindigkeit Faktor Myelinisierung (Schabe & Tintenfisch vs. Frosch): Trotz geringeren Durchmessers ist die Leitungsgeschwindigkeit des myelinisierten Axons höher, da es nur an den Ranvier-Schnürringen erregbar ist. Faktor Temperatur (Frosch vs. Katze): Bei der Katze (ca. 37°C) ist die Leitungsgeschwindigkeit am Axon deutlich höher als beim Frosch (10°C). Grund: schneller ablaufende Stoffwechselvorgänge (RGT Regel)
Neurone kommunizieren miteinander über Synapsen
A1 Beschreiben Sie die Abläufe an einer chemischen Synapse vom Eintreffen eines Aktionspotenzials an der präsynaptischen Membran bis zur Entstehung eines postsynaptischen Potenzials am nachgeschalteten Neuron.
z.B.: Eintreffen von APs am Endknöpfchen
Öffnung von (spannungsabhängigen) Ca2+-Kanälen
Einstrom von Ca2+-Ionen – diese „veranlassen“ die Wanderung von synaptischen Vesikeln zur präsynaptischen Membran
Ausschüttung von Transmitter in den synaptischen Spalt
Diffusion der Transmittermoleküle zur postsynaptischen Membran
Andocken der Transmittermoleküle an (ligandengesteuerte) Na+-Kanäle
Öffnung der Na+-Kanäle und Na+-Einstrom
Depolarisation der Membranspannung der postsynaptischen Zelle
EPSP
Sich öffnende Na+Kanäle: Bedingt durch das Konzentrationsgefälle kommt es zum Na+-Einstrom und damit zur Positivierung des Membranpotenzials (= Depolarisation) erregender Einfluss
Sich öffnende K+Kanäle: Bedingt durch das Konzentrationsgefälle kommt es zum K+-Ausstrom und damit zur Negativierung des Membranpotenzials (= Hyperpolarisation) hemmender Einfluss
Sich öffnende Cl¯Kanäle: Bedingt durch das Konzentrationsgefälle kommt zum Cl¯-Einstrom und damit zur Negativierung des Membranpotenzials (= Hyperpolarisation) hemmender Einfluss
Tranquilizer sind Stoffe, die unter anderem eine muskelentspannende und schlaffördernde Wirkung haben. Bestimmte Tranquilizer können den Liganden GABA an der Bindungsstelle des Cl¯-Kanals ersetzen und den Kanal öffnen. Erklären Sie, wie die Wirkung dieser Tranquilizer zustande kommt.
Bedingt durch das Andocken an der GABA Stelle der Cl¯-Kanäle kommt es zum Öffnen des Kanals und zum Cl¯-Einstrom und damit zur Negativierung des Membranpotenzials (= Hyperpolarisation) = hemmender Einfluss
Chemische Synapsen ermöglichen eine Verrechnung von Informationen
Beschreiben Sie, welche Antwort Sie auf dem Axon in Abb. 1a erwarten, wenn an der Synapse ein EPSP und ein IPSP nicht gleichzeitig einlaufen, sondern zeitlich zueinander versetzt. Begründen Sie Ihre Erwartung.
Bei gleichzeitigem Eintreffen von IPSP und EPSP wie in Abb. 1a dargestellt, gleichen sich die beiden Signale aus, sodass am Axonhügel kein Effekt zu verzeichnen ist. Dies wird bei zeitversetztem Eintreffen nicht so sein. Läuft das EPSP zeitlich voraus, wird vor dem Axonhügel eine Depolarisation ankommen, die — falls überschwellig — zu einem Aktionspotenzial führen kann. Das kann durch das nachlaufende IPSP nur verhindert werden, wenn es so zeitig eintrifft, dass es das EPSP noch abschwächt. Auch wenn das EPSP nach dem IPSP einläuft, wird es vor dem Axonhügel eine Depolarisation mit möglicherweise entstehendem Aktionspotenzial am Axon geben.
Medikamente, Gifte und Drogen beeinflussen die synaptische Übertragung
Marine räuberische Kegelschnecken der Gattung Conus können Beutetieren, z.B. Fischen, durch einen Stich mit ihrem harten Zungenapparat einen Giftcocktail aus Conotoxinen injizieren. Eines dieser Toxine blockiert die Ligandenbindestellen der Na+-Kanäle in der postsynaptischen Membran, ohne diese zu öffnen. Auch auf den Menschen wirkt dieses Gift: Schon 0,2 – 1g sind tödlich. Erläutern Sie, welche Symptome Sie bei Personen erwarten, die von einer Kegelschnecke gestochen wurden.
Bedingt durch den dauernden Verschluss der Na+-Kanäle wird es keine Weiterleitung von Aktionspotenzialen zu nachgeschalteten Nerven- oder Muskelzellen geben können. Damit kommt es zu einer Lähmung (im Sinne einer Erschlaffung) der Muskulatur. Ist z.B. die Atemmuskulatur betroffen, fällt die Atmung aus und der Tod tritt ein.
Atropin, das Gift der Tollkirsche, blockiert Acetylcholin-Rezeptoren im Herzmuskel, in den Eingeweiden und im Irismuskel des Auges. Erklären Sie, warum es in geringen Dosen zur Pupillenerweiterung bei Augenuntersuchungen eingesetzt werden kann. Beschreiben Sie, welche Symptome Sie bei Personen mit Vergiftung durch Atropin erwarten.
Atropinwirkung: Die Aktionspotenziale können nicht mehr weitergeleitet werden, da die ACh Rezeptoren belegt sind. Pupillenerweiterung tritt durch Erschlaffung des Irismuskels ein. Die durch Atropin belegten Rezeptoren führen also nicht zur Ionenkanalöffnung. Bei Vergiftung mit Atropin (= Aufnahme größerer Mengen) müssten auch die Herzmuskelzellen erschlaffen
Kreislaufprobleme bis Kreislaufstillstand mit Todesgefahr Hinweis: Die tatsächliche Wirkung des Atropins am Herzen ist eine andere, da es im Herzen spezielle ACh-Rezeptoren gibt über den eine verlangsamende Aktion der Herzmuskelzellen gesteuert wird (z.B. in Entspannungssituationen, während bei Anspannung adrenalinartige Transmitter die Herzaktionen verschnellern). Daher bewirkt Atropin also das Gegenteil von ACh, nämlich eine Zunahme der Herzfrequenz und des Herzschlags = Einsatz in Notfallmedizin.
Es gibt erregende und hemmende Synapsen. Ein bestimmter erregender Synapsentyp besitzt Acetylcholin(ACh)-Rezeptoren, die ligandengesteuerte Na+-Ionenkanäle sind. Ein bestimmter hemmender Synapsentyp besitzt Aminobuttersäure-(GABA)-Rezeptoren, die ligandengesteuerte Cl–-Ionenkanäle sind. Beschreiben und vergleichen Sie die molekularen Vorgänge dieser Synapsentypen vom einlaufenden Aktionspotenzial bis zum postsynaptischen Potenzial (ohne Rückgewinnung der Transmittersubstanz).
Die Abläufe entsprechen sich weitgehend — mit dem entscheidenden Unterschied, dass bei der erregenden Synapse andere ligandengesteuerte Kanäle geöffnet werden als bei der hemmenden Synapse. Im ersten Fall strömen Kationen in die postsynaptische Zelle und bewirken ein EPSP, im zweiten Fall strömen Anionen in die postsynaptische Zelle und bewirken ein IPSP.
Erregende Synapse: einlaufendes AP, Depolarisation öffnet spannungsgesteuerte
- Ca2+-Kanäle, Ca2+ strömt entlang Konzentrationsgefälle ein, bewirkt
- Exocytose des ACh-Vesikels
- ACh diffundiert im synaptischen Spalt an die ligandengesteuerten
- Na+-Kanäle Öffnung
- Na+-Einstrom entlang Konzentrationsgefälle
- Depolarisation
- EPSP Hemmende Synapse: einlaufendes AP, Depolarisation öffnet spannungsgesteuerte Ca2+-Kanäle
- Ca2+ strömt entlang Konzentrationsgefälle ein, bewirkt
- Exocytose des GABA-Vesikels
- GABA diffundiert im synaptischen Spalt an die ligandengesteuerten Cl¯-Kanäle Öffnung
- Cl¯-Einstrom entlang Konzentrationsgefälle
- Hyperpolarisation
- IPSP
Das Nervensystem des Menschen ist hoch spezialisiert und zentralisiert
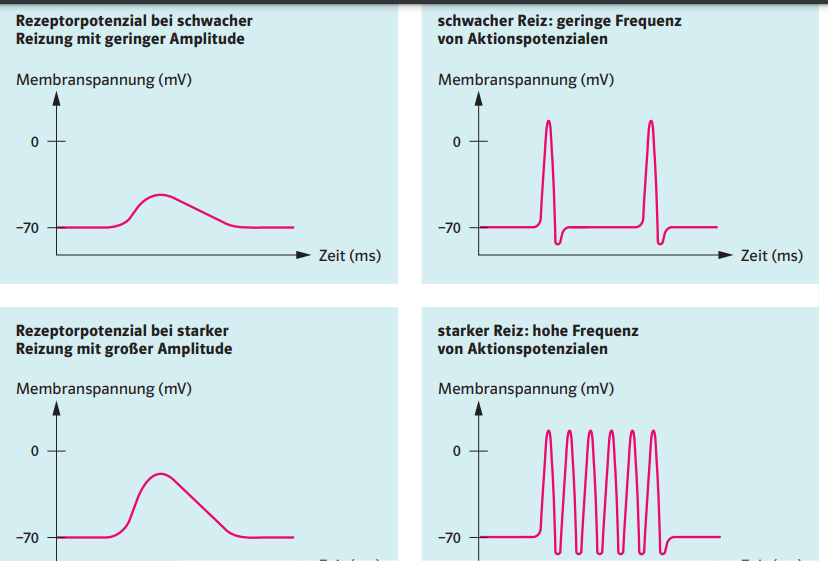
Erläutern Sie, welches Rezeptorpotenzial Sie in Abb. 1 am Messpunkt 1 und welche Aktionspotenziale Sie am Messpunkt 2 erwarten, wenn ein Rezeptor schwach, jedoch überschwellig gereizt wird. Skizzieren Sie hierzu Diagramme. Vergleichen Sie Ihr Ergebnis mit den zu erwartenden Messergebnissen bei einer starken Reizung.
Schwache Reizung: Es wird ein der Reizstärke entsprechendes Rezeptorpotenzial erzeugt (Amplitudencodierung; Messpunkt 1). Dieses Rezeptorpotenzial wird in eine seiner Amplitude entsprechende Frequenz von Aktionspotenzialen umcodiert (Messpunkt 2). Beispiel siehe Diagramme obere Reihe. Starke Reizung: Es entsteht im Vergleich zur schwachen Reizung ein Rezeptorpotenzial mit höherer Amplitude (Messpunkt 1) und eine entsprechend höherfrequente Folge von Aktionspotenzialen (Messpunkt 2).
Glossar - Definitionen
https://link.springer.com/content/pdf/bbm:978-3-662-57263-4/1.pdf