REACCIONES QUIMICAS 4-3
Historia del modelo atómico
Átomo: clave para entender la estructura y comportamiento de la materia.
DEMÓCRITO llamó al átomo.
1803—Modelo de Dalton: Postuló que los átomos son unidades indivisibles de la materia.
1897—Modelo de Thomson: Introdujo el concepto de electrón y propuso un modelo atómico como una “esfera positiva” con electrones incrustados.
1911—Modelo de Rutherford: Propuso la idea de un núcleo atómico pequeño y denso al descubrir que la mayoría de la masa del átomo está concentrada en él.
1913—Modelo de Bohr: Introdujo el concepto de órbitas cuantizadas para los electrones alrededor del núcleo.
1920—Modelo mecánico cuántico: Trato a los electrones como ondas y partículas.
1927—Modelo atómico actual: Compuesto por un núcleo central de p+ y n0 rodeado por e- en orbitales/capas. Los e- se distribuyen en estas capas según su energía.
Partículas subatómicas (EJERCICIOS)
Z = número atómico
A = masa atómica
A = p + n
Isótopos: átomos con el mismo número atómico e igual número de protones, pero diferente número de masa. Diferente número de neutrones.
Relacionadas con la gestión medioambiental. Carbono-13 (analizar cuánto carbono se acumula en el suelo por la fertilización y si esas prácticas son sostenibles).
Estructura atómica (EJERCICIOS)

El número atómico está determinado por protones.
Debe tener el mismo número de electrones.
El número másico está determinado por los neutrones.
Configuración electrónica (EJERCICIOS)
n = número cuántico principal (nivel energético del electrón); mayor n, mayor energía orbital.
l = número cuántico angular (forma del orbital en el espacio) puede tomar un valor de 0 a n-1. Cada forma del orbital se asocia a los valores de l = 0, 1, 2 y 3 con las letras ns, np, nd y nf, donde n es el número cuántico principal.
ml = número cuántico magnético (orientaciones espacialidades posibles de cada tipo de orbital); valor de -l a +l, incluyendo 0. Donde hay un orbital, hay mayor probabilidad de encontrar un electrón.
ms = número cuántico de espín (sentido del giro del electrón sobre su propio eje); en un orbital no puede haber dos electrones con espines iguales.
Principios de la configuración electrónica
De construcción: Los electrones de un átomo ocupan los orbitales disponibles de menor energía antes de llenar los orbitales de mayor energía. Cada nivel de energía cuenta con uno o más subniveles y cada uno se conforma de uno o más orbitales.
De exclusión de Pauli: no pueden existir dos electrones en un átomo con los mismos cuatro números cuánticos; por tanto, en un orbital solo coexisten dos electrones con espines opuestos.
De máxima multiplicidad o regla de Hund: varios electrones ocupan orbitales de igual energía; estos se distribuyen de manera que el número de electrones desapareados sea máximo y que tengan espines paralelos.
Resolver ejercicios
Tabla periódica (LLENAR UNA TABLA)
1861—Alexandre de Chancourtois: Presento la primera propuesta de organizar los elementos químicos con base en su masa atómica. Los ordeno en forma de cilindro.
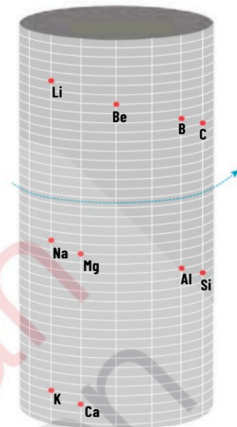
1869—Mendeleiev: Su propuesta contenía 64 elementos conocidos. Fueron organizados con base en su masa atómica en 8 columnas y 12 filas. Reservo espacios vacíos para elementos que aún no eran descubiertos.
1913—Henry Moseley: Propuso ordenar los elementos químicos de acuerdo con su número atómico. Considero que las propiedades químicas y físicas tienden a repetirse en forma sistemática conforme aumenta su número atómico. Las aportaciones de Moseley originaron la tabla periódica moderna que propusieron Werner y Paneth.
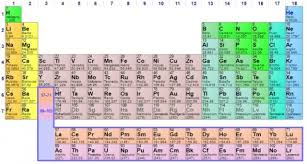
La tabla periódica es un sistema de organización y clasificación de los elementos químicos.
118 elementos
7 períodos
18 familias
Enlaces químicos
Compuestos químicos:
Son sustancias formadas por distintos elementos. Los compuestos químicos se mantienen unidos gracias a enlaces químicos.
Mantienen unidos a los átomos en las moléculas/compuestos.
Enlaces metálicos: Átomos metálicos interactúan entre sí.
Enlaces iónicos: Interacción entre iones metálicos (cationes) y no metálicos (aniones). Permite la formación de una “red cristalina”.
Enlaces covalentes: Átomos no metálicos. Los protones atraerán simultáneamente a los electrones de valencia disponibles.
Ley de conservación de la materia
Antoine Lavoisier, un químico francés del siglo XVIII, es reconocido por su papel en el establecimiento de la ley de conservación de la materia.
- La materia no se crea ni se destruye, se transforma.
La cantidad total de átomos de cada elemento debe ser la misma en reactivos y productos.
Reacciones químicas
Las características y estructuras internas de la materia cambian.
Reacción de síntesis: dos o más sustancias simples reaccionan para formar un único compuesto.
Reacción de descomposición: ruptura de un único reactante para formar dos o más productos simples.
Reacción de desplazamiento simple: reaccionan un elemento y un compuesto; el elemento reemplaza su posición.
Reacción de desplazamiento doble: reaccionan dos compuestos y se produce el intercambio mutuo entre alguno de los átomos de dichas sustancias.
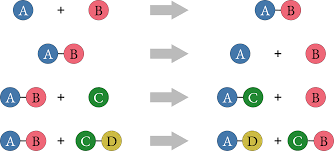
Balanceo de ecuaciones
Tanteo
Algebraico
Redox
Mol y relaciones proporcionales
Joseph Louis Proust
Propuso la ley de las proporciones divididas, que establece que un compuesto siempre tiene los mismos elementos químicos en las mismas proporciones en masa, sin importar su origen o modo de preparación.
Los compuestos químicos tienen masa propia.
Fórmula química:
Representación de la composición química de un compuesto; indica qué elementos lo forman y en qué proporciones.
Mol y constante de Avogadro (EJERCICIOS)
Un mol se define como la cantidad de materia que contiene con exactitud 6.022141×10²³ partículas. (NA)
Masa molar: Es la masa de un mol de una sustancia, expresada en gramos por mol (g/mol); es igual a la masa atómica o molecular de la sustancia en unidades de masa atómica.
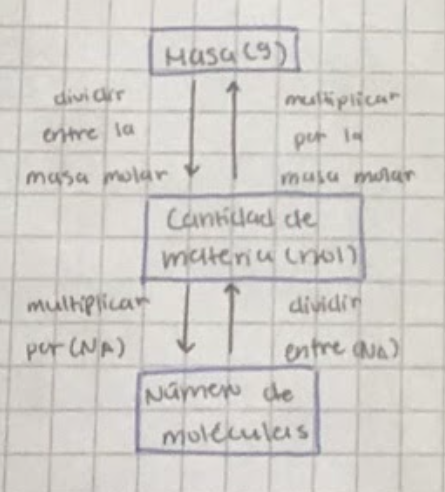
Concentración molar (EJERCICIOS)
Cantidad de moles de soluto (n) en 1 L de disolución (V).
M = n/V
Reacciones exotérmicas y endotérmicas
La energía es la capacidad de realizar un trabajo, generar movimiento o producir un cambio.
Energía química: almacena una sustancia, se libera durante un cambio químico.
Termodinámica: rama de las ciencias naturales que estudia los intercambios de energía de las reacciones químicas.
Sistema: Porción del universo que nos interesa para su estudio.
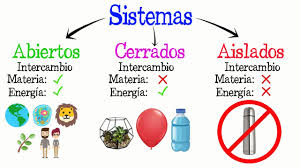
Reacciones exotérmicas: Liberan más energía en forma de calor durante el proceso; suelen aumentar la temperatura de su entorno.
Reactivo → Productos + energía.
Reacciones endotérmicas: absorben más energía en forma de calor de su entorno; para llevarse a cabo, suelen bajar la temperatura de su entorno. Reactivos + energía → productos
Procesos nucleares
Radiactividad: una reacción nuclear en la que núcleos de átomos pesados inestables se descomponen de forma espontánea y emiten radiación en forma de ondas electromagnéticas de otra energía.
Los Curie: experimentos de Becquerel despertaron curiosidad; torio, radiación similar a uranio; radio y polonio también. La llamaron radiactividad.
Ondas alfa (α): resultado de la desintegración de un núcleo inestable de elementos radiactivos pesados; produce partículas alfa que tienen carga positiva con 2 protones y 2 neutrones.
Ondas beta (β): Tienen carga negativa, masa y energía y se emiten por isótopos inestables como el tritio y el carbono-14 y el estroncio-40.
Ondas gamma (γ): emiten rayos gamma que únicamente tienen energía, no masa; son similares a la luz visible, solo que pasan en mayor energía.
Fisión: núcleos que se rompen para formar núcleos más pequeños, liberando grandes cantidades de energía y neutrones.
Fusión: 2 núcleos ligeros se combinan para tomar un núcleo más pesado; después se libera una gran cantidad de energía nuclear, mayor que la fisión.