
Wolne rodniki
Podział wolnych rodników
Tlen
ROS= RFT ( Rekatywne formy tlenu)

Azot
RNS=RFA ( reaktywne formy azotu)

Enzymatyczna linia obrony antyoksydacyjnej
Dysmutaza ponadtlenkowa
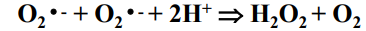
przekształca jon ponadtlenkowy w nadtlenek wodoru oraz tlen cząsteczkowy. Jon ponadtlenkowy jest reaktywnym związkiem tlenowym
Peroksydaza glutationu [ GPx ]
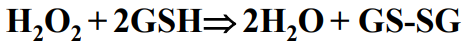 redukuje nadtlenek wodoru do wody oraz alkoholi przy wykorzystaniu glutationu jako donorów elektronów
redukuje nadtlenek wodoru do wody oraz alkoholi przy wykorzystaniu glutationu jako donorów elektronów
Katalaza [ CAT ]
 pomaga w eliminacji nadtlenku wodoru, zapobiegając uszkodzeniom oksydacyjnym komórek.
pomaga w eliminacji nadtlenku wodoru, zapobiegając uszkodzeniom oksydacyjnym komórek.Reduktaza glutationowa [ GR ]
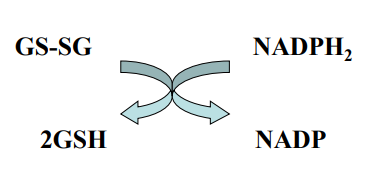 przekształca GSSG ( disuldifid glutationu ) do glutationu poprzez transfer elektronów z NADPH
przekształca GSSG ( disuldifid glutationu ) do glutationu poprzez transfer elektronów z NADPH
Powstanie nadtlenku wodoru
SOD → Dysmutaza ponadtlenkowa ( przeprowadza reakcje )
Reakcja Habera-Weisa
 Rekacja Fentona
Rekacja Fentona

Nieenzymatyczna linia obrony antyoksydacyjnej
Witamina E i C
Witamina E jako antyoksydant, reaguje z wolnym rodnikiem, który oddaje elektrony → witamina E staje się wolnym rodnikiem
Wolny rodnik witaminy E reaguje z witaminą C. Witamina C oddaje 2 elektronu, powodując redukcje witaminy E do tokoferolu oraz sama się utleniając do kwasu dehydroaskorbionowego → przywrócenie aktywnego antyoksyoksydantu i witamina C staje się wolnym rodnikiem
Rodnik witaminy C ulega zredukowaniu dzięki utleniniu NADPH. → rodnik witaminy C zregenerowany do witaminy C lub jej degradacja
rodnik z fazy lipidowej przechodzi do fazy wodnej
Syntaza tlenku azotu i jej reakcje
rysunek
Wolnorodnikowe uszkodzenie lipidów
Peroksydacja lipidów
inicjacja - oderwanie atomu wodoru, znajdującego się pomiędzy dwoma wiązaniami podwójnymi cząsteczki kwasu tłuszczowego za pomocą rodnika hydroksylowego (rodnik hydroksylowy odrywa jeden z atomów wodoru przy podwójnym wiązaniu kwasu tłuszczowego, przez co dany kwas tłuszczowy staje się wolnym rodnikiem (rodnikiem alkilowym), a rodnik hydroksylowy przemienia się w wodę, następnie rodnik alkilowy reaguje z tlenem, w rezultacie czego powstaje rodnik nadtlenkowy, który może reagować z następnym kwasem tłuszczowym i odrywając od niego wodór zamienia się w nadtlenek kwasu tłuszczowego)
propagacja: rodnik nadtlenkowy powstały z kwasu tłuszczowego reaguje z kwasem tłuszczowym, w rezultacie czego powstaje nadtlenek kwasu tłuszczowego itd - peroksydacja rozszerza się na inne kwasy tłuszczowe
terminacja: produktem reakcji zachodzącej pomiędzy dwoma wolnymi rodnikami jest związek niebędący wolnym rodnikiem (np. alkany, dialdehyd malonowy)
Znaczenie peroksydacji lipidów
Zwięsza przepuszczalność błon
depolaryzuje błody
hamuje enzymy i błonowe białka trannsportujące
Wolnorodnikowe uszkodzenie białek
Inicjacja
Beta-eliminacja
modyfikacja reszt aminokwasowych i rozpad uszkodzonych białek - fragmentacja
Im większe wolnorodnikowe uszkodzenie białek tym więcej karbonylowych grup a mniej sulfhydrylowch
Przyczyniają się do utraty integralności błon komórkowych i upośledzenie metabolizmu komórek
Wolnorodnikowe uszkodzenie kwasów nukleinowych
marker wolnorodnikowego uszkodzenia RNA → wzrost 8- hydroksy guanozyny
marker wolnorodnikowego uszkodzenia DNA → wzrost stężenia 8-hydroksy 2-deoksyguanozyny
Przyczyniają się do mutacji a następnie do powstawania nowotworów
Stres oksydacyjny
Brak równowagi pomiędzy RFT a biologicznej zdolności do szybkiej detoksykacji reaktywnych produktów pośrednich lub naprawy wyrządzanych szkód
Glutation
pełna nazwa : L-glutamylo-L-cysteinylo-glicyna [ GSH ]
GSSG → disulfid glutationu
Posiada wiązanie peptydowe gamma → odporność na proteolityczną degradację
Synteza glutationu
Zachodzi w cytozulu, obejmuje 2 reakcje enzymatycnze, każda wymaga udziału energiiw postaci ATP
RYSUNEK
Działanie glutationy w walce z RFT
Gutation jako antyoksydant
Powstający w reakcji rodnik glutationylowy może dimeryzować tworząc disulfid glutationu
W komórkach ssaków reakcje redukcji nadtlenku wodoru i nadtlenku lipidów przez GSH katalizuje selenoenzym ( peroksydaza glutationowa)
Odtwarza uszkodzone składniki komórek - utryzmywanie gruo tiolowych białek w stanie zredukowanym
Reakcja redukcji GSSG przez NADPH
Odbudowa NADPH zachodzi przy udziale:
dh. izocytrynianowej
dh. glukozo-6-fosforanowej
dh. fosfoglukonianowej
enzymy jabłczanowego
Gutation - rozpad
Katalizowana przez gamma-glutamylotransferaze [ GGT ]
Zlokalizowany enzym w zew. błonie komórkowej, wykorzystuje ATP i katalizuje rozpad GSH do cysteinoglicyny oraz glutaminiany, który jest przenoszony na inny aminokwas i powstanie gamma-glutamylo-aminokwas
Cyetinoglicyna następnie dehradowana przez zewnątrzkomórkową dipeptydazę do wolnej glicyny i cysteiny
Glicyna i cysteina ograniczane są do komorki, podaż cysteiny ogranicza syntezę GSH
Wolne rodniki
Podział wolnych rodników
Tlen
ROS= RFT ( Rekatywne formy tlenu)

Azot
RNS=RFA ( reaktywne formy azotu)

Enzymatyczna linia obrony antyoksydacyjnej
Dysmutaza ponadtlenkowa
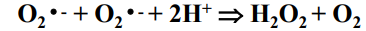
przekształca jon ponadtlenkowy w nadtlenek wodoru oraz tlen cząsteczkowy. Jon ponadtlenkowy jest reaktywnym związkiem tlenowym
Peroksydaza glutationu [ GPx ]
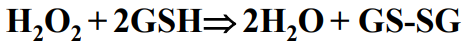 redukuje nadtlenek wodoru do wody oraz alkoholi przy wykorzystaniu glutationu jako donorów elektronów
redukuje nadtlenek wodoru do wody oraz alkoholi przy wykorzystaniu glutationu jako donorów elektronów
Katalaza [ CAT ]
 pomaga w eliminacji nadtlenku wodoru, zapobiegając uszkodzeniom oksydacyjnym komórek.
pomaga w eliminacji nadtlenku wodoru, zapobiegając uszkodzeniom oksydacyjnym komórek.Reduktaza glutationowa [ GR ]
 przekształca GSSG ( disuldifid glutationu ) do glutationu poprzez transfer elektronów z NADPH
przekształca GSSG ( disuldifid glutationu ) do glutationu poprzez transfer elektronów z NADPH
Powstanie nadtlenku wodoru
SOD → Dysmutaza ponadtlenkowa ( przeprowadza reakcje )
Reakcja Habera-Weisa
 Rekacja Fentona
Rekacja Fentona

Nieenzymatyczna linia obrony antyoksydacyjnej
Witamina E i C
Witamina E jako antyoksydant, reaguje z wolnym rodnikiem, który oddaje elektrony → witamina E staje się wolnym rodnikiem
Wolny rodnik witaminy E reaguje z witaminą C. Witamina C oddaje 2 elektronu, powodując redukcje witaminy E do tokoferolu oraz sama się utleniając do kwasu dehydroaskorbionowego → przywrócenie aktywnego antyoksyoksydantu i witamina C staje się wolnym rodnikiem
Rodnik witaminy C ulega zredukowaniu dzięki utleniniu NADPH. → rodnik witaminy C zregenerowany do witaminy C lub jej degradacja
rodnik z fazy lipidowej przechodzi do fazy wodnej
Syntaza tlenku azotu i jej reakcje
rysunek
Wolnorodnikowe uszkodzenie lipidów
Peroksydacja lipidów
inicjacja - oderwanie atomu wodoru, znajdującego się pomiędzy dwoma wiązaniami podwójnymi cząsteczki kwasu tłuszczowego za pomocą rodnika hydroksylowego (rodnik hydroksylowy odrywa jeden z atomów wodoru przy podwójnym wiązaniu kwasu tłuszczowego, przez co dany kwas tłuszczowy staje się wolnym rodnikiem (rodnikiem alkilowym), a rodnik hydroksylowy przemienia się w wodę, następnie rodnik alkilowy reaguje z tlenem, w rezultacie czego powstaje rodnik nadtlenkowy, który może reagować z następnym kwasem tłuszczowym i odrywając od niego wodór zamienia się w nadtlenek kwasu tłuszczowego)
propagacja: rodnik nadtlenkowy powstały z kwasu tłuszczowego reaguje z kwasem tłuszczowym, w rezultacie czego powstaje nadtlenek kwasu tłuszczowego itd - peroksydacja rozszerza się na inne kwasy tłuszczowe
terminacja: produktem reakcji zachodzącej pomiędzy dwoma wolnymi rodnikami jest związek niebędący wolnym rodnikiem (np. alkany, dialdehyd malonowy)
Znaczenie peroksydacji lipidów
Zwięsza przepuszczalność błon
depolaryzuje błody
hamuje enzymy i błonowe białka trannsportujące
Wolnorodnikowe uszkodzenie białek
Inicjacja
Beta-eliminacja
modyfikacja reszt aminokwasowych i rozpad uszkodzonych białek - fragmentacja
Im większe wolnorodnikowe uszkodzenie białek tym więcej karbonylowych grup a mniej sulfhydrylowch
Przyczyniają się do utraty integralności błon komórkowych i upośledzenie metabolizmu komórek
Wolnorodnikowe uszkodzenie kwasów nukleinowych
marker wolnorodnikowego uszkodzenia RNA → wzrost 8- hydroksy guanozyny
marker wolnorodnikowego uszkodzenia DNA → wzrost stężenia 8-hydroksy 2-deoksyguanozyny
Przyczyniają się do mutacji a następnie do powstawania nowotworów
Stres oksydacyjny
Brak równowagi pomiędzy RFT a biologicznej zdolności do szybkiej detoksykacji reaktywnych produktów pośrednich lub naprawy wyrządzanych szkód
Glutation
pełna nazwa : L-glutamylo-L-cysteinylo-glicyna [ GSH ]
GSSG → disulfid glutationu
Posiada wiązanie peptydowe gamma → odporność na proteolityczną degradację
Synteza glutationu
Zachodzi w cytozulu, obejmuje 2 reakcje enzymatycnze, każda wymaga udziału energiiw postaci ATP
RYSUNEK
Działanie glutationy w walce z RFT
Gutation jako antyoksydant
Powstający w reakcji rodnik glutationylowy może dimeryzować tworząc disulfid glutationu
W komórkach ssaków reakcje redukcji nadtlenku wodoru i nadtlenku lipidów przez GSH katalizuje selenoenzym ( peroksydaza glutationowa)
Odtwarza uszkodzone składniki komórek - utryzmywanie gruo tiolowych białek w stanie zredukowanym
Reakcja redukcji GSSG przez NADPH
Odbudowa NADPH zachodzi przy udziale:
dh. izocytrynianowej
dh. glukozo-6-fosforanowej
dh. fosfoglukonianowej
enzymy jabłczanowego
Gutation - rozpad
Katalizowana przez gamma-glutamylotransferaze [ GGT ]
Zlokalizowany enzym w zew. błonie komórkowej, wykorzystuje ATP i katalizuje rozpad GSH do cysteinoglicyny oraz glutaminiany, który jest przenoszony na inny aminokwas i powstanie gamma-glutamylo-aminokwas
Cyetinoglicyna następnie dehradowana przez zewnątrzkomórkową dipeptydazę do wolnej glicyny i cysteiny
Glicyna i cysteina ograniczane są do komorki, podaż cysteiny ogranicza syntezę GSH
 Knowt
Knowt