BIOQUIMICA
Ligações/ interações fracas
1.1 Ligações Hidrogênio
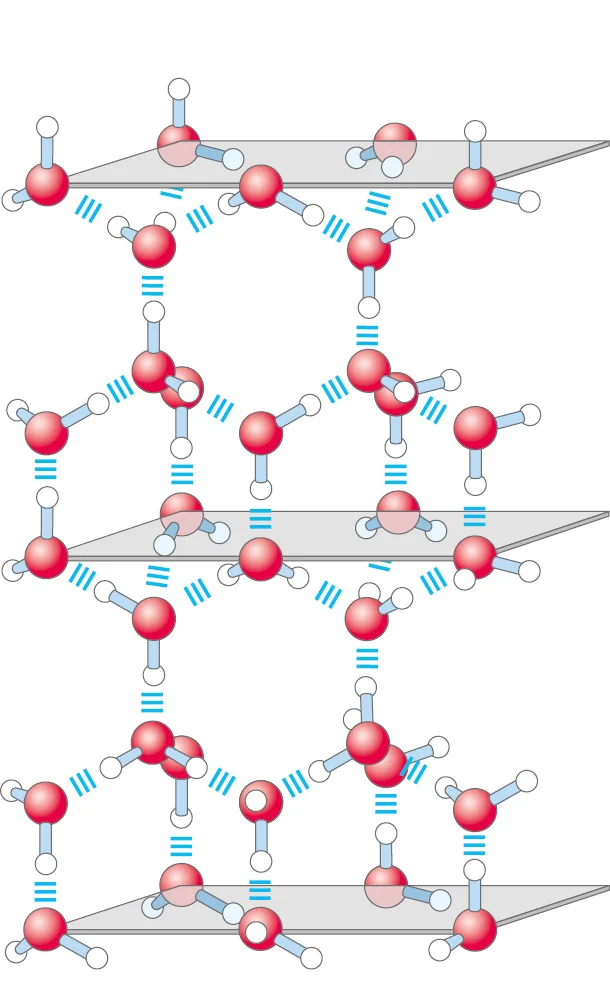
As ligações de hidrogênio: interações que ocorrem entre moléculas de água, contribuindo para suas propriedades únicas, como a alta tensão superficial e a capacidade de dissolver substâncias. A ligação de hidrogênio ocorre devido a eletronegatividade do grupo (F,O,N) fosfato, oxigênio e nitrogênio que atraí átomos de hidrogênio devido a sua carga positiva, de forma que (H+ —- FON-).
Por exemplo, numa ligação (água - água) o H+ ligasse ao centro da molécula de outro H2O, pois o (O) é eletronegativo e atrai o hidrogênio.
São relativamente fracas (porém juntas , fortes). Sua energia de dissociação da lig., isto é, a energia necessária para quebrar uma lig. é de cerca de 23 kJ/mol. (10% covalente e 90% eletrostática)
Expressão “agrupamentos oscilantes” é aplicada aos grupos com vida curta, que se formam e se rompem rapidamente, sendo essenciais para a dinâmica das interações entre moléculas de água. Esses agrupamentos permitem que as moléculas de água interajam de maneira eficiente, influenciando propriedades como a solubilidade e a reatividade química em soluções biológicas.
O arranjo tetraédrico ao redor do oxigênio permite que cada molécula de água forme até 4 ligações de hidrogênio. A lig. de Hidrogênio é a principal responsável pelo ponto de ebulição da água já que exige-se uma quantidade maior de energia para quebra-la.
Apolar e Polar
Uma molécula é considerada APOLAR quando dois átomos identicos fazem uma ligação covalente e compartilham seus elétrons
Uma molécula é considerada POLAR quando dois átomos diferentes, com eletronegatividades diferentes compartilham elétrons via lig. covalente.
Interações
Dipolo-dipolo : cargas opostas se atraem (polar), não possuem H - FON
Ion-dipolo: Um íon se liga a uma molécula polar.
Lig. de hidro: Hidrogênios ligam-se a grupos mais eletronegativos (FON)
O ponto de ebulição aumenta com o aumento da massa molecular (aumento das forças de dispersão).
• Exceção: H2O
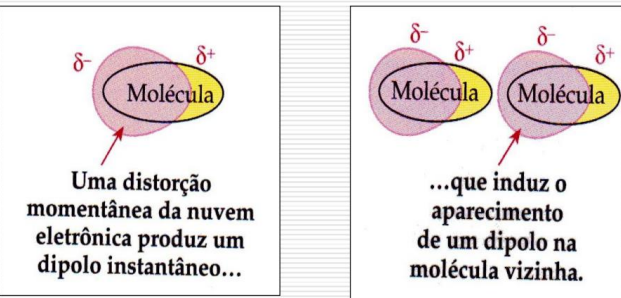
Dipolo instantaneo - dipolo induzido (Forças de London) : Uma movimentação/alteração momentânea na nuvem eletrônica cria um dipolo (+ . -) e por conta disso, átomo próximo se torna um dipolo induzido (- +)
Forças de Van der Waals É um termo genérico que engloba todas as forças intermoleculares fracas.
Incluindo: • Dipolo-dipolo, • Dipolo induzido • Forças de dispersão de London
Solvatação e Solubilidade
Solvatação trata-se do processo de dissolução de um composto polar em um solvente polar, sem gerar outra nova substância (Isso ocorre nas moleculas de Nacl pela hidratação dos íons Na+ e Cl-
A água também dissolve prontamente biomoléculas carregadas, incluindo compostos com grupos funcionais como grupos carboxílicos ionizados (-COO– ), aminas protonadas (-NH3 + ) e ésteres de fosfato ou anidridos. A água substitui as ligações de hidrogênio soluto-soluto conectando essas biomoléculas umas com as outras por ligações de hidrogênio soluto-água, blindando as interações eletrostáticas entre as moléculas de soluto
Moléculas polares se dissolvem mais facilmente
Compostos anfipáticos (polar e apolar) em soluções aquosas
Um composto anfipático trata-se de uma molécula que possui tanto regiões apolares como polares, ou seja, uma região hidrofílica e outra hidrofóbica.
Diante disso, a região apolar tende a interagir menos ou evitar o contato com a água, já a parte polar interage de forma mais ativa, devido a sua propriedade hidrofílica.
Muitas biomoléculas são anfipáticas; proteínas, pigmentos, certas vitaminas e os esteroides e fosfolipídeos de membranas apresentam regiões polares e apolares. As estruturas formadas por essas moléculas são estabilizadas por interações hidrofóbicas entre as regiões apolares. As interações hidrofóbicas entre os lipídeos, e entre lipídeos e proteínas, são as mais importantes na determinação da estrutura de membranas biológicas. Interações hidrofóbicas entre aminoácidos apolares também estabilizam as estruturas tridimensionais das proteínas
Propriedades coligativas (osmose)
Solutos de todos os tipos modificam algumas propriedades físicas do solvente, a água: a pressão de vapor, o ponto de ebulição e de fusão (ponto de congelamento) e a pressão osmótica. São chamadas de propriedades coligativas:
Tonoscopia
Ebulioscopia
Crioscopia
Pressão Osmótica
No caso do corpo humano, a mais importante é a osmótica. A osmose trata-se do processo em que os solutos (geralmente íons) atravessam da região menos concentrada para a mais concentrada
Para medir a pressão osmótica é utilizada a equação de van´t hoff (pressão osmotica: Pressão osmótica, π, medida como a força necessária para resistir ao movimento da água)
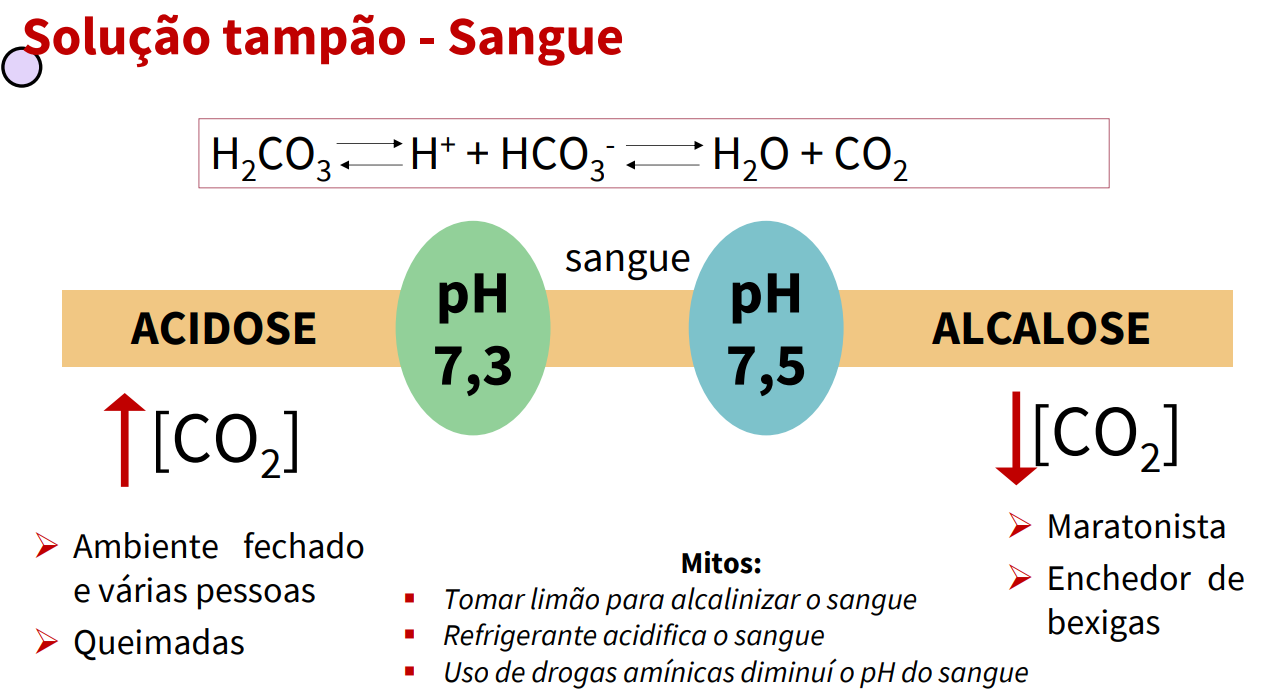
Solução Tampão
A solução tampão é um mecanismo responsável por manter o pH estável mesmo com perturbações, por meio de um doador de protons e um receptor de protons
No sangue ocorre o Tampão de Bicarbonato
O CO2 no espaço aéreo pulmonar está em equilíbrio com o tampão bicarbonato do plasma sanguíneo que circula pelos capilares pulmonares. Como a concentração de CO2 dissolvido pode ser ajustada rapidamente por mudanças na taxa de respiração, o sistema tampão bicarbonato do sangue está em estreito equilíbrio com um grande reservatório potencial dOe CO2
EQUAÇÃO:
H2CO3 — (H+) + HCO3- —-Co2 + H2O
Equação de Henderson Hasselbach
Possui a função de avaliar a variação do pH no sistema tampão pós perturbação
pH= pKa + log([A-] / [HA])
Osmose
Trata-se do movimento da água através de uma membrana semipermeavel, do meio menos concentrado para o mais concentrado
Se numa solução a osmolaridade for igual ao do citosol, então se chama isotônicas, e circundada por subs. isotônica a célula nunca perde nem ganha água.
Se a osmolaridade for maior, então ela é hipertônica, sendo assim a célula perde água e encolhe
Se menor, hipotônica, a célula ganha água e incha
Nas células animais, quando o meio é rico em soluto, as células perdem água para o meio e murcham.
Nos seus ambientes naturais, as células geralmente têm maior concentração de biomoléculas e íons do que as vizinhanças, logo a pressão osmótica tende a trazer água para dentro das células. Se não for contrabalançado de alguma maneira, esse movimento de água para dentro das células pode distender a membrana plasmática e, por fim, causar o rompimento da célula (osmólise).
Fatores que alteram o Equilibrio
CONCENTRAÇÃO
A adição de substâncias desloca
o equilibrio para o lado oposto.
A retirada de substâncias delosca o
equilibrio para o mesmo lado.

TEMPERATURA
O aumento da temperatura favorece a ação endotérmica
A diminuição da temperatura favorece a ação exotérmica
PRESSÃO
O aumento da pressão, contração ocasiona no deslocamento para a região de menor volume
A baixa na pressão, expansão do volume, desloca para a região de maior volume
Eletrólitos
São todas as substâncias dissociadas ou ionizadas que formam cátions (íons positivos) ou ânions (íons negativos).
Para a Medicina, eletrólitos trata-se de sais minerais, especificamente os íons. Seja ele positivo (cátions) ou negativo (ânions).
EX: íons de Sódio são cátions, pois são carregados positivamente (Na+)
EX: íons de Cloreto são ânions, pois são negativamente (Cl-)

A concentração dos eletrólitos em uma solução de sais dissolvidos pode ser mensurada e, geralmente, é expressa como a quantidade em miliequivalentes (mEq) por unidade de volume da solução (normalmente em litros). Os eletrólitos encontram-se dissolvidos nos três principais compartimentos de água corpórea:
o líquido no interior das células (intracelular)
o líquido no espaço que circunda as células (extracelular)
o sangue (na realidade, os eletrólitos solubilizam-se no soro - parte líquida do sangue). As concentrações normais dos eletrólitos nesses líquidos variam (alguns eletrólitos são encontrados em concentrações variáveis intra e extracelular).
Biomoléculas
Para lembrar
Carboidratos
Como o próprio nome indica, carbono hidrato, geralmente segue estrutura CH2O, são poli-hidroxialdeídos ou poli-hidroxicetonas (varias hidroxilas (-OH)).
São divididos em 3 grupos - Monossacarídeos, Dissacarídeos e Polissacarídeos.
Monossacarídeos
São estruturas sólidas incolores e cristalinas, extremamente solúveis em água (substância polar) porém inssoluveis em solventes apolares.
São estruturas mais simples, cerca de 3 a 9 carbonos no máximo. Se o grupo carbonil estiver nas extremidades, formando um aldeído será uma aldose e quando estiver em qualquer outro local será uma cetose (pois forma uma cetona).
Podem receber nomenclatura L (levo) ou D (dextro) com base no último carbono (no caso, geralmente penúltimo) contrário ao grupo carbonila, e usa-se de referência a carboxila. Se a carboxila (OH) estiver a direita então recebera designação D, se na esquerda, L.
TÉCNICA PARA CARACTERIZAÇÃO DE MONOSSACARÍDEOS : DIFRAÇÃO DE RAIO-X: Esta técnica permite obter informações da distância interplanar (d) a partir dos picos de difração, ou seja, das intensidades máximas, obtidas no difratograma, no qual permite identificar o tipo de material e sua estrutura cristalina, dado que um máximo de intensidade corresponde à distância característica entre os planos de átomos
Vale lembrar que os monossacarídeos podem ter estereoisomêros (estruturas moleculares diferentes porém de mesma fórmula molecular)
Exemplos: D-Glicose, D-galactose, D-gliceroaldeído, D-frutose, etc…
Das 16 aldo-hexoses possíveis, oito estão na forma D e oito na forma L.
Em sua maioria as hexoses dos organismos vivos são isômeros D.
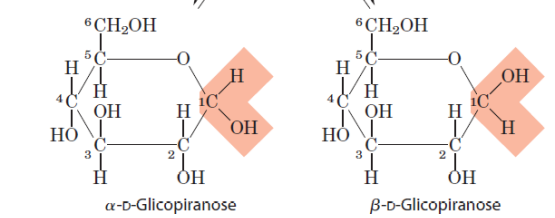
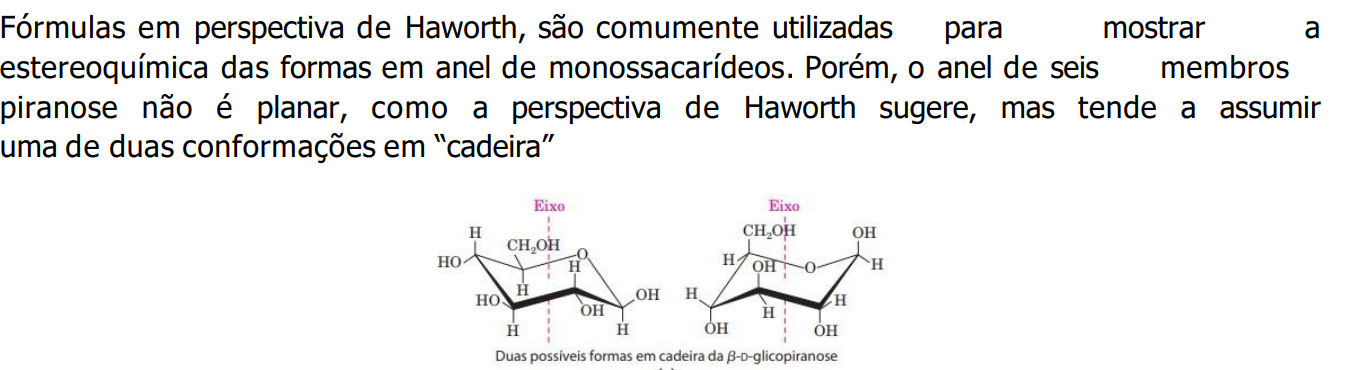
Cadeias com 5 ou mais carbonos tendem a se tornarem ciclicas, por conta disso o grupo carboxila se torna anomérico, e se liga ao carbono 1 (C do grupo carbonila) e doando seu H para O desse grupo, formando uma carboxila. Então, se a carboxila formada ficar na parte de cima será denominada Beta (ß) e se para baixo, Alfa (α).
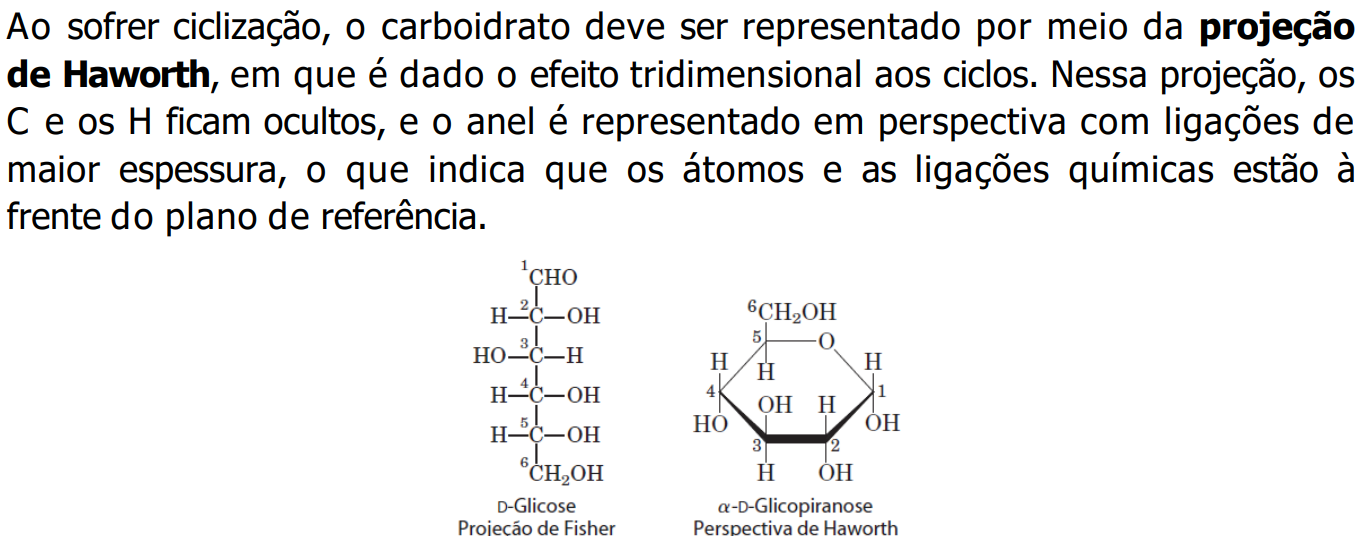
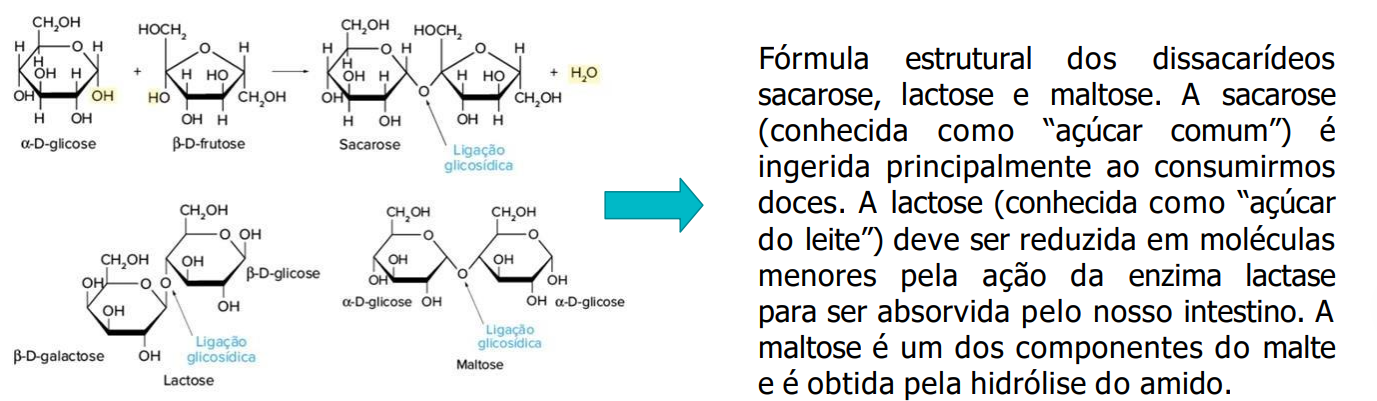
Dissacarídeos
Dois monossacarídeos
Ligação glicosídica - ligação covalente entre 2 ou mais carboidratos, com liberação de água (H2O)
EXEMPLO: C6H12O6 (glicose) + C6H12O6 (frutose) — C12H22O11 (Sacarose) + H2O
Essa ligação glicosídica ocorre por meio de condensação Hemiacetal, que funciona da seguinte forma:
O carbono do grupo carbonila, agora com hidroxila, ao realizar a ligação perde as moléculas que formarão H2O, ou seja, perdem uma hidroxila e um hidrogênio.
Ocorre no carbono anomérico 1 e no carbono 4.
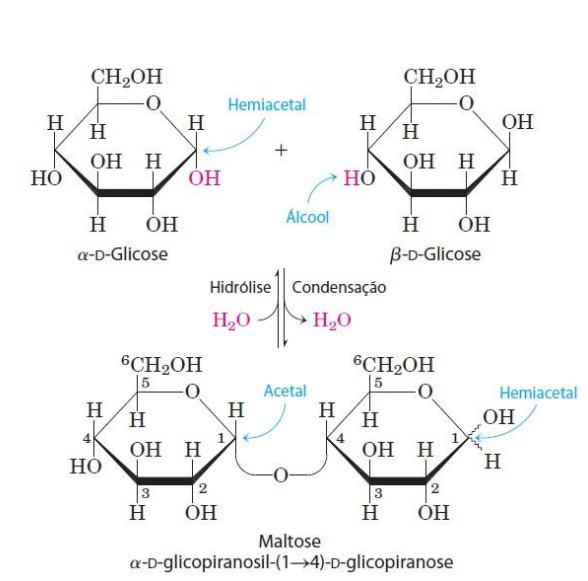
O processo oposto, chama-se hidrólise, e ao adicionar H2O, quebra o dissacarídeo em dois monossacarídeos.
Quando ocorre a ligação de 3 até 10 monossacarídeos forma um estrutura chamada de oligossacarídeos.
Polissacarídeos
A maior parte dos carboidratos ocorrem como polissacarídeos no mundo. São polímeros de média e alta massa molecular (M > 20000)
Conhecidos como Glicanos
Podem ser dividos em dois grupos, homo polissacarídeos (somente uma espécie monomérica) ou heteropolissacarídeos (mais de uma espécie monomérica)
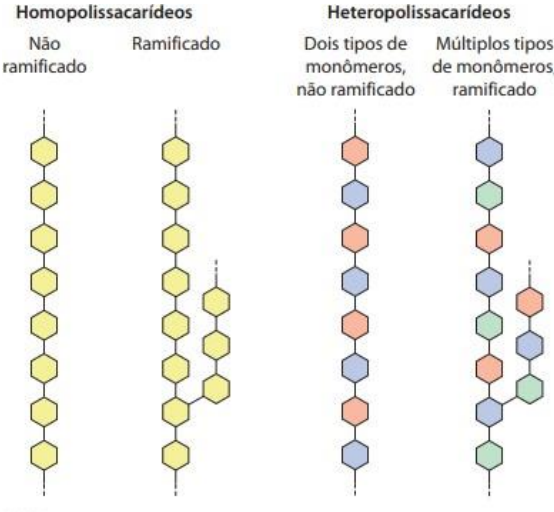
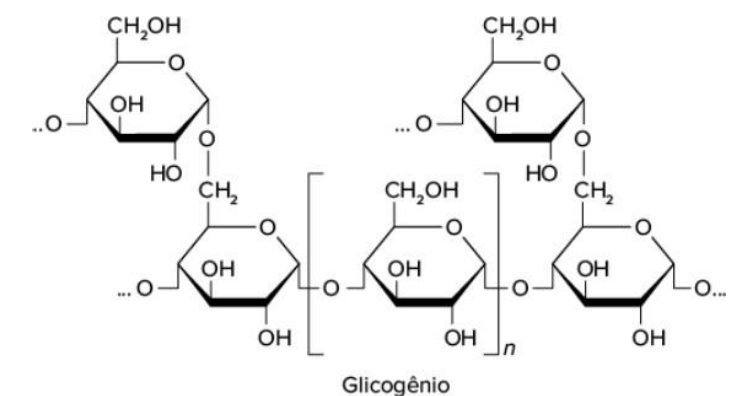
O mais importante para os humanos, dos polissacarídeos de armazenamento é o glicogênio. É mais compacto e ramificado que o amido (poli. de armaz. das plantas).
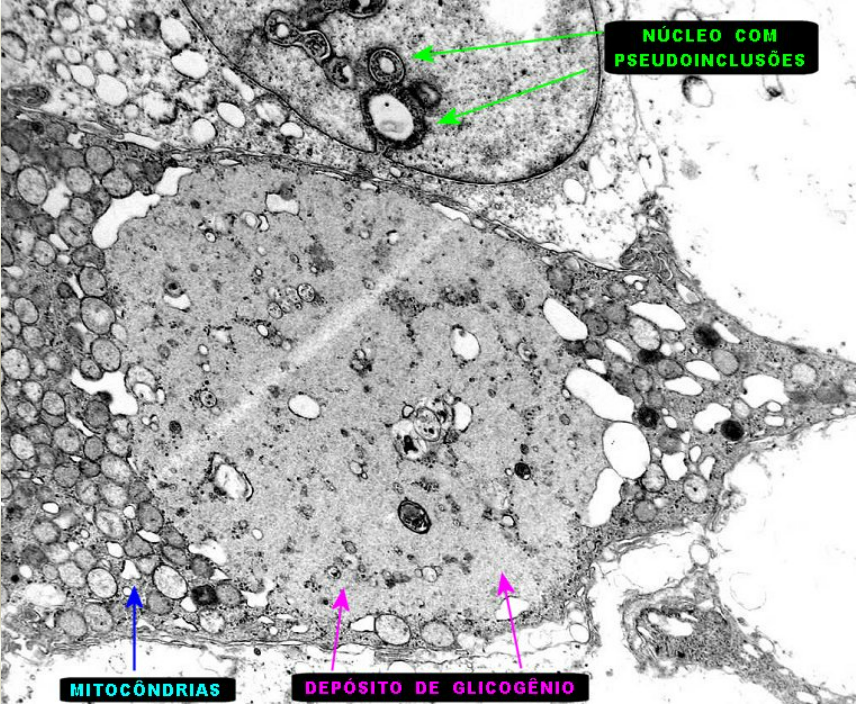
O glicogênio é especialmente abundante no fígado, onde pode constituir até 7% do peso líquido; ele também está presente no músculo esquelético. Nos hepatócitos, o glicogênio é encontrado em grandes grânulos, os quais são agrupamentos de grânulos menores compostos por moléculas únicas de glicogênio, altamente ramificadas, com massa molecular média de alguns milhões. Esses grânulos de glicogênio também apresentam, firmemente ligadas, as enzimas responsáveis(glicogênio fosforilase e a enzima desramificadora do glicogênio) pela síntese e degradação do glicogênio.
Exemplo de polissacarídeo
Proteínas
As proteínas são as macromoléculas biológicas mais abundantes, uma vez que estão presentes em todas as células e em todas as partes das células.
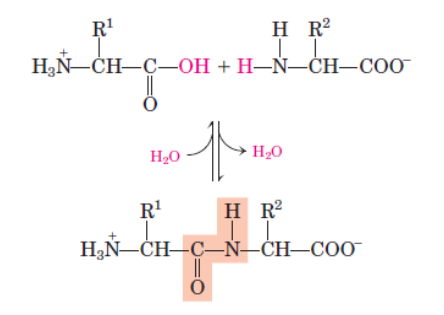
Surgem ao grupamento de aminoácidos a partir da ligação peptídica.
Aminoácidos
20 aminoácidos diferentes que formam várias proteinas diferentes quando juntos
Estrutura base
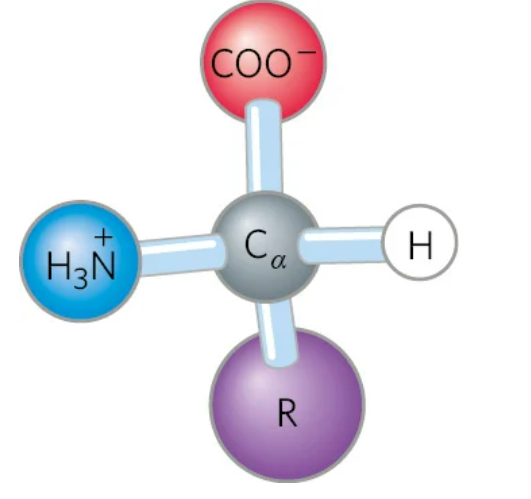
INFOS IMPORTANTES
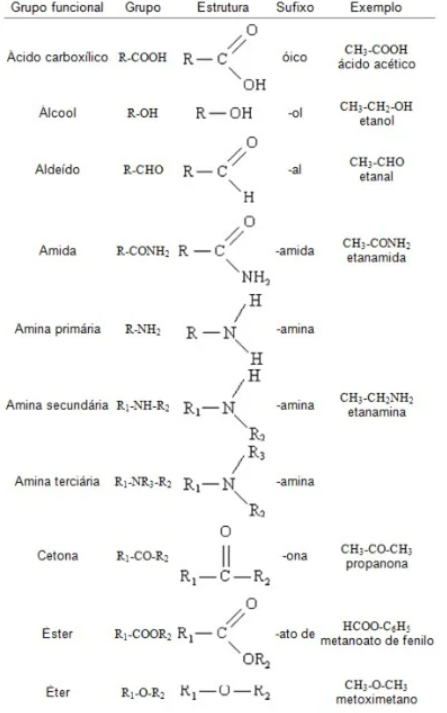
Amina → R - NH2
Ac. carbox → R - COOH ou R - CO2H
a O
A ||
Amida → R - C - NH2
Possuem algumas classificações
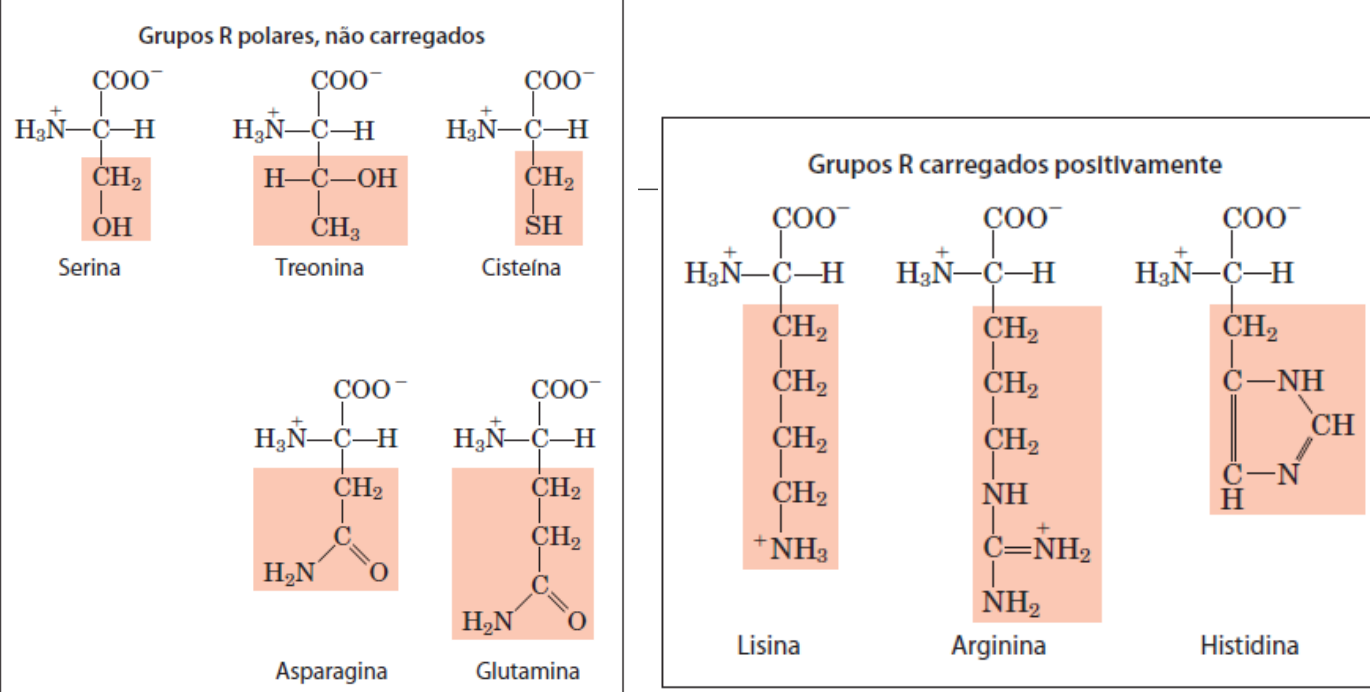
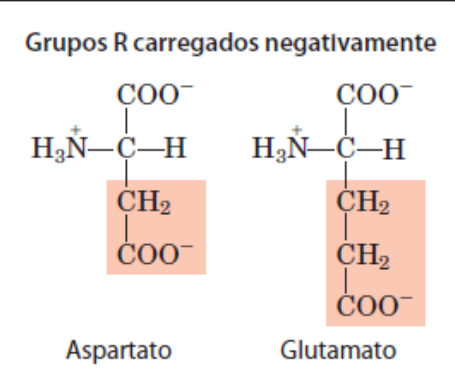
A histidina embora n explicito que carregada + , por estar sempre em movimento, em determinado momento obrigara N a fazer 4 ligações, tornando o positvamente carregado
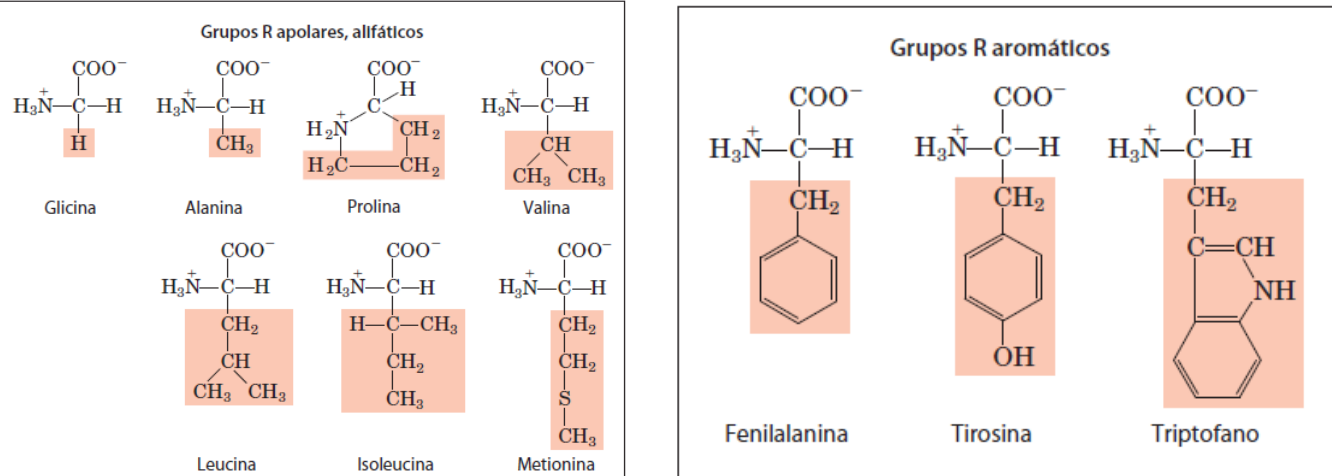
A metionina é apolar embora possua o atomo de sulfeto.
Espectro fotomero UV-VIS (triptofano, feninalanina e tironisa absorvem luz UV)
Lei de lambert beer: A intensidade da luz emitida decresce exponencialmente à medida que a espessura do meio absorvente aumenta aritmeticamente ".
Peptídeos
Podemos dizer que se tratam de cadeias de aminoácidos de 20 a 40 residuos (acima disso, tornam-se proteínas), é valido ainda lembrar que são formados via ligação peptídica por condensação.
Cadeias de peptidicas com muitos aminoacidos formam polipeptideos.
Proteínas estrutura
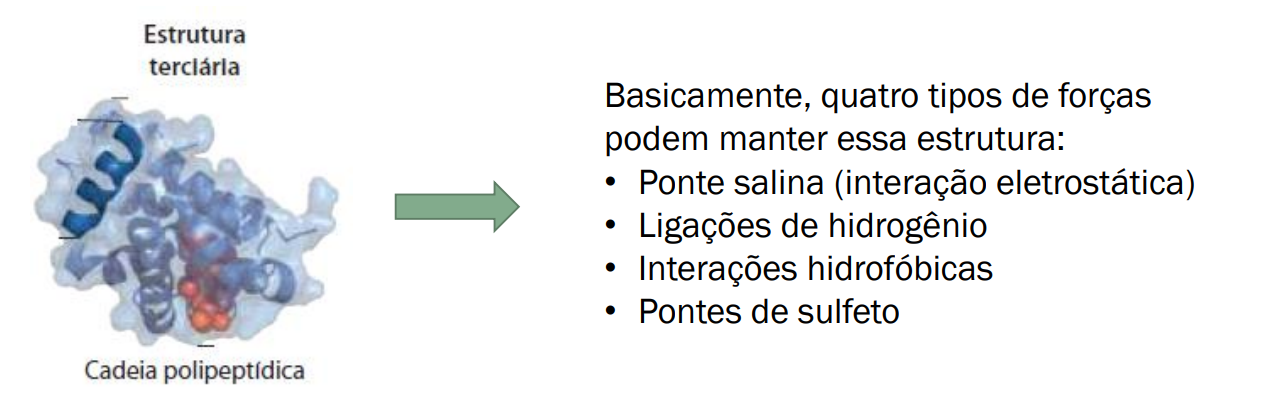
Ligações que podem ocorrer: Lig. de hidrogênio (pontes de H), Forças de Vander Waals e pontes dissulfeto (Formação reversível pela oxidação de duas moléculas de cisteína)
Estrutura primária: Uma cadeia simples de aminoácidos, um seguido do outro.
Estrutura Secundária: Formação de dupla hélice a partir da junção de estruturas primárias via ligação de hidrogênio.
Estrutura Terciária: Emaranhado de estruturas secundárias.
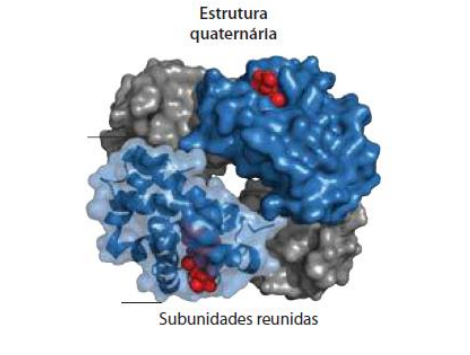
Estrutura Quaternária: Podem ter mais de uma cadeia polipeptídica, mas em resumo, trata-se de um emaranhado tridimensional de estruturas terciárias.
Desnaturação de proteína
Os seguintes fatores podem influenciar na desnaturação das proteínas
Alteração de pH do meio.
Ação de detergente
Alteração de temperatura
Estresse Mecânico
Solventes orgânicos
Na desnaturação de proteínas, a estrutura primária não é alterada
Hemoglobina e Mioglobina
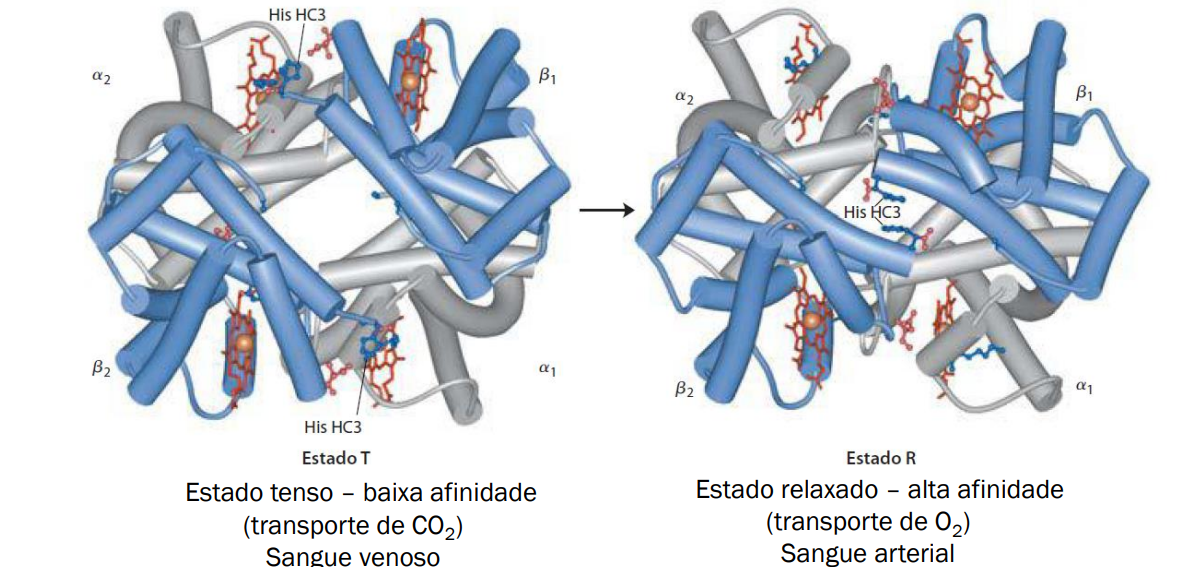
Hemoglobina → Estrutura quaternaria, grupo prostético (Não-proteína que se liga a uma proteína, nesse caso o grupo HEME, mas exemplos: íons metalicos…) Nesse caso temos 4 grupos heme.
A hemoglobina armazena ferro, e por meio deste ocorre a captação de oxigênio.
A falta de ferro, causa anemia ferropriva.
Presente nas hemácias é a principal responsável pela coloração vermelha do sangue, além de como citado, captação de oxigênio.
O oxigênio tem afinidade com o HEME.
É composta de 4 subunidades (globinas) cada uma com um grupo HEME, que contém um íon férrico no centro.
O dióxido de carbono (CO2) se liga a hemoglobina, mas não ao grupo heme
Já o monóxido de carbono (CO) se liga ao grupo HEME, sendo assim prejudicial a saude, visto que compete com o gás oxigênio (O2) pelo grupo heme.
No sangue arterial, onde é mais oxigenada, a hemoglobina reflete a luz vermelha, por isso a coloração. Porém, quando em sangue venoso, ela tende a ser mais escura devido a menor concentração de oxigênio.
Funciona como um sistema tampão do CO2 e O2.

Interage com as aminas terminais
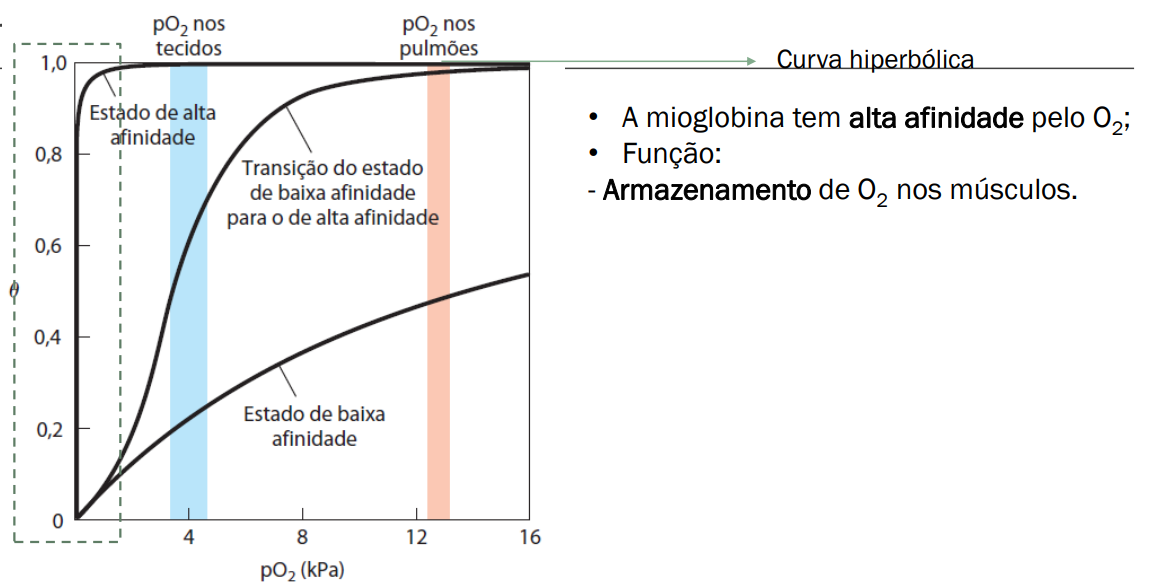
Mioglobina → Estrutura terciária, cadeia polipeptidica (Possui 1 grupo HEME)
Cadeia polipeptídica única composta de 8 alfa-hélices. (MONOMÊRO)
Proteína pequena que carrega O2 aos musculos, favorecendo a respiração destas células, visto que possuem alta demanda de oxigênio
O grupo HEME, é presente em várias outras proteínas além destas, as denominadas hemeproteínas.
O grupo HEME trata-se de uma orgânica complexa em anel a protoporfirina IX, com um átomo de ferro ligado e no estado ferroso Fe2+
Enzimas
São catalizadores poderosos e específicos, praticamente todas as reações bioquimicas são catalisadas por enzimas.
Em si, elas aceleram e muito as reações, agilizando o processo, seja recpção, interpretação ou liberação de estimulo. (aumento de 10^5 a 10^17)
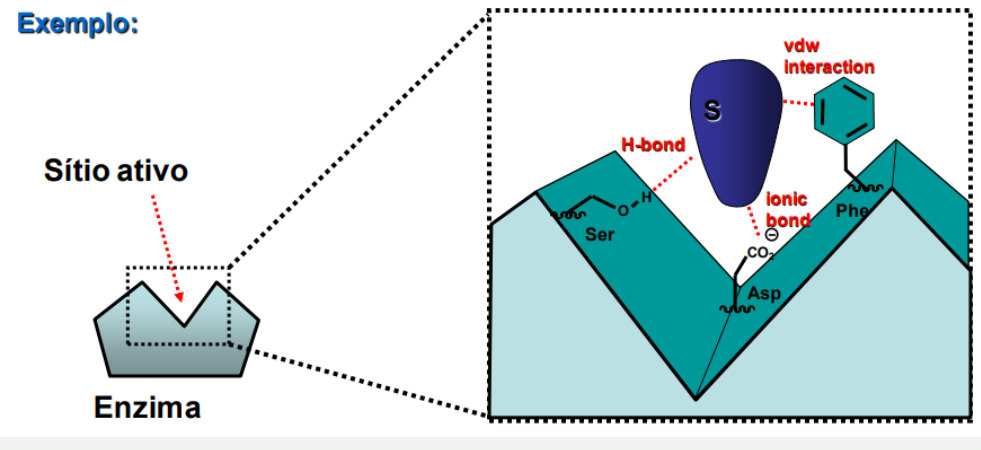
Caracterizadas pelo complexo ES (enzima e substrato), a ligação do substrato ocorre em um bolsão chamado sitio ativo.
Uma reação enzimática simples pode ser representada da seguinte forma:
Resumidamente, mecanismo chave-fechadura
SITIO ATIVO:
O sitio ativo é composto de cavidade hidrofóbica, a qual aceita reagente (substratos e cofatores) e aminoácidos que ligam-se aos reagentes e catalisam a reação.
Cofatores → São substâncias inorgânicas que auxiliam no funcionamento substrato/enzima. Quando uma enzima exige um cofator, ela se torna uma Coenzima. ex: NAD+
Quando os a ligação com coenzimas é covalente, são chamados de grupo protéstico, visto que a maioria das coenzimas se ligam por ligação iônica ou não covalentes.

Substrato → Substância que será catalisada pela enzima, ou seja, em termos gerais é a substância que vai interagir com a enzima numa reação bioquimica.
Como funcionam?
O sitio ativo da enzima está em um formato parecido com o substrato.
Assim, as ligações alteram o formato da enzima para se ajustar levemente ao substrato. (preenchimento induzido)
Ocorre a ligação por meio de forças intermoleculares ( Forças de Van der Waals, Lig. Hidro ou Iônicas)
Válido lembrar que o equilibrio das reações não é afetado pelas enzimas
Classificação
As enzimas possuem algumas classificações:
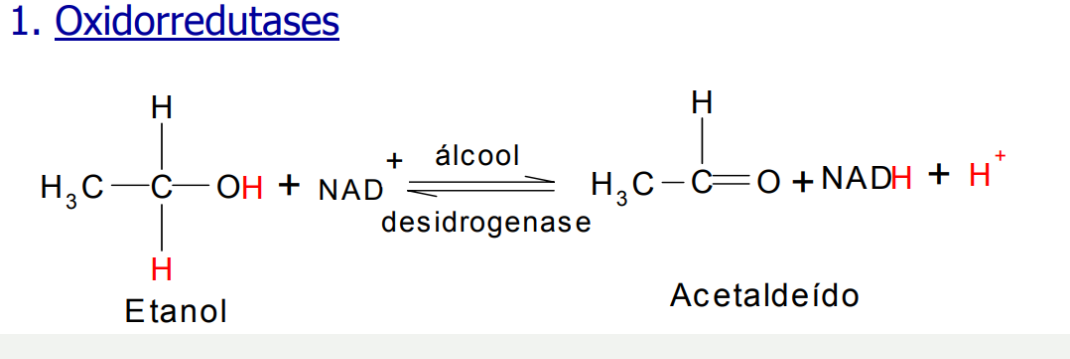
Oxirredutases: Ocorre a transferência de elétrons (íons de hidreto ou átomos de H)
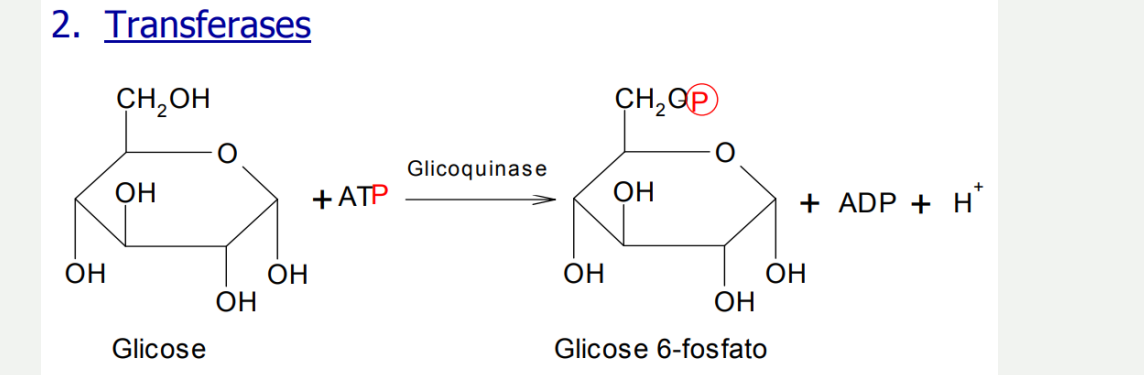
Transferase: Como o próprio nome sugere é sobre transferência de grupos. Por exemplo: transferência do fósforo na seguinte reação:
Hidrolases: Processo de hidrólise, ou seja, movimento de grupos funcionais de água.
Inibidores
Os inibidores são substâncias capazes de impedir que uma reação enzimática ocorra e eles podem funcionar de duas formas: Reversiveis e irreversiveis.
Os inibidores reversiveis: são aqueles que duram momentanêamente e podem deixar a enzima funcionar depois de um tempo. Eles são dividos em dois grupos:
Competitivos: Competem com o substrato pelo sitio ativo, pois apresentam formato parecido. O inibidor usado no tratamento da AIDS compete com o DNA polimerase, impedindo a replicação daquele gene.
Não-competitivos: Se ligam nas periferias da enzima, sem ser no sitio ativo do substrato, desativando momentaneamente a reação enzima substrato.
Inibidores irreversíveis: são aqueles que desativam a célula definitiva ou praticamente definitiva. Ex: organofosforados, aspirina, penicilina
As enzimas possuem além de um sitio ativo ligante, um sitio ativo alostérico (onde os inibidores podem se ligar), conforme ocorre a ligação ao sitio alostérico, o sitio ativo pode ser transformado, impedindo a ligação de novos substratos, visto que o formato agora é diferente.