Thermochemie
Warmte die in een chemische reactie gegenereerd word
🪫inwendige energie U🪫
de totale energie dat aanwezig is in een stof
kan opnemen of afnemen → deltaU
atomair niveau | intramoleculair nvieau | intermoleculair niveau |
|
|
|
Toestandsfunctie / grootheid: het verschil in inwendige energie tussen de reactieproducten en reagentia is meetbaar tijdens het proces niet. Alleen de begin en eind waardes.
Systeem: Plaats waar de reactie plaatsvindt
Omgeving: alles buiten systeem
De wet van behoud van energie: energie kan niet geschapen of vernietigd worden, wel van de ene vorm in de andere worden omgezet.
open | gesloten | geïsoleerd |
✅ Materie uitwisselen ✅ Energie uitwisselen | ✅ materie uitwisselen 🟥energie uitwisselen Energie is al op voorhand aanwezig door inwendige energie | 🟥materie uitwisselen 🟥energie uitwisselen |
Exotherm | Endotherm |
inwendige energie reagentia hoger dan producten | Inwendige energie reagentia lager producten |
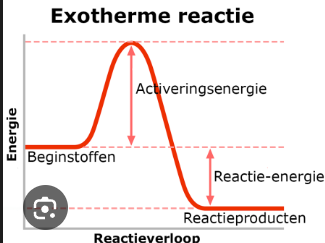 | 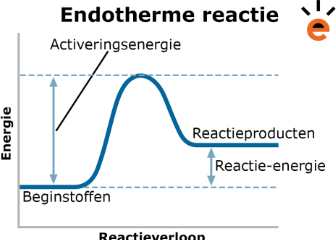 |
⚗Drijfveren⚗
enthalpie
reactiewarmte dat gecorrigeerd is let geleverde of ontvangen arbeid.
Formule: Arbeid + warmte = enthalpie / H = w + q
energie afgegeven: DeltaH < 0
energie opgenomen: DeltaH > 0
Enthalpie = toetsandsgrootheid, die 3 factoren bepalen die
druk
temperatuur
aggregatietoestand
Soorten
verbrandingsenthalpie
bindingenthalpie
neutralisatie enthalpie
vormingsenthalpie
sublimatieenthalpie
dissociatieenthalpie
Wet van hess
Als een reactie kan worden geschreven als de som van 2 of meerdere deelreacties, dan is de reactie-enthalpie gelijk aan de som van de reactie-enthalpie van de deelreacties.
bekijk voorbeelden in boek
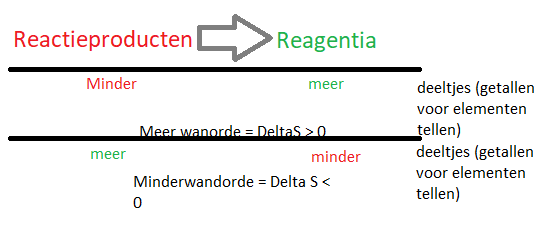
Entropie
streven naar een hoge wanorde
Symbool: S
Gibbs vrije energie
checken als een reactie al dan niet spontaan zou verlopen.
Enthalpieverandering gecorrigeerd voor de energie die het systeem gebruikt om wanorde te creëren.
DeltaG = DeltaH-T*deltaS
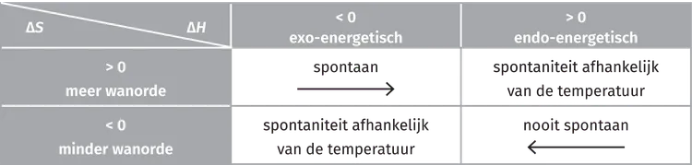
Systemen drijven naar minemale gis energie = vrije enerige
 Knowt
Knowt