Zuren en basen
Naamgeving 📛
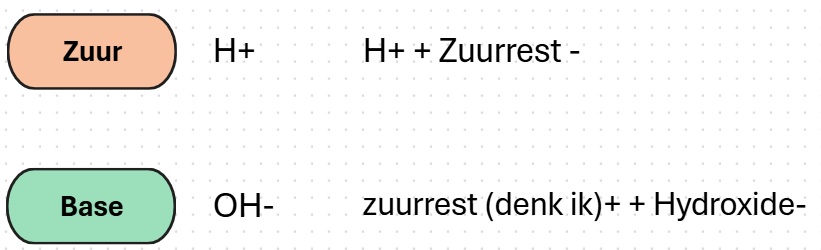
een wetenschapper genaamd Arrhenius onderscheid zuren en basen van hoe ze gingen reageren in water. Zuren gaan H+-ionen of protonen afstaan en dan een zuurrest achterlaten. Een base laat dan de concentratie van hydroxide-ionen toenemen
 |
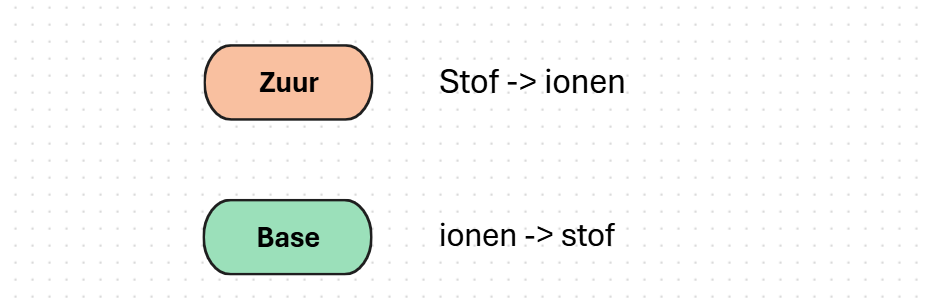
Bronsted gaat er op verder, hij zegt dat zuren ook effect hebben in andere oplosmiddelen en aggregatietoestanden. Hij zegt dat zuren en basen protonen overdragen, Het zuur is een protondonor en een base is een acceptor. Hierdoor kan je een zuurbase reactie een protonenoverdracht / protolyse noemen.
 |
Bij elk zuur hoort een base en omgekeerd. Een geconjugeerde zuur is dat een proton opneemt waardoor die weer eentje kan afstaan, een geconjugeerde base staat eentje af en kan dus ook eentje opnemen.
Yk wat je hieruit kan afleiden? EVENWICHT YAAAY DEPREISSEI IS TERUG.
Een amfolyt is zowel een zuur als base, het hangt af van de omgeving hoe die reageert.
Autoprotlyse is dat protnonen worden uitgewisseld tussen dezeflde deeltjes.
Depressie 😥
Zoals eerder gezegd zit er bij een zuur-base koppel een evenwicht.
Water doet aan autoprotolyse, deze reactie is omkeerbaar en krijg je een waterconstante D:
De autoprotolyse reactie:

De waterconstante.

Bij een evenwichtsconstante hoort ook de wet van chatelier ook nog bij. Bij concentratieverandering
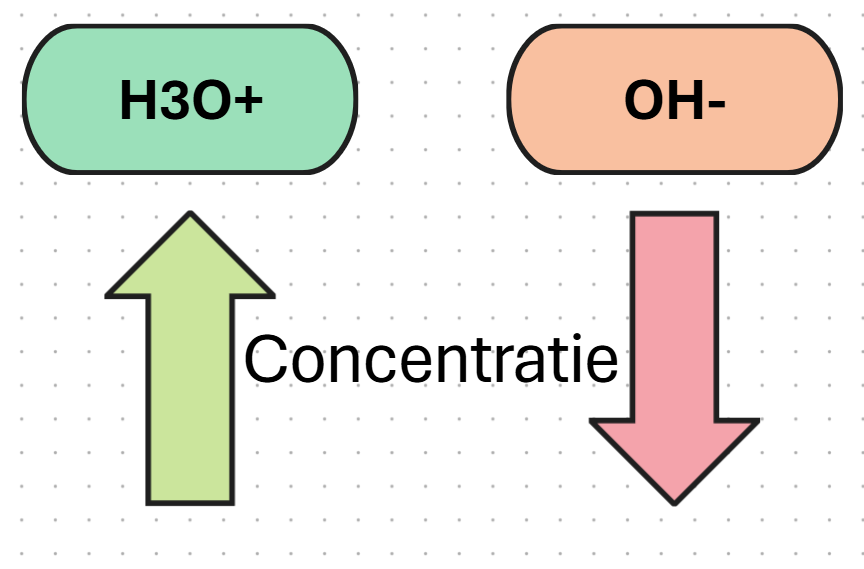
wanneer je een zuur toevoegd
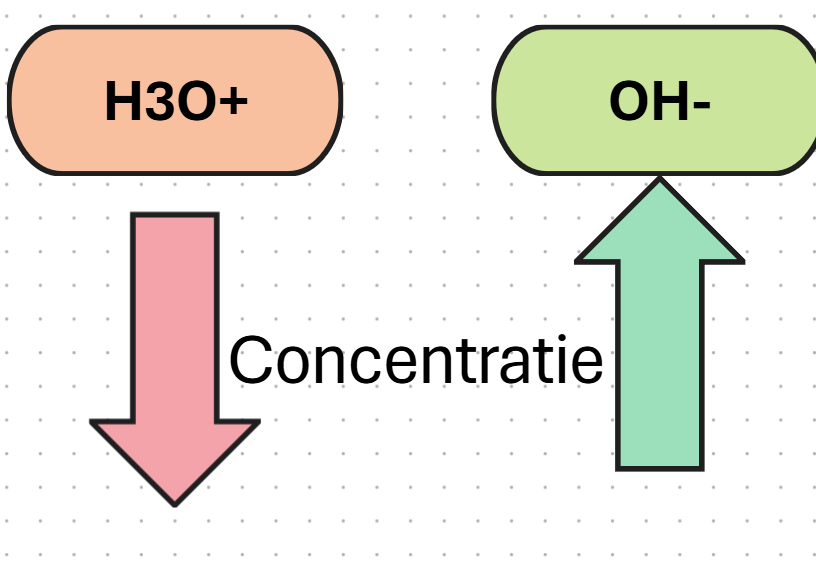
Wanneer je een base toevoegd
als de temperatuur veradert hoort er altijd een nieuwe constante bij wat op de tabel staat op pagina 112. De waarde dat je vanboven ziet is de constante op 25°. Hoe hoger de temperatuur hoe hoger de waarde en omgekeerd.
zuur base constante
i,