
Enzymo 1
Notions de base
une enzyme est un catalyseur biologique. C’est presque toujours une protéine. La réaction a lieu dans le site actif de la protéine. Une enzyme augmente la vitesse de réaction. Un catalyseur accélère une réaction chimique dans être consommé par la réaction. le substrat est le composé transformé en produit P par l’enzyme E à une vitesse k. Formule de la vitesse : V=(d[P]/dt) = k [s]. avec k la constante catalytique : kcat/knoncat = 10^6 à10^12.
les enzymes abaissent l’énergie d’activation d’une réacton en fixant leur substrat de manière à stabiliser l’état de transition, ce qui augmente la vitesse de réaction.

le site actif assure la spécificité de l’interaction entre l’enzyme et son substrat. la structure de la protine va former le site actif dans lequel se fixe le substrat. le site de fixation va fixer et orienter le substrat, et le site catalytique va catalyser la réaction.
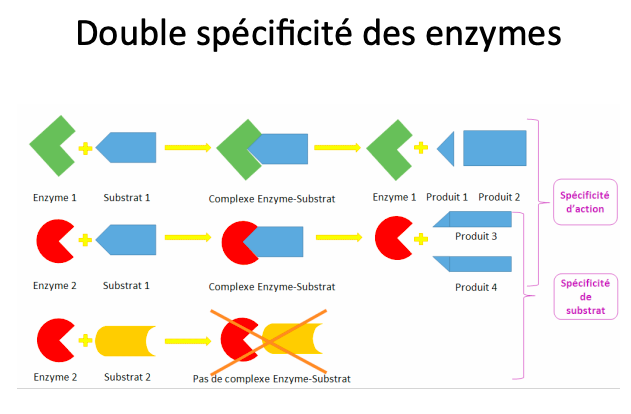
2 modèles de spécificité des sites actifs. Clé-serrure : forme du site actif complémentaire à celle du substrat. forme induite : l’enzyme change sa conformation lors de la liaison du substrat.
tests enzymatiques
mesure spectrophotométrique directe : on mesure le produit ou le substrat de la réaction, en fonction des propriétés spectrophotométriques du milieu et des réactifs.
mesure spectrophotométrique indirecte : on mesure le produit d’une seconde réaction (appelée indicatrice) utilisant le produit de la réaction principale pour réaliser la réaction suivie. on se place dans des conditions telles que la réaction principale soit limitante.
utilisation d’un pseudosubstrat : on réalise une réaction avec un pseudosubstrat ayant des propriétés spectrophotométriques intéressantes.
tests enzymatiques coupléx au DTNB : On mélange l’enzyme avec son substrat (la spermidine) et le DTNB qui, à chaque cycle enzymatique, va réagir avec le CoA-SH et libérer du TNB dont on suit la cinétique d’apparition à 412nm
test enzymatique couplé à la luciférase
test enzymatique couplé à 2 réactions : On incube les 3 enzymes avec les substrats indiqués en bleu mais c’est bien l’ADP-Mg produit par la réaction principale qui est utilisé par la réaction intermédiaire qui fournit à son tour le pyruvate nécessaire à la réaction indicatrice
test enzymatique par marquage radioactif
test en CCM
Enzymo 1
Notions de base
une enzyme est un catalyseur biologique. C’est presque toujours une protéine. La réaction a lieu dans le site actif de la protéine. Une enzyme augmente la vitesse de réaction. Un catalyseur accélère une réaction chimique dans être consommé par la réaction. le substrat est le composé transformé en produit P par l’enzyme E à une vitesse k. Formule de la vitesse : V=(d[P]/dt) = k [s]. avec k la constante catalytique : kcat/knoncat = 10^6 à10^12.
les enzymes abaissent l’énergie d’activation d’une réacton en fixant leur substrat de manière à stabiliser l’état de transition, ce qui augmente la vitesse de réaction.


le site actif assure la spécificité de l’interaction entre l’enzyme et son substrat. la structure de la protine va former le site actif dans lequel se fixe le substrat. le site de fixation va fixer et orienter le substrat, et le site catalytique va catalyser la réaction.
2 modèles de spécificité des sites actifs. Clé-serrure : forme du site actif complémentaire à celle du substrat. forme induite : l’enzyme change sa conformation lors de la liaison du substrat.
tests enzymatiques
mesure spectrophotométrique directe : on mesure le produit ou le substrat de la réaction, en fonction des propriétés spectrophotométriques du milieu et des réactifs.
mesure spectrophotométrique indirecte : on mesure le produit d’une seconde réaction (appelée indicatrice) utilisant le produit de la réaction principale pour réaliser la réaction suivie. on se place dans des conditions telles que la réaction principale soit limitante.
utilisation d’un pseudosubstrat : on réalise une réaction avec un pseudosubstrat ayant des propriétés spectrophotométriques intéressantes.
tests enzymatiques coupléx au DTNB : On mélange l’enzyme avec son substrat (la spermidine) et le DTNB qui, à chaque cycle enzymatique, va réagir avec le CoA-SH et libérer du TNB dont on suit la cinétique d’apparition à 412nm
test enzymatique couplé à la luciférase
test enzymatique couplé à 2 réactions : On incube les 3 enzymes avec les substrats indiqués en bleu mais c’est bien l’ADP-Mg produit par la réaction principale qui est utilisé par la réaction intermédiaire qui fournit à son tour le pyruvate nécessaire à la réaction indicatrice
test enzymatique par marquage radioactif
test en CCM
 Knowt
Knowt