
BIOLOGIA 6 - Biotekniikka ja sen sovellukset (copy)
2. Bakteerit ja arkeonit ovat tumattomia mikrobeja
Mikrobeja ovat kaikki paljaalle silmälle näkymättömät pienet eliöt. Suurin osa niistä on joko arkeoneja, bakteereja, alkueliöitä ja sieniä. Mikrobeihin leutaan lisäksi virukset, vaikka ne eivät ole periaatteissa eliöitä. Mikrobi ei ole biologinen, vaan lääketieteellinen termi.
Tautia aiheuttavia mikrobeja kutsutaan patonogeenisiksi mikrobeiksi, ja eläimestä bakteerina ihmiseen levinnyttä tautia zoonoosiksi. Vaikka bakteerit saattavatkin kuulostaa pelottavilta ja vaarallisilta, on olemassa paljon ei-patogeenisiä bakteereja. Aikuisen ihmisen painosta kilo tulee kehossa olevien bakteerien, suurimmaksi osaksi siis ihmistä hyödyttävien bakteerien massasta. Patogeenisiä arkeoneja ei tunneta, mutta arkeoneja ei myöskään ole ihmiselimistössä kovinkaan montaa.
Bakteerit
Likimain kaikki tarvittava tieto löytyy alla olevasta ajatuskartasta. Lisämainintana:
on olemassa soluseinättömiä bakteereja, mykoplasmoja
bakteerien soluseinä on paksuuntunut ja koostuu mureenista
jotkin bakteerit voivat elää sekä aerobisissa että anaerobisissa oloissa
denitrifikaatiobakteerit ovat typpeä ilmakehään vapauttavia bakteereja, joita hyödynnetään esim. jätevedenpuhdistamoiden biologisessa puhdistuksessa
Kuva bakteerin pinnalla olevista bakteriofageista, joita bakteeri tuhoaa cas-entsyymillä:
Arkeonit
Arkeonit ovat myös pieniä tumattomia eliöitä, joita elää joka nurkassa. Itse arkeonien lisäksi arkeonien domeeniin kuuluvat myös tumalliset eliöt, koska tuman perimä on lähtöisin arkeonista (1. endosymbioosi). Arkeoneilla ja tumallisilla on myös paljon yhteisiä proteiineja ja samankaltainen proteiinisynteesi.
Arkeonien rakenne on erilainen bakteerien rakenteeseen verrattuna, mutta ne vaihtelevat paljon myös keskenään. Arkeoneita on pyöreitä, neliömäisiä, sukkulamaisia ja littania. Arkeonien soluseinä on rakenteeltaan bakteerin, kasvi- tai sienisolun soluseinää yksinkertaisempi, eikä se koostu kitiinistä, selluloosasta tai mureenista. Sen sijaan sen pinnalla on proteeneista koostuva rakenne, joka suojaa etenkin äärioloissa kasvavia arkeoneja. Mitä tulee rasvahapoista koostuvaan solukalvoon, on se bakteerin solukalvoa jähmeämpi ja vaikeammin läpäisevä, mutta korkeita lämpötiloja kestävä.
Arkeonien energian hankitakeinot ja niiden vaikutus ekosysteemiin:
kemoautotrofit, eli kemosynteesillä energiansa hankkivat → toimivat ranvintona muille ja tuottavat tärkeitä hiilihydraatteja
toisenvaraiset mädättäjät tai hajottajat → tuhoavat kuollutta ainesta ja edistävät aineiden kiertoa
mutualistisessa suhteessa toisen lajin kanssa elävät → lajien välinen koevoluutio
metaania “syövät” → hiilinieluja
Kuten sanottu, arkeoneja elää likimain kaikkialla ympäristössämme (vaikkei niinkään meissä itseissämme), jopa ääriolosuhteissa. Erilaisia “selviytyjä” arkeoneja:
termofiiliset arkeonit = äärimmäistä kuumuutta kestävät arkeonit
halofiiliset arkeonit = äärimmäisiä suolapitoisuuksia kestävät arkeonit
(metanogeeniset arkeonit =arkeonit jotka elävät anaerobisissa oloissa tuottaen metaania)
Ihmisen mikrobiomi
Mikrobiomi = ihmiselimistössä olevat ja elävät mikrobit
Valtaosa ihmisen mikrobiomin mikrobeista on bakteereja, joita elää pääosin ruuansulatuselimistössä, iholla ja limakalvoilla. Iholla esiintyy myös sieniä ja arkeoneja. Bakteereilla on monia tärkeitä tehtäviä:
Suolistobakteerit tuottavat K- ja B12-vitamiinia, edistävät ruoansulatusta ja ravintoaineidne pilkkoutumista sekä estävät haitallisten bakteerien kiinnittymisen suolen seinämiin.
Ihon ja limakalvojen bakteerit estävät haitallisten bakteerien pääsyn kehoon.
Lisäksi bakteerit vaikuttavat aineenvaihduntaan, immuunijärjestelmään, hermoston toimintaan ja mielialaan.
Mikrobeja hyödynnetään monella sektorilla
Bakteereja hyödynnetään esimerkiksi jäteveden, maaperän tai vesien puhdistamisessa, kompostoinnissa ja maitotuotteiden tai muiden raaka-aineiden valmistuksessa.
Eliöiden, esimerkiksi mikrobien käyttöä ympäristön puhdistamiseen ympäristömyrkyistä tai muista haitallisista aineista kutsutaan biopuhdistukseksi
3. Tumallisilla mikrobeilla on moni tärkeitä rooleja ekosysteemeissä
Tumalliset mikrobit ovat paljaalla silmällä näkymättömiä, tumallisia eliöitä. Niihin luetaan mm. yksisoluiset levät sekä hiiva- ja homesienet.
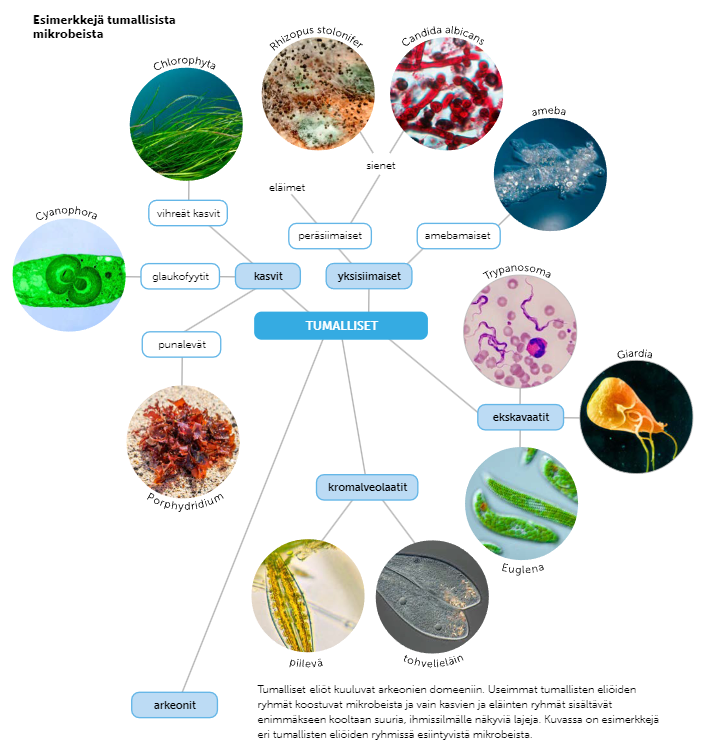
Yksisoluiset levät
Kaikilla yksisoluisilla levillä on soluseinä, ja ne ovat fotoautotrofeja.
Elävät joko yksittäin tai soluryhminä, keijuvat vapaina tai ovat kiinnittyneinä kosteille pinnoille
kasviplankton = veden pinnalla vapaasti keijuvat mikroskooppiset levät ja syanobakteerit
Merkitys biosfäärille:
toimivat hiilinieluina
elävät usein mutualistisessa suhteessa muiden tärkeiden lajien kanssa
tuottavat happea ja ravintoaineita muille eliöille
→ arvioilta noin 70% ilmakehän hapesta on peräisin kyseisten levien yhteyttämisestä
Tauteja aiheuttavat tumalliset, toisenvaraiset mikrobit
Taudinaiheuttajamikrobeille yhtenäisiä piirteitä ovat yksisoluisuus, soluseinän puuttuminen, toisenvaraisuus, liikkuminen sekä monistumalla tai jakautumalla lisääntyminen. Taudinaiheuttajamikrobeja ovat esimerkiksi suoliameebat, malarialoisio ja trypanosoma. Niiden elämä jakautuu yleisesti kahteen vaiheeseen: väli-isännässä kehittymiseen ja isäntäeliössä loisimiseen. Jos elinolosuhteet ovat mikrobeille liian haasteellisia, ne voivat vaipua lepovaiheeseen tai kasvattaa itselleen paksumman kuoren.
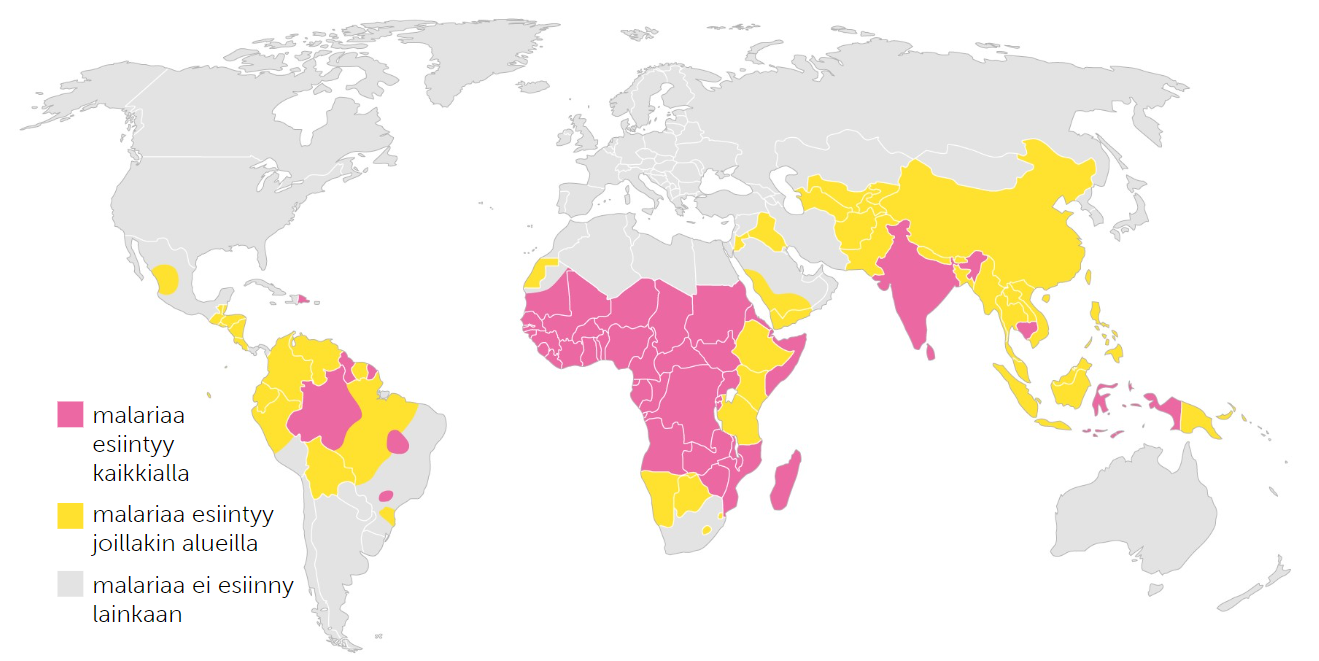
Malarian leviäminen
Malaria on malarialoisiosta leviävä tauti, joka kaata ihmisiä etenkin tropiikin aluella.
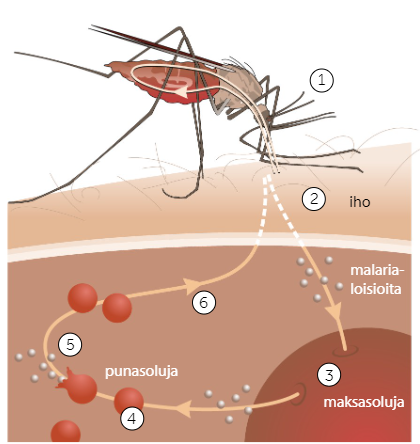
Malarian elinkaaren vaiheet:
Malarialoisio lisääntyy suvullisesti hyttysessä.
Naarashyttynen pistää ihmistä, jolloin malarialoisiot leviävät ihmiseen hyttysen syljen mukana
Malarialoisiot suuntaavat veren mukana maksaan, jossa ne lisääntyvät suvuttomasti monistumalla.
Monistuneet malarialoisiot vapautuvat takaisin verenkiertoon, jossa ne siirtyvät veren punasoluihin. Malarialoisiot jatkavat siellä monistumista.
Kun malarialoisio on monistunut riittäävän monta kertaa, punasolu räjähtää. Räjähtäneen punasolun malarialoisiot lähtevät myrkyttämään uusia punasoluja. OIREET ALKAVAT TÄSSÄ KOHTAA.
Malarialoisio voi myös siirtyä ihmisestä hyttyseen.
Hiiva- ja homesienet
Hiiva- ja homesienien solut ovat hyvin yhtäläisiä sienisolujen kanssa, ja ne kuuluvatkin sienten lohkoon. Eron hiiva- ja homesienien erotetaan kolmella tavalla:
homesienet elävät rihmoissa ja hiivasienet yksisoluisina
hiivasienten soluissa on plasmideja
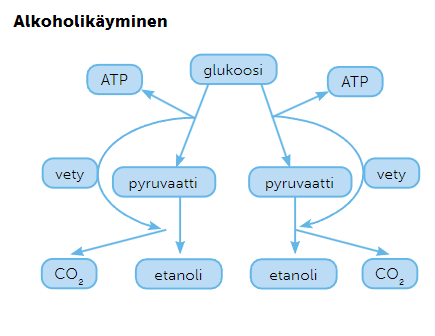
hiivasienet pystyvät tuottamaan energiaa myös hapettomasti, alkoholikäymisen avulla, eli ovat fakultatiivejä eliöitä
Harvat hiiva- tai homesienistä ovat patogeenisiä, mutta jotkin homesienistä tuottavat ihmiselle myrkyllisiä aineita. Älä siis syö homeisia hedelmiä tai leipiä.
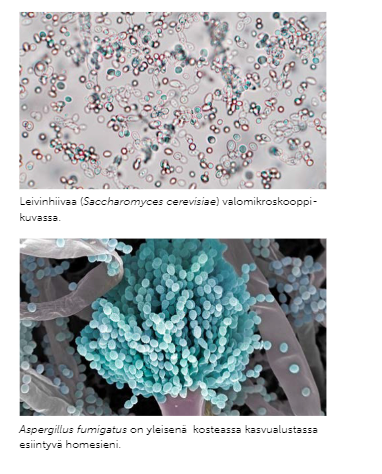
Home- ja hiivasienten merkitys meille
Homesienet tuottavat luonnostaan antibiootteja bakteereja vastaan
Homelajeja hödynnetään juustojen valmistuksessa
Hiivoja käytetään viinin ja oluen valmistuksessa, sekä leivonnassa
4. Virukset lisääntyvät soluissa
Viruksia ei luokitella eliöksi, koska niillä ei ole omaa aineenvaihduntaa. Virukset ovat kuitenkin osa mikrobeja.
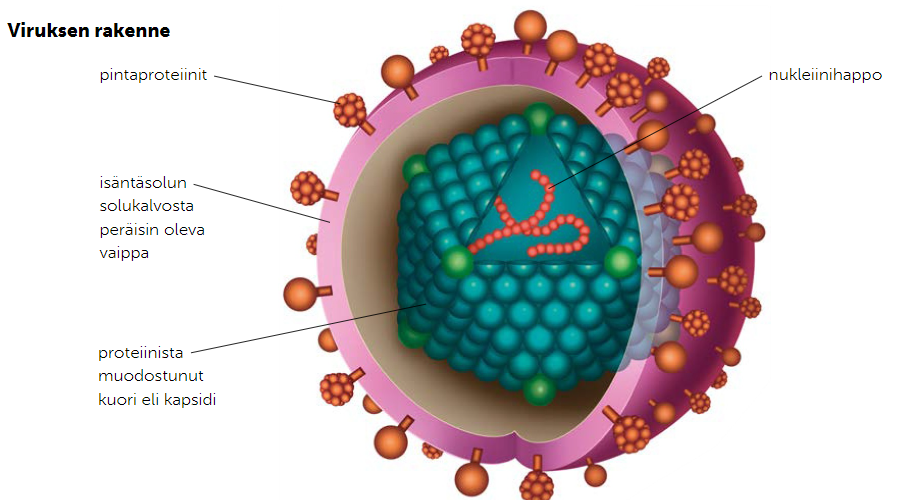
Rakenne
Isäntäsolun solukalvosta kurottu vaippa, jolla voidaan hämätä eliön muita soluja.
Pintaproteiinit, joiden avulla virus tunnisttaa soluja ja kiinnittyy isäntäsoluun
Kapsidi, eli proteeinikuori siojaa viruksen perimää
Perimä, joka voi olla yksi- tai kaksijuosteista, DNA:ta tai RNA:ta (geenejä kymmenistä satoihin)
Lajittelu
Viruksia lajitellaan:
Muodon mukaan
pyöreät virukset, esim. influenssa- ja koronavirus
sukkulamaiset virukset, esim. mosaiikkivirus
kulmikkaat virukset, esim. adenovirus
nauhamaiset virukset, esim. ebolavirus
bakteriofagin muotoiset virukset
Isäntäeliön mukaan
lisääntyykö virus bakteeri-, eläin vai kasvisoluissa
lisääntyykö virus vain yksissä tietyissä soluissa tai tietyn lajin yksilöissä
Perimän mukaan
kaksijuosteinen RNA
yksijuosteinen RNA
positiivinen
negatiivinen
kaksijuosteinen DNA
yksijuosteinen DNA
Lisääntyminen isäntäsolussa
Viruksilla ei ole omaa aineenvaihduntaa, joten ne voivat lisääntyä vain loisimalla isäntäsolussa. Viruksen lisääntyminen isäntäsolussa johtaa yleensä isäntäsolun kuolemaan. Erilaiset virukset lisääntyvät eri tavoin:
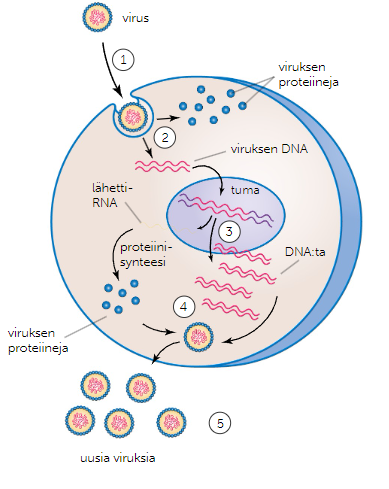
DNA-perimän omaava virus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Perimä vaeltaa tumaan, jossa se liittyy osaksi isäntäsolun omaa perimää. Syntynyttä perimää aletaan kopioimaan tuottaen uutta perimää uusille viruksille, ja valmistaen lähetti-RNA:ta virusten muiden proteiinien tuotantoa varten.
Proteiinisynteesissä valmisteneista proteiineista muodostuu uuden viruksen kapsidi, joka kuroutuu tuotetun perimän ympärille.
Uudet virukset poistuvat isäntäsolusta eksosytoosin avulla, jolloin niiden pinnalle kuorutuu vaippa isäntäsolun solukalvosta.
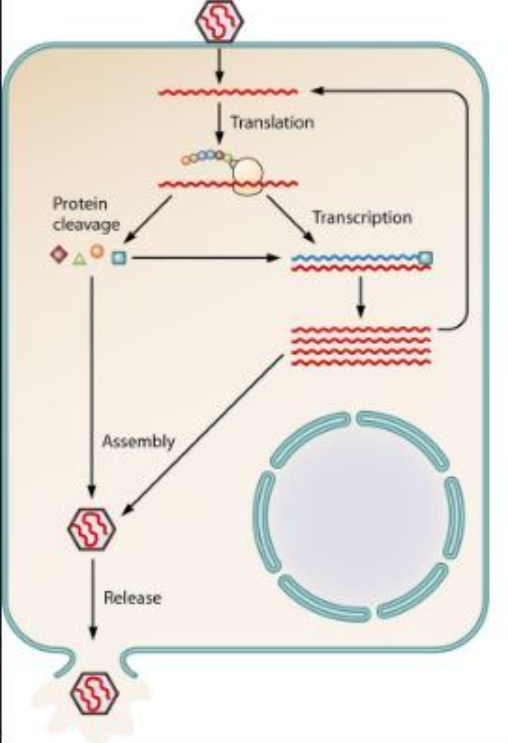
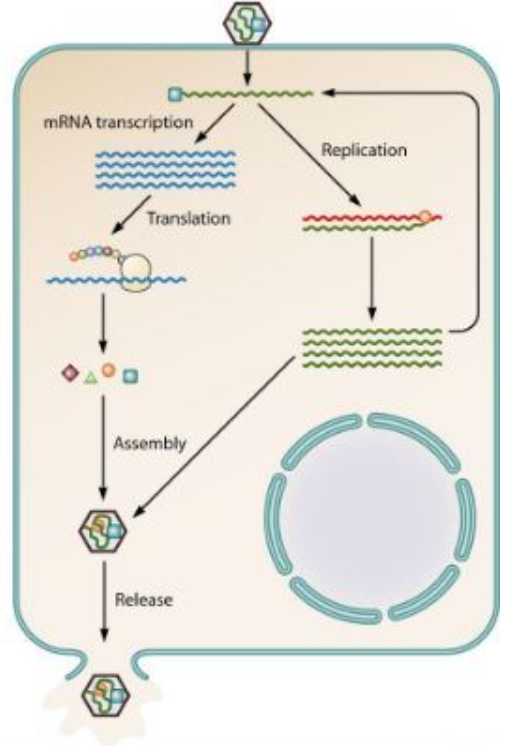
Positiivisen RNA-perimän omaava virus:
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Perimä toimii suoranaisesti lähetti-RNA:n tavoin, jolloin siitä voidaan tuottaa translaatiossa proteiineja tai transskriptiossa uutta RNA:ta
Syntyneet proteiinit muodostavat kapsidin joka kuroutuu tuotetun perimän ympärille.
Virus poistuu solusta eksosytoosilla kuroten samalla ympärilleen vaipan isäntäsolun solukalvosta.
Negatiivisen RNA-perimän omaava virus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Negatiivinen RNA-täytyy kääntää positiiviseksi RNA:ksi ennen kuin sitä voidaan käyttää translaatiossa. Negatiivista RNA:ta myös kopioidaan uusiin uusiin viruksiin.
Tuotetut proteiinit muodostavat kapsidin, joka kuroutuu uuden negatiivisen RNA:n ympärille.
Valmistunut virus poistuu solusta eksosytoosilla kurouen samalla ympärilleen vaipan.
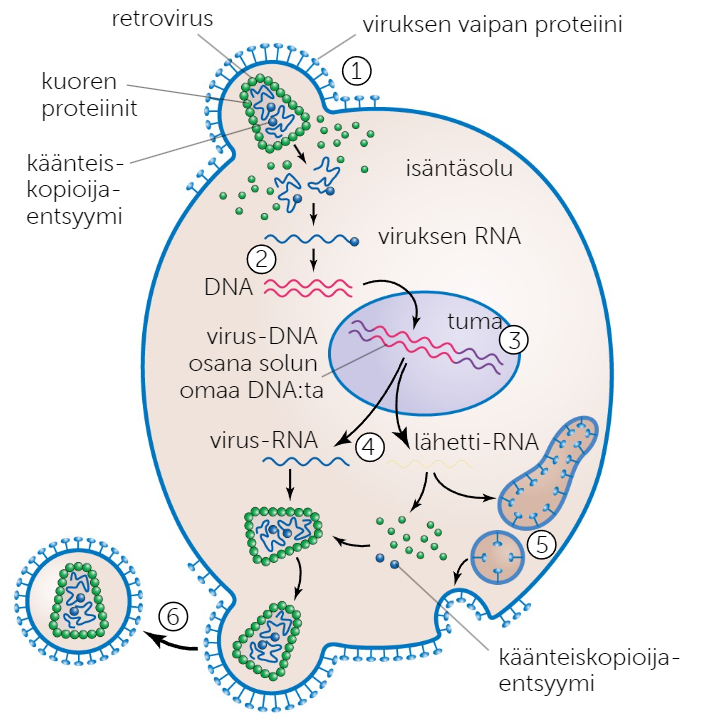
Retrovirus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään. Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Viruksen RNA:ssa on käänteiskopioijaentsyymi, jonka avulla yksijuosteinen RNA voidaan kääntää kaksijuosteiseksi DNA:ksi.
Kaksijuosteinen DNA vaeltaa soluun ja yhtyy tuman perimään DNA:n oman integraalientsyymin avulla. Tumassa aletaan valmistamaan virusta tuottavaa lähetti-RNA:ta.
Syntyneet RNA:t siirtyvät joko valmiiseen uuteen virukseen tai ribosomille, jossa niiden ohjeen mukaan valmistetaan viruksen proteiineja.
Translaatiossa valmistuneet proteiinit siirtyvät valmiille viruksille kapsidin proteiineiksi tai kalvorakkulan sisällä solukalvolle vaipan pintaproteiineiksi.
Valmis virus poistuu eksosytoosin avulla keroen samalla ympärilleen vaipan pintaproteiineineen.
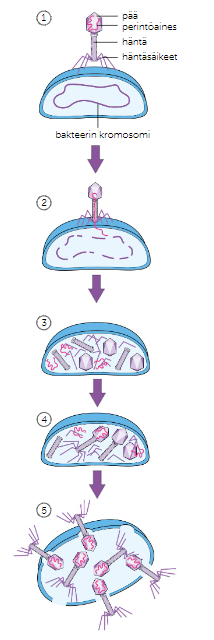
Bakteriofagi
Bakteriofagi tarttuu kiinni bakteerin pintaan.
Bakteriofagi ruiskuttaa perimäänsä bakteerin sisään, jolloin bakteerin oma perimä hajoaa.
Bakteeri muuntu virustehtaaksi, jossa tuotetaan bakteriofagin osia
Valmiit osat kootaan yhteen.
Uudet bakteriofagit poistuvat bakteerista, jolloin bakteeri kuolee.
Perinnöllinen muuntelu ja evoluutio
Virusten evoluutio on nopeaa johtuen jatkuvasta muuntelusta. Kun tautia aiheuttava virus muuntuu, puhutaan uudesta variantista, jolle vanhat antibiootit eivät toimi. Muuntelua viruksissa aiheuttavat:
Geenimutaatiot
→ viruksilla, etenkin yksijuosteisilla RNA-viruksilla tai retroviruksilla, on huono oikolukuaktiivisuus, eli kyky korjata virheellisiä geenejä/nukleotidejä.
→ viruksen perimällä ei ole vastinalleelipareja, joten geenimutaatiot ilmenevät suoraan
→ on arvioitu, ettei ole kahta genotyypiltään samanlaista yksijuosteista RNA-virusta
Rekombinaatio
→ jos samaan soluun päätyy kaksi erilaista virusta, kuten ihmisen influenssavirus ja lintuinfluenssavirus, voivat ne vaihtaa perimää keskenään
→ synnyttää uudenlaisia viruksia uusine vaikutuksineen
→ aiheuttavat pandemioita, eli maailmanlaajuisia tautiepidemioita.
Leviämistavat
Myös virukset esiintyvät zoonooseina, eli eläimistä ihmisiin leviävinä tauteina. Virukset voivat kuitenkin levitä monella muullakin tavalla eläimeltä ihmiselle tai ihmiseltä ihmiselle:
Virusten leviämistä edistävät tiivis asutus, huono hygienia, lämpimät ja kosteat olot, biodiversiteetin väheneminen ja tehoeläintuotanto.
5. Geenitekniikka perustuu tutkimustietoon geenien rakenteesta ja toiminnasta
Geenitekniikalla tarkoitetaan tieteelliseen tutkimukseen pohjautuvia menetelmiä, joissa DNA:ta tai RNA:ta tutkitaan eristämällä, muokkaamalla, analysoimalla tai siirtämällä sitä muihin soluihin. Geenitekniikan avulla voidaan siirtää perimää nopeasti eliöltä tai solulta toiselle, tehdä lääkeaineita ja diagnooseja, korjata geenivirheitä ja laajentaa tietoa eri eliöiden koko perimästä. Geenitekniikan menetelmiä sovelletaan usealla sektorilla, kuten ratkaistaessa terveydenhuoltoon, ravinnontuottoon tai ympäristöön liittyviä ongelmia.
Huomaa käsite-erot:
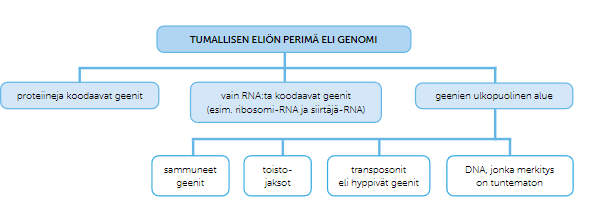
Genomi = eliön koko perimä, eli kaikki yksilön geenit
Geeni = DNA:n toiminnallinen jakso, eli osa, joka sisältää tietoa geenituotteista
Geenin säätelyalue =geenin osa (koostuu tehostajajaksoista ja promoottorista), joka säätelee geenien luentaa
Geenin koodaava alue = geenin osa, joka koostuu geneettistä informaatiota sisältävistä eksoneista ja ei informaatiota sisältävistä introneista
Eksomi = Geenin kaikki eksonit
Geenituote = Eksoneiden informaation perusteella tuotetut RNA:t tai proteiinit
DNA:n rakenne ja kahdentuminen
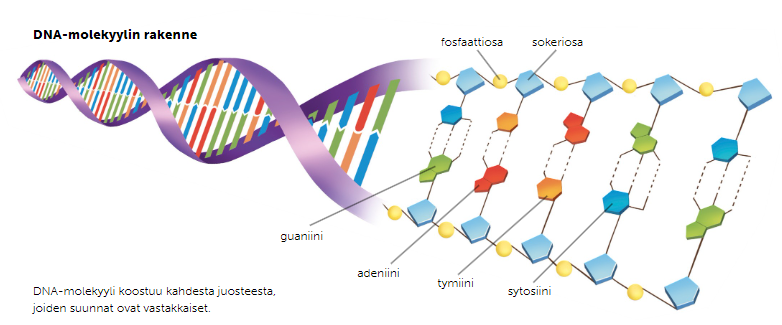
DNA-molekyyli koostuu kahdesta vastakkaissuuntaisesta juosteesta, jotka ovat liittyneet toisiinsa emästen välisin vetysidoksin. DNA-juosteen perusrakenneosa on nukleotidi, joka koostuu fosfaatti-, sokeri- ja emäsosasta. DNA:n sokeriosa on viisikulmainen deoksiriboosisokeri ja emäsosana voi olla joko adeniini, sytosiini, guaniini tai tymiini. Kahden juosteen nukleotidien emäkset kiinnityvät toisiinsa emäsparisäännön mukaisesti, jonka mukaan tymiini ja adeniini liittyvät toisiinsa kahdella vetysidoksella, ja guaniini ja sytosiini toisiinsa kolmella vetysidoksella. Kun DNA-molekyyli on saanut itselleen kaksijuosteisen rakenteen, se kiertyy kuvan mukaiselle kierteelle.
Deoksiriboosisokeri on viisikulmainen sokeri, millä on suuri merkitys DNA:n kahdentumisessa. Kun DNA:ta kahdennetaan tai kopioidaan, uusi nukleotidi voidaan kiinnittää vain sokerin kolmanteen kulmaan, eli OH-päähän. Tämän vuoksi DNA:ta voidaan rakentaa vain 3’-5’-suuntaisesti, mikä tuottaa eron mallijuosteen ja koodaavan juosteen kopioimisen välillä.
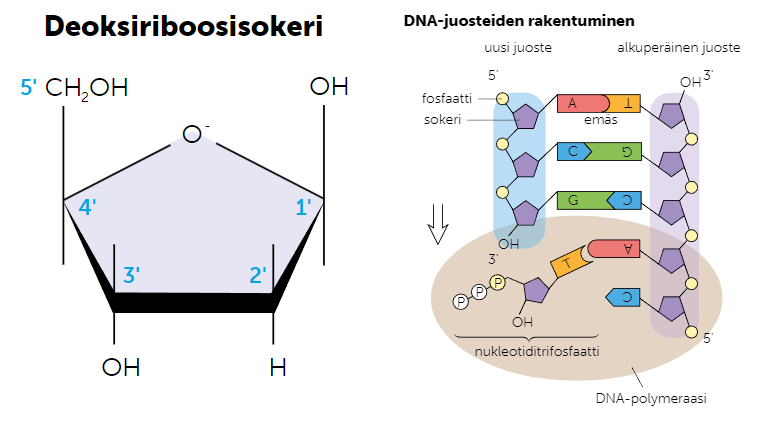
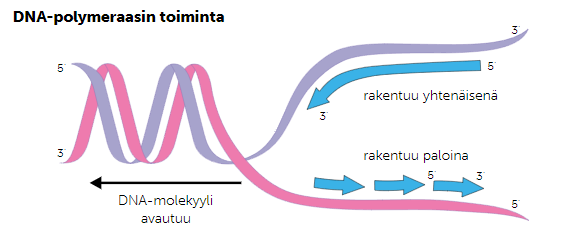
Kun DNA:ta kahdennetaan DNA-polymeraasientsyymi voi kopioida mallijuostetta järjestyksessä nukleotidi kerrallaan, mutta 3’-5’-suunnan säilyttämiseksi koodaavaa juostetta kopioidaan fragmentti kerrallaan juosteen muodostaman silmukan avulla.
DNA:n puhdistus
Kun DNA:ta halutaan eristää näytteestä, se täytyy ensin puhdistaa muista solun rakenneosista. Bakteerien ja arkeonien perimä sijaitsee vapaana solulimassa, toisin kuin tumallisten solujen perimä sijaitsee tumakotelon sisällä. Kun bakteerien tai arkeonien perimää eristetään, solun soluseinä tai mahdollinen kapseli hajotetaan kemikaaleilla ja lämmöllä. Tumallisten DNA-molekyylien käsittelemiseksi kudokset ja solut on hajoitettava mekaanisesti, ja solun rasvarakenteet (kuten solukalvo) on hajoitettava kemiallisesti liuottimien avulla. Tumallisten DNA-molekyylit ovat kiertyneet histoniproteiinien ympärille, jotka poistetaan proteaasientsyymien avulla. Kun DNA on saatuu puhdistettua muista solun osista, se sakkautetaan vielä alkoholilla.
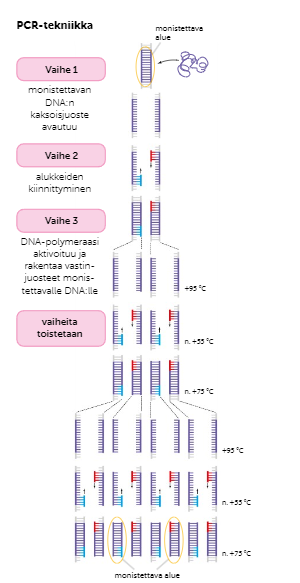
PCR-tekniikka
Kun eliön DNA:ta on saatu puhdistettua, se täytyy monistaa ennen kuin sitä voidaan alkaa tutkia. DNA:ta voidaan monistaa bakteerin plasmidissa tai PCR-laitteella.
PCR-laitteeseen asetetaan pätkä tutkittavaa DNA:ta, nukleotidejä, DNA-alukkeita ja DNA-polymeraasientsyymejä. PCR-tekniikka jakautuu kolmeen osaan:
Kun kaikki tarvittavat tuotteet on laitettu PRC-laitteen koeputkeen, lämpötila nostetaan 95 asteeseen. Tällöin DNA-molekyylin juosteiden väliset vetysidokset katkeavat, ja muostuu kaksi toisistaan kokonaaan erillä olevaa DNA-juostetta.
Lämpötila lasketaan noin 55 asteeseen, jolloin DNA-alukkeet voivat kiinnittyä monistettaviin DNA-pätkiin. DNA-alukkeet ovat noin 20-30 nukletidin mittaisia, ja tilattavissa laboratorioista.
Lämpötila nostetaan noin 75 asteeseen, jolloin DNA-polymeraasientsyymit voivat kiinnittyä monistettaviin DNA-juosteisiin. DNA-polymeraasientsyymi kopioi DNA-pätkiä 3’-5’-suuntaisesti liittäen vapaita nukleotidejä kopioitavaan juosteeseen emäspariperiaatteen mukaisesti.
Vaiheita toistetaan noin 30 kertaa, jolloin DNA:ta on riittävä määrä tutkimuksiin.
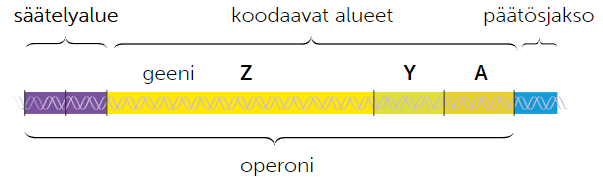
Geenien rakenne on erilainen tumallisilla ja tumattomilla eliöillä
Bakteerin geenien rakenne
Bakteerien DNA koostuu pitkälti geeneistä, jotka koostuvat säätelyaluista ja koodaavista alueista. Koodaavat alueet sisältävät vain eksoneita, eli geenettistä informaatiota sisältäviä osia. Bakteerien säätelyalueen merkistystä vähentävät ympäristötekiöiden vaikutus, koska bakteerien on pystyttävä reagoimaan ympärsitössä tapahtuviin muutoksiin herkästi. Säätelyalueen ja koodaavien alueiden muodostamaa kokonaisuutta kutsutaan operoniksi.
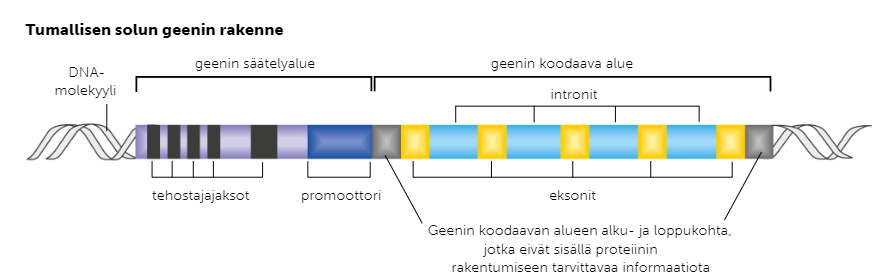
Tumallisten geenien rakenne
Tumallisten geenejä on DNA:ssa harvemmin. Geenit ovat rakenteeltaan monimutkaisempia, mutta koostuvat kuitenkin samalla tavalla säätelyalueesta ja koodaavasta alueesta. Säätelyalue koostuu tehostajajaksoista, jotka säätelevät geenien luentaa, ja promoottorista, johon RNA-polymeraasi kiinnittyy lukiessaan geeniä. Koodavalla alueella vuororttelevat informaatiota sisältävät eksonit ja poissilmukoitavat intronit.
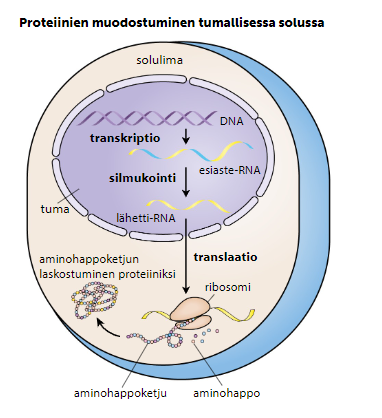
Geneettisen informaation perusteella rakennetaan proteiineja
Proteeinit jaetaan toiminnaltaan neljään rakennetasoon:
primaariproteiini (ei toiminnallinen)
sekundaariproteiini (ei toiminnallinen)
tertiaariproteiini (toiminnallinen)
kvaternaariproteiini (toiminnallinen)
Primaariproteiinit valmistuvat proteiinisynteesissä (kuva alla), ja proteiinien toimintaa edistetään jatkokäsittelyllä solulimakalvostossa tai Golgin laitteessa.
Bakteereissa proteiinisynteesi on geenien rakenteen vuoksi lyhyempi ja yksinkertaisempi:
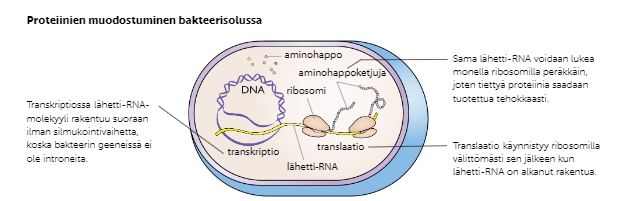
Entsyymejä hyödynnetään geenitekniikassa
Entsyymit ovat biokemiallisten reaktioiden biokatalyyttejä, joita hyödynnetään myös geenitekniikassa. Entsyymejä käytetään mm. DNA:n kahdentamiseen, monistamiseen, katkaisemiseen, liittämiseen ja puhdistamiseen. Tärkeimpiä entsyymejä geenitekniikassa ovat käänteiskopioija-, liittäjä- ja katkaisuentsyymit sekä proteaasit.

Katkaisu- ja liittäjäentsyymit
Katkaisuentsyymit ovat entsyymejä, jotka ovat erikoistuneet katkaisemaan DNA-juostetta. Katkaisuentsyymejä saadaan eristettyä bakteereista, ja ne ovat erikoistuneet kukin tietyn emäsjärjestyksen katkaisuun. Geenitekniikassa käytettävät katkaisuentsyymit jättävät katkaistavan kaksijuosteisen DNA:n kummallekin juosteelle muutaman parittoman nukleotidin niin, että juosteeseen on helpompi liittää toista juostetta ligaasin, eli liittäjäentsyymin avulla.
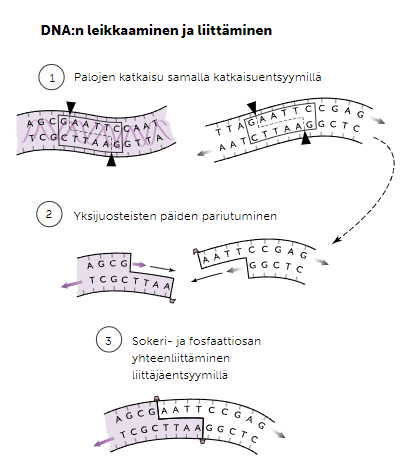
Katkaisu- ja liittäjäentsyymejä hyödynnetään yhdistelmä-DNA-tekniikassa, joka on menetelmä, jossa vierasta geeniä monistetaan bakteerin plasmidissa. Plasmidi katkaistaan samalla katkaisuentsyymillä vieraan geenin ja antibioottiresistanssin kanssa, jolloin vieras geeni ja antibioottiresistanssi voidaan liittää liittäjäentsyymillä plasmidin katkaisukohtiin.
Antibioottiresistanssi liitetään plasmidiin, koska se helpottaa vieraan geenin sisältävien bakteerien tunnistamisessa, kun bakteerit asetetaan samalle petrimaljalle antibiootin kanssa.
→ resistanssin sisältävät bakteerit selviävät ja muut kuolevat (=antibioottivalinta)
Plasmidi toimii meneltelmässä vektorina eli “kuljettajana”, joka toimii työkaluna geenien monistamisessa
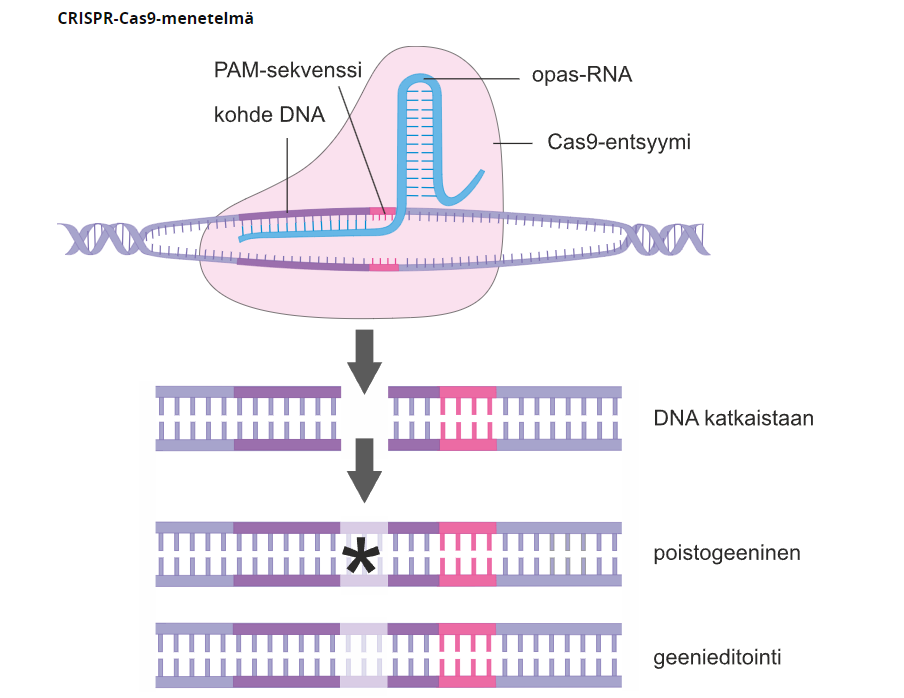
Toinen DNA:n katkaisumenetelmä on CRISPR-tekniikka, jossa hyödynnetään “geenisaksia”, eli CRISPR-Cas-entsyymiä. Cas-entsyymi on osa bakteerien puolustautumista bakteriofageja vastaan. CRISPR-tekniikassa DNA-juoste voidaan katkaista tarkasti halutusta kohdasta entsyymin ja opas-RNA:n avulla.
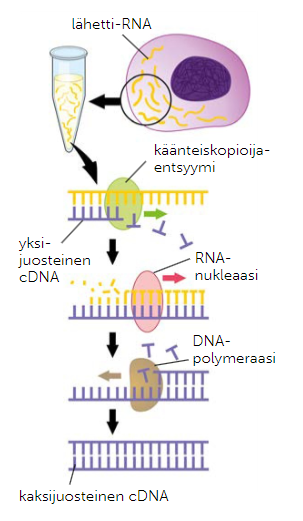
Käänteiskopioijaentsyymi
Käänteiskopioijaentsyymi on retroviruksissa esiintyvä entsyymi, joka pystyy kääntämään yksijuosteisen RNA:n kaksijuosteiseksi DNA:ksi. Sitä voidaan hyödyntää myös geenitekniikassa, kun halutaan tutkia RNA:ta. Geenitekniikassa paljon käytetty käänteiskopioijaentsyymi kääntää yksijuosteisen RNA:n vastin-DNA:ksi, eli yhdeksi DNA-juosteeksi, joka ei sisällä introneita. Yksijuosteista vastin-DNA:ta voidaan näin kopioida CPR-tekniikan avulla.
6. DNA-tietoa kerätään ja käytetään monin tavoin
Kun DNA on eritetty ja puhdistettu, sitä voidaan alkaa tutkimaan. Sekvensoinnilla tarkoitetaan DNA:n tai RNA:n emäsjärjestyksen selvittämistä, ja se voidaan suorittaa monilla eri tavoilla.
DNA-palojen erottelu
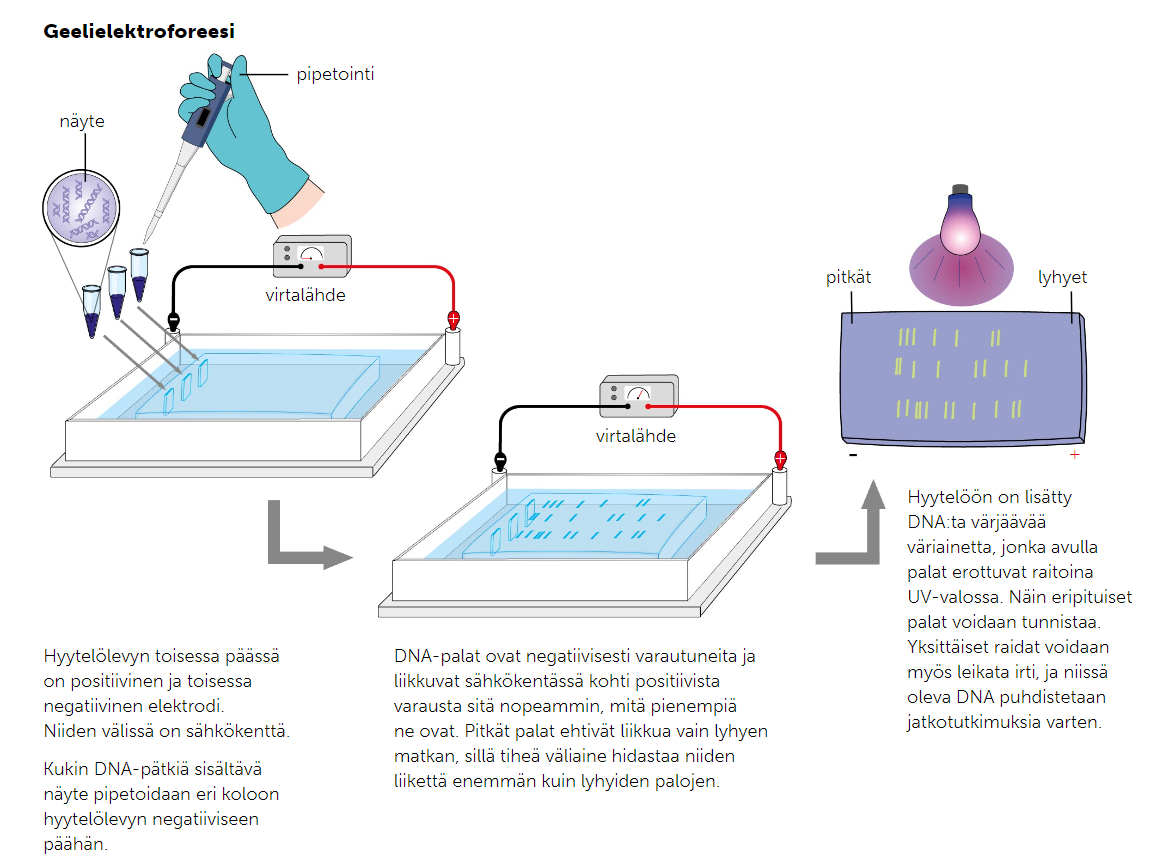
1. Geelielektroforeesi
Geelielektroforeesi perustuu eri mittaisten DNA-pätkien erotteluun sähkövarauksen avulla. Geelielektroforeesissa eri mittaiset DNA-pätkät asetetaan agaroosigeelin peittämälle alustelle, johon on kytketty sähkövaraus. Kun DNA-pätkät on pipetoitu alustan negatiiviselle puolelle, aloitetaan elektroforeesiajo.
DNA-palat ovat negatiivisesti varautuneita fosfaattirunkonsa vuoksi
→ sähkövaraus saa ne liikkumaan kohti alustan positiivista napaa
Agaroosigeelin verkkomainen rakenne hidastaa pidempien DNA-pätkin liikettä
→ lyhyemmät DNA-pätkät liikkuvat elektroforeesiajon aikana lähemmäs plusnapaa kuin pidemmät
Kun elektroforeesiajo on päättynyt, DNA-pätkät voidaan nähdä alustalla UV-valon kanssa hyytelöön lisätyn väriaineen ansiosta
Saatuja tuloksia voidaan verrata mallinäytteeseen, esim. isyystestissä
Geelielektroforeesi ei kerro emäsjärjestystä!!
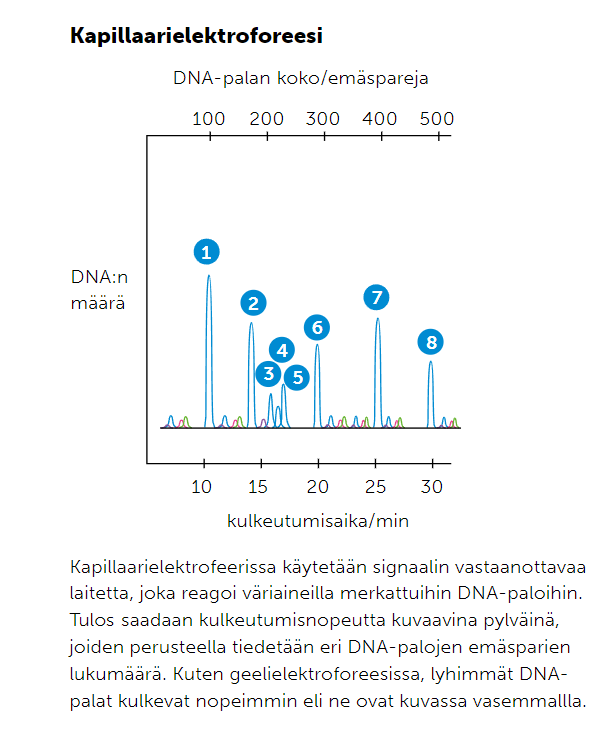
2. Kapillaarielektroforeesi
Kapillaarielektroforeesi on geelielektroforeesia nopeampi menetelmä, jossa tutkittavat DNA-palat kulkevat pitkin ohutta kapillaariputkea. DNA-palat on värikoodattu, jolloin niiden etenemistä voidaan seurata reaaliaikaisesti seurantalaitteen avulla.
DNA-jakson ja alleelien tunnistaminen
1. Koetin ja DNA-siru
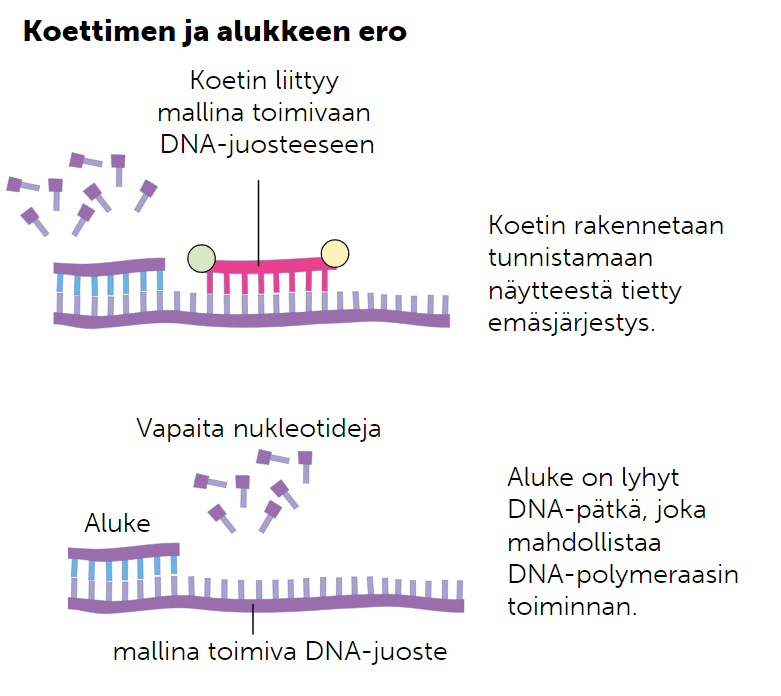
Koetin on lyhyt pätkä yksijuosteista RNA:ta tai DNA:ta, jonka tiedetään olevan jotakin tietty tautialleeli. Koettimen avulla voidaan selvittää, onko henkilöllä koetinta vastaava tautialleeli. Jos henkilöllä on kyseinen alleeli, koetin kiinnittyy antaen värireaktion, joka johtuu koettimeen kiinnitetystä fluerosoivasta leimasta.
DNA-siru on lasi- tai muovilevy, jonka pinnalla on useita, jopa tuhansia koettimia. Kun DNA-sirua verrataan tutkittavaan perimään, saadaan samalla kertaa selville useita mahdollisia tautialleeleja.
2. PCR ja elektroforeesi
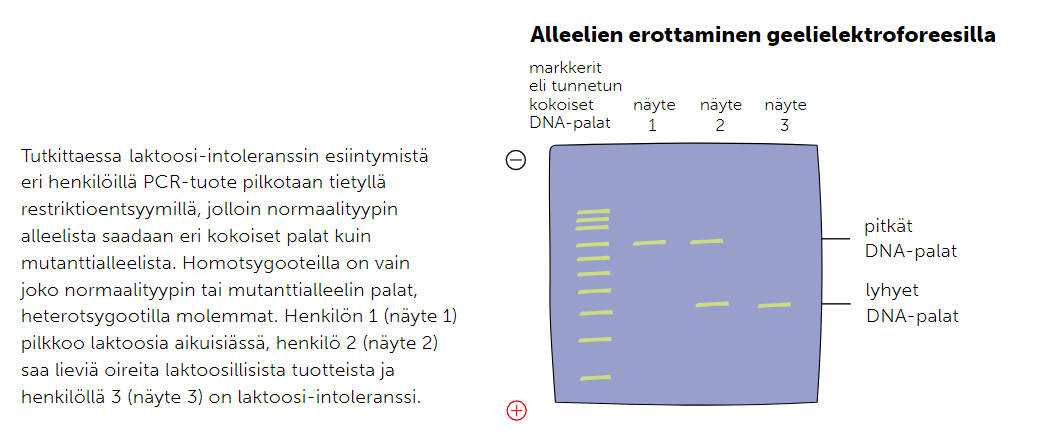
Jos halutaan selvittää, onko jollakin henkilöllä jokin alleeli resessiivisenä homo- tai heterotsygoottina tai dominoivana ominaisuutena, voidaan käyttää PCR-tekniikkaa ja elektroforeesia yhdessä. Jotta alleeleja voidaan selvittää, tarvitaan monistettuja ja katkaisuentsyymillä katkottuja DNA-pätkiä sekä mallisarja, johon voidaan selkeästi verrata tuloksia.
3. Reaaliaikainen PCR
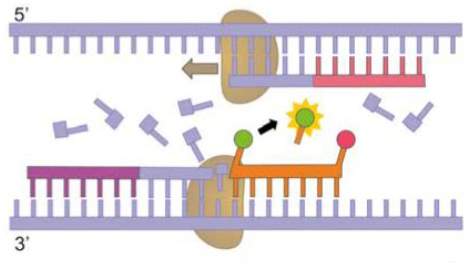
Reaaliaikaisessa PCR:llä voidaan tunnistaa alleeleja ja DNA-jaksoja. Reaaliaikainen PCR toimii kuin PCR, mutta mukana on koettimia. Koettimet kiinnittyvät DNA-juosteeseen samalla tavalla kuin alukkeetkin. Kun DNA-polymeraasientsyymi on aloittanut DNA:n monistamisen alukkeesta eteenpäin 3’-5’-suuntaisesti, törmää se jossakin vaiheessa koettimeen. Kun DNA-polymeraasi törmää koettimeen, koetin vapauttaa värileimansa. Irronnut värileima kirjaantuu signaalinlukulaitteeseen, joka laskee koettimien löytämien kohtien määrää ja paikkaa.
DNA:n emäsjärjestyksen selvittäminen
Rinnakkaissekvensointi
Rinnakkaissekvensoinnissa tutkittava DNA monistetaan, ja monistetut DNA:t pilkotaan paloiksi. RInakkaissekvensointia suorittava laite lukee leikatut palat, ja selvittää DNA-jaksojen emäsjärjestyksen palojen päällekkäisyyksien avulla.
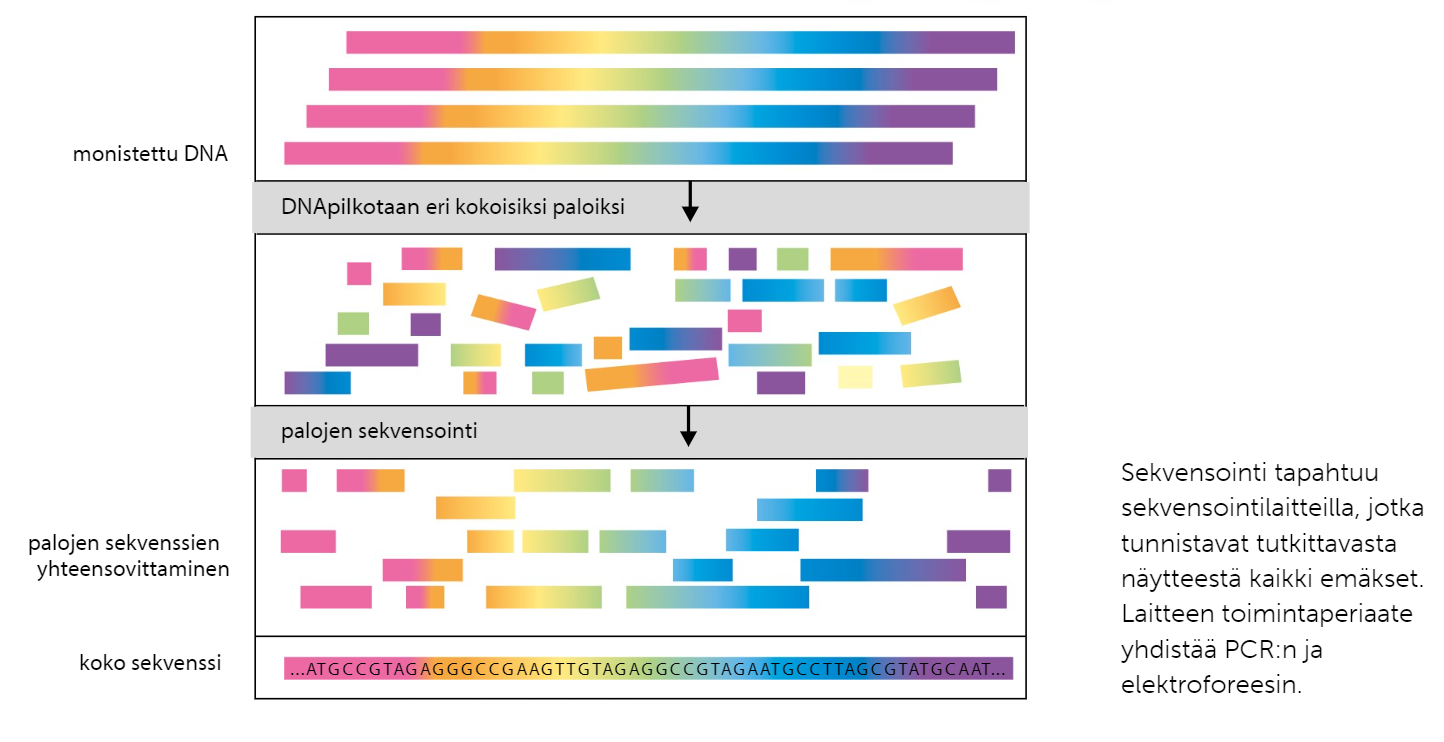
Sekvensoinnilla voidaan selvittää koko genomia, eksomia tai tiettyjä geenejä.
https://www.biologiikka.com/2019/01/30/geenitekniikka
7. Muuntogeenisiä eliöitä tuotetaan ja eliöitä kloonataan usealla tavalla
Muuntogeenisellä eliöllä tarkoitetaan eliötä, jonka perimä on muutettu geenitekniikan avulla. Muuntogeeniset eliöt jaetaan siirto- ja poistogeenisiin eliöihin. Siirtogeeninen eliö on eliö, joka on saanut itselleen vierasta perimää geenisiirrossa, kun taas postogeeninen eliö on eliö, jonka omaa perimää on muokattu niin, että sen jokin geeni on tehty toimimattomaksi.
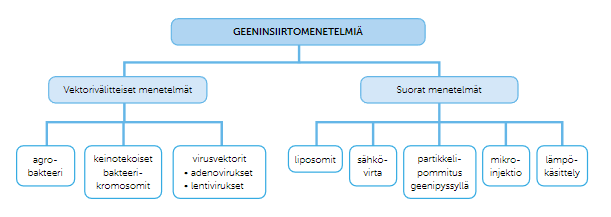
Geeninsiirtotekniikat jaetaan suoriin ja vektorivälitteisiin, sekä kasvisoluun ja eläinsoluun tehtäviin geeninsiirtoihin. Suoralla geeninsiirtomeneltelmällä tarkoitetaan geeninsiirtomenetelmää, jossa geeni saadaan siirrettyä suoraan eliön soluun ilman välikäsiä, kun taas vektorivälitteisessä geeninsiirtomenetelmässä siirtoon käytetään niin sanottua kuljettajaa. Se, mitä geeninsiirtomenetelmää käytetään riippuu siitä, millainen kohdesolu ja -eliö on.
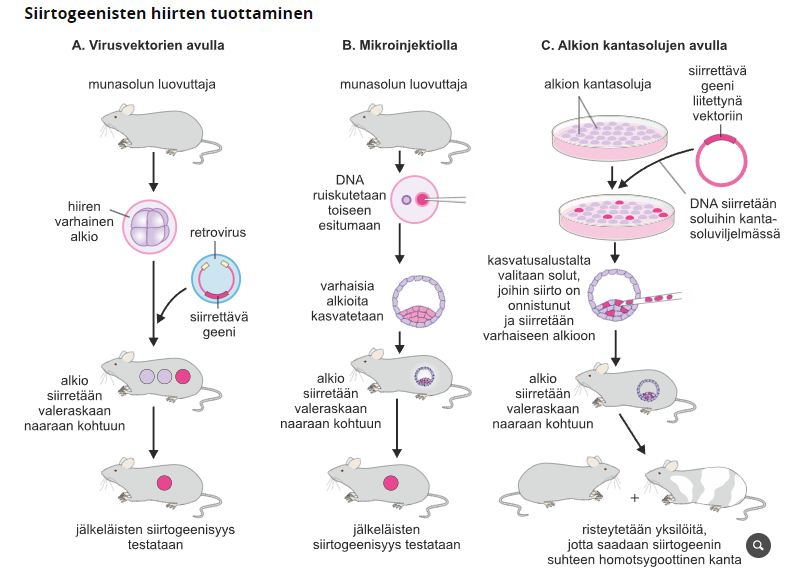
Geenien siirtämisen ja jalostamisen tarkoituksena on uusien lajien kehittäminen, niin että ne ovat kestävämpiä tai tuotteliaampia, sekä puuttelisten ominaisuuksien parantaminen. Siirtogeenisiä eliöitä voidaan myös käyttää lääketieteellisessä tutkimuksessa sekä lääkkeiden tai proteiinien tuotannossa, mutta tällöin siirtogeenisyyttä harjoitetaan yleensä soluviljelmissä. Geenitekniikan soveullukset vaativat kuitenkin välillä uhrikseen myös koe-eläimiä, joista yleisempiä ovat hiiret. Tutkimuskäyttöön kehitettyjä muuntogeenisiä hiirilinjoja pidetään yllä pakastettuina alkioina tai siittiöinä useissa laboratorioissa, joista tutkijat pystyvät tilaamaan niitä käyttöönsä.
Vektorivälitteiset geeninsiirtomeneltelmät
1. Yhdistelmä-plasmidi
Yhdistelmä-plasmidi on yhdistelmä-DNA-tekniikalla tuotettu plasmidi, eli plasmidi, johon on siirretty jonkin toisen eliön geenejä. Kun tumallisen eliön geenejä siirretään bakteerin plasmidiin, täytyy se suorittaa niin, että geenin lähetti-RNA käännetään vastin-DNA:ksi, joka voidaan liittää plasmidiin. Liitettyä DNA-pätkää kutsutaan insertiksi.
Yhdistelmä-plasmidia käytetään yleisesti proteiinien tuottamiseen tai geenien monistamiseen. Hiivoihin lisätyissä yhdistelmä-plasmideissa tutotettaan esimerkiksi insuliinia.
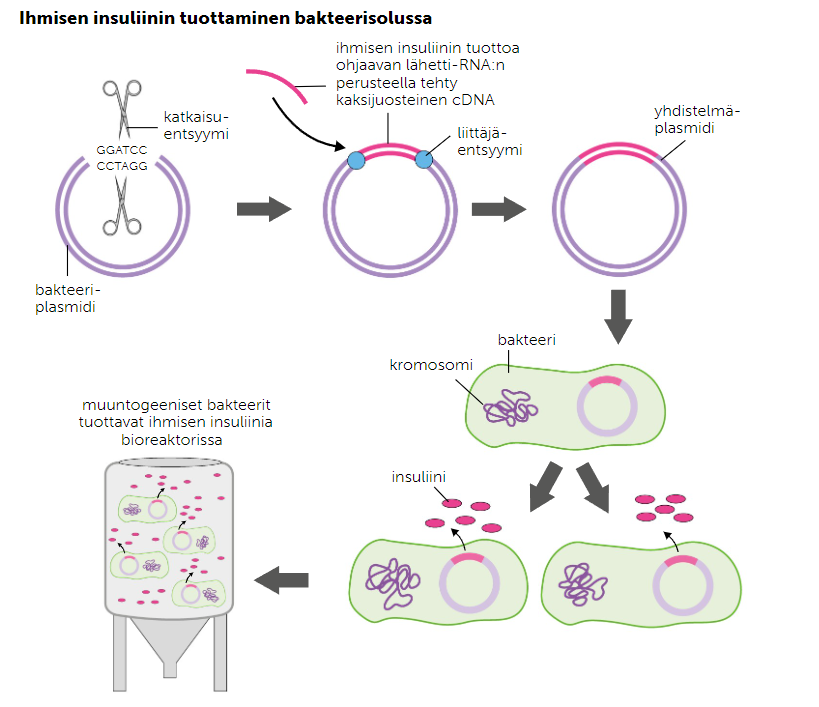
Agrobakteerin palsmidia käytetään usein yhdistelmä-plasmidina, kun jokin geeni halutaan siirtää osaksi kasvisolua. Agrobakteeri infektoi luontaisesti useita eri kasvilajeja liittämällä perimänsä osaksi isäntäsolun perimää, joka alkaa tuottamaan taudille typillisiä äkämiä. Kun akrobakteerin perimää muokataan niin, että taudin aiheuttava geeni sammutetaan, ja perimään liitetään haluttu geeni, voidaan geenejä siirtää kasvisoluille kasvatusmaljalla.
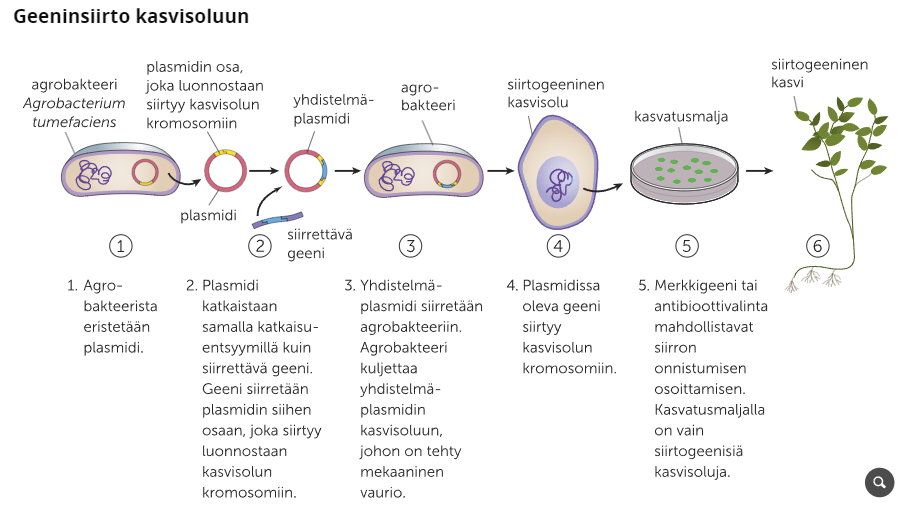
2. Virusvektorit
Viruksia käytetään vektoreina etenkin, kun halutaan tehdä geenin siirtoja eläinsoluille. Viruksilla on luonnostaan kyky tunkeutua isäntäsolunsa sisään ja liittää perimäänsä osaksi isäntäsolun perimää. Jotta viruksia voidaan käyttää vektoreina, viruksen omaan perimään on liitettävä haluttua geeniä, geeni, joka normaalisti aloittaisi viruksen tuottaman infektion ja viruksen lisääntymisen, on muutettava toimimattomaksi.
Tyypillisiä virusvektoreita ovat muuntogeeniset adeno - ja lentivirukset.
Suorat geeninsiirtomenetelmät
1. Mikroinjektio
Mikroinjektiossa jonkin geenin kopioita liitetään hedelmöittyneeseen munasoluun, jossa siittiön ja munasolun tumat eivät ole vielä yhdistyneet, eli alkion perimä ei ole vielä muodostunut. Geenin kopiot liitetään toiseen esitumista (joko munasolun tai siitiön tumaan) mikroskooppisen pienellä lasiputkella. Jos geeninsiirto on onnistunut geeni siirtyy osaksi alkion perimää, kun jakautumana alkanut munasolu siirretään hormoneilla valeraskaaksi tehtyyn naiseen.
Mikrohedelmöityksessä siittiö liitetään munasoluun samalla tavalla mikroskooppisen pienellä lasiputkella. Mikrohedelmöitys voidaan toteuttaa, jos siemennesteen laatu estää raskauden.
2. Liposomit
Liposomit ovat fosfolipidikalvorakkuloita, joiden sisällä on siirrettävän geenin DNA:ta. Liposomien kalvorakkulan rakenne on samanlainen eläinsolun soluseinän rakenteen kanssa, joten liposomin on helppo sulautua solun sisään vapauttaen kantamansa geeni solun solulimaan.
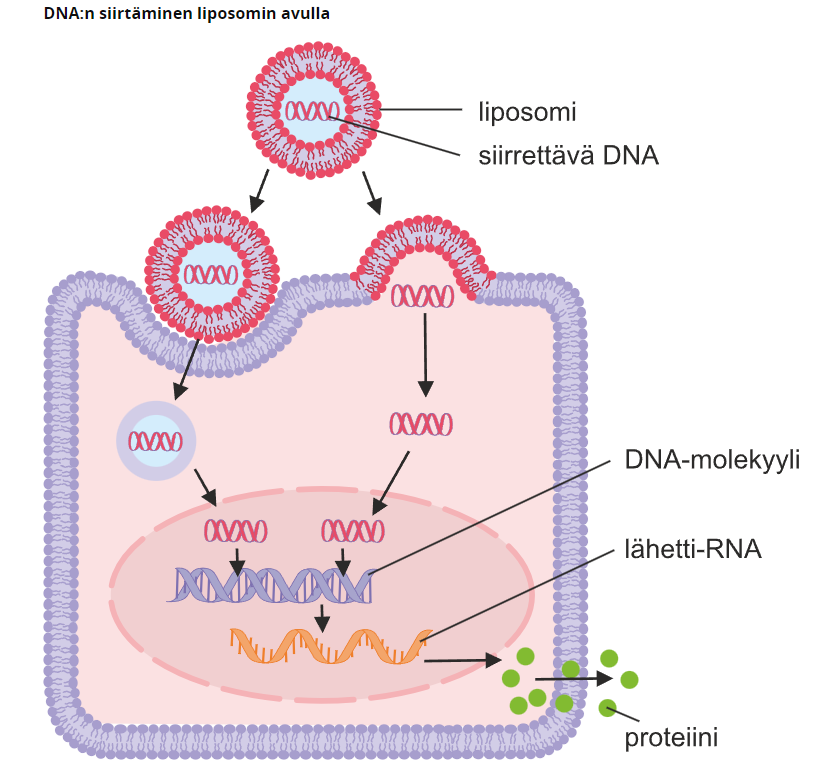
3. Sähköimpulssit ja lämpökäsittely
Sähköimpulsseilla voidaan tehostaa geenin pääsyä osaksi eläinsolua soluviljelmässä, ja lämpökäsittelyllä voidaan heikentää kasvi- tai sienisolun solusoluseinää niin, että esimerkiksi mikroinjektio on mahdollista.
4. Geenipyssy
Geenipyssyllä tarkoitetaan menetelmää, jossa haluttua geeniä ammutaan kasvin kasvisoluihin. Pyssyyn lisätään halutulla geenillä päällystettyjä kultapartikkeleja, jotka ammutaan sattumanvaraisesti kasvia kohti toivoen, että geenit löytäisivät tiensä kasvin kasvisolujen tumaan, eivätkä esimerkiksi viherhiukkasiin tai mitokondrioihin.
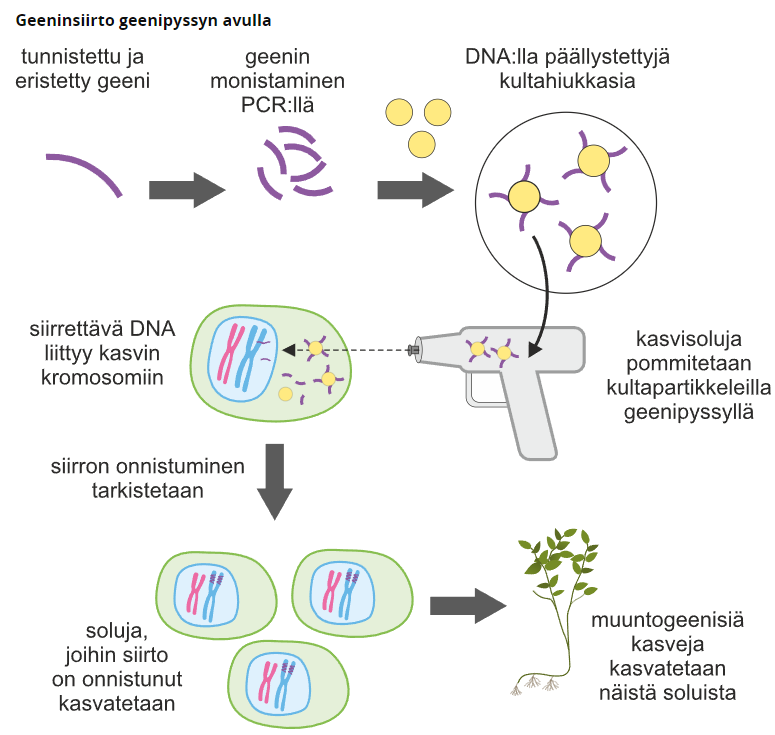
Poistogeenisyys ja poistogeenisen eliön tuottaminen
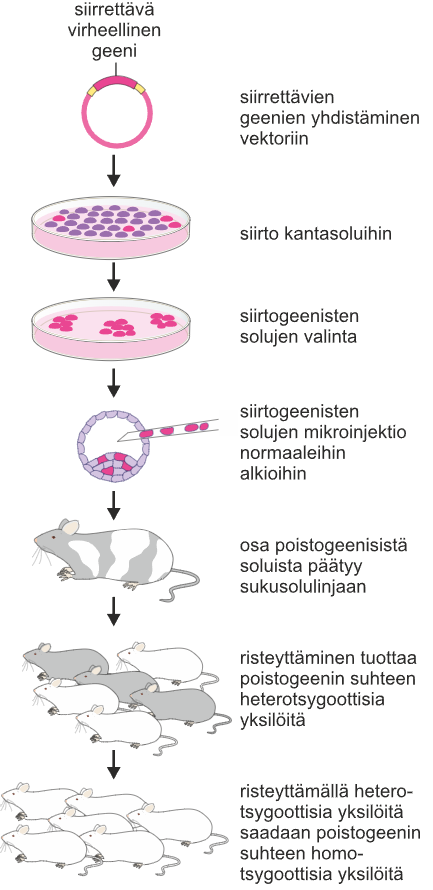
Kantasolujen muokkaaminen
Poistogeeninen eliö on eliö, jonka jokin geeni on tukahdetettu toimintakyvyttömäksi, jotta saadaan tietoa, mihin kaikkeen geeni vaikuttaa. Yleisimmin käytetty poistogeeninen nisäkäs on hiiri.
Poistogeenistä hiirtä tehdessä hiiiren kantasoluja muokataan kasvatusmaljalla niin, että hiiren toimivat geenit korvataan viallisilla. Tämän jälkeen poistogeeniset kantasolut siirretään hiiren alkioihin, jotka saavat perimäänsä viallisia/toimimattomia geenejä. Kun tämän syntyneen sukupolven hiiriä risteytetään keskenään, saadaan sukupolvi, joka ilmentää suuremmalla varmuudella poistogeenisiä geenejä.
CRISPR-tekniikka
CRISPR-tekniikalla voidaan
muokata geenin viallisia nukleotidejä
siirtää eliöön pätkä DNA:ta
sammuttaa jonkin geeni
Kun CRISPR-tekniikkaa hyödynnetään poistogeenisyydessä täytyy tuntea poistettavan geenin emäsjärjestys. Kun emäsjärjestys tunnetaan voidaan tuottaa opas-RNA, joka hybridisoituisi muokattavan geenin kanssa. Valmistetaan opas-RNA-cas-entsyymi-kompleksi, joka siirretään sähköimpulssilla hedelmöittyneeseen munasoluun. Kun opas-RNA pariutuu etsityn geenin kanssa, cas-entsyymi katkaisee DNA:n opas-RNA:n osoittamasta paikasta poistaen geenin PAM-sekvenssin, eli muutaman nulkeotidin mittaisen alueen DNA-juosteessa. Tämän jälkeen solu korjaa DNA-juosteen geenieditoinnilla, jolloin lopputuloksena on poistogeeninen solu.
Kloonaaminen
Kasvien kloonaaminen
Kasvien kloonaaminen on helppoa, koska kasvit tekevät sitä jo luonnostaankin lisääntyessään suvuttomasti. Jos kasvin klooneja halutaan kasvattaaa laboratoriossa, eristetään kasvista soluja, joita aletaan kasvattaa solukkoviljemissäkasvatusalustoilla. Kasvisolun jakautumista ja kasvin kasvamista tehostetaan glukoosilla, ravinteilla ja kasvihormoneilla.
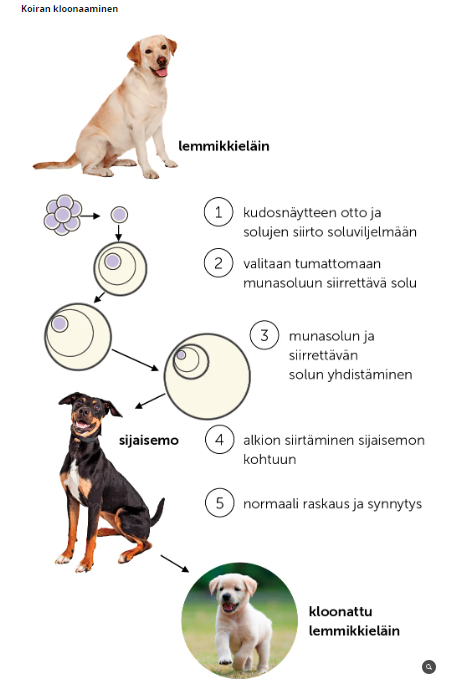
Eläinten kloonaaminen
Eläinten kloonaaminen on kasvien kloonaamista monimutkaisempaa. Eläimiä voidaan kloonata kahdella tavalla:
Tumansiirtotekniikka
= luovuttajan hedelmöittymättömästä munasolusta poistetaan tuma ja tilalle laitetaan kloonattavan yksilön erikoistuneen solun tuma
ei kovin onnistunut tai tuottelias tekniikka → paljon kuolleisuutta
harvemmin käytössä
Kantasolujen hyödyntäminen
= luovuttavan hedelmöittymättömästä munasolusta poistetaan tuma, jonka tilalle laitetaan kloonattavan yksilön solu, joka on uudelleen ohjelmoitu kantasoluksi
onnistuneempi menetelmä, tosin tieteellisessä tutkimuksessa harvaltaan käytetty
8 DNA-tietoa käytetään yksilöiden ja lajien tunnistuksessa
Ihmisiä voidaan geneettisten näytteiden lisäksi tunnistaa biometrisistä ominaisuuksista, eli biologisista ominaisuuksista sekä DNA:n toistojaksojen avulla. Jos halutaan tutkia lajeja ja lajien välisiä eroja voidaan paneutua esimerkiksi DNA-viivakoodeihin.
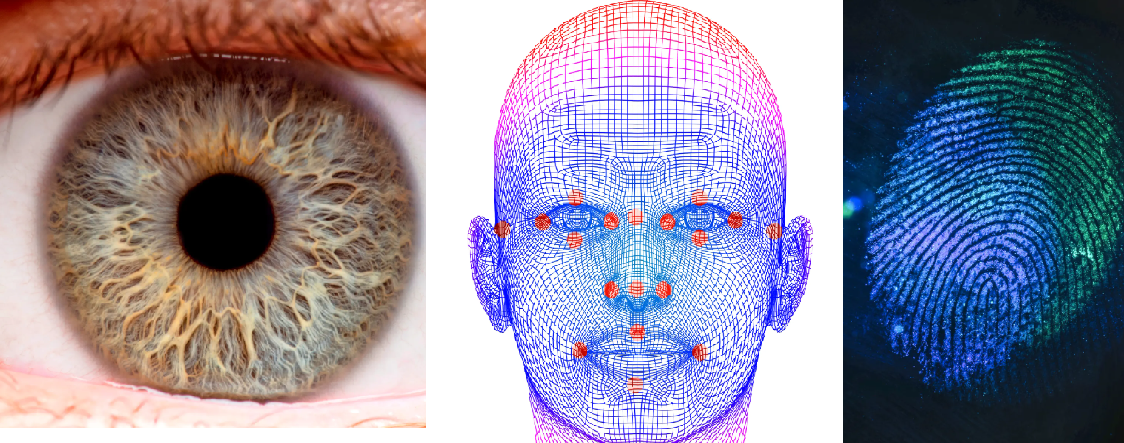
Biometriset tunnisteet
Biometriset tunnisteet ovat ihmisen biologisiin ominaisuuksiin liittyviä yksilöllisiä piirteitä, kuten sormenjäljet tai silmän iiris. Biometrisiä tunnisteita hyödynnetään rikostutkimuksen lisäksi esimerkiksi puhelimien tai kulkutilojen lukituksen avaamisessa tai passeissa. Passia, jossa hyödynnetään biometrisiä tunnisteita, eli kasvojen tunnistusta ja sormenjälkeä, kutsutaan biopasseiksi.
Sormenjälkien tutkimuksessa kiinnitetään huomiota ihon harjanteiden muodostamiin kuvioihin, silmän iiriksiä tutkittaessa iiriksen kuviointiin ja väritykseen, ja kasvon tunnistuksessa silmien, nenän ja suun mittasuhteisiin. Jopa identtisillä kaksosilla nämä poikkeavat toisistaan, vaikka perimä olisikin samanlainen.
DNA-tunnisteet
Kun halutaan tunnistaa joku ihminen tarkasti kovalla varmuudella käytetään DNA-tunnisteita. DNA-tunnisteet, jotka muodostavat henkilön DNA-profiilin, perustuvat geenien ulkopuolisilla alueilla oleviin toistojaksoihin. Toistojaksot ovat 2-6 emäsparin mittaisia DNA-pätkiä, jotka toistuvat useamman kerran yksilöstä riippuen. Jonkun toistojaksona voisi olla esimerkiksi AGCAAGCAAGCAAGCAAGCAAGCAAGCA, jossa emäsparijoukko AGCA toistuu kuudesti. Toki oikeasti emäsparijoukot toistuvat kymmeniä tai satoja kertoja. Mahdollisuus siihen, että kahden henkilön DNA-profiili olisi samanlainen on noin 1 miljardista, poislukien identtiset kaksoset, joilla tostojaksot ovat samanlaisia.
DNA-tunnisteiat voidaan käyttää esimerkiksi isyystutkimuksissa, sillä kun äidin ja lapsen DNA-tunnisteet tiedetään, pitäisi poikkeavuudet lapsen ja äidin DNA-tunnisteissa selittyä isän DNA-tunnisteella.
DNA-tunnisteita käytetään myös rikostutkimuksissa, joissa DNA:ta voidaan eristää esimerkiksi veriroiskeesta tai hiuksen pätkästä. Kun tekijän soluja ollaan saatu kerättyä, monistettua PCR-laitteella ja ajettua elektroforeesilla, verrataan tuloksia epäillyistä otettuihin näytteisiin.
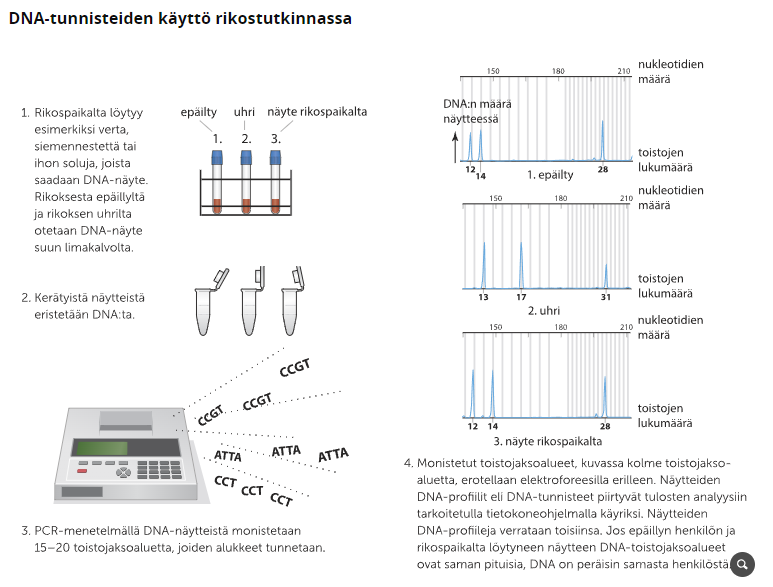
Geneettinen sukututkimus
Geneettisellä sukutukimuksella tarkoitetaan DNA-testeihin perustuvaa sukulinjojen ja sukulaisuuksien selvittämistä. DNA-testit perustuvat tiettyjen DNA-jaksojen selvittämiseen. Yleisempiä sukutestejä ovat Y-DNA-testi eli isälinjan testaus, mtDNA-testi eli äitilinjan testaus sekä autosomaalinen DNA-testi. Testien tuloksia vertaillaan muiden tekemien testien tuloksiin. Vertailutulokset kertovat yhteisen DNA:n määrän, jonka perusteella voidaan todeta sukulaisuuden läheisyys.
DNA-näytteistä tehtyjen sekvensointien perusteella voidaan mallintaa, miltä henkilö olisi kasvon piirteiltään voinut näyttää perimänsä puolesta. Tällaista tutkimusta kutsutaan fenotyyppitutkimukseksi, joka on joissakin maissa (ei suomessa) osa rikostutkimuksia. Sekvensointitietojen avulla voidaan mallintaa esimerkiksi kasvojen muoto sekä ihon, silmien ja hiusten väri.
DNA-viivakoodi
Eri lajien erottaminen toisistaan pelkkien ulkoisten ominaisuuksien perusteella on epävarmaa etenkin, jos kyseinen yksilö ei ole kehityskaarensa täydessä vaiheessa tai yksilö kuuluu lajiin, jolla on läheinne sukulaishistoria toisen lajin kanssa. Lajien tunnistamisen helpottamiseksi on kehitetty DNA-viivakoodit, jotka perustuvat lajista sekvensoidun tietyn DNA-jakson emäsjärjestykseen. Emäsjärjestyksestä luodaan nelivärinen viivakoodisto, jossa jokainen emäspari vastaa omaa viivaansa. Eri DNA-viivakoodeista rakennetaan DNA-viivakoodikirjasto.

DNA-viivakoodeja voidaan käyttää rikostutkimuksessa, kun selvitetään esimerkiksi ruokaväärennöksiä, salakuljetettujen ja -metsästettyjen eläinten alkuperää tai huumekasvien viljelyä.
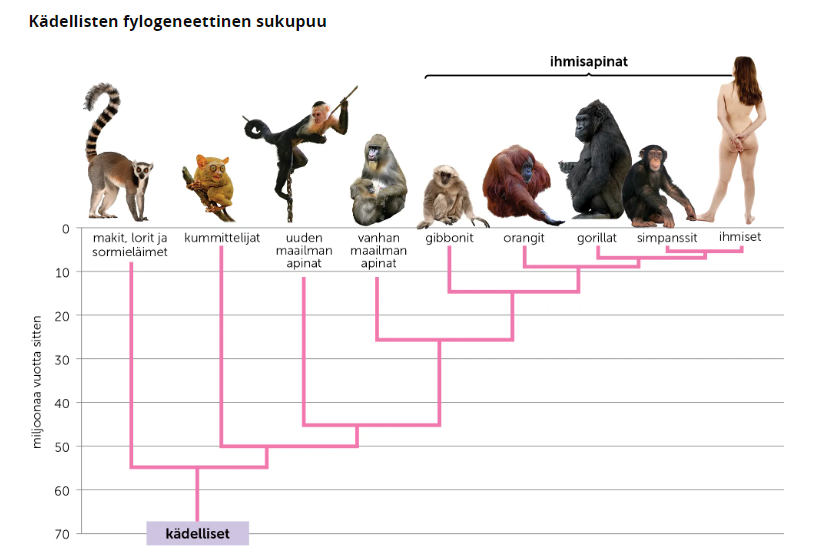
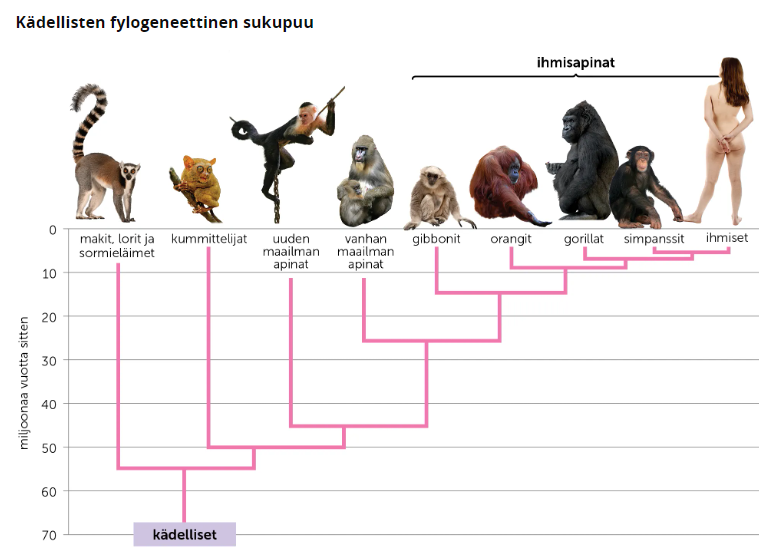
DNA-viivakoodit ovat apuna myös evoluutiotutkimuksessa ja eliöiden luokittelussa, koska niiden avulla voidaan vertailla yksilöiden perimän välisiä eroja ja samanlaisuuksia. Erojen ja samainlaisuuksien avulla saadaan selvitettyä sukulaissuhteita ja evolutiivista historiaa, jotka voidaan ilmoittaa fylogeneettisen sukupuun avulla. DNA-viivakoodien avulla voidaan myös seurata muuntogeenisten lajien leviämistä.
9 Biotekniikka auttaa tautien tutkimista ja diagnosointia
Diagnoosilla tarkoitetaan päätelmää taudinaiheuttajasta, ja se luodaan oireiden ja tutkimusten pohjalta. Diagnostiikassa hyödynnetään biotekniikan sovelluksia, kuten reaaliaikaista PCR:ää tai vasta-ainetestejä. Kun tutkitaan ihmisten tai muiden eliöiden geenejä, kudoksia tai koko genomia, voidaan tietoja tallettaa tulevia tutkimuksia, tautien tai lajien tunnistusta varten tietopankkeihin, kuten genomitietokantaan tai biopankkiin.
Tautien tutkiminen
Tautimallit
Tautimalleilla tarkoitetaan koe-eläimiä, joilla tutkitaan sairauksia ja niiden hoitokeinoja. Yleisimpiä tautimallieläimiä ovat hiirien lisäksi esimerkiksi siat, joiden elintoiminnot ovat hiiren elimtoimintoja yhtäläisempiä ihmisen kanssa. Tautimallien käyttöön vaaditaan eettisen lautakunnan suostumus, koska koe-eläinten kiduttaminen erilaisilla sairauksilla on eettiisesti väärin. Hakiessaan lupaa täytyy perustella, miksi tutkimusta ei voida suorittaa soluviljelmässä, eli miksi kokeeseen täytyy käyttää elävää eläinyksilöä.
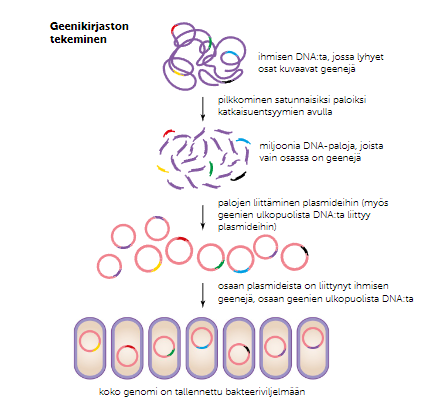
Geenikirjastot
Geenikirjastolla tarkoitetaan esimerkiksi bakteerin plasmideihin siirrettyä perimää ja sen osia. Geenikirjastoja käytetään, kun perimää halutaan säilyttää ja monistaa samalla. Geenit siirretään bakteeriviljelmään yhdistelmä-DNA-tekniikan avulla, ja onnistuneet siirrot erotetaan epäonnistuneista antibioottivalinnalla. Geenikirjasto voidaan tehdä joko genomiseksi kirjastoksi tai eksomikirjastoksi.
Genomisessa kirjastossa bakteeriviljemään säilötään perimästä otetusta näytteessä satunnaisesti pilkottuja DNA-jaksoja, jotka voivat joko sisältää geenin tai eivät. Genomikirjaston avulla voidaan tutkia myös geenien ulkopuolisia alueita.
Kun tehdään eksomikirjastoa, perimästä eristetään lähetti-RNA:t joista käännetään käänteiskopioijaentsyymillä vastin-DNA:t, jotka liitetään bakteerin plasmidiin. Eksomikirjastossa on siis vain DNA:sta eristettyjen geenien eksoneja.
Genomitietokannat
Genomitietokannalla tarkoitetaan maailmanlaajuista tietokantaa, johon on tallennettu eri puolin maailmaa tehtyjä sekvensointitietoja ja muita tutkimustuloksia ihmiskehon toiminnasta, sairauksista ja sairauksien hoidosta. Genomitietokantoihin kerrättyä tietoa analyisoidaan bioinformatiikan avulla.
Biopankki
Biopankkeihin säilötään muutakin kuin dataa - biopankkeihin talletetaan DNA- ja kudosnäytteitä sekä potilaskertomuksia eli kuvauksia potilaiden oireista ja hoidosta - tietenkin vain potilaan luvalla. Biopankkien tietojen avulla kehitetään diagnostiikkaa ja tautien parantamista.
Tautien diagnostiikka
DNA-sirut
DNA-sirut ovat pieniä ja ohuita, muovisia tai lasisia laattoja, joille on asetettu useita, tautialleeleja tunnistavia koettimia. DNA-sirun jokainen koetin sisältää jonkin tietyn tautialleelille sopivan vastin-DNA-pätkän, johon on kiinnitetty fluerisoiva merkkigeeni. Kun tutkittavan henkilön perimää asetetaan DNA-sirun koettimille, voidaan värireaktioiden avulla tutkia koettimien löytämiä osumia. Kun kaikki reagoivat geenit ovat reagoineet koettimien kanssa, DNA-sirua voidaan lukea analyysilaitteella.
DNA-sirujen, esim Suomi-sirun, avulla voidaan selvittää useiden tautien ilmentymistä, tai missä kudoksessa mikäkin geeni esiintyy.
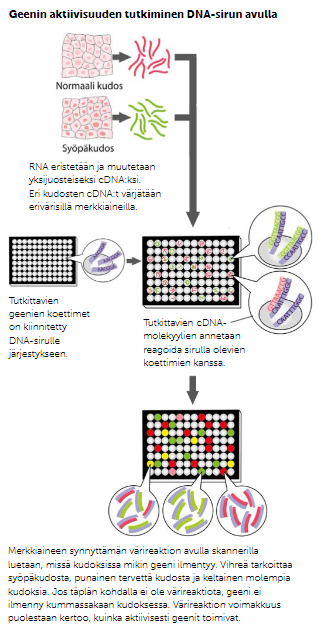
Leimatut koettimet
Leimatuilla koettimilla voidaan selvittää, sisältääkö jokin kudos tai näyte jotakin tiettyä tutkittavaa geeniä. Leimattu koetin on lyhyt pätkä DNA:ta, jonka on tarkoitus pariutua hybridisaatiolla halutun geenin tuottaman lähetti-RNA:n kanssa. Koska koetin on leimattu fluerisoivalla väriaineella, hybridisaatio tuottaa värimerkin, joka voidaan havaita UV-valolla.
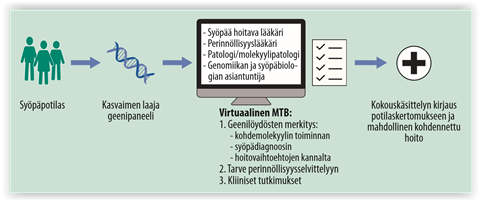
Geenitestit ja -paneeli
Geenitesteillä selvitetään, onko tutkittavalla henkilöllä perimänsä perusteella sairautta tai alttiutta siihen. Geenitestejä käytetään myös sairauden diagnosoimiseksi, tautigeenien kantajuuden toteamiseksi, sairastumisriskin arvioimiseksi sekä sairausgeenien tunnistamiseksi alkio- ja sikiöaikana. Posken limakalvolta otettavia geenitestejä voidaan myös tilata esimerkiksi netistä, joiden avulla voidaan rakentaa sukupuita ja tunnistaa sukulaisia.
Geenipaneelilla tarkoitetaan laitetta, jolla voidaan tunnistaa sairauden eri muotoja eli erilaisia alleeleja, jotka aiheuttavat sairauden. Geenipaneelille voidaan valita jopa tuhat erilaista, tiettyä sairautta ja sen eri muotoja aiheuttavan geeniä. Kun tutkittavasta henkilöstä on otettu näyte, näytettä analysoidaan rinnakkaissekvensoinnin avulla. Rinnakkaissekvensoinnin tuloksia verrataan vertailutietokantoihin, jolloin saadaan selville, minkä tautimutaation henkilö on saanut.
→ Geenipaneelin avulla voidaan tutkia tarkemmin taudin aiheuttavaa geeniä, ja luoda näin yksillöllisempi hoitosuunnitelma.
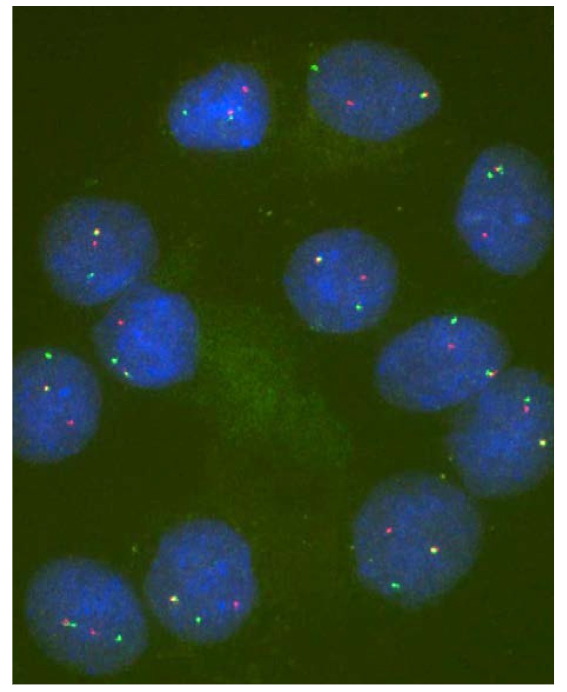
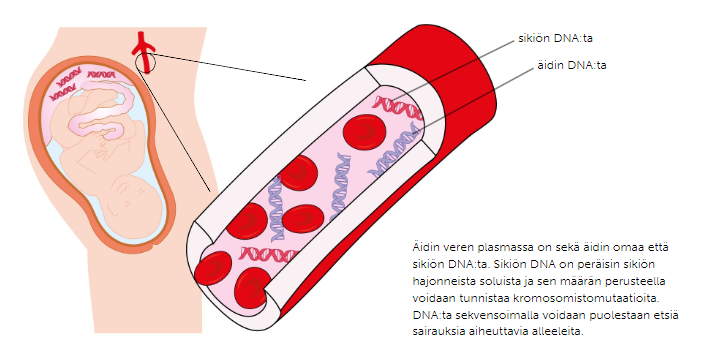
Alkio- ja sikiödiagnostiikka
Jokainen raskausajan neuvolassa käyvä tulee olemaan tekemisissä sikiödiagnostiikan kanssa. Sikiödiagnostiikalla pyritään löytämään kromosomi- ja kromosomistomutaatiota, eli pyritään selvittämään onko sikiö kunnossa, vai onko sillä mahdollisuuksia sairastaa jotakin geneettistä sairautta. Yleisiä sikiödiagnostiikan menetelmiä ovat esimerkiksi ultraäänitutkimus, sikiön sydänäänien kuunteleminen tai äidltä verinäytteen ottaminen, mutta jos näussä yleisesti kaikille tehtävissä kokeissa havaitaan poikkeuksia, voidaan ottaa esimerkiksi lapsivesinäyte.
Alkiodiagnostiikalla tarkoitetaan keinohedelmöityksessä luotujen alkioiden tutkimista mahdollisten geenivirheiden johdosta. Jos esimerkiksi on suuri mahdollisuus sille, että lapsi syntyisi elämänlaatua rajoittavaa sairautta/oireyhtymää sairastavana, voidaan lapsi tuottaa alulleen keinohedelmöityksessä. Kun keinohedelmöityksessä hedelmöittynyt solu alkaa jakautua mitoottisesti voidaan sille suorittaa geenitutkimuksia, joilla voidaan poissulkea epäiltyjä sairauksia tai oireyhtymiä.
Alkiodiagnostiikassa geenitestit suoritaan kuvan kaltaisille solurypäleille.
Sekvensointi
Sekvensointi ollaan tuotu esiin kaikkialla, mutta näin se putkahtaa mukaan jälleen, koska on tärkeä osa tautidiagnostiikkaa. Jotta voidaan tuntea ihmisen perimää, sairauksia ja niiden hoitokeinoja, on tiedettävä, minkälaisten geenien kanssa ollaan tekemisissä. Sekvensointi on perustana melkein kaikille tautien tutkimis- ja DNA:n emäsjärjestyksen selvitysmenetelmille. Sekvensoida voidaan koko genomi tai vain eksomit. Molemmissa tapauksissa informaatio on valtavaa - onhan ihmisellä yli 20 tuhatta geeniä. Tämän vuoksi informaatiota käsitellään paljon tekoälyn avulla, joka kykenee esimerkiksi jäsentelemään tuloksia.
Antigeenitestit
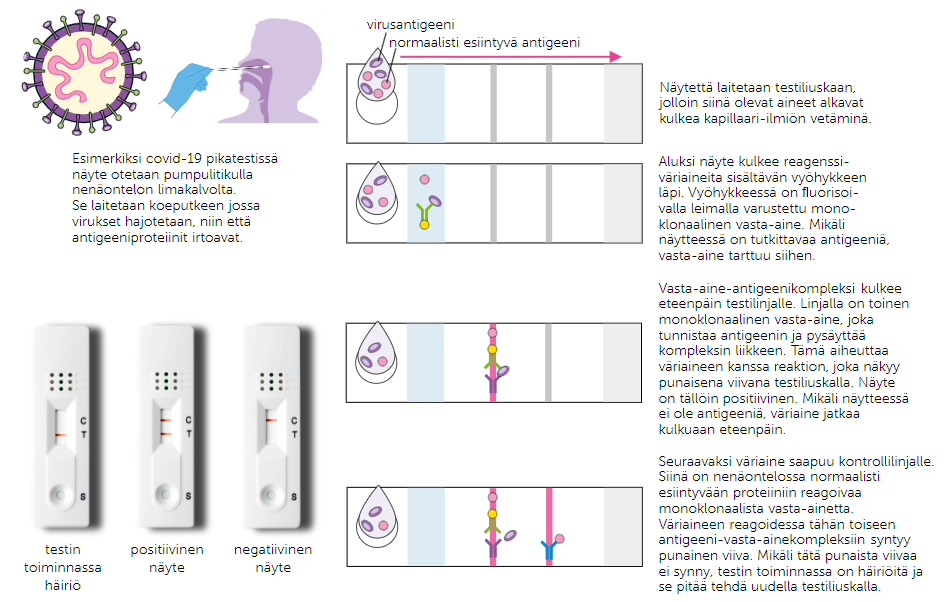
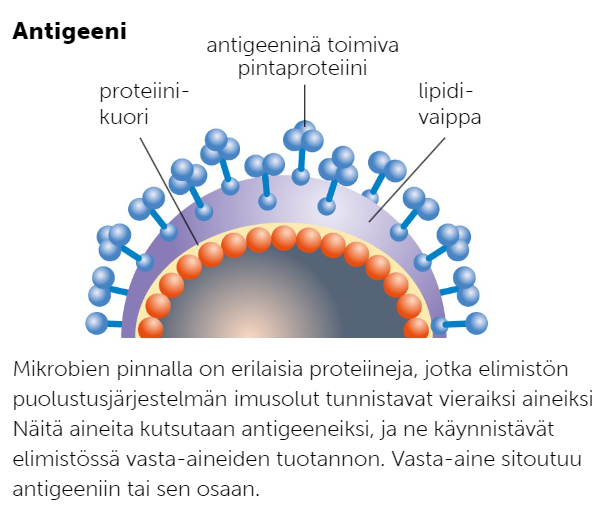
Antigeenitestit perustuvat monoklonaalisten vasta-aineiden toimintaan. Monoklonaalisella vasta-aineella tarkoitetaan B-imusolun tuottamaa vasta-ainetta, joka osaa tunnistaa yhden tietyn pintaproteiinin, eli antigeenin. Monoklonaalisia vasta-aineita ollaan voitu hyödyntää esim. koronatesteissä.
Antigeenitesteissä henkilöstä otetaan näyte, joka asetetaan testiliuskalle. Näyte kulkee kapillaari-ilmiön avulla läpi testiliuskan. Positiiviseen näytteeseen tarttuu värikoodattu, virukselle monoklonaalinen vasta-aine, joka jättää värijäljen ensimmäiselle testilinjalle. Näyte jatkaa eteenpäin kontrolliviivalle, jossa värikoodattu, normaalisti näytteessä esiintyvälle antigeenillä monoklonaalinen vasta-aine tarttuu antigeenin jättäen värijäljen kontrolliviivalle. Jos kontrolliviiva ei tule näkyviin testissä, näytteeseen ei ole tarttunut edes normaalisti näytealueella esiintyvää antigeeniä, jolloin tulos luetaan virheelliseksi.
Reaaliaikainen PCR
Reaaliaikainen PCR on menetelmä, joka toimii samalla pääperiaatteella PCR:n kanssa. Reaaliaikaisessa PCR:ssä emäksiltään tuntematonta DNA-juostetta monistetaan lämpötilan vaihtelun avulla. Reaaliaikaisessa PCR:ssä PCR-laitteeseen lisäätään emäksiltään tunnettu koetin, johon on liitetty fluerisoiva leima. Koetin pariutuu juosteen kanssa ennen DNA:n monistumista. Kun DNA-polymeraasi entsyymi osuu koettimeen, koettimen värileima irtoaa ja antaa värimerkin. Saatujen värimerkkien perusteella voidaan määrittää DNA:n emäsjärjestys.

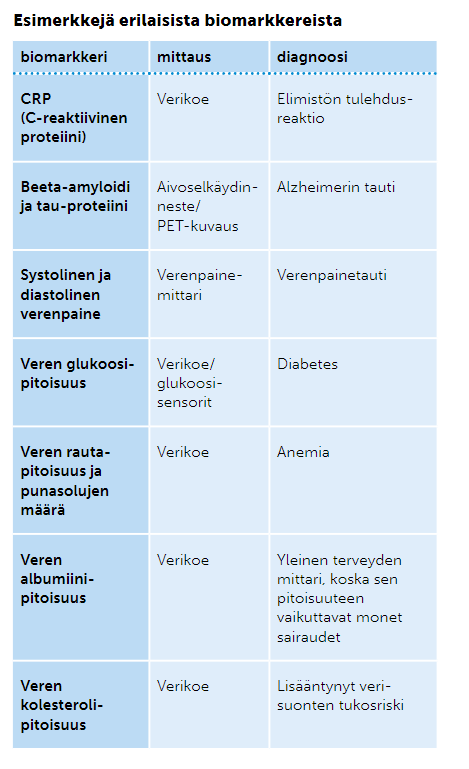
Biomarkkerit
Biomarkkereilla tarkoitetaan kehoissamme olevia yhdisteitä tai tekijöitä, joita mittaamalla voidaan tehdä tutkimusta terveydentilastamme. Biomarkkereita voivat olla lipidit, proteiinit ja aineenvaihduntatuotteet, joiden määrällinen muutos voidaan yhdistää johonkin tautiin. Biomarkkeirien määrää tutkitaan esimerkiksi massaspektroskopialla tai monoklonaalisilla vasta-aineilla.
käsitteitä:
hybridisaatio=DNA-juosteidien pariutuminen
monitekijäinen sairaus= sairuas, johon vaikuttavat useart tekijät, kuten perinnölliset tekijät, ympäristön vaikutus ja elintavat
10. Lääkkeet ja hoidot kehittyvät yhä tehokaammiksi
Biotekniikan sovelluksia hyödynnetään useissa tautien hoitokeinoissa ja lääkkeissä. Biotekniikka on auttanut kehittämään yhä tehokaampia ja täsmällisempiä lääkkeitä ja hoitokeinoja, joita ovat esimerkiksi antibiootit, nukleiinihapporokotteet ja kantasoluhoidot. Lääkkeitä, jotka tehoavat virusten, bakteerien, hiiva- ja homesienien sekä yksisoluisten loisten aiheuttamiin infektioihin, kutsutaan mikrobilääkkeiksi.
Antibiootit
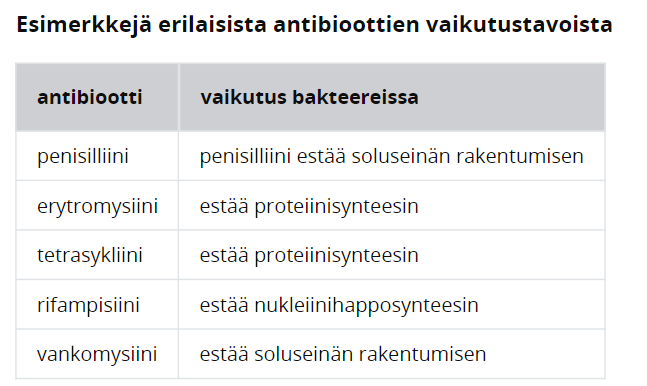
Antibiooteilla tarkoitetaan lääkkeitä, jotka hillitsevät bakteeri- ja sieni-infektioita vaikuttamalla niiden aineenvaihduntareaktioihin tai estämällä niiden lisääntymisen. Antibiootit ovat alkujaan olleet sienien (tai joidenkin bakteerien) erittämää aineitta, joka on toiminut kilpailijoiden kukistajana. Myöhemmin ihminen on alkanut keräämään ja valmistamaan antibiootteja infektiotautien hoitamiseen. Antibiootteja valmistetaan nykyään suurissa bioreaktoreissa, joissa homeet ja bakteerit erittävät antibiootin kasvatusliuokseen, mistä antibiootti puhdistetaan talteen.
Laajakirjoisilla antibiooteilla tarkoitetaan antibiootteja, jotka vaikuttavat kerralla usemapaan bakteerilajiin. Vastaavasti kapeakirjoinen antibiootti on antibiootti, joka vaikuttaa vain yhteen ja tiettyyn bakteerilajiin. Laajakirjoisilla ja kapeakirjoisilla antibiooteilla on hyvät ja huonot puolensa. Laajakirjoinen antibiootti sopii tapaukseen, jossa infektoivaa bakteeria ei tarkasti tunneta. Kapeakirjoinen antibiootti sopii paremmin tapaukseen, jossa bakteerilaji tunnetaan, jolloin hoito voidaan kohdistaa suoraan siihen, eikä keholle hyödyllisiin bakteereihin.
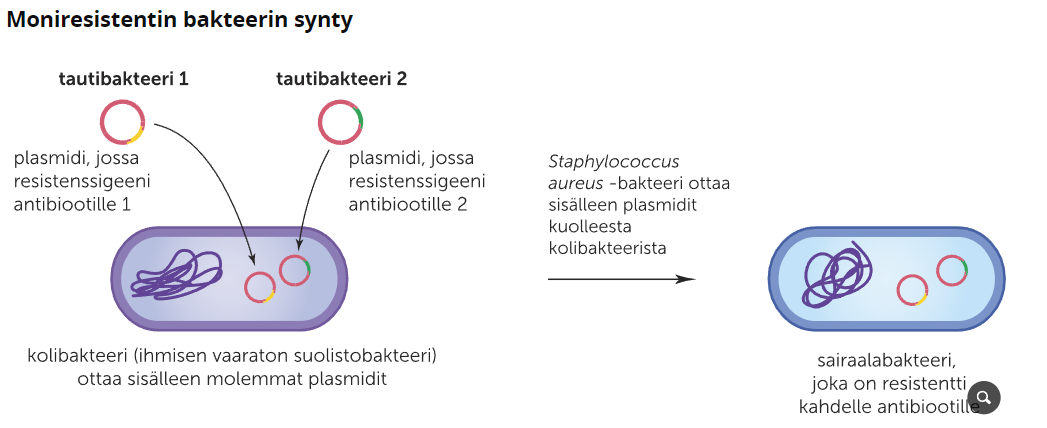
Tänä päivän ongelma ihan ympäri maailman ovat resistanssibakteerit. Resistanssibakteereilla tarkoitetaan bakteereita, joihin antibiootit eivät tehoa. Resistanssi, eli vastustuskyky johtuu pitkäaikaisesta asteittaisesta altistumisesta antibiootille, joka johtaa bakteerikantojen muunteluun. Ja koska resistenssigeeni sijaitsee usein plasmidissa, resistenssigeeni siirtyy helposti bakteerista toiseen rekombinaation avulla. Sairaalassa syntyneitä moniresistenssejä bakteereja kutsutaan sairaalabakteereiksi. MRSA on Suomessa laajalti esiintyvä sairaalabakteeri.
Resistenssibakeeri kantoja kehittää esimerkiksi antibioottien käyttö tehomaataloudessa sekä antibioottien runsas ja tarpeeton käyttö.
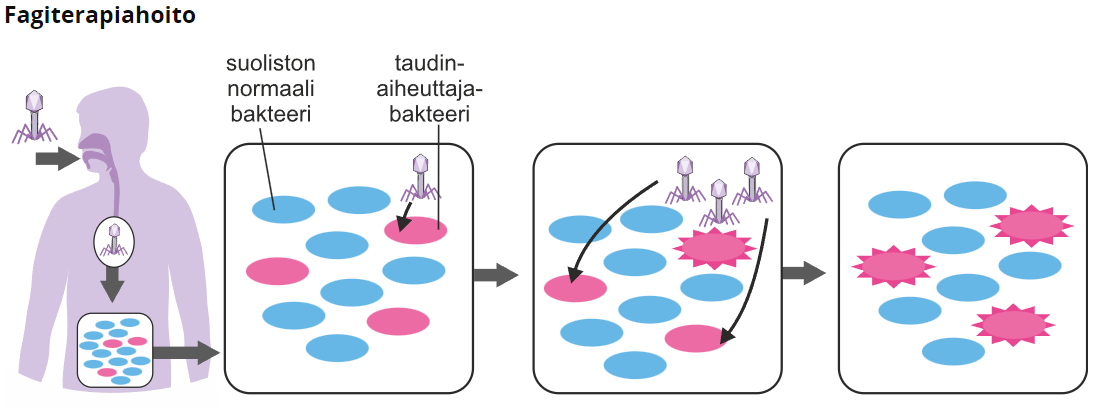
Fagiterapia
Fagiterapialla tarkoitetaan bateriofagien, eli bakteereja infektoivien virusten, käyttöä bakteeri-infektion hoitoon. Bakteriofagit tuhoavat luonnostaan vain yhtä bakteerilajia, joten ne eivät tuhoa muita keholle hyödyllisiä bakteerikantoja. Fagiterapia on vanha menetelmä, jota on alettu uudelleen harkita hoitamaan resistansseja bakteerikantoja.
Rokotteet
Sekä bakteeri- että virusinfektioita ennaltaehkäistään rokotteilla. Rokotteet ovat aktiivista immunisaatiota. Rokotteiden tarkoituksena on aktivoida elimistö tunnistamaan ja tuhoamaan taudinaiheuttajat.
Rokotteita valmistetaan bakteerien tai hiivojen plasmideissa yhdistelmä-DNA-tekniikalla. Plasmideihin liitetään pintaproteiinia koodaava geeni, ja plasmidin annetaan kahdentua hiivan tai bakteerien jakaantuessa. Siirron onnistuttua bakteerit ja hiivat alkavat tuottamaan pintaproteiineja, joita eristetään rokotteisiin.
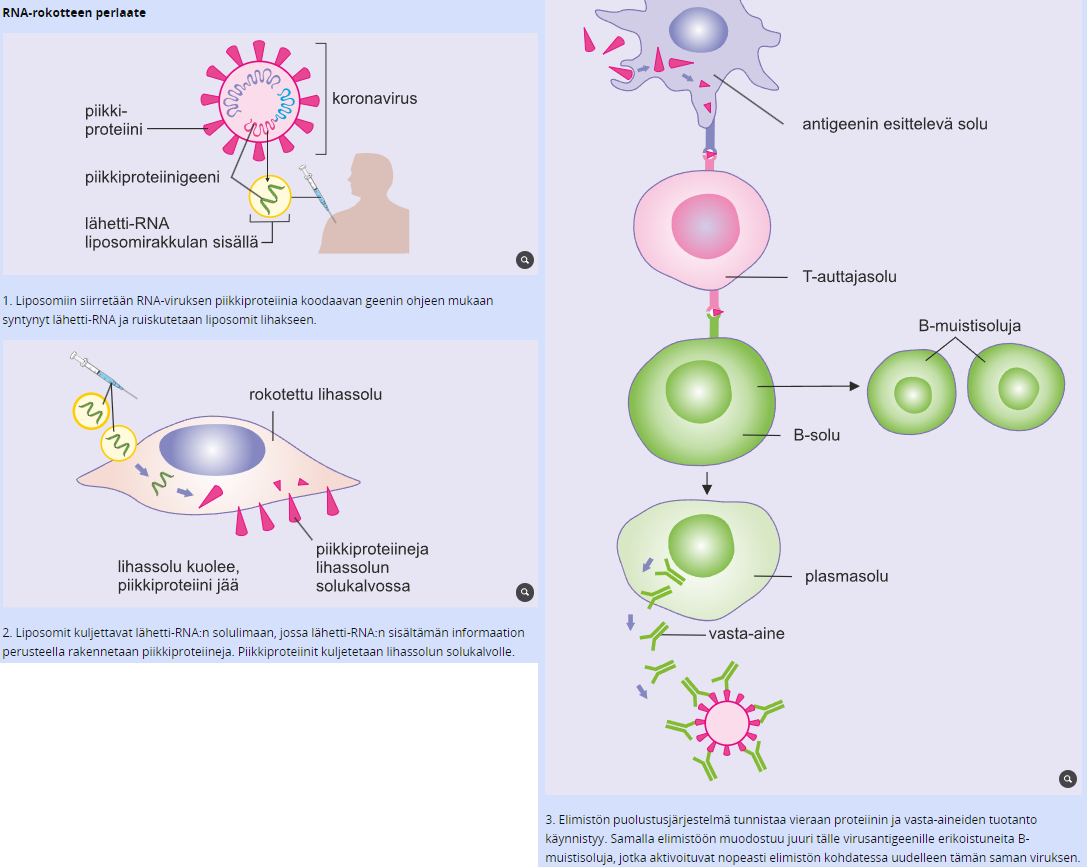
Ennen rokotteet sisälsivät heikennettyjä tai tapettuja taudinaiheuttajia tai niidne osia. Nykyään geenitekniikan avulla valmistettu rokote sisältää ainoastaan osan taudinaiheuttajan pintaproteiinista tai sitä koodaavasta nukleiinihaposta. Näitä rokotteita, joissa on osa taudinaiheuttajan pintaproteiinin DNA:ta tai RNA:ta, kutsutaan nukleiinihapporokotteiksi, eli DNA- tai RNA-rokotteiksi.
Nukleiinihapporokotteiden toiminta perustuu siihen, että rokotettavan soluihin viedään antigeenin, kuten viruksen pintaproteiinin, rakennusohje lähetti-RNA:n tai DNA:n muodossa. Kun rakennusohje on saatu siirrettyä soluihin, ne alkavat tuottaa elimistölle vierasta proteiinia. Vieraan proteiinin vuoksi kyseistä taudinaiheuttajaa vastaan ihmisessä syntyy immuunivaste ja muistisoluja kehittyy lisää. Kun taudinaiheuttaja joutuu myöhemmin elimistöön, puolustusjärjestelmään kuuluvat valkosolut aktivoituvat ja tuhoavat sen.
Hormonilääkkeet ja monoklonaaliset vasta-ainelääkkeet
Sellaisia hormoneja, joita ennen eristettiin eläimistä ja kuolleista ihmisistä, voidaan nykyään valmistaa bakteeri- ja hiivasoluviljelmissä yhdistelmä-DNA-tekniikan avulla. Näitä soluviljelmissä valmistettuja hormoneita kutsutaan hormonilääkkeiksi. Esimerkiksi interferonia voidaan tuottaa kolibakteereissa mm. virusinfektioiden hoitoon.
Monoklonaalisilla vasta-aineilla tarkoitetaan vasta-aineita, jotka tunnistavat yhden tietyn antigeenin. Monoklonaalisia vasta-aineita on alettu hyödyntää täsmälääkkeinä taudeille, joiden tekijät ja solutyyppi tunnetaan hyvin. Vasta-ainelääkkeitä käyteen mm. syöpien ja reuman hoitoon.
Geenihoidot
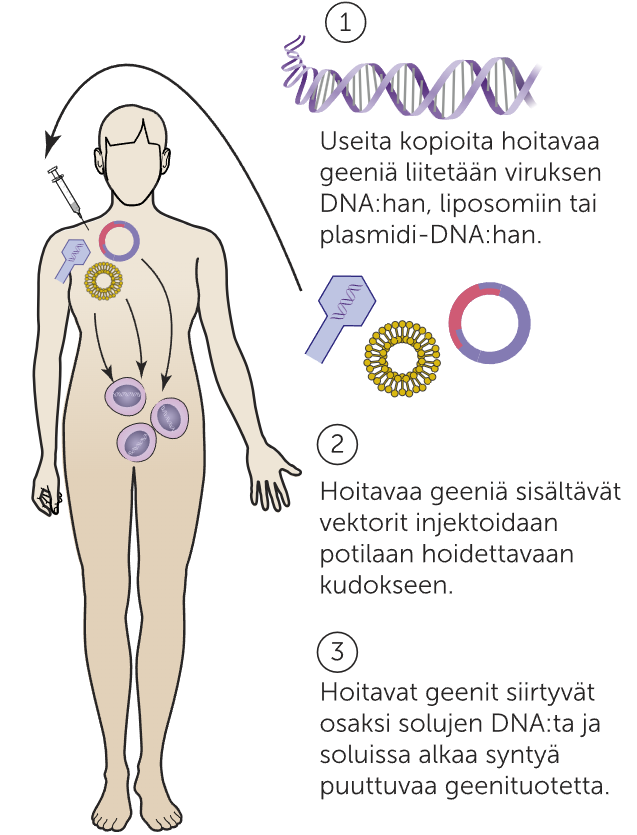
Geenihoidoissa soluviljelmään tai potilaaseen siirretään geenivirhettä korjaavasta geenistä toimiva alleeli, jonka ohjeiden mukaan solut alkavat tuottaa puuttuvaa proteiinia. Geeninsiirto voidaan tehdä joko suoraan tai potilaan omien solujen avulla soluviljelmässä.
Soluviljelmässä tehtävässä geeninsiirrossa siirrettävä alleeli liitetään vektoriin, joka on useimmiten virus tai liposomi. Siirron saavalta henkilöltä eristetään soluja, joita kasvatetaan soluviljelmässä yhdessä siirtogeenisten virusten tai liposomien kanssa. Kun alleeli on saatu siirrettyä soluihin, solut palautetaa takaisin potilaaseen toivoen, että palautetut solut alkavat tuottamaan haluttua proteiinia.
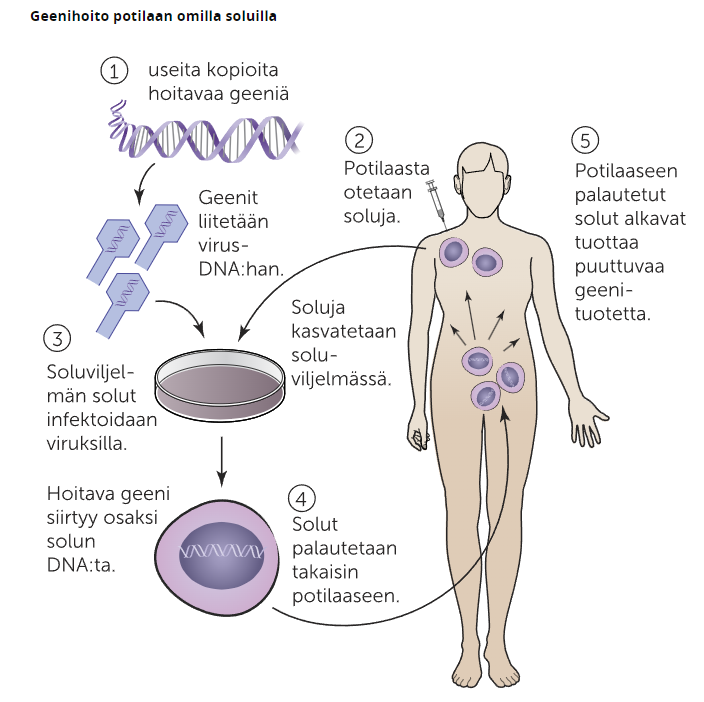
Suorassa geenin siirrossa alleeli liitetään vektroriin yhdistelmä-DNA-tekniikalla. Vektori injektoidaan potilaan hoidettavaan kudokseen toivoen, että alleelit löytävät potilaan solut alkaen tuottamaan haluttua proteiinia.
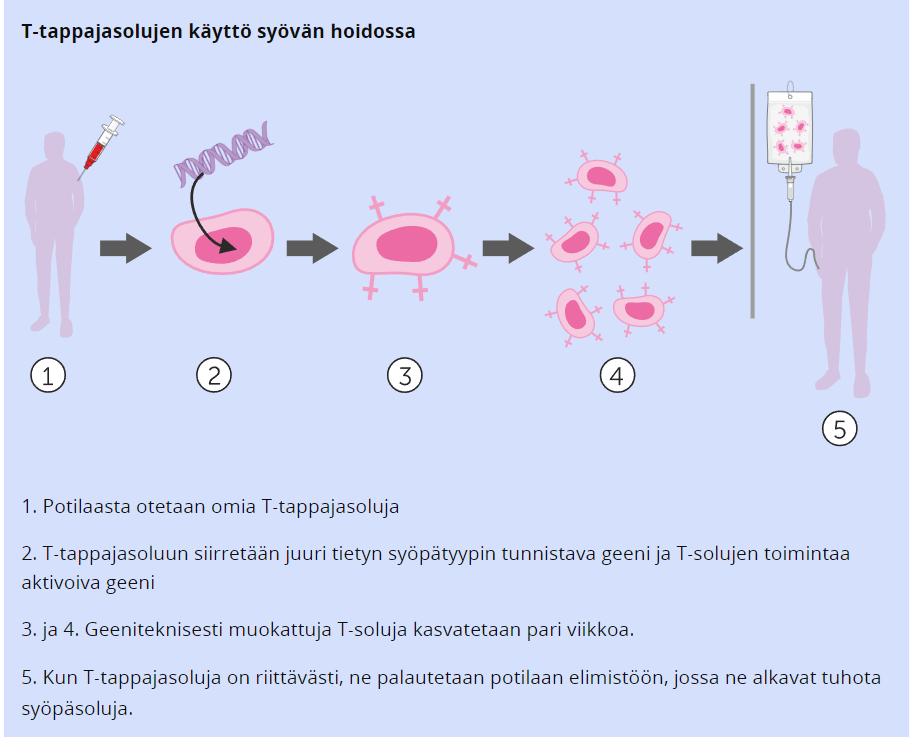
Geeninsiirto voidaan tehdä myös T-tappajasoluihin, jolloin niiden avulla voidaan hoitaa syöpää. T-tappajasoluja eristetään potilaasta, ja niihin liitetään geeni, joka tunnistaa syöpäsolun, ja geeni, joka tappaa ne.
Geeninsiirtojen lisäksi voidaan tehdä geenimuokkauksia, joihin käytetään CRISPR-tekniikkaa. CRISPR-tekniikassa toimivaa alleelia ei siirretä vaan viallinen alleeli korjataan. Korjaus on mahdollista tehdä soluviljelmän soluihin, minkä jälkeen muuntogeeniset solut siirretään potilaaseen. CRISPR-tekniikka mahdollistaa geenien muokkaamisen jo koeputkihedelmöityksessä, jolloin mahdollisia sairauksia voidaan poiskytkeä jo ennen sikiön kehitystä.
Geenihoidoissa on paljon käytännöllisiä ja eettisiä ongelmia. Pahimassa tapauksessa geenihoito voi käynnistää ehkäistävän tai hoidettavan sairauden, sillä geeninsiirto saattaa kohdentua väärään soluun tia CRISPR-tekniikan cas-entsyymi saattaa korjata väärän geenin. Etenkin alkioihin tehtyjen geeninhoitojen on uskottu esimerkiksi rajoittavan itsemääräämisoikeuutta ja johtavan ihmisen jalostamiseen sairauksien poistamisen sijaan.
Kantasoluhoidot
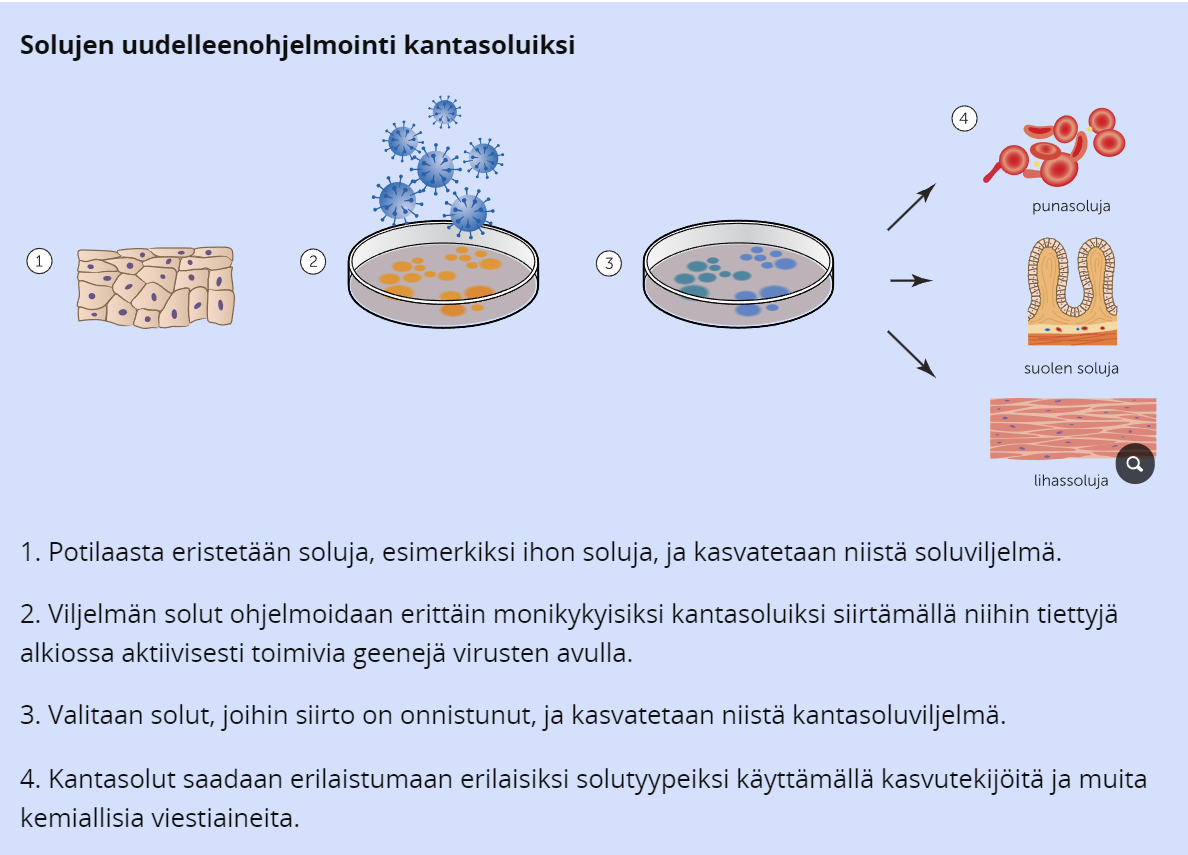
Erittäin monikykyisillä kantasoluilla tarkoitetaan soluja, jotka voivat erikoistua miksi tahansa ihmisen yli kahdestasadasta solutyypistä, ja luonnostaan niitä esiintyy vain alkioilla. Nykybioteknologian avulla mikä tahansa ihmisen solu, esim. ihosolu, voidaan uudelleenohjelmoida alkutilaansa eli erittäin monikykyiseksi kantasoluksi. Uudelleen erittäin monikykyisiksi kantaosluksi ohjelmoitua soluja kutsutaan IPS-soluiksi.
IPS-solujen avulla tehtävä solukorvaushoito perustuu siihen, että kantasolut eristetään potilaasta, jonka jälkeen niihin siirretään vektorin avulla geeni, jota ilmenee alkioiden soluissa. Tästä solu alkaa uudelleenohjelmoitumaan alkutilaansa, jonka jälkeen solu voidaan erilaistaa halutuksi solutyypiksi kasvutekijöiden ja muiden kemiallisten aineiden avulla.
Kudosteknologia
Kudosteknologialla tarkoitetaan keinotekoisten kudosten kehittämistä biologian, lääketieteen ja insinööritieteiden avulla. Kudoksia voidaan esimerkiksi valmistaa 3D-biotulostimella.
BIOLOGIA 6 - Biotekniikka ja sen sovellukset (copy)
2. Bakteerit ja arkeonit ovat tumattomia mikrobeja
Mikrobeja ovat kaikki paljaalle silmälle näkymättömät pienet eliöt. Suurin osa niistä on joko arkeoneja, bakteereja, alkueliöitä ja sieniä. Mikrobeihin leutaan lisäksi virukset, vaikka ne eivät ole periaatteissa eliöitä. Mikrobi ei ole biologinen, vaan lääketieteellinen termi.
Tautia aiheuttavia mikrobeja kutsutaan patonogeenisiksi mikrobeiksi, ja eläimestä bakteerina ihmiseen levinnyttä tautia zoonoosiksi. Vaikka bakteerit saattavatkin kuulostaa pelottavilta ja vaarallisilta, on olemassa paljon ei-patogeenisiä bakteereja. Aikuisen ihmisen painosta kilo tulee kehossa olevien bakteerien, suurimmaksi osaksi siis ihmistä hyödyttävien bakteerien massasta. Patogeenisiä arkeoneja ei tunneta, mutta arkeoneja ei myöskään ole ihmiselimistössä kovinkaan montaa.
Bakteerit
Likimain kaikki tarvittava tieto löytyy alla olevasta ajatuskartasta. Lisämainintana:
on olemassa soluseinättömiä bakteereja, mykoplasmoja
bakteerien soluseinä on paksuuntunut ja koostuu mureenista
jotkin bakteerit voivat elää sekä aerobisissa että anaerobisissa oloissa
denitrifikaatiobakteerit ovat typpeä ilmakehään vapauttavia bakteereja, joita hyödynnetään esim. jätevedenpuhdistamoiden biologisessa puhdistuksessa

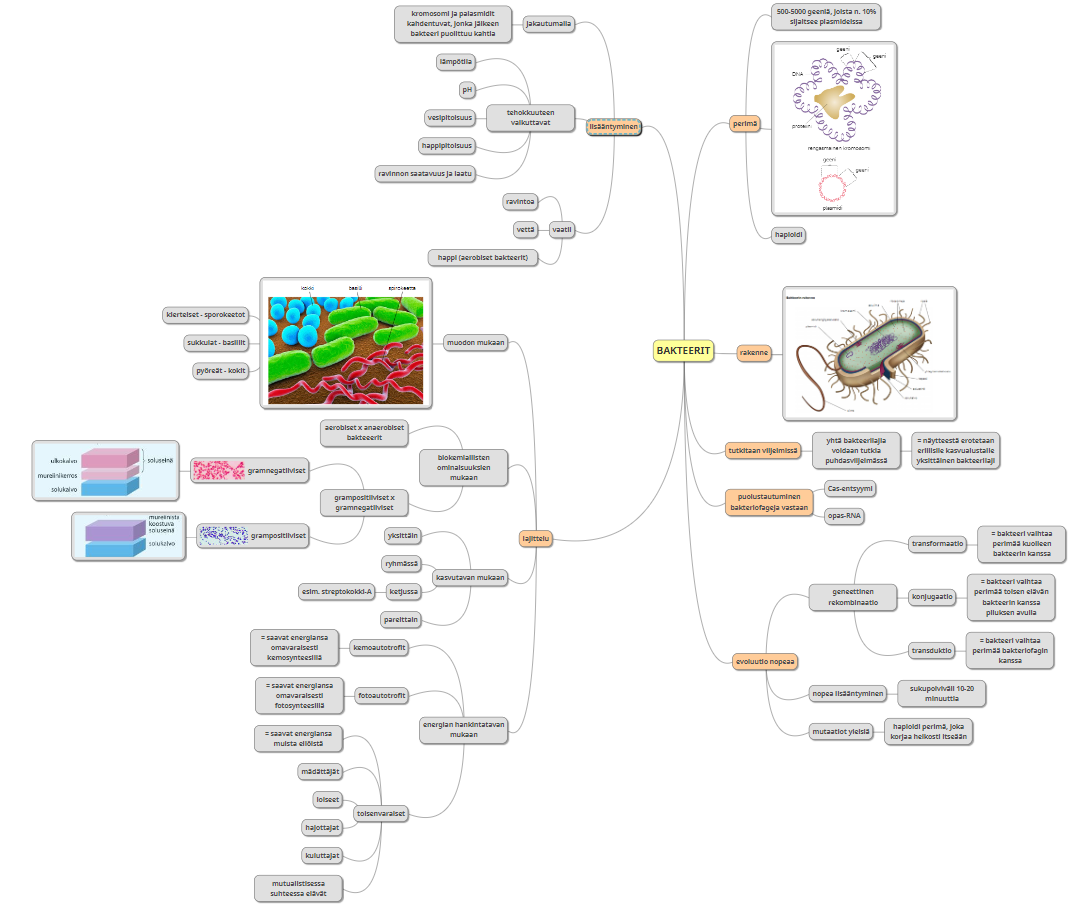
Kuva bakteerin pinnalla olevista bakteriofageista, joita bakteeri tuhoaa cas-entsyymillä:

Arkeonit
Arkeonit ovat myös pieniä tumattomia eliöitä, joita elää joka nurkassa. Itse arkeonien lisäksi arkeonien domeeniin kuuluvat myös tumalliset eliöt, koska tuman perimä on lähtöisin arkeonista (1. endosymbioosi). Arkeoneilla ja tumallisilla on myös paljon yhteisiä proteiineja ja samankaltainen proteiinisynteesi.

Arkeonien rakenne on erilainen bakteerien rakenteeseen verrattuna, mutta ne vaihtelevat paljon myös keskenään. Arkeoneita on pyöreitä, neliömäisiä, sukkulamaisia ja littania. Arkeonien soluseinä on rakenteeltaan bakteerin, kasvi- tai sienisolun soluseinää yksinkertaisempi, eikä se koostu kitiinistä, selluloosasta tai mureenista. Sen sijaan sen pinnalla on proteeneista koostuva rakenne, joka suojaa etenkin äärioloissa kasvavia arkeoneja. Mitä tulee rasvahapoista koostuvaan solukalvoon, on se bakteerin solukalvoa jähmeämpi ja vaikeammin läpäisevä, mutta korkeita lämpötiloja kestävä.
Arkeonien energian hankitakeinot ja niiden vaikutus ekosysteemiin:
kemoautotrofit, eli kemosynteesillä energiansa hankkivat → toimivat ranvintona muille ja tuottavat tärkeitä hiilihydraatteja
toisenvaraiset mädättäjät tai hajottajat → tuhoavat kuollutta ainesta ja edistävät aineiden kiertoa
mutualistisessa suhteessa toisen lajin kanssa elävät → lajien välinen koevoluutio
metaania “syövät” → hiilinieluja
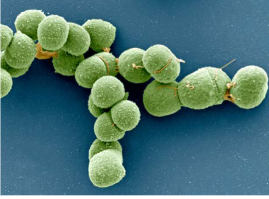
Kuten sanottu, arkeoneja elää likimain kaikkialla ympäristössämme (vaikkei niinkään meissä itseissämme), jopa ääriolosuhteissa. Erilaisia “selviytyjä” arkeoneja:
termofiiliset arkeonit = äärimmäistä kuumuutta kestävät arkeonit
halofiiliset arkeonit = äärimmäisiä suolapitoisuuksia kestävät arkeonit
(metanogeeniset arkeonit =arkeonit jotka elävät anaerobisissa oloissa tuottaen metaania)

Ihmisen mikrobiomi
Mikrobiomi = ihmiselimistössä olevat ja elävät mikrobit
Valtaosa ihmisen mikrobiomin mikrobeista on bakteereja, joita elää pääosin ruuansulatuselimistössä, iholla ja limakalvoilla. Iholla esiintyy myös sieniä ja arkeoneja. Bakteereilla on monia tärkeitä tehtäviä:
Suolistobakteerit tuottavat K- ja B12-vitamiinia, edistävät ruoansulatusta ja ravintoaineidne pilkkoutumista sekä estävät haitallisten bakteerien kiinnittymisen suolen seinämiin.
Ihon ja limakalvojen bakteerit estävät haitallisten bakteerien pääsyn kehoon.
Lisäksi bakteerit vaikuttavat aineenvaihduntaan, immuunijärjestelmään, hermoston toimintaan ja mielialaan.
Mikrobeja hyödynnetään monella sektorilla
Bakteereja hyödynnetään esimerkiksi jäteveden, maaperän tai vesien puhdistamisessa, kompostoinnissa ja maitotuotteiden tai muiden raaka-aineiden valmistuksessa.
Eliöiden, esimerkiksi mikrobien käyttöä ympäristön puhdistamiseen ympäristömyrkyistä tai muista haitallisista aineista kutsutaan biopuhdistukseksi
3. Tumallisilla mikrobeilla on moni tärkeitä rooleja ekosysteemeissä
Tumalliset mikrobit ovat paljaalla silmällä näkymättömiä, tumallisia eliöitä. Niihin luetaan mm. yksisoluiset levät sekä hiiva- ja homesienet.

Yksisoluiset levät
Kaikilla yksisoluisilla levillä on soluseinä, ja ne ovat fotoautotrofeja.
Elävät joko yksittäin tai soluryhminä, keijuvat vapaina tai ovat kiinnittyneinä kosteille pinnoille
kasviplankton = veden pinnalla vapaasti keijuvat mikroskooppiset levät ja syanobakteerit
Merkitys biosfäärille:
toimivat hiilinieluina
elävät usein mutualistisessa suhteessa muiden tärkeiden lajien kanssa
tuottavat happea ja ravintoaineita muille eliöille
→ arvioilta noin 70% ilmakehän hapesta on peräisin kyseisten levien yhteyttämisestä
Tauteja aiheuttavat tumalliset, toisenvaraiset mikrobit
Taudinaiheuttajamikrobeille yhtenäisiä piirteitä ovat yksisoluisuus, soluseinän puuttuminen, toisenvaraisuus, liikkuminen sekä monistumalla tai jakautumalla lisääntyminen. Taudinaiheuttajamikrobeja ovat esimerkiksi suoliameebat, malarialoisio ja trypanosoma. Niiden elämä jakautuu yleisesti kahteen vaiheeseen: väli-isännässä kehittymiseen ja isäntäeliössä loisimiseen. Jos elinolosuhteet ovat mikrobeille liian haasteellisia, ne voivat vaipua lepovaiheeseen tai kasvattaa itselleen paksumman kuoren.
Malarian leviäminen
Malaria on malarialoisiosta leviävä tauti, joka kaata ihmisiä etenkin tropiikin aluella.

Malarian elinkaaren vaiheet:
Malarialoisio lisääntyy suvullisesti hyttysessä.
Naarashyttynen pistää ihmistä, jolloin malarialoisiot leviävät ihmiseen hyttysen syljen mukana
Malarialoisiot suuntaavat veren mukana maksaan, jossa ne lisääntyvät suvuttomasti monistumalla.
Monistuneet malarialoisiot vapautuvat takaisin verenkiertoon, jossa ne siirtyvät veren punasoluihin. Malarialoisiot jatkavat siellä monistumista.
Kun malarialoisio on monistunut riittäävän monta kertaa, punasolu räjähtää. Räjähtäneen punasolun malarialoisiot lähtevät myrkyttämään uusia punasoluja. OIREET ALKAVAT TÄSSÄ KOHTAA.
Malarialoisio voi myös siirtyä ihmisestä hyttyseen.

Hiiva- ja homesienet
Hiiva- ja homesienien solut ovat hyvin yhtäläisiä sienisolujen kanssa, ja ne kuuluvatkin sienten lohkoon. Eron hiiva- ja homesienien erotetaan kolmella tavalla:
homesienet elävät rihmoissa ja hiivasienet yksisoluisina
hiivasienten soluissa on plasmideja
hiivasienet pystyvät tuottamaan energiaa myös hapettomasti, alkoholikäymisen avulla, eli ovat fakultatiivejä eliöitä

Harvat hiiva- tai homesienistä ovat patogeenisiä, mutta jotkin homesienistä tuottavat ihmiselle myrkyllisiä aineita. Älä siis syö homeisia hedelmiä tai leipiä.

Home- ja hiivasienten merkitys meille
Homesienet tuottavat luonnostaan antibiootteja bakteereja vastaan
Homelajeja hödynnetään juustojen valmistuksessa
Hiivoja käytetään viinin ja oluen valmistuksessa, sekä leivonnassa
4. Virukset lisääntyvät soluissa
Viruksia ei luokitella eliöksi, koska niillä ei ole omaa aineenvaihduntaa. Virukset ovat kuitenkin osa mikrobeja.
Rakenne
Isäntäsolun solukalvosta kurottu vaippa, jolla voidaan hämätä eliön muita soluja.
Pintaproteiinit, joiden avulla virus tunnisttaa soluja ja kiinnittyy isäntäsoluun
Kapsidi, eli proteeinikuori siojaa viruksen perimää
Perimä, joka voi olla yksi- tai kaksijuosteista, DNA:ta tai RNA:ta (geenejä kymmenistä satoihin)

Lajittelu
Viruksia lajitellaan:
Muodon mukaan
pyöreät virukset, esim. influenssa- ja koronavirus
sukkulamaiset virukset, esim. mosaiikkivirus
kulmikkaat virukset, esim. adenovirus
nauhamaiset virukset, esim. ebolavirus
bakteriofagin muotoiset virukset
Isäntäeliön mukaan
lisääntyykö virus bakteeri-, eläin vai kasvisoluissa
lisääntyykö virus vain yksissä tietyissä soluissa tai tietyn lajin yksilöissä
Perimän mukaan
kaksijuosteinen RNA
yksijuosteinen RNA
positiivinen
negatiivinen
kaksijuosteinen DNA
yksijuosteinen DNA
Lisääntyminen isäntäsolussa
Viruksilla ei ole omaa aineenvaihduntaa, joten ne voivat lisääntyä vain loisimalla isäntäsolussa. Viruksen lisääntyminen isäntäsolussa johtaa yleensä isäntäsolun kuolemaan. Erilaiset virukset lisääntyvät eri tavoin:
DNA-perimän omaava virus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Perimä vaeltaa tumaan, jossa se liittyy osaksi isäntäsolun omaa perimää. Syntynyttä perimää aletaan kopioimaan tuottaen uutta perimää uusille viruksille, ja valmistaen lähetti-RNA:ta virusten muiden proteiinien tuotantoa varten.
Proteiinisynteesissä valmisteneista proteiineista muodostuu uuden viruksen kapsidi, joka kuroutuu tuotetun perimän ympärille.
Uudet virukset poistuvat isäntäsolusta eksosytoosin avulla, jolloin niiden pinnalle kuorutuu vaippa isäntäsolun solukalvosta.

Positiivisen RNA-perimän omaava virus:
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Perimä toimii suoranaisesti lähetti-RNA:n tavoin, jolloin siitä voidaan tuottaa translaatiossa proteiineja tai transskriptiossa uutta RNA:ta
Syntyneet proteiinit muodostavat kapsidin joka kuroutuu tuotetun perimän ympärille.
Virus poistuu solusta eksosytoosilla kuroten samalla ympärilleen vaipan isäntäsolun solukalvosta.

Negatiivisen RNA-perimän omaava virus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään.
Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Negatiivinen RNA-täytyy kääntää positiiviseksi RNA:ksi ennen kuin sitä voidaan käyttää translaatiossa. Negatiivista RNA:ta myös kopioidaan uusiin uusiin viruksiin.
Tuotetut proteiinit muodostavat kapsidin, joka kuroutuu uuden negatiivisen RNA:n ympärille.
Valmistunut virus poistuu solusta eksosytoosilla kurouen samalla ympärilleen vaipan.

Retrovirus
Viruksen pintaproteiinit liittyvät isäntäsolun solukalvon reseptoriproteiineihin, ja virus sulautuu solun sisään. Isäntäsolun entsyymit hajottavat viruksen kapsidin vapauttaen viruksen perimän solulimaan.
Viruksen RNA:ssa on käänteiskopioijaentsyymi, jonka avulla yksijuosteinen RNA voidaan kääntää kaksijuosteiseksi DNA:ksi.
Kaksijuosteinen DNA vaeltaa soluun ja yhtyy tuman perimään DNA:n oman integraalientsyymin avulla. Tumassa aletaan valmistamaan virusta tuottavaa lähetti-RNA:ta.
Syntyneet RNA:t siirtyvät joko valmiiseen uuteen virukseen tai ribosomille, jossa niiden ohjeen mukaan valmistetaan viruksen proteiineja.
Translaatiossa valmistuneet proteiinit siirtyvät valmiille viruksille kapsidin proteiineiksi tai kalvorakkulan sisällä solukalvolle vaipan pintaproteiineiksi.
Valmis virus poistuu eksosytoosin avulla keroen samalla ympärilleen vaipan pintaproteiineineen.

Bakteriofagi
Bakteriofagi tarttuu kiinni bakteerin pintaan.
Bakteriofagi ruiskuttaa perimäänsä bakteerin sisään, jolloin bakteerin oma perimä hajoaa.
Bakteeri muuntu virustehtaaksi, jossa tuotetaan bakteriofagin osia
Valmiit osat kootaan yhteen.
Uudet bakteriofagit poistuvat bakteerista, jolloin bakteeri kuolee.

Perinnöllinen muuntelu ja evoluutio
Virusten evoluutio on nopeaa johtuen jatkuvasta muuntelusta. Kun tautia aiheuttava virus muuntuu, puhutaan uudesta variantista, jolle vanhat antibiootit eivät toimi. Muuntelua viruksissa aiheuttavat:
Geenimutaatiot
→ viruksilla, etenkin yksijuosteisilla RNA-viruksilla tai retroviruksilla, on huono oikolukuaktiivisuus, eli kyky korjata virheellisiä geenejä/nukleotidejä.
→ viruksen perimällä ei ole vastinalleelipareja, joten geenimutaatiot ilmenevät suoraan
→ on arvioitu, ettei ole kahta genotyypiltään samanlaista yksijuosteista RNA-virusta
Rekombinaatio
→ jos samaan soluun päätyy kaksi erilaista virusta, kuten ihmisen influenssavirus ja lintuinfluenssavirus, voivat ne vaihtaa perimää keskenään
→ synnyttää uudenlaisia viruksia uusine vaikutuksineen
→ aiheuttavat pandemioita, eli maailmanlaajuisia tautiepidemioita.
Leviämistavat
Myös virukset esiintyvät zoonooseina, eli eläimistä ihmisiin leviävinä tauteina. Virukset voivat kuitenkin levitä monella muullakin tavalla eläimeltä ihmiselle tai ihmiseltä ihmiselle:
Virusten leviämistä edistävät tiivis asutus, huono hygienia, lämpimät ja kosteat olot, biodiversiteetin väheneminen ja tehoeläintuotanto.
5. Geenitekniikka perustuu tutkimustietoon geenien rakenteesta ja toiminnasta
Geenitekniikalla tarkoitetaan tieteelliseen tutkimukseen pohjautuvia menetelmiä, joissa DNA:ta tai RNA:ta tutkitaan eristämällä, muokkaamalla, analysoimalla tai siirtämällä sitä muihin soluihin. Geenitekniikan avulla voidaan siirtää perimää nopeasti eliöltä tai solulta toiselle, tehdä lääkeaineita ja diagnooseja, korjata geenivirheitä ja laajentaa tietoa eri eliöiden koko perimästä. Geenitekniikan menetelmiä sovelletaan usealla sektorilla, kuten ratkaistaessa terveydenhuoltoon, ravinnontuottoon tai ympäristöön liittyviä ongelmia.
Huomaa käsite-erot:
Genomi = eliön koko perimä, eli kaikki yksilön geenit
Geeni = DNA:n toiminnallinen jakso, eli osa, joka sisältää tietoa geenituotteista
Geenin säätelyalue =geenin osa (koostuu tehostajajaksoista ja promoottorista), joka säätelee geenien luentaa
Geenin koodaava alue = geenin osa, joka koostuu geneettistä informaatiota sisältävistä eksoneista ja ei informaatiota sisältävistä introneista
Eksomi = Geenin kaikki eksonit
Geenituote = Eksoneiden informaation perusteella tuotetut RNA:t tai proteiinit

DNA:n rakenne ja kahdentuminen
DNA-molekyyli koostuu kahdesta vastakkaissuuntaisesta juosteesta, jotka ovat liittyneet toisiinsa emästen välisin vetysidoksin. DNA-juosteen perusrakenneosa on nukleotidi, joka koostuu fosfaatti-, sokeri- ja emäsosasta. DNA:n sokeriosa on viisikulmainen deoksiriboosisokeri ja emäsosana voi olla joko adeniini, sytosiini, guaniini tai tymiini. Kahden juosteen nukleotidien emäkset kiinnityvät toisiinsa emäsparisäännön mukaisesti, jonka mukaan tymiini ja adeniini liittyvät toisiinsa kahdella vetysidoksella, ja guaniini ja sytosiini toisiinsa kolmella vetysidoksella. Kun DNA-molekyyli on saanut itselleen kaksijuosteisen rakenteen, se kiertyy kuvan mukaiselle kierteelle.

Deoksiriboosisokeri on viisikulmainen sokeri, millä on suuri merkitys DNA:n kahdentumisessa. Kun DNA:ta kahdennetaan tai kopioidaan, uusi nukleotidi voidaan kiinnittää vain sokerin kolmanteen kulmaan, eli OH-päähän. Tämän vuoksi DNA:ta voidaan rakentaa vain 3’-5’-suuntaisesti, mikä tuottaa eron mallijuosteen ja koodaavan juosteen kopioimisen välillä.

Kun DNA:ta kahdennetaan DNA-polymeraasientsyymi voi kopioida mallijuostetta järjestyksessä nukleotidi kerrallaan, mutta 3’-5’-suunnan säilyttämiseksi koodaavaa juostetta kopioidaan fragmentti kerrallaan juosteen muodostaman silmukan avulla.

DNA:n puhdistus
Kun DNA:ta halutaan eristää näytteestä, se täytyy ensin puhdistaa muista solun rakenneosista. Bakteerien ja arkeonien perimä sijaitsee vapaana solulimassa, toisin kuin tumallisten solujen perimä sijaitsee tumakotelon sisällä. Kun bakteerien tai arkeonien perimää eristetään, solun soluseinä tai mahdollinen kapseli hajotetaan kemikaaleilla ja lämmöllä. Tumallisten DNA-molekyylien käsittelemiseksi kudokset ja solut on hajoitettava mekaanisesti, ja solun rasvarakenteet (kuten solukalvo) on hajoitettava kemiallisesti liuottimien avulla. Tumallisten DNA-molekyylit ovat kiertyneet histoniproteiinien ympärille, jotka poistetaan proteaasientsyymien avulla. Kun DNA on saatuu puhdistettua muista solun osista, se sakkautetaan vielä alkoholilla.

PCR-tekniikka
Kun eliön DNA:ta on saatu puhdistettua, se täytyy monistaa ennen kuin sitä voidaan alkaa tutkia. DNA:ta voidaan monistaa bakteerin plasmidissa tai PCR-laitteella.
PCR-laitteeseen asetetaan pätkä tutkittavaa DNA:ta, nukleotidejä, DNA-alukkeita ja DNA-polymeraasientsyymejä. PCR-tekniikka jakautuu kolmeen osaan:
Kun kaikki tarvittavat tuotteet on laitettu PRC-laitteen koeputkeen, lämpötila nostetaan 95 asteeseen. Tällöin DNA-molekyylin juosteiden väliset vetysidokset katkeavat, ja muostuu kaksi toisistaan kokonaaan erillä olevaa DNA-juostetta.
Lämpötila lasketaan noin 55 asteeseen, jolloin DNA-alukkeet voivat kiinnittyä monistettaviin DNA-pätkiin. DNA-alukkeet ovat noin 20-30 nukletidin mittaisia, ja tilattavissa laboratorioista.
Lämpötila nostetaan noin 75 asteeseen, jolloin DNA-polymeraasientsyymit voivat kiinnittyä monistettaviin DNA-juosteisiin. DNA-polymeraasientsyymi kopioi DNA-pätkiä 3’-5’-suuntaisesti liittäen vapaita nukleotidejä kopioitavaan juosteeseen emäspariperiaatteen mukaisesti.
Vaiheita toistetaan noin 30 kertaa, jolloin DNA:ta on riittävä määrä tutkimuksiin.

Geenien rakenne on erilainen tumallisilla ja tumattomilla eliöillä
Bakteerin geenien rakenne
Bakteerien DNA koostuu pitkälti geeneistä, jotka koostuvat säätelyaluista ja koodaavista alueista. Koodaavat alueet sisältävät vain eksoneita, eli geenettistä informaatiota sisältäviä osia. Bakteerien säätelyalueen merkistystä vähentävät ympäristötekiöiden vaikutus, koska bakteerien on pystyttävä reagoimaan ympärsitössä tapahtuviin muutoksiin herkästi. Säätelyalueen ja koodaavien alueiden muodostamaa kokonaisuutta kutsutaan operoniksi.

Tumallisten geenien rakenne
Tumallisten geenejä on DNA:ssa harvemmin. Geenit ovat rakenteeltaan monimutkaisempia, mutta koostuvat kuitenkin samalla tavalla säätelyalueesta ja koodaavasta alueesta. Säätelyalue koostuu tehostajajaksoista, jotka säätelevät geenien luentaa, ja promoottorista, johon RNA-polymeraasi kiinnittyy lukiessaan geeniä. Koodavalla alueella vuororttelevat informaatiota sisältävät eksonit ja poissilmukoitavat intronit.

Geneettisen informaation perusteella rakennetaan proteiineja
Proteeinit jaetaan toiminnaltaan neljään rakennetasoon:
primaariproteiini (ei toiminnallinen)
sekundaariproteiini (ei toiminnallinen)
tertiaariproteiini (toiminnallinen)
kvaternaariproteiini (toiminnallinen)
Primaariproteiinit valmistuvat proteiinisynteesissä (kuva alla), ja proteiinien toimintaa edistetään jatkokäsittelyllä solulimakalvostossa tai Golgin laitteessa.

Bakteereissa proteiinisynteesi on geenien rakenteen vuoksi lyhyempi ja yksinkertaisempi:

Entsyymejä hyödynnetään geenitekniikassa
Entsyymit ovat biokemiallisten reaktioiden biokatalyyttejä, joita hyödynnetään myös geenitekniikassa. Entsyymejä käytetään mm. DNA:n kahdentamiseen, monistamiseen, katkaisemiseen, liittämiseen ja puhdistamiseen. Tärkeimpiä entsyymejä geenitekniikassa ovat käänteiskopioija-, liittäjä- ja katkaisuentsyymit sekä proteaasit.

Katkaisu- ja liittäjäentsyymit
Katkaisuentsyymit ovat entsyymejä, jotka ovat erikoistuneet katkaisemaan DNA-juostetta. Katkaisuentsyymejä saadaan eristettyä bakteereista, ja ne ovat erikoistuneet kukin tietyn emäsjärjestyksen katkaisuun. Geenitekniikassa käytettävät katkaisuentsyymit jättävät katkaistavan kaksijuosteisen DNA:n kummallekin juosteelle muutaman parittoman nukleotidin niin, että juosteeseen on helpompi liittää toista juostetta ligaasin, eli liittäjäentsyymin avulla.

Katkaisu- ja liittäjäentsyymejä hyödynnetään yhdistelmä-DNA-tekniikassa, joka on menetelmä, jossa vierasta geeniä monistetaan bakteerin plasmidissa. Plasmidi katkaistaan samalla katkaisuentsyymillä vieraan geenin ja antibioottiresistanssin kanssa, jolloin vieras geeni ja antibioottiresistanssi voidaan liittää liittäjäentsyymillä plasmidin katkaisukohtiin.
Antibioottiresistanssi liitetään plasmidiin, koska se helpottaa vieraan geenin sisältävien bakteerien tunnistamisessa, kun bakteerit asetetaan samalle petrimaljalle antibiootin kanssa.
→ resistanssin sisältävät bakteerit selviävät ja muut kuolevat (=antibioottivalinta)
Plasmidi toimii meneltelmässä vektorina eli “kuljettajana”, joka toimii työkaluna geenien monistamisessa
Toinen DNA:n katkaisumenetelmä on CRISPR-tekniikka, jossa hyödynnetään “geenisaksia”, eli CRISPR-Cas-entsyymiä. Cas-entsyymi on osa bakteerien puolustautumista bakteriofageja vastaan. CRISPR-tekniikassa DNA-juoste voidaan katkaista tarkasti halutusta kohdasta entsyymin ja opas-RNA:n avulla.
Käänteiskopioijaentsyymi
Käänteiskopioijaentsyymi on retroviruksissa esiintyvä entsyymi, joka pystyy kääntämään yksijuosteisen RNA:n kaksijuosteiseksi DNA:ksi. Sitä voidaan hyödyntää myös geenitekniikassa, kun halutaan tutkia RNA:ta. Geenitekniikassa paljon käytetty käänteiskopioijaentsyymi kääntää yksijuosteisen RNA:n vastin-DNA:ksi, eli yhdeksi DNA-juosteeksi, joka ei sisällä introneita. Yksijuosteista vastin-DNA:ta voidaan näin kopioida CPR-tekniikan avulla.

6. DNA-tietoa kerätään ja käytetään monin tavoin
Kun DNA on eritetty ja puhdistettu, sitä voidaan alkaa tutkimaan. Sekvensoinnilla tarkoitetaan DNA:n tai RNA:n emäsjärjestyksen selvittämistä, ja se voidaan suorittaa monilla eri tavoilla.
DNA-palojen erottelu
1. Geelielektroforeesi
Geelielektroforeesi perustuu eri mittaisten DNA-pätkien erotteluun sähkövarauksen avulla. Geelielektroforeesissa eri mittaiset DNA-pätkät asetetaan agaroosigeelin peittämälle alustelle, johon on kytketty sähkövaraus. Kun DNA-pätkät on pipetoitu alustan negatiiviselle puolelle, aloitetaan elektroforeesiajo.
DNA-palat ovat negatiivisesti varautuneita fosfaattirunkonsa vuoksi
→ sähkövaraus saa ne liikkumaan kohti alustan positiivista napaa
Agaroosigeelin verkkomainen rakenne hidastaa pidempien DNA-pätkin liikettä
→ lyhyemmät DNA-pätkät liikkuvat elektroforeesiajon aikana lähemmäs plusnapaa kuin pidemmät
Kun elektroforeesiajo on päättynyt, DNA-pätkät voidaan nähdä alustalla UV-valon kanssa hyytelöön lisätyn väriaineen ansiosta
Saatuja tuloksia voidaan verrata mallinäytteeseen, esim. isyystestissä
Geelielektroforeesi ei kerro emäsjärjestystä!!

2. Kapillaarielektroforeesi
Kapillaarielektroforeesi on geelielektroforeesia nopeampi menetelmä, jossa tutkittavat DNA-palat kulkevat pitkin ohutta kapillaariputkea. DNA-palat on värikoodattu, jolloin niiden etenemistä voidaan seurata reaaliaikaisesti seurantalaitteen avulla.

DNA-jakson ja alleelien tunnistaminen
1. Koetin ja DNA-siru
Koetin on lyhyt pätkä yksijuosteista RNA:ta tai DNA:ta, jonka tiedetään olevan jotakin tietty tautialleeli. Koettimen avulla voidaan selvittää, onko henkilöllä koetinta vastaava tautialleeli. Jos henkilöllä on kyseinen alleeli, koetin kiinnittyy antaen värireaktion, joka johtuu koettimeen kiinnitetystä fluerosoivasta leimasta.
DNA-siru on lasi- tai muovilevy, jonka pinnalla on useita, jopa tuhansia koettimia. Kun DNA-sirua verrataan tutkittavaan perimään, saadaan samalla kertaa selville useita mahdollisia tautialleeleja.

2. PCR ja elektroforeesi
Jos halutaan selvittää, onko jollakin henkilöllä jokin alleeli resessiivisenä homo- tai heterotsygoottina tai dominoivana ominaisuutena, voidaan käyttää PCR-tekniikkaa ja elektroforeesia yhdessä. Jotta alleeleja voidaan selvittää, tarvitaan monistettuja ja katkaisuentsyymillä katkottuja DNA-pätkiä sekä mallisarja, johon voidaan selkeästi verrata tuloksia.

3. Reaaliaikainen PCR
Reaaliaikaisessa PCR:llä voidaan tunnistaa alleeleja ja DNA-jaksoja. Reaaliaikainen PCR toimii kuin PCR, mutta mukana on koettimia. Koettimet kiinnittyvät DNA-juosteeseen samalla tavalla kuin alukkeetkin. Kun DNA-polymeraasientsyymi on aloittanut DNA:n monistamisen alukkeesta eteenpäin 3’-5’-suuntaisesti, törmää se jossakin vaiheessa koettimeen. Kun DNA-polymeraasi törmää koettimeen, koetin vapauttaa värileimansa. Irronnut värileima kirjaantuu signaalinlukulaitteeseen, joka laskee koettimien löytämien kohtien määrää ja paikkaa.

DNA:n emäsjärjestyksen selvittäminen
Rinnakkaissekvensointi
Rinnakkaissekvensoinnissa tutkittava DNA monistetaan, ja monistetut DNA:t pilkotaan paloiksi. RInakkaissekvensointia suorittava laite lukee leikatut palat, ja selvittää DNA-jaksojen emäsjärjestyksen palojen päällekkäisyyksien avulla.

Sekvensoinnilla voidaan selvittää koko genomia, eksomia tai tiettyjä geenejä.
https://www.biologiikka.com/2019/01/30/geenitekniikka
7. Muuntogeenisiä eliöitä tuotetaan ja eliöitä kloonataan usealla tavalla
Muuntogeenisellä eliöllä tarkoitetaan eliötä, jonka perimä on muutettu geenitekniikan avulla. Muuntogeeniset eliöt jaetaan siirto- ja poistogeenisiin eliöihin. Siirtogeeninen eliö on eliö, joka on saanut itselleen vierasta perimää geenisiirrossa, kun taas postogeeninen eliö on eliö, jonka omaa perimää on muokattu niin, että sen jokin geeni on tehty toimimattomaksi.
Geeninsiirtotekniikat jaetaan suoriin ja vektorivälitteisiin, sekä kasvisoluun ja eläinsoluun tehtäviin geeninsiirtoihin. Suoralla geeninsiirtomeneltelmällä tarkoitetaan geeninsiirtomenetelmää, jossa geeni saadaan siirrettyä suoraan eliön soluun ilman välikäsiä, kun taas vektorivälitteisessä geeninsiirtomenetelmässä siirtoon käytetään niin sanottua kuljettajaa. Se, mitä geeninsiirtomenetelmää käytetään riippuu siitä, millainen kohdesolu ja -eliö on.

Geenien siirtämisen ja jalostamisen tarkoituksena on uusien lajien kehittäminen, niin että ne ovat kestävämpiä tai tuotteliaampia, sekä puuttelisten ominaisuuksien parantaminen. Siirtogeenisiä eliöitä voidaan myös käyttää lääketieteellisessä tutkimuksessa sekä lääkkeiden tai proteiinien tuotannossa, mutta tällöin siirtogeenisyyttä harjoitetaan yleensä soluviljelmissä. Geenitekniikan soveullukset vaativat kuitenkin välillä uhrikseen myös koe-eläimiä, joista yleisempiä ovat hiiret. Tutkimuskäyttöön kehitettyjä muuntogeenisiä hiirilinjoja pidetään yllä pakastettuina alkioina tai siittiöinä useissa laboratorioissa, joista tutkijat pystyvät tilaamaan niitä käyttöönsä.

Vektorivälitteiset geeninsiirtomeneltelmät
1. Yhdistelmä-plasmidi
Yhdistelmä-plasmidi on yhdistelmä-DNA-tekniikalla tuotettu plasmidi, eli plasmidi, johon on siirretty jonkin toisen eliön geenejä. Kun tumallisen eliön geenejä siirretään bakteerin plasmidiin, täytyy se suorittaa niin, että geenin lähetti-RNA käännetään vastin-DNA:ksi, joka voidaan liittää plasmidiin. Liitettyä DNA-pätkää kutsutaan insertiksi.
Yhdistelmä-plasmidia käytetään yleisesti proteiinien tuottamiseen tai geenien monistamiseen. Hiivoihin lisätyissä yhdistelmä-plasmideissa tutotettaan esimerkiksi insuliinia.

Agrobakteerin palsmidia käytetään usein yhdistelmä-plasmidina, kun jokin geeni halutaan siirtää osaksi kasvisolua. Agrobakteeri infektoi luontaisesti useita eri kasvilajeja liittämällä perimänsä osaksi isäntäsolun perimää, joka alkaa tuottamaan taudille typillisiä äkämiä. Kun akrobakteerin perimää muokataan niin, että taudin aiheuttava geeni sammutetaan, ja perimään liitetään haluttu geeni, voidaan geenejä siirtää kasvisoluille kasvatusmaljalla.

2. Virusvektorit
Viruksia käytetään vektoreina etenkin, kun halutaan tehdä geenin siirtoja eläinsoluille. Viruksilla on luonnostaan kyky tunkeutua isäntäsolunsa sisään ja liittää perimäänsä osaksi isäntäsolun perimää. Jotta viruksia voidaan käyttää vektoreina, viruksen omaan perimään on liitettävä haluttua geeniä, geeni, joka normaalisti aloittaisi viruksen tuottaman infektion ja viruksen lisääntymisen, on muutettava toimimattomaksi.
Tyypillisiä virusvektoreita ovat muuntogeeniset adeno - ja lentivirukset.
Suorat geeninsiirtomenetelmät
1. Mikroinjektio
Mikroinjektiossa jonkin geenin kopioita liitetään hedelmöittyneeseen munasoluun, jossa siittiön ja munasolun tumat eivät ole vielä yhdistyneet, eli alkion perimä ei ole vielä muodostunut. Geenin kopiot liitetään toiseen esitumista (joko munasolun tai siitiön tumaan) mikroskooppisen pienellä lasiputkella. Jos geeninsiirto on onnistunut geeni siirtyy osaksi alkion perimää, kun jakautumana alkanut munasolu siirretään hormoneilla valeraskaaksi tehtyyn naiseen.
Mikrohedelmöityksessä siittiö liitetään munasoluun samalla tavalla mikroskooppisen pienellä lasiputkella. Mikrohedelmöitys voidaan toteuttaa, jos siemennesteen laatu estää raskauden.
2. Liposomit
Liposomit ovat fosfolipidikalvorakkuloita, joiden sisällä on siirrettävän geenin DNA:ta. Liposomien kalvorakkulan rakenne on samanlainen eläinsolun soluseinän rakenteen kanssa, joten liposomin on helppo sulautua solun sisään vapauttaen kantamansa geeni solun solulimaan.

3. Sähköimpulssit ja lämpökäsittely
Sähköimpulsseilla voidaan tehostaa geenin pääsyä osaksi eläinsolua soluviljelmässä, ja lämpökäsittelyllä voidaan heikentää kasvi- tai sienisolun solusoluseinää niin, että esimerkiksi mikroinjektio on mahdollista.
4. Geenipyssy
Geenipyssyllä tarkoitetaan menetelmää, jossa haluttua geeniä ammutaan kasvin kasvisoluihin. Pyssyyn lisätään halutulla geenillä päällystettyjä kultapartikkeleja, jotka ammutaan sattumanvaraisesti kasvia kohti toivoen, että geenit löytäisivät tiensä kasvin kasvisolujen tumaan, eivätkä esimerkiksi viherhiukkasiin tai mitokondrioihin.

Poistogeenisyys ja poistogeenisen eliön tuottaminen
Kantasolujen muokkaaminen
Poistogeeninen eliö on eliö, jonka jokin geeni on tukahdetettu toimintakyvyttömäksi, jotta saadaan tietoa, mihin kaikkeen geeni vaikuttaa. Yleisimmin käytetty poistogeeninen nisäkäs on hiiri.
Poistogeenistä hiirtä tehdessä hiiiren kantasoluja muokataan kasvatusmaljalla niin, että hiiren toimivat geenit korvataan viallisilla. Tämän jälkeen poistogeeniset kantasolut siirretään hiiren alkioihin, jotka saavat perimäänsä viallisia/toimimattomia geenejä. Kun tämän syntyneen sukupolven hiiriä risteytetään keskenään, saadaan sukupolvi, joka ilmentää suuremmalla varmuudella poistogeenisiä geenejä.

CRISPR-tekniikka
CRISPR-tekniikalla voidaan
muokata geenin viallisia nukleotidejä
siirtää eliöön pätkä DNA:ta
sammuttaa jonkin geeni
Kun CRISPR-tekniikkaa hyödynnetään poistogeenisyydessä täytyy tuntea poistettavan geenin emäsjärjestys. Kun emäsjärjestys tunnetaan voidaan tuottaa opas-RNA, joka hybridisoituisi muokattavan geenin kanssa. Valmistetaan opas-RNA-cas-entsyymi-kompleksi, joka siirretään sähköimpulssilla hedelmöittyneeseen munasoluun. Kun opas-RNA pariutuu etsityn geenin kanssa, cas-entsyymi katkaisee DNA:n opas-RNA:n osoittamasta paikasta poistaen geenin PAM-sekvenssin, eli muutaman nulkeotidin mittaisen alueen DNA-juosteessa. Tämän jälkeen solu korjaa DNA-juosteen geenieditoinnilla, jolloin lopputuloksena on poistogeeninen solu.

Kloonaaminen
Kasvien kloonaaminen
Kasvien kloonaaminen on helppoa, koska kasvit tekevät sitä jo luonnostaankin lisääntyessään suvuttomasti. Jos kasvin klooneja halutaan kasvattaaa laboratoriossa, eristetään kasvista soluja, joita aletaan kasvattaa solukkoviljemissäkasvatusalustoilla. Kasvisolun jakautumista ja kasvin kasvamista tehostetaan glukoosilla, ravinteilla ja kasvihormoneilla.

Eläinten kloonaaminen
Eläinten kloonaaminen on kasvien kloonaamista monimutkaisempaa. Eläimiä voidaan kloonata kahdella tavalla:
Tumansiirtotekniikka
= luovuttajan hedelmöittymättömästä munasolusta poistetaan tuma ja tilalle laitetaan kloonattavan yksilön erikoistuneen solun tuma
ei kovin onnistunut tai tuottelias tekniikka → paljon kuolleisuutta
harvemmin käytössä
Kantasolujen hyödyntäminen
= luovuttavan hedelmöittymättömästä munasolusta poistetaan tuma, jonka tilalle laitetaan kloonattavan yksilön solu, joka on uudelleen ohjelmoitu kantasoluksi
onnistuneempi menetelmä, tosin tieteellisessä tutkimuksessa harvaltaan käytetty

8 DNA-tietoa käytetään yksilöiden ja lajien tunnistuksessa
Ihmisiä voidaan geneettisten näytteiden lisäksi tunnistaa biometrisistä ominaisuuksista, eli biologisista ominaisuuksista sekä DNA:n toistojaksojen avulla. Jos halutaan tutkia lajeja ja lajien välisiä eroja voidaan paneutua esimerkiksi DNA-viivakoodeihin.
Biometriset tunnisteet
Biometriset tunnisteet ovat ihmisen biologisiin ominaisuuksiin liittyviä yksilöllisiä piirteitä, kuten sormenjäljet tai silmän iiris. Biometrisiä tunnisteita hyödynnetään rikostutkimuksen lisäksi esimerkiksi puhelimien tai kulkutilojen lukituksen avaamisessa tai passeissa. Passia, jossa hyödynnetään biometrisiä tunnisteita, eli kasvojen tunnistusta ja sormenjälkeä, kutsutaan biopasseiksi.
Sormenjälkien tutkimuksessa kiinnitetään huomiota ihon harjanteiden muodostamiin kuvioihin, silmän iiriksiä tutkittaessa iiriksen kuviointiin ja väritykseen, ja kasvon tunnistuksessa silmien, nenän ja suun mittasuhteisiin. Jopa identtisillä kaksosilla nämä poikkeavat toisistaan, vaikka perimä olisikin samanlainen.

DNA-tunnisteet
Kun halutaan tunnistaa joku ihminen tarkasti kovalla varmuudella käytetään DNA-tunnisteita. DNA-tunnisteet, jotka muodostavat henkilön DNA-profiilin, perustuvat geenien ulkopuolisilla alueilla oleviin toistojaksoihin. Toistojaksot ovat 2-6 emäsparin mittaisia DNA-pätkiä, jotka toistuvat useamman kerran yksilöstä riippuen. Jonkun toistojaksona voisi olla esimerkiksi AGCAAGCAAGCAAGCAAGCAAGCAAGCA, jossa emäsparijoukko AGCA toistuu kuudesti. Toki oikeasti emäsparijoukot toistuvat kymmeniä tai satoja kertoja. Mahdollisuus siihen, että kahden henkilön DNA-profiili olisi samanlainen on noin 1 miljardista, poislukien identtiset kaksoset, joilla tostojaksot ovat samanlaisia.
DNA-tunnisteiat voidaan käyttää esimerkiksi isyystutkimuksissa, sillä kun äidin ja lapsen DNA-tunnisteet tiedetään, pitäisi poikkeavuudet lapsen ja äidin DNA-tunnisteissa selittyä isän DNA-tunnisteella.
DNA-tunnisteita käytetään myös rikostutkimuksissa, joissa DNA:ta voidaan eristää esimerkiksi veriroiskeesta tai hiuksen pätkästä. Kun tekijän soluja ollaan saatu kerättyä, monistettua PCR-laitteella ja ajettua elektroforeesilla, verrataan tuloksia epäillyistä otettuihin näytteisiin.

Geneettinen sukututkimus
Geneettisellä sukutukimuksella tarkoitetaan DNA-testeihin perustuvaa sukulinjojen ja sukulaisuuksien selvittämistä. DNA-testit perustuvat tiettyjen DNA-jaksojen selvittämiseen. Yleisempiä sukutestejä ovat Y-DNA-testi eli isälinjan testaus, mtDNA-testi eli äitilinjan testaus sekä autosomaalinen DNA-testi. Testien tuloksia vertaillaan muiden tekemien testien tuloksiin. Vertailutulokset kertovat yhteisen DNA:n määrän, jonka perusteella voidaan todeta sukulaisuuden läheisyys.
DNA-näytteistä tehtyjen sekvensointien perusteella voidaan mallintaa, miltä henkilö olisi kasvon piirteiltään voinut näyttää perimänsä puolesta. Tällaista tutkimusta kutsutaan fenotyyppitutkimukseksi, joka on joissakin maissa (ei suomessa) osa rikostutkimuksia. Sekvensointitietojen avulla voidaan mallintaa esimerkiksi kasvojen muoto sekä ihon, silmien ja hiusten väri.
DNA-viivakoodi
Eri lajien erottaminen toisistaan pelkkien ulkoisten ominaisuuksien perusteella on epävarmaa etenkin, jos kyseinen yksilö ei ole kehityskaarensa täydessä vaiheessa tai yksilö kuuluu lajiin, jolla on läheinne sukulaishistoria toisen lajin kanssa. Lajien tunnistamisen helpottamiseksi on kehitetty DNA-viivakoodit, jotka perustuvat lajista sekvensoidun tietyn DNA-jakson emäsjärjestykseen. Emäsjärjestyksestä luodaan nelivärinen viivakoodisto, jossa jokainen emäspari vastaa omaa viivaansa. Eri DNA-viivakoodeista rakennetaan DNA-viivakoodikirjasto.

DNA-viivakoodeja voidaan käyttää rikostutkimuksessa, kun selvitetään esimerkiksi ruokaväärennöksiä, salakuljetettujen ja -metsästettyjen eläinten alkuperää tai huumekasvien viljelyä.
DNA-viivakoodit ovat apuna myös evoluutiotutkimuksessa ja eliöiden luokittelussa, koska niiden avulla voidaan vertailla yksilöiden perimän välisiä eroja ja samanlaisuuksia. Erojen ja samainlaisuuksien avulla saadaan selvitettyä sukulaissuhteita ja evolutiivista historiaa, jotka voidaan ilmoittaa fylogeneettisen sukupuun avulla. DNA-viivakoodien avulla voidaan myös seurata muuntogeenisten lajien leviämistä.


9 Biotekniikka auttaa tautien tutkimista ja diagnosointia
Diagnoosilla tarkoitetaan päätelmää taudinaiheuttajasta, ja se luodaan oireiden ja tutkimusten pohjalta. Diagnostiikassa hyödynnetään biotekniikan sovelluksia, kuten reaaliaikaista PCR:ää tai vasta-ainetestejä. Kun tutkitaan ihmisten tai muiden eliöiden geenejä, kudoksia tai koko genomia, voidaan tietoja tallettaa tulevia tutkimuksia, tautien tai lajien tunnistusta varten tietopankkeihin, kuten genomitietokantaan tai biopankkiin.
Tautien tutkiminen
Tautimallit
Tautimalleilla tarkoitetaan koe-eläimiä, joilla tutkitaan sairauksia ja niiden hoitokeinoja. Yleisimpiä tautimallieläimiä ovat hiirien lisäksi esimerkiksi siat, joiden elintoiminnot ovat hiiren elimtoimintoja yhtäläisempiä ihmisen kanssa. Tautimallien käyttöön vaaditaan eettisen lautakunnan suostumus, koska koe-eläinten kiduttaminen erilaisilla sairauksilla on eettiisesti väärin. Hakiessaan lupaa täytyy perustella, miksi tutkimusta ei voida suorittaa soluviljelmässä, eli miksi kokeeseen täytyy käyttää elävää eläinyksilöä.
Geenikirjastot
Geenikirjastolla tarkoitetaan esimerkiksi bakteerin plasmideihin siirrettyä perimää ja sen osia. Geenikirjastoja käytetään, kun perimää halutaan säilyttää ja monistaa samalla. Geenit siirretään bakteeriviljelmään yhdistelmä-DNA-tekniikan avulla, ja onnistuneet siirrot erotetaan epäonnistuneista antibioottivalinnalla. Geenikirjasto voidaan tehdä joko genomiseksi kirjastoksi tai eksomikirjastoksi.
Genomisessa kirjastossa bakteeriviljemään säilötään perimästä otetusta näytteessä satunnaisesti pilkottuja DNA-jaksoja, jotka voivat joko sisältää geenin tai eivät. Genomikirjaston avulla voidaan tutkia myös geenien ulkopuolisia alueita.
Kun tehdään eksomikirjastoa, perimästä eristetään lähetti-RNA:t joista käännetään käänteiskopioijaentsyymillä vastin-DNA:t, jotka liitetään bakteerin plasmidiin. Eksomikirjastossa on siis vain DNA:sta eristettyjen geenien eksoneja.

Genomitietokannat
Genomitietokannalla tarkoitetaan maailmanlaajuista tietokantaa, johon on tallennettu eri puolin maailmaa tehtyjä sekvensointitietoja ja muita tutkimustuloksia ihmiskehon toiminnasta, sairauksista ja sairauksien hoidosta. Genomitietokantoihin kerrättyä tietoa analyisoidaan bioinformatiikan avulla.
Biopankki
Biopankkeihin säilötään muutakin kuin dataa - biopankkeihin talletetaan DNA- ja kudosnäytteitä sekä potilaskertomuksia eli kuvauksia potilaiden oireista ja hoidosta - tietenkin vain potilaan luvalla. Biopankkien tietojen avulla kehitetään diagnostiikkaa ja tautien parantamista.
Tautien diagnostiikka
DNA-sirut
DNA-sirut ovat pieniä ja ohuita, muovisia tai lasisia laattoja, joille on asetettu useita, tautialleeleja tunnistavia koettimia. DNA-sirun jokainen koetin sisältää jonkin tietyn tautialleelille sopivan vastin-DNA-pätkän, johon on kiinnitetty fluerisoiva merkkigeeni. Kun tutkittavan henkilön perimää asetetaan DNA-sirun koettimille, voidaan värireaktioiden avulla tutkia koettimien löytämiä osumia. Kun kaikki reagoivat geenit ovat reagoineet koettimien kanssa, DNA-sirua voidaan lukea analyysilaitteella.
DNA-sirujen, esim Suomi-sirun, avulla voidaan selvittää useiden tautien ilmentymistä, tai missä kudoksessa mikäkin geeni esiintyy.

Leimatut koettimet
Leimatuilla koettimilla voidaan selvittää, sisältääkö jokin kudos tai näyte jotakin tiettyä tutkittavaa geeniä. Leimattu koetin on lyhyt pätkä DNA:ta, jonka on tarkoitus pariutua hybridisaatiolla halutun geenin tuottaman lähetti-RNA:n kanssa. Koska koetin on leimattu fluerisoivalla väriaineella, hybridisaatio tuottaa värimerkin, joka voidaan havaita UV-valolla.

Geenitestit ja -paneeli
Geenitesteillä selvitetään, onko tutkittavalla henkilöllä perimänsä perusteella sairautta tai alttiutta siihen. Geenitestejä käytetään myös sairauden diagnosoimiseksi, tautigeenien kantajuuden toteamiseksi, sairastumisriskin arvioimiseksi sekä sairausgeenien tunnistamiseksi alkio- ja sikiöaikana. Posken limakalvolta otettavia geenitestejä voidaan myös tilata esimerkiksi netistä, joiden avulla voidaan rakentaa sukupuita ja tunnistaa sukulaisia.
Geenipaneelilla tarkoitetaan laitetta, jolla voidaan tunnistaa sairauden eri muotoja eli erilaisia alleeleja, jotka aiheuttavat sairauden. Geenipaneelille voidaan valita jopa tuhat erilaista, tiettyä sairautta ja sen eri muotoja aiheuttavan geeniä. Kun tutkittavasta henkilöstä on otettu näyte, näytettä analysoidaan rinnakkaissekvensoinnin avulla. Rinnakkaissekvensoinnin tuloksia verrataan vertailutietokantoihin, jolloin saadaan selville, minkä tautimutaation henkilö on saanut.
→ Geenipaneelin avulla voidaan tutkia tarkemmin taudin aiheuttavaa geeniä, ja luoda näin yksillöllisempi hoitosuunnitelma.

Alkio- ja sikiödiagnostiikka
Jokainen raskausajan neuvolassa käyvä tulee olemaan tekemisissä sikiödiagnostiikan kanssa. Sikiödiagnostiikalla pyritään löytämään kromosomi- ja kromosomistomutaatiota, eli pyritään selvittämään onko sikiö kunnossa, vai onko sillä mahdollisuuksia sairastaa jotakin geneettistä sairautta. Yleisiä sikiödiagnostiikan menetelmiä ovat esimerkiksi ultraäänitutkimus, sikiön sydänäänien kuunteleminen tai äidltä verinäytteen ottaminen, mutta jos näussä yleisesti kaikille tehtävissä kokeissa havaitaan poikkeuksia, voidaan ottaa esimerkiksi lapsivesinäyte.

Alkiodiagnostiikalla tarkoitetaan keinohedelmöityksessä luotujen alkioiden tutkimista mahdollisten geenivirheiden johdosta. Jos esimerkiksi on suuri mahdollisuus sille, että lapsi syntyisi elämänlaatua rajoittavaa sairautta/oireyhtymää sairastavana, voidaan lapsi tuottaa alulleen keinohedelmöityksessä. Kun keinohedelmöityksessä hedelmöittynyt solu alkaa jakautua mitoottisesti voidaan sille suorittaa geenitutkimuksia, joilla voidaan poissulkea epäiltyjä sairauksia tai oireyhtymiä.
Alkiodiagnostiikassa geenitestit suoritaan kuvan kaltaisille solurypäleille.
Sekvensointi
Sekvensointi ollaan tuotu esiin kaikkialla, mutta näin se putkahtaa mukaan jälleen, koska on tärkeä osa tautidiagnostiikkaa. Jotta voidaan tuntea ihmisen perimää, sairauksia ja niiden hoitokeinoja, on tiedettävä, minkälaisten geenien kanssa ollaan tekemisissä. Sekvensointi on perustana melkein kaikille tautien tutkimis- ja DNA:n emäsjärjestyksen selvitysmenetelmille. Sekvensoida voidaan koko genomi tai vain eksomit. Molemmissa tapauksissa informaatio on valtavaa - onhan ihmisellä yli 20 tuhatta geeniä. Tämän vuoksi informaatiota käsitellään paljon tekoälyn avulla, joka kykenee esimerkiksi jäsentelemään tuloksia.
Antigeenitestit
Antigeenitestit perustuvat monoklonaalisten vasta-aineiden toimintaan. Monoklonaalisella vasta-aineella tarkoitetaan B-imusolun tuottamaa vasta-ainetta, joka osaa tunnistaa yhden tietyn pintaproteiinin, eli antigeenin. Monoklonaalisia vasta-aineita ollaan voitu hyödyntää esim. koronatesteissä.
Antigeenitesteissä henkilöstä otetaan näyte, joka asetetaan testiliuskalle. Näyte kulkee kapillaari-ilmiön avulla läpi testiliuskan. Positiiviseen näytteeseen tarttuu värikoodattu, virukselle monoklonaalinen vasta-aine, joka jättää värijäljen ensimmäiselle testilinjalle. Näyte jatkaa eteenpäin kontrolliviivalle, jossa värikoodattu, normaalisti näytteessä esiintyvälle antigeenillä monoklonaalinen vasta-aine tarttuu antigeenin jättäen värijäljen kontrolliviivalle. Jos kontrolliviiva ei tule näkyviin testissä, näytteeseen ei ole tarttunut edes normaalisti näytealueella esiintyvää antigeeniä, jolloin tulos luetaan virheelliseksi.


Reaaliaikainen PCR
Reaaliaikainen PCR on menetelmä, joka toimii samalla pääperiaatteella PCR:n kanssa. Reaaliaikaisessa PCR:ssä emäksiltään tuntematonta DNA-juostetta monistetaan lämpötilan vaihtelun avulla. Reaaliaikaisessa PCR:ssä PCR-laitteeseen lisäätään emäksiltään tunnettu koetin, johon on liitetty fluerisoiva leima. Koetin pariutuu juosteen kanssa ennen DNA:n monistumista. Kun DNA-polymeraasi entsyymi osuu koettimeen, koettimen värileima irtoaa ja antaa värimerkin. Saatujen värimerkkien perusteella voidaan määrittää DNA:n emäsjärjestys.

Biomarkkerit
Biomarkkereilla tarkoitetaan kehoissamme olevia yhdisteitä tai tekijöitä, joita mittaamalla voidaan tehdä tutkimusta terveydentilastamme. Biomarkkereita voivat olla lipidit, proteiinit ja aineenvaihduntatuotteet, joiden määrällinen muutos voidaan yhdistää johonkin tautiin. Biomarkkeirien määrää tutkitaan esimerkiksi massaspektroskopialla tai monoklonaalisilla vasta-aineilla.

käsitteitä:
hybridisaatio=DNA-juosteidien pariutuminen
monitekijäinen sairaus= sairuas, johon vaikuttavat useart tekijät, kuten perinnölliset tekijät, ympäristön vaikutus ja elintavat
10. Lääkkeet ja hoidot kehittyvät yhä tehokaammiksi
Biotekniikan sovelluksia hyödynnetään useissa tautien hoitokeinoissa ja lääkkeissä. Biotekniikka on auttanut kehittämään yhä tehokaampia ja täsmällisempiä lääkkeitä ja hoitokeinoja, joita ovat esimerkiksi antibiootit, nukleiinihapporokotteet ja kantasoluhoidot. Lääkkeitä, jotka tehoavat virusten, bakteerien, hiiva- ja homesienien sekä yksisoluisten loisten aiheuttamiin infektioihin, kutsutaan mikrobilääkkeiksi.
Antibiootit
Antibiooteilla tarkoitetaan lääkkeitä, jotka hillitsevät bakteeri- ja sieni-infektioita vaikuttamalla niiden aineenvaihduntareaktioihin tai estämällä niiden lisääntymisen. Antibiootit ovat alkujaan olleet sienien (tai joidenkin bakteerien) erittämää aineitta, joka on toiminut kilpailijoiden kukistajana. Myöhemmin ihminen on alkanut keräämään ja valmistamaan antibiootteja infektiotautien hoitamiseen. Antibiootteja valmistetaan nykyään suurissa bioreaktoreissa, joissa homeet ja bakteerit erittävät antibiootin kasvatusliuokseen, mistä antibiootti puhdistetaan talteen.
Laajakirjoisilla antibiooteilla tarkoitetaan antibiootteja, jotka vaikuttavat kerralla usemapaan bakteerilajiin. Vastaavasti kapeakirjoinen antibiootti on antibiootti, joka vaikuttaa vain yhteen ja tiettyyn bakteerilajiin. Laajakirjoisilla ja kapeakirjoisilla antibiooteilla on hyvät ja huonot puolensa. Laajakirjoinen antibiootti sopii tapaukseen, jossa infektoivaa bakteeria ei tarkasti tunneta. Kapeakirjoinen antibiootti sopii paremmin tapaukseen, jossa bakteerilaji tunnetaan, jolloin hoito voidaan kohdistaa suoraan siihen, eikä keholle hyödyllisiin bakteereihin.

Tänä päivän ongelma ihan ympäri maailman ovat resistanssibakteerit. Resistanssibakteereilla tarkoitetaan bakteereita, joihin antibiootit eivät tehoa. Resistanssi, eli vastustuskyky johtuu pitkäaikaisesta asteittaisesta altistumisesta antibiootille, joka johtaa bakteerikantojen muunteluun. Ja koska resistenssigeeni sijaitsee usein plasmidissa, resistenssigeeni siirtyy helposti bakteerista toiseen rekombinaation avulla. Sairaalassa syntyneitä moniresistenssejä bakteereja kutsutaan sairaalabakteereiksi. MRSA on Suomessa laajalti esiintyvä sairaalabakteeri.
Resistenssibakeeri kantoja kehittää esimerkiksi antibioottien käyttö tehomaataloudessa sekä antibioottien runsas ja tarpeeton käyttö.

Fagiterapia
Fagiterapialla tarkoitetaan bateriofagien, eli bakteereja infektoivien virusten, käyttöä bakteeri-infektion hoitoon. Bakteriofagit tuhoavat luonnostaan vain yhtä bakteerilajia, joten ne eivät tuhoa muita keholle hyödyllisiä bakteerikantoja. Fagiterapia on vanha menetelmä, jota on alettu uudelleen harkita hoitamaan resistansseja bakteerikantoja.

Rokotteet
Sekä bakteeri- että virusinfektioita ennaltaehkäistään rokotteilla. Rokotteet ovat aktiivista immunisaatiota. Rokotteiden tarkoituksena on aktivoida elimistö tunnistamaan ja tuhoamaan taudinaiheuttajat.
Rokotteita valmistetaan bakteerien tai hiivojen plasmideissa yhdistelmä-DNA-tekniikalla. Plasmideihin liitetään pintaproteiinia koodaava geeni, ja plasmidin annetaan kahdentua hiivan tai bakteerien jakaantuessa. Siirron onnistuttua bakteerit ja hiivat alkavat tuottamaan pintaproteiineja, joita eristetään rokotteisiin.
Ennen rokotteet sisälsivät heikennettyjä tai tapettuja taudinaiheuttajia tai niidne osia. Nykyään geenitekniikan avulla valmistettu rokote sisältää ainoastaan osan taudinaiheuttajan pintaproteiinista tai sitä koodaavasta nukleiinihaposta. Näitä rokotteita, joissa on osa taudinaiheuttajan pintaproteiinin DNA:ta tai RNA:ta, kutsutaan nukleiinihapporokotteiksi, eli DNA- tai RNA-rokotteiksi.
Nukleiinihapporokotteiden toiminta perustuu siihen, että rokotettavan soluihin viedään antigeenin, kuten viruksen pintaproteiinin, rakennusohje lähetti-RNA:n tai DNA:n muodossa. Kun rakennusohje on saatu siirrettyä soluihin, ne alkavat tuottaa elimistölle vierasta proteiinia. Vieraan proteiinin vuoksi kyseistä taudinaiheuttajaa vastaan ihmisessä syntyy immuunivaste ja muistisoluja kehittyy lisää. Kun taudinaiheuttaja joutuu myöhemmin elimistöön, puolustusjärjestelmään kuuluvat valkosolut aktivoituvat ja tuhoavat sen.

Hormonilääkkeet ja monoklonaaliset vasta-ainelääkkeet
Sellaisia hormoneja, joita ennen eristettiin eläimistä ja kuolleista ihmisistä, voidaan nykyään valmistaa bakteeri- ja hiivasoluviljelmissä yhdistelmä-DNA-tekniikan avulla. Näitä soluviljelmissä valmistettuja hormoneita kutsutaan hormonilääkkeiksi. Esimerkiksi interferonia voidaan tuottaa kolibakteereissa mm. virusinfektioiden hoitoon.
Monoklonaalisilla vasta-aineilla tarkoitetaan vasta-aineita, jotka tunnistavat yhden tietyn antigeenin. Monoklonaalisia vasta-aineita on alettu hyödyntää täsmälääkkeinä taudeille, joiden tekijät ja solutyyppi tunnetaan hyvin. Vasta-ainelääkkeitä käyteen mm. syöpien ja reuman hoitoon.
Geenihoidot
Geenihoidoissa soluviljelmään tai potilaaseen siirretään geenivirhettä korjaavasta geenistä toimiva alleeli, jonka ohjeiden mukaan solut alkavat tuottaa puuttuvaa proteiinia. Geeninsiirto voidaan tehdä joko suoraan tai potilaan omien solujen avulla soluviljelmässä.
Soluviljelmässä tehtävässä geeninsiirrossa siirrettävä alleeli liitetään vektoriin, joka on useimmiten virus tai liposomi. Siirron saavalta henkilöltä eristetään soluja, joita kasvatetaan soluviljelmässä yhdessä siirtogeenisten virusten tai liposomien kanssa. Kun alleeli on saatu siirrettyä soluihin, solut palautetaa takaisin potilaaseen toivoen, että palautetut solut alkavat tuottamaan haluttua proteiinia.

Suorassa geenin siirrossa alleeli liitetään vektroriin yhdistelmä-DNA-tekniikalla. Vektori injektoidaan potilaan hoidettavaan kudokseen toivoen, että alleelit löytävät potilaan solut alkaen tuottamaan haluttua proteiinia.

Geeninsiirto voidaan tehdä myös T-tappajasoluihin, jolloin niiden avulla voidaan hoitaa syöpää. T-tappajasoluja eristetään potilaasta, ja niihin liitetään geeni, joka tunnistaa syöpäsolun, ja geeni, joka tappaa ne.

Geeninsiirtojen lisäksi voidaan tehdä geenimuokkauksia, joihin käytetään CRISPR-tekniikkaa. CRISPR-tekniikassa toimivaa alleelia ei siirretä vaan viallinen alleeli korjataan. Korjaus on mahdollista tehdä soluviljelmän soluihin, minkä jälkeen muuntogeeniset solut siirretään potilaaseen. CRISPR-tekniikka mahdollistaa geenien muokkaamisen jo koeputkihedelmöityksessä, jolloin mahdollisia sairauksia voidaan poiskytkeä jo ennen sikiön kehitystä.
Geenihoidoissa on paljon käytännöllisiä ja eettisiä ongelmia. Pahimassa tapauksessa geenihoito voi käynnistää ehkäistävän tai hoidettavan sairauden, sillä geeninsiirto saattaa kohdentua väärään soluun tia CRISPR-tekniikan cas-entsyymi saattaa korjata väärän geenin. Etenkin alkioihin tehtyjen geeninhoitojen on uskottu esimerkiksi rajoittavan itsemääräämisoikeuutta ja johtavan ihmisen jalostamiseen sairauksien poistamisen sijaan.
Kantasoluhoidot
Erittäin monikykyisillä kantasoluilla tarkoitetaan soluja, jotka voivat erikoistua miksi tahansa ihmisen yli kahdestasadasta solutyypistä, ja luonnostaan niitä esiintyy vain alkioilla. Nykybioteknologian avulla mikä tahansa ihmisen solu, esim. ihosolu, voidaan uudelleenohjelmoida alkutilaansa eli erittäin monikykyiseksi kantasoluksi. Uudelleen erittäin monikykyisiksi kantaosluksi ohjelmoitua soluja kutsutaan IPS-soluiksi.
IPS-solujen avulla tehtävä solukorvaushoito perustuu siihen, että kantasolut eristetään potilaasta, jonka jälkeen niihin siirretään vektorin avulla geeni, jota ilmenee alkioiden soluissa. Tästä solu alkaa uudelleenohjelmoitumaan alkutilaansa, jonka jälkeen solu voidaan erilaistaa halutuksi solutyypiksi kasvutekijöiden ja muiden kemiallisten aineiden avulla.

Kudosteknologia
Kudosteknologialla tarkoitetaan keinotekoisten kudosten kehittämistä biologian, lääketieteen ja insinööritieteiden avulla. Kudoksia voidaan esimerkiksi valmistaa 3D-biotulostimella.

 Knowt
Knowt