Reacciones Químicas 4-1
1. Historia del modelo atómico
1803—Modelo de Dalton: Postuló que los átomos son unidades indivisibles de la materia.
1897—Modelo de Thomson: Introdujo el concepto de electrón y propuso un modelo atómico como una “esfera positiva” con electrones incrustados.
1911—Modelo de Rutherford: Propuso la idea de un núcleo atómico pequeño y denso al descubrir que la mayoría de la masa del átomo está concentrada en él.
1913—Modelo de Bohr: Introdujo el concepto de órbitas cuantizadas para los electrones alrededor del núcleo.
1920—Modelo mecánico cuántico: Trato a los electrones como ondas y partículas.
1927—Modelo atómico actual: Compuesto por un núcleo central de p+ y n0 rodeado por e- en orbitales/capas. Los e- se distribuyen en estas capas según su energía.
2. Partículas subatómicas
1932—James Chadwick:
Observo una radiación que no se desviaba en un campo electrónico o magnético. Átomos de berilio.
Demostró que esta radiación consiste en partículas sin carga que se encuentran en el núcleo del átomo (neutrones).
Descifro que e = -, p = + y n = 0.
Z = número atómico
A = masa atómica
A = p + n
Isótopos: átomos con el mismo número atómico e igual número de protones, pero diferente número de masa. Diferente número de neutrones.
Relacionadas con la gestión medioambiental. Carbono-13 (analizar cuánto carbono se acumula en el suelo por la fertilización y si esas prácticas son sostenibles).
3. Estructura atómica
Identificar la estructura:

El número atómico está determinado por protones.
Debe tener el mismo número de electrones.
El número másico está determinado por los neutrones.
4. Configuración electrónica
n = número cuántico principal (nivel energético del electrón); mayor n, mayor energía orbital.
l = número cuántico angular (forma del orbital en el espacio) puede tomar un valor de 0 a n-1. Cada forma del orbital se asocia a los valores de l = 0, 1, 2 y 3 con las letras ns, np, nd y nf, donde n es el número cuántico principal.
ml = número cuántico magnético (orientaciones espacialidades posibles de cada tipo de orbital); valor de -l a +l, incluyendo 0. Donde hay un orbital, hay mayor probabilidad de encontrar un electrón.
ms = número cuántico de espín (sentido del giro del electrón sobre su propio eje) en un orbital no puede haber dos electrones con espines iguales.
Principios de la configuración electrónica
De construcción: Los electrones de un átomo ocupan los orbitales disponibles de menor energía antes de llenar los orbitales de mayor energía. Cada nivel de energía cuenta con uno o más subniveles y cada uno se conforma de uno o más orbitales.
De exclusión de Pauli: no pueden existir dos electrones en un átomo con los mismos cuatro números cuánticos, por tanto, en un orbital solo coexisten dos electrones con espines opuestos.
De máxima multiplicidad o regla de Hund: varios electrones ocupan orbitales de igual energía; estos se distribuyen de manera que el número de electrones desapareados sea máximo y que tengan espines paralelos.
Resolver ejercicios
5. Tabla periódica
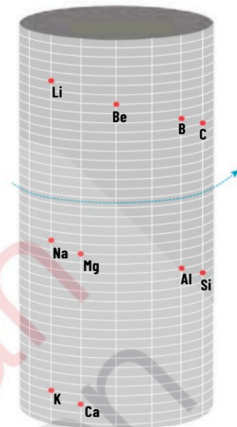
1861—Alexandre de Chancourtois: Presento la primera propuesta de organizar los elementos químicos con base en su masa atómica. Los ordeno en forma de cilindro.
1869—Mendeleiev: Su propuesta contenía 64 elementos conocidos. Fueron organizados con base en su masa atómica en 8 columnas y 12 filas. Reservo espacios vacíos para elementos que aún no eran descubiertos.
1913—Henry Moseley: Propuso ordenar los elementos químicos de acuerdo con su número atómico. Considero que las propiedades químicas y físicas tienden a repetirse en forma sistemática conforme aumenta su número atómico. Las aportaciones de Moseley originaron la tabla periódica moderna que propusieron Werner y Paneth.
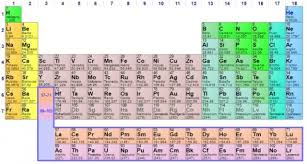
La tabla periódica es un sistema de organización y clasificación de los elementos químicos.
118 elementos
7 períodos
18 familias
6. Propiedades periódicas
Tamaño de los átomos:
Su tamaño varía según el número de protones, neutrones y electrones.
Si aumenta en Z, se incrementa el número de partículas subatómicas y el número de capas electrónicas.
Iones: Cuando un electrón de valencia es cedido o aceptado por un átomo neutro, se forma un ion que puede tener carga positiva o negativa.
Cationes = +
Aniones = -Si el átomo cede su electrón, su tamaño disminuye; si acepta uno, su tamaño aumenta.
Energía de ionización:
Energía necesaria para remover un electrón de un átomo neutro en estado gaseoso. Mientras más cerca esté el electrón del núcleo, más difícil será removerlo.
Afinidad electrónica:
Energía relacionada con el proceso de captar un electrón de un átomo neutro en estado gaseoso, donde el electrón se convierte en anión.
Electronegatividad:
Capacidad de un átomo de un elemento para atraer hacia sí los electrones compartidos cuando se forma un enlace químico. Está asociado al tamaño de los átomos, la energía de ionización y la afinidad electrónica.
Oxidantes y reductores:
Reductores: Ceden electrones.
Oxidantes: Sustancia que acepta electrones de otra sustancia en una reacción química.
Al ceder electrones, el reductor se oxida. Al aceptar electrones, el oxidante se reduce.
Acidez y basicidad:
Describen la capacidad de una sustancia para donar o aceptar protones en una disolución.
7. Enlaces químicos
Compuestos químicos:
Son sustancias formadas por distintos elementos. Los compuestos químicos se mantienen unidos gracias a enlaces químicos.
Mantienen unidos a los átomos en las moléculas/compuestos.
Enlaces metálicos: Átomos metálicos interactúan entre sí.
Enlaces iónicos: Interacción entre iones metálicos (cationes) y no metálicos (aniones). Permite la formación de una “red cristalina”.
Enlaces covalentes: Átomos no metálicos. Los protones atraerán simultáneamente a los electrones de valencia disponibles.
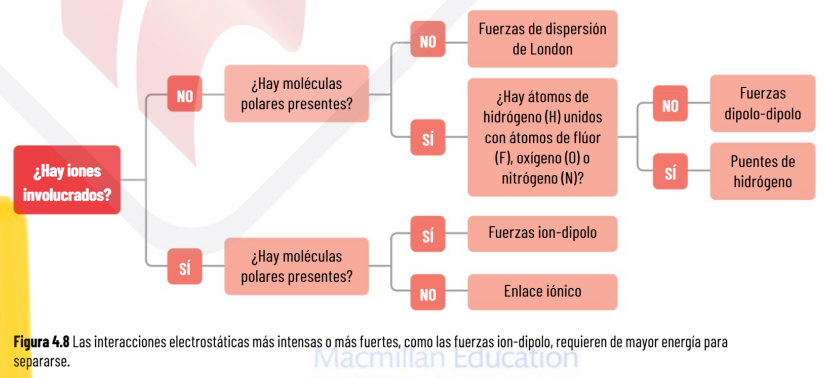
8. Fuerzas intermoleculares
9. Reacciones químicas
Procesos químicos en los que una o más sustancias interaccionan entre sí para formar nuevas especies químicas.
Puede suceder:
Cambio de color
Formación de un gas
Aparición de un sólido (precipitado)
Liberación de energía en forma de luz o calor.
Se caracterizan por el cambio.
*Conservación de la masa: La masa de los productos debe ser igual a la de los reactivos.
Ecuaciones químicas: Se utilizan para representar una reacción química.
Componentes: Símbolo, significado y descripción.