Att kunna till provet, Kemi V2
Att kunna till provet, Kemi V2
Atomens uppbyggnad.
Vad som finns i syror och baser. Syror består av molekyler eller joner som avger vätejoner (H⁺) när de löses i vatten. När syror dissocieras ökar koncentrationen av H⁺-joner i lösningen, vilket ger lösningen dess sura egenskaper. Starka syror dissocieras fullständigt i vatten, vilket betyder att nästan alla syramolekyler avger H⁺-joner. Svaga syror dissocieras endast delvis, vilket innebär att bara en del av syramolekylerna avger H⁺-joner. Baser består av molekyler eller joner som tar upp vätejoner (H⁺) eller avger hydroxidjoner (OH⁻) när de löses i vatten. Detta minskar koncentrationen av H⁺-joner i lösningen och gör den basisk (alkalisk). Starka baser dissocieras fullständigt i vatten och avger OH⁻-joner direkt. Svaga baser dissocieras endast delvis eller reagerar med vatten för att skapa OH⁻-joner. Mängden fria vätejoner (H⁺) i en lösning avgör om den är sur, neutral eller basisk.
pH-värde och pH-skalan (logaritmisk skala, x10)
Veta vad som händer med syror och baser i vatten: När syror hamnar i vattnet delas syramolekylen upp i positiva vätejoner och negativa syrajoner. Mängden fria vätejoner i en lösning avgör hur sur den blir. Starka syror släpper ifrån sig alla vätejoner medan svaga syror bara släpper iväg några. De fria vätejonerna (H⁺) är instabila på egen hand och binder sig snabbt till vattenmolekyler (H₂O), vilket bildar oxoniumjoner (H₃O⁺). Det är dessa oxoniumjoner som faktiskt gör lösningen sur. När baser släpps i vatten börjar basmolekylerna interragera med vattenmolekylerna. Starka baser släpper direkt ifrån sig hydroxidjoner (OH-). Det är hydroxidjonerna och hur många de är som avgör hur basisk en lösning är. Svaga baser tar istället upp positiva vätejoner (H+) från vattnet, och då bildas det hydroxidjoner av vattenmolekylerna.
Förstå skillnaden mellan starka och svaga syror och baser. Starka baser bryts upp helt och släpper ut många hydroxidjoner, medan svaga baser bara delvis delas upp och släpper därför inte ut lika många hydroxidjoner. Starka baser avger hydroxidjoner direkt medan svaga baser reagerar med vatten för att skapa hydroxidjoner. Starka syror bryts upp helt och släpper lös alla vätejoner, medan svaga syror bara delvis delas upp och inte släpper fri lika många vätejoner.
Förstå skillnaden mellan koncentrerade och utspädda syror och baser. Skillnaden mellan koncentrerade och uspädda syror/baser handlar om mängden syra/bas i förhållande till mängden vatten.
Ge exempel på några indikatorer: pH-mätare (bra om man vill veta ett exakt värde, t.ex inom sjukvården), Fenolftalein (blir färglös i sura lösningar och rosa i basiska), BTB (droppa i vätskan, vätskan får olika färg beroende på pH), pH-papper
Veta vad neutralisation är: Neutralisation är en kemisk reaktion där en syra och en bas reagerar med varandra och bildar ett salt och vatten. I denna process kombineras vätejoner (H⁺) från syran och hydroxidjoner (OH⁻) från basen, vilket resulterar i vatten (H₂O). Samtidigt bildas ett salt från de kvarvarande jonerna. Grundläggande neutralisationsreaktionn:
H+ + OH−→H2O. Exempel på neutralisation: Saltsyra (HCl) och natriumhydroxid (NaOH): När saltsyra (en stark syra) och natriumhydroxid (en stark bas) blandas, sker en neutralisationsreaktion där saltet natriumklorid (NaCl) och vatten (H₂O) bildas:
HCl (saltsyra) +NaOH (natriumhydroxid)→NaCl+H2OH⁺
HCl reagerar med OH⁻ från NaOH för att bilda vatten. Kvar blir natriumjonerna (Na⁺) och kloridjonerna (Cl⁻), som tillsammans bildar natriumklorid (NaCl), ett salt. KALK
C-A
Veta vad som händer med syror och baser i vatten på ett mer detaljerat sätt. Exempelvis skillnaden mellan starka och svaga baser: Se ovan
Förklara hur pH-skalan fungerar och hur graderingen fungerar:
Citronsyra (pH ≈ 2): Surt, används som smaksättare och konserveringsmedel.
Kaffe (pH ≈ 5): Lätt surt.
Vatten (pH ≈ 7): Neutralt.
Tvål (pH ≈ 9): Lätt basiskt.
Natriumhydroxid (pH ≈ 13): Mycket basiskt.
Förstå enklare reaktionsformler.
Exempel 1: Saltsyra och natriumhydroxid HCl+NaOH→NaCl+H2O
Här reagerar saltsyra (HCl) med natriumhydroxid (NaOH) och bildar natriumklorid (NaCl, vanligt bordssalt) och vatten (H₂O).
Dissociation av en syra
Syror kan dissociera i vatten och bilda vätejoner (H⁺).
Exempel 4: Saltsyra HCl→H+ + Cl
Saltsyra dissocierar i vatten och ger vätejoner och kloridjoner.
Dissociation av en bas
Baser kan också dissociera i vatten och bilda hydroxidjoner (OH⁻).
Exempel 5: Natriumhydroxid NaOH→Na+ + OH− Natriumhydroxid delas upp i vatten och bildar natriumjoner och hydroxidjoner.
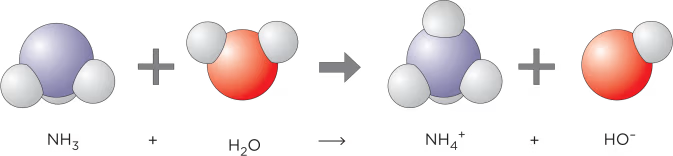
Exempel 6: Ammoniak löses upp i vatten och bildar ammoniumjon och hydroxidjon
Syror har svårt att bryta ned ädla metaller men löser gärna upp andra metaller. Metall + syra ---> vätgas
När det regnar surt släpps vätejoner ut och amoniumjoner som ofta används för att ge näring neutraliseras så att växten inte längre kan ta till sig näringen.